I.3.3.2. Analyse physicochimiques du jus de raisins
On filtre ou on centrifuge l'échantillon de jus puis On
détermine la valeur du résidu sec soluble par
réfractomètre (lecture directe de la valeur du Brix)
I.3.3.2.1.Analyse des sucres (selon la méthode
Duboid, 1956)
? Mode opératoire
? Préparation du jus de
l'échantillon
V' -Peser 5 g d'échantillons puis mélanger le avec
25 ml eau distillée et broyage.
V' -Centrifuger les mélanges obtenus à 900 r
pendants 20 min.
V' Prendre un volume à partir du surnageant obtenues.
V' Préparation de l'échantillon
Page 55
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
y' On mélange 2ml de l'échantillon avec 50 ml
d'eau distillée et 01 g de CaCO3 (bicarbonate de calcium).
y' Puis le mélange subit un chauffage à
ébullition pendant 30 minutes. Après le refroidissement du
mélange, on complète le volume jusqu'à 100 ml, puis on
ajoute une quantité d'acétate de plomb (10%).
y' On fait une 1ere filtration pour éliminer les
protéines précipitées par l'acétate du plomb.
Après cette opération, on ajoute une quantité d'oxalate de
potassium qui se combine avec l'excès d'acétate de plomb et on
fait une 2ème filtration
y' La concentration en sucres totaux a été
déterminée en se référant à la courbe
d'étalonnage préparé.
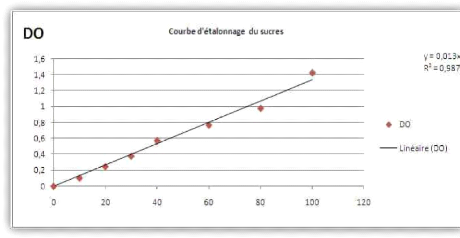
Figure 1: Courbe d'étalonnage de dosage
de ST (Zribi Hatima; 2019).
Le taux de sucre est calculé selon la formule (7)
ST=A' × V ×
D/? ?×100 (7)
ST: Taux de sucres totaux(%).
X: Quantité de sucres calculée
à partir de la courbe d'étalonnage (mg/ml).
D: Facteur de dilution.
V : Volume de la solution analysée
(ml).
P:Poids de la prise d'essai (g).
Page 56
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
I.3.3.2. Dosage d'acidité titrable
? Principe
Au cours de la fermentation acétique,
l'évolution de l'acide acétique est le facteur essentiel à
contrôler, c'est le produit fini recherché.
L'acide acétique est dosé par titrimétrie
selon la méthode directe par Follaman (Follaman
,1983).
Produits utilisés
- Phénolphtaléine (1%).
- Hydroxyde de sodium 0.1N.
? Mode opératoire
? On a fait dilution des jus des dattes et raisins
(dilué à 10%)(10ml de jus de datte et raisins +90ml eau
distillée)
? Prélever VA=10ml de jus de raisin et jus des dattes
dilué à l'aide d'une pipette, on ajoute 3 gouttes de
Phénolphtaléine, remplir la burette de solution d'hydroxyde de
sodium de concentration molaire CB=0.1mol/L, ajuster le niveau du liquide au
niveau zéro de la burette, placer alors l'Arleen Meyer sous la burette,
agiter afin d'homogénéiser le mélange ( jus de D et R
+phénolphtaléine), verser à la burette, goutte à
goutte de l'hydroxyde de sodium dans L'Erlen Meyer jusqu' au virage au rose
persistant.
? On indiquer la valeur du volume d'hydroxyde sodium
correspondant à la zone de virage au rose persistant.
A l'équivalence CAXVA=CBXVB (8)
- CA est la concentration de la solution A.
-VA le volume de la solution A.
-CB est la concentration de la solution B.
-VA le volume de la solution B.
* on a A°=a. acétique + a. lactique (la
matière première «Datte, Raisin» contient la flore
lactique).
Le degré d'acidité D°(A°)
de vinaigre s'exprime par la masse.
La concentration en acide acétique est exprimée en
g/l par la formule (9) (Clavet, 1992).
(9)
C (g/l) = F.V X 60
V : Volume de la soude versé en ml.
F : Facteur correspondant à la
normalité de soude 0,1N.
Page 57
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
60 : La masse molaire de l'acide
acétique.
Le degré d'acidité de vinaigre est mesuré
par la formule suivante : D° = Macide Msolution
1 × 100 (ONEFD)
M acide : concentration de l'acide
acétique.
M solution : la masse d'un litre de solution.
| 


