6. L'éthylène chez les champignons
filamenteux
6.1. Effet de l'éthylène sur
différentes espèces fongiques
Un certain nombre d'études ont porté sur le
rôle de l'éthylène chez les champignons, principalement en
raison de l'importance à comprendre les interactions entre le champignon
et les plantes, en particulier les champignons pathogènes et
toxinogènes. Ces études ont montré que, suite à un
traitement avec de l'éthylène exogène, certains
champignons présentent des altérations dans leur physiologie
(germination et production des spores), montrant que ces espèces
fongiques réagissent à l'éthylène (Pristijono
et al., 2018 ; Chagué et al., 2006 ; Flaishman et
Kolattukudy, 1994). En effet, des expérimentations faites sur des
espèces fongiques toxinogènes et non-toxinogènes ont
montré un effet observable de l'éthylène : A. nidulans
avec une inhibition du développement des ascospores (cellules
reproductrices) (Roze et al., 2004) ; A. parasiticus avec une
inhibition de la biosynthèse de l'aflatoxine (Roze et al., 2004
; Gunterus et al., 2007) ; P. expansum avec une diminution du
nombre de spores lors d'un traitement à fortes doses
d'éthylène (Kepczynski et Kepczynska, 1977). Cependant, il a
également été prouvé que certaines espèces
de champignons ne subiraient aucun effet apparent de l'éthylène
sur un quelconque processus physiologique (Lynch, 1975 ; El-Kazzaz et
al., 1983). Peu d'études ont été faites sur les
récepteurs et/ou la voie de signalisation de l'éthylène
chez les champignons filamenteux, mais des pistes de recherche commencent
à émerger. En effet, des études de transcriptomiques ont
montré que des variations transcriptionnelles ont été
observées dans la voie de signalisation couplée aux
protéines G lors de l'application d'un traitement à
l'éthylène (Lin et al., 2019).
6.2. Potentiel rôle des GPCR dans la
réponse à l'éthylène
Les récepteurs couplés aux protéines G
(GPCR) sont des complexes protéiques membranaires fortement
représentés dans le monde des organismes eucaryotes. Ils sont
constitués de 7 hélices transmembranaires attachées les
unes aux autres par des boucles internes et externes. Ces récepteurs
sont capables de détecter une large gamme de signaux extracellulaires
différents tels que les ions, la lumière, les acides
aminés/nucléiques, les sucres, les peptides de phéromones,
les oxylipines...(Kenakin et Miller, 2010). La liaison du ligand provoque un
changement conformationnel du récepteur permettant la transmission des
informations à l'intérieur de la cellule et induisant ainsi
différents types de réponses en fonction de la nature du
ligand.
Après l'activation de la GPCR chez les champignons
filamenteux, il semble que les effecteurs en aval soient principalement les
cascades de phosphorylation des protéines MAP kinases et des voies
adénylate cyclase/ cAMP / PKA (Lengeler et al., 2000) ayant un
rôle dans les différentes fonctions cellulaires telles que le
développement fongique, le métabolisme, la virulence et la
biosynthèse de mycotoxines. Par exemple, chez A. nidulans, il a
été prouvé que les protéines G peuvent
réguler la
12
production de stérigmatocystine (mycotoxine et
précurseur de l'aflatoxine) par une régulation transcriptionnelle
et post-transcriptionnelle des médiateurs impliqués dans la voie
de biosynthèse des mycotoxines (Hicks et al., 1997 ; Shimizu
et al., 2003). De même, l'implication des protéines G a
également été démontrée dans la
biosynthèse des aflatoxines chez A. parasiticus (Roze et
al., 2004 ; Gunterus et al., 2007). Fait intéressant,
certains champignons toxinogènes tels que P. expansum semblent
déclencher une réponse à l'éthylène
exogène, même si aucune preuve directe n'a été
trouvée entre les GPCR et la biosynthèse de patuline (Kepczynski
et Kepczynska, 1977).
Au cours de la dernière décennie, une
étude génomique a montré que de nombreux champignons
filamenteux, pathogènes ou non, détiennent des GPCR similaires
à ceux déjà caractérisés (Krishnan et
al., 2012). Cependant, plusieurs analyses bio-informatiques ont permis
d'appréhender l'existence potentielle de nouveaux GPCR fongiques (Zheng
et al., 2010 ; Martin et al., 2019 ; Brown et al.
2018). La connaissance et la compréhension des récepteurs
à l'éthylène et des voies de signalisation chez les
espèces fongiques, potentiellement via les GPCR, semblent être une
piste prometteuse en termes de régulation, de contrôle ou encore
même d'élimination de la production de mycotoxines lors de moments
critiques du cycle de vie des fruits infectés.
6.3. Perspective d'utilisation de
l'éthylène comme agent de biocontrôle
Jusqu'à récemment, l'utilisation des produits
phytosanitaires était favorisée dans la lutte contre la
contamination par les champignons toxinogènes et leurs mycotoxines
associées. Cependant, la toxicité de ces produits ainsi que leurs
effets sur la santé humaine, animale et sur l'environnement encouragent
le développement de méthodes de luttes alternatives basées
sur l'utilisation d'agents biologiques ou de composés naturels. En
France, ce type d'approches se traduit par l'adoption du plan Ecophyto 2025 qui
a pour objectif de réduire de 50% l'usage de pesticides en agriculture.
Certains composés naturels tels que les épices, les huiles
essentielles ou des extraits aqueux de plantes ont montré une bonne
capacité à réduire la mycotoxigenèse in vitro
(Bluma et Etcheverry, 2008 ; Razzaghi-Abyaneh et al., 2005 ;
Jahanshiri et al., 2012). Néanmoins, malgré cette preuve
de concept, se pose la problématique de la mise en oeuvre de ce type de
stratégie. En effet, une fois au contact des denrées
alimentaires, ces composés peuvent altérer les qualités
organoleptiques de ces dernières, ce qui en résulterait par une
perte économique pour le producteur.
Parmi les composés naturels candidats au
développement de telles approches écoresponsables,
l'éthylène semble constituer une piste de recherche prometteuse.
En effet, l'éthylène étant déjà
utilisé en agroalimentaire pour faire mûrir les bananes ou
déverdir les agrumes (Mahajan et al., 2014), le
développement d'une stratégie de lutte contre la contamination en
mycotoxines par l'utilisation d'un gaz semble tout à fait
réalisable tant sur le plan de la mise en oeuvre que sur le plan
réglementaire.
13
II. Matériels &
Méthodes
1. Analyses bio-informatiques
A l'aide d'outils de bio-informatique, nous avons
essayé de localiser au sein des génomes fongiques des
séquences nucléiques qui pourraient coder pour des
récepteurs à l'éthylène. Pour cela nous avons
utilisé des outils de comparaison de séquences afin de rechercher
des similitudes de séquences entre les séquences codantes pour
les récepteurs à l'éthylène chez les plantes dans
les génomes des espèces fongiques. Nous avons choisi de nous
focaliser sur les GPCR fongiques car il est reconnu que les champignons
filamenteux possèdent un panel diversifié de GPCR mais
également qu'un traitement à l'éthylène
engendrerait des changements transcriptionnels dans la voie métabolique
de ces GPCR (Chagué et al., 2006).
Botrytis cinerea est un champignon
non-pathogène connu pour réagir à l'éthylène
et posséder des GPCRs. A partir de la séquence protéique
du récepteur couplé à la protéine G3 de B.
cinerea (GPCR3), des alignements ont été
réalisés sur l'ensemble des séquences protéiques
d'A. flavus, A. parasiticus et P. expansum grâce au logiciel
BLASTp proposé par le serveur NCBI. Dans un second temps, les
séquences protéiques obtenues ont été
individuellement soumises à une analyse par le logiciel TMPred afin de
visualiser les domaines transmembranaires (annexes). Sur la base de la
représentation schématique du récepteur à
l'éthylène présenté par Wang et al., 2006,
les acides aminés essentiels à la liaison de
l'éthylène avec son récepteur identifié chez A.
thaliana (ETR1) ont été colorés dans les parties
transmembranaires identifiées. De la même manière que
précédemment, ces mêmes étapes ont été
répétées sur les 15 GPCRs identifiées dans le
génome d'A. flavus dans la publication de Affeldt et
al., 2014. Le même travail a ensuite été
réalisé sur le génome de P. expansum.
2. Souches, origines des gaz et milieux de culture
utilisés
2.1. Souches fongiques et origines des
gaz
Les souches des champignons A. flavus (NRRL 62477),
A. parasiticus (NRRL 502) et P. expansum (NRRL 35695)
proviennent du Laboratoire de Génie Chimique. Elles sont
conservées sous forme de suspension de spores stockées au
congélateur à -20°C.
L'éthylène et le
1-MéthylCycloPropène (1-MCP) pur ont été fournis
par le laboratoire de Génomique et Biotechnologie des Fruits dans des
contenants en verre hermétique.
2.2. Milieux de culture
Le milieu de culture utilisé pour la culture des
souches fongiques est le milieu Czapek Yeast Agar (CYA). Pour préparer
un volume de 1L de milieu CYA, il est nécessaire de mélanger 50
mL de solution A (40 g/L de NaNO3, 10 g/L de KCl, 10 g/L de MgSO4
heptahydraté et 0,2 g/L de FeSO4 heptahydraté) avec 50 mL de
solution B (20 g/L de K2HPO4) ainsi que 0,5 mL de solution C (10 g/L de
ZnSO45H20et 5 g/L de CuSO4 5H20), 5 g d'extrait de levure, 30 g de saccharose
et 15 g d'agar bactériologique, complété jusqu'au volume
final de 1 L avec de l'eau osmosée.
14
3. Préparation des suspensions de
spores
3.1. Revivification des souches
fongiques
Pour chaque espèce fongique, 3 à 5 boîtes
de Pétri de CYA sont ensemencées à partir des suspensions
de spores congelées. Pour cela, 100 uL de suspension de spores sont
étalés sur la gélose. Les boîtes de Pétri
sont incubées pour une période de 7 jours à
l'obscurité dans une étuve à 28°C avec un taux
d'humidité compris entre 70 et 80%. Pour chaque champignon, une
boîte de Pétri sera utilisée pour extraire les mycotoxines
( 7 - Extraction des mycotoxines) afin de les quantifier par HPLC.
3.2. Préparation de la solution de Tween 80
à 0,05%
Au terme de l'incubation, les spores sont
récupérées sur les boîtes de Pétri à
l'aide d'une solution de Tween 80 à 0,05%. Pour préparer cette
solution, 5 g de Tween 80 sont mélangés à 95 mL d'eau
distillée afin d'obtenir une solution mère de Tween 80 à
5%. Cette solution est stérilisée par autoclavage (121°C, 20
min) puis diluée au 100ème dans des contenants en
verre. La solution de Tween 80 à 0,05% obtenue est de nouveau
autoclavée à 121°C pendant 20 minutes.
3.3. Récupération des
spores
En condition d'asepsie, la récupération des
spores se fait par ajout de 9 mL de Tween 80 à 0,05% directement sur les
cultures mycéliennes en boîte de Pétri. A l'aide d'un
râteau stérile, la surface des cultures est raclée
doucement afin de décrocher les spores. Ces spores sont ensuite
récupérées à la pipette et placées dans un
tube plastique stérile. La suspension de spores obtenue est alors
filtrée dans un nouveau tube plastique stérile à l'aide
d'une seringue de 20 mL contenant du coton cardé stérile. Cette
étape de filtration permet d'éliminer les fragments de
mycélium qui aurait pu être entraînés avec les spores
lors du grattage de la gélose avec le râteau.
3.4. Numération à la cellule de
Thoma
La numération cellulaire permet de déterminer
une quantité de spores par unité de volume. Elle est
réalisée directement par comptage au microscope optique
(grossissement x400) à l'aide d'une cellule de Thoma. Pour permettre un
comptage plus aisé, des dilutions de la suspension de spores peuvent
être réalisée en prélevant 1 mL de cette suspension
que l'on additionne à 9 mL de Tween 80 à 0,05% (dilution au
1/10ème). Des dilutions successives peuvent être faites
si nécessaire. La numération est réalisée par
comptage du nombre de spores présent dans au moins 5 des « grands
» carrés constituant la cellule de Thoma. Après avoir
effectué la manipulation, la concentration cellulaire de la suspension
de spores peut être déterminée selon le calcul suivant :
N = (n/V) x f
Avec n = moyenne du nombre de spores comptées par «
grands » carrés ; V = volume de comptage
(1 « grand »
carré = 4. 10-9 dm3) ; f = facteur de dilution.
3. 15
Préparation des gaz
L'éthylène pur est fourni dans un contenant
hermétique d'un volume de 150 mL à une concentration de
1,0.105 ppm. Les plus hautes concentrations d'éthylène
testées lors des expériences proviendront de cette solution non
diluée (appelée D0). Pour les plus petites concentrations, des
dilutions sont faites dans d'autres contenants hermétiques de 580 mL. La
première dilution est faite en prélevant 1,9 mL de gaz, puis
injectés dans un flacon de 580 mL (concentration de 3200 ppm
appelée D1). La seconde est générée en
prélevant 5,8 mL de gaz de D1, injectés dans un second contenant
de 580 mL (concentration de 32 ppm appelée D2).
Le 1-MCP étant un gaz plus instable que
l'éthylène, il est difficile de le conserver pendant des mois
sous sa forme gazeuse. Il est donc reçu sous forme de poudre à
humidifier afin d'obtenir la concentration de gaz souhaitée
(échantillon de la société AgroFresh). Dans notre cas, les
plus fortes concentrations de 1-MCP testées lors des expériences
viendront du premier flacon de 150 mL dans lequel est mélangé 2,4
g de 1-MCP avec 40 mL d'eau (concentration de 1,0.105 ppm
appelée M0). La seconde concentration, toujours dans un récipient
de 150 mL, est obtenue de la même façon en mélangeant 240
mg de 1-MCP avec 4 mL d'eau donnant alors une concentration de 1000 ppm
appelée M1. A partir de M1, 1,5 mL de gaz sont prélevés et
injectés dans un autre récipient de 150 mL générant
ainsi une concentration de 10 ppm appelée M2.
4. Ensemencement et conditions de
culture
4.1. Ensemencement des boîtes de
Pétri
A partir des suspensions de spores préparées,
les boîtes de Pétri sont ensemencées en point central avec
10 uL d'une suspension de spores calibrée à 1,0.106
spores/mL pour A. flavus et A. parasiticus et
1,0.108 spores/mL pour P. expansum. Les boîtes sont
laissées entrouvertes sous le poste de sécurité
microbiologique afin de faire sécher les gouttes déposées.
Une fois les gouttes sèches, le montage du système
expérimental débute. Pour ce faire, des bocaux septés
d'une contenance de 3,2 L ont été préalablement
autoclavés avec à l'intérieur une boîte de conserve
vide et propre d'un diamètre et d'une hauteur de 8 cm. En condition
aseptique, 10 mL d'eau stérile sont ajoutés dans le fond du bocal
pour assurer une humidité relative tout au long de l'expérience.
Sur la boîte de conserve est placée une première
boîte de Pétri contenant de la chaux sodée dans le but de
capturer le CO2, qui peut altérer la croissance du champignon et
perturber l'action de l'éthylène. Par-dessus cette boîte de
Pétri est installé un « échafaudage » qui va
accueillir une première boîte de Pétri ensemencée.
Cette action est répétée jusqu'à placer les
triplicats à l'intérieur du bocal. Les « échafaudages
» permettent de créer une séparation nette entre les
boîtes permettant aux gaz d'atteindre le champignon étudié.
Une fois le montage terminé, un joint hermétique est
adapté sur le couvercle du bocal qui est alors fermé et
totalement hermétique. Après injection des gaz, les bocaux sont
placés dans une étuve à 28°C pendant 72h.
16
4.2. Injection des gaz
Les gaz sont injectés grâce à des
seringues étanches via les septums présents sur les couvercles
des bocaux. Les concentrations de gaz testées sont pour
l'éthylène : 0,1 ppm (injection de 10 mL de D2),
10 ppm (injection de 10 mL de D1), 100 ppm
(injection de 0,32 mL de D0) et 1000 ppm (injection de 3,2 mL
de D0) ; pour le 1-MCP : 0,01 ppm (injection de 3,2 mL de M2),
1 ppm (injection de 3,2 mL de M1), 5 ppm
(injection de 1,6 mL de M0) et 10 ppm (injection de 3,2 mL de
M0).
5. Détermination de la croissance
fongique
La croissance fongique est évaluée en mesurant
le diamètre de la colonie fongique au dos de la boîte de
Pétri correspondant à la croissance radiale du champignon. Deux
mesures perpendiculaires sont réalisées par colonie fongique.
6. Extraction des mycotoxines
6.1. Extraction des aflatoxines
Au terme de l'incubation, la gélose est
découpée à l'aide d'une lame de scalpel. L'ensemble des
morceaux de gélose sont récupérés dans un tube
plastique de 50 mL. L'extraction est ensuite réalisée en ajoutant
25 mL de chloroforme. Les tubes sont agités 2h à 160 rpm à
température ambiante. Le solvant est ensuite
récupéré et filtré à l'aide d'un filtre
Whatman séparateur de phase (1PS) permettant de récupérer
uniquement la phase organique. Le filtrat est ensuite transvasé dans un
ballon puis évaporé à 60°C à l'aide d'un
évaporateur rotatif jusqu'à obtenir un volume d'environ 3 mL. Ce
volume est ensuite transféré dans un tube en verre puis
évaporé à sec en utilisant un TurboVap (Biotage). Ces
tubes sont fermés avec du parafilm et stockés au
congélateur à -20°C. Avant l'analyse HPLC, les extraits secs
sont repris dans 1 mL de phase mobile (eau acidifiée 0,2% acide
acétique/acétonitrile/méthanol, v/v/v, 65/17,5/17,5), puis
filtrés dans un vial en verre de 2 mL à l'aide d'un filtre 0,45
um PTFE (Thermo Scientific, Illkirch, France).
6.2. Extraction de la patuline
Pour P. expansum, la procédure est exactement
la même que précédemment mais l'extraction est
réalisée avec de l'acétate d'éthyle. Avant
l'analyse HPLC, les extraits secs sont repris dans 1 mL de phase mobile
(eau/méthanol, v/v, 80/20), puis filtrés dans un vial en verre de
2 mL à l'aide d'un filtre 0,45 um PTFE (Thermo Scientific, Illkirch,
France).
7. Dosage des mycotoxines par HPLC
Les analyses HPLC sont faites grâce à un
système Dionex Ultimate 3000 UHPLC (Thermo Scientific, Illkirch, France)
selon deux méthodes différentes en fonction de la mycotoxine
recherchée.
7.1. Préparation des gammes
étalon
Trois standards commerciaux ont été
utilisés pour préparer les gammes étalons. Un standard
d'aflatoxine B1 pour la doser dans les cultures d'A. flavus, un
standard constitué d'un mélange des quatre aflatoxines (AFB1 (1
ug/L), AFB2 (3 ug/L), AFG1 (1 ug/L) et AFG2 (3 ug/L)) permettant de doser
17
chacune de ces molécules dans les cultures d'A.
parasiticus et un standard de patuline afin de doser la patuline dans les
cultures de P. expansum. Les concentrations des différentes
gammes étalons utilisées sont présentées dans le
tableau 4.
Tableau 4 - Concentrations en mycotoxines des
différentes gammes étalons utilisées
|
Patuline (ng/mL)
|
Aflatoxine mix (B1 et G1) (ng/mL)
|
Aflatoxine mix (B2 et G2) (ng/mL)
|
Aflatoxine B1 (ng/mL)
|
|
5
|
50
|
150
|
50
|
|
10
|
62,5
|
187,5
|
1000
|
|
25
|
100
|
300
|
2500
|
|
50
|
125
|
375
|
5000
|
|
100
|
250
|
750
|
|
|
250
|
|
|
|
500
|
|
7.2. Analyse HPLC des aflatoxines
L'analyse des échantillons des cultures d'A. flavus
et A. parasiticus a été faite en utilisant une
colonne de chromatographie Luna® C18 (125 x 2 mm, 5 rim, 100 Å)
(Phenomenex, Torrance, CA, USA) à 30 °C. Les conditions de
séparation ont été adaptées de Fu et al.
(2008). Un mode isocratique de 20 minutes a été utilisé
avec 82,5% d'éluant A : eau acidifiée (0,2% d'acide
acétique) et acétonitrile (65/17,5 v/v) et 17,5% d'éluant
B : méthanol pur de qualité HPLC (Fisher Scientific, Illkirch,
France). Le débit était de 0,2 mL/min et le volume d'injection de
5 riL. Les aflatoxines sont détectées à l'aide d'un
détecteur à fluorescence réglé à des
longueurs d'ondes d'excitation/émission de 365/430 nm. Les
résultats obtenus ont été confirmés en comparant le
spectre d'absorption UV avec un détecteur à barrette de diodes
(DAD) couplé au système et le temps de rétention avec un
standard commercial. Les niveaux de production des aflatoxines ont
été calculés sur la base des gammes étalon.
7.3. Analyse HPLC de la patuline
L'analyse des échantillons des cultures de P.
expansum a été faite en utilisant une colonne de
chromatographie Gemini® C6-phényl (250 x 4,60 mm, 5
ìm, 100 Å) (Phenomenex, Torrance, CA, USA). Les analyses ont
été effectuées à un débit de 0,9 mL/min avec
un volume d'injection de 5 riL en utilisant le programme d'élution en
gradient suivant : l'éluant A était de l'eau acidifié
à 0,2% avec de l'acide acétique et l'éluant B était
du méthanol pur de qualité HPLC (Fisher Scientific, Illkirch,
France). Les conditions d'élution utilisées étaient les
suivantes : un gradient croissant linéaire du solvant B de 0 à
15% pendant 20 min ; 15% de solvant B pendant 5 min ; un gradient croissant
linéaire du solvant B de 15 à 90% pendant 10 min ; 90% de solvant
B pendant 5 min ; un gradient décroissant linéaire du solvant B
de 90 à 0% pendant 5 min ; 0% de solvant B pendant 15 min. La patuline a
été détectée à l'aide d'un détecteur
à barrette diodes (DAD) à une longueur d'onde de 277 nm. Les
résultats obtenus ont été confirmés en analysant le
spectre d'absorption au DAD et le temps de rétention avec un standard
commercial. La production de patuline a été quantifiée
grâce à une gamme étalon.
8. 18
Dosage de l'éthylène par
GC
8.1. Courbe standard
Une gamme étalon d'éthylène est
établie par injection de 1 mL de différentes concentrations
connues de ce gaz. La gamme étalon permettra de déterminer la
concentration du gaz d'intérêt dans les différentes
conditions expérimentales.
8.2. Analyses GC
Après incubation, les gaz présents dans
l'espace de tête des bocaux sont récupérés à
l'aide d'une seringue de 1 mL, avant ouverture des bocaux. Les seringues sont
plantées sur un support permettant de n'avoir aucun échange entre
l'air ambiant et le contenu de la seringue. Les gaz sont ensuite
injectés et analysés par chromatographie gazeuse. Cette
manipulation est répétée une fois par jour tout au long de
l'expérience afin de garantir que le gaz étudié reste
à la concentration souhaitée dans la jarre.
Les analyses en chromatographie gazeuse (Agilent) ont
été réalisées avec une GC-FID (Agilent 7820a)
équipée d'une colonne 80/100 alumina (4x2 mm x 2m, Agilent) avec
les paramètres suivants : température du four de 70°C,
température de l'injecteur de 110°C, débit de gaz vecteur
(azote) 30 mL/min, température du détecteur à ionisation
de flamme de 250°C.
9. Dosage de CO2 par infrarouge
Avant ouverture des bocaux et à l'aide d'une seringue,
1 mL des gaz présents dans les bocaux est récupéré
pour chacune des conditions. Tous les prélèvements sont
injectés dans un analyseur infrarouge non dispersif (NDIR) permettant de
mesurer le taux de CO2 présent au moment du
prélèvement.
10. Analyses statistiques
Dans un premier temps, la normalité de la distribution
des données a été testée par un test de
Shapiro-Wilk. Puis, l'analyse de la variance a été
réalisée par un test ANOVA suivi d'un test de comparaison
multiple de Dunnett afin de comparer les différences de production de
mycotoxines dans les différentes conditions de culture. Les analyses
statistiques ont été réalisées avec le logiciel
GraphPad Prism 8 (GraphPad Software, La Jolla, CA, USA). Les différences
ont été considérées statistiquement significatives
lorsque la p-value était inférieure à 0,05.
III. Résultats &
discussion
1. Analyses bio-informatique
A cause de la crise COVID, le début du stage a
été consacré à une recherche in silico de
récepteurs potentiels à l'éthylène chez les
espèces d'Aspergillus et P. expansum. A partir de la
séquence protéique du récepteur couplé à la
protéine G3 de B. cinerea, des alignements ont
été obtenus sur le génome d'A. flavus, A.
parasiticus et P. expansum et par la suite soumis à une
analyse TMPred. Des exemples de résultats sont mis en forme dans
l'annexe 1 pour A. flavus, l'annexe 2 pour
A. parasiticus et l'annexe 3 pour P.
expansum. Les domaines protéiques surlignés en vert
correspondent aux domaines transmembranaires retrouvés par le logiciel
TMPred sur la base du « Strongly prefered model ». Puis, selon la
représentation de l'ETR1 présenté par Wang et
al., 2006, les acides aminés considérés comme
essentiel dans la liaison de l'éthylène au récepteur sont
représentés en rouge à l'intérieur des domaines
transmembranaires.
Tout d'abord, la première observation a
été de retrouver des GPCRs fongiques analogues à celles de
B. cinerea, champignon réagissant à
l'éthylène. Cependant, les observations faites sur les
différentes séquences GPCR retrouvées nous permettent
uniquement de spéculer sur un rôle potentiel des GPCR dans la
signalisation cellulaire de l'éthylène chez les champignons
filamenteux. En effet, la répartition exacte des acides aminés
décrite chez Wang et al. (2006) n'est retrouvé dans
aucune des séquences protéiques des champignons
d'intérêts. Cela laisse supposer plusieurs hypothèses dont
les deux les plus probables sont : 1. Les GPCRs fongiques chez A.
flavus, A. parasiticus et P. expansum ne sont pas ou
n'ont aucun lien avec les récepteurs à l'éthylène
ou 2. Les récepteurs à l'éthylène sont
potentiellement les GPCRs fongiques mais très différents de
l'ETR1 décrit chez A. thaliana.
2. Dosage de
l'éthylène
Le dosage de l'éthylène a été fait
sur les premières semaines de manipulation par GC, lorsque le
système expérimental a été mis en place. En effet,
cela nous a permis de vérifier que les gaz injectés
étaient à la concentration souhaitée tout au long des
expériences et par conséquent d'apprécier
l'étanchéité du système
d'expérimentation.
|
Figure 6 - Réplicats techniques d'une même
concentration d'éthylène injectée en GC
|
19
Tableau 5 - Exemple de dosage de la concentration
d'éthylène dans les bocaux
|
Temps de
rétention (min)
|
Aire
d'intégration
(pA*s)
|
Valeurs mesurées
(ppm)
|
|
Standard 4 ppm
|
1.073
|
77.12039
|
4
|
|
0,1 ppm
|
4.488
|
2.26196
|
0.117
|
|
10 ppm
|
6.029
|
208.49281
|
10.814
|
|
0,1 ppm
|
9.556
|
2.26953
|
0.118
|
|
10 ppm
|
11.029
|
201.47733
|
10.450
|
20
Les vérifications des concentrations en
éthylène par GC sont effectuées
régulièrement et seulement quelques résultats sont
présentés ici. Les résultats du tableau 5 montrent que la
concentration retrouvée dans les conditions expérimentales
(valeurs mesurées) correspondent aux concentrations que l'on souhaite
tester (0,1 et 10 ppm). Ces mesures ont été
répétées sur les deux premières expériences,
et les valeurs mesurées étaient proches des valeurs
souhaitées.
3. Aspergillus flavus
Lors des expérimentations, plusieurs paramètres
ont été analysés : la croissance radiale fongique, la
production de mycotoxines ainsi que la teneur en CO2. Cependant, ayant
l'opportunité de doser le CO2 que tardivement dans le stage, seule la
teneur en CO2 pour A. flavus a été
étudiée.
Les résultats de croissance radiale obtenus pour A.
flavus ne montrent pas d'effet significatif de l'éthylène et
du 1-MCP sur la croissance du champignon. En effet, les diamètres
mesurés oscillent entre 3,67 cm et 3,97 cm (? = 0,30 cm) que
l'expérience soit faite avec de la chaux sodée ou non (Figure
7).

Diamètre (cm)
4.2
4.1
3.9
3.8
3.7
3.6
3.5
4
Figure 7 - Mesure de la croissance radiale d'A. flavus avec
et sans chaux sodée après 72h d'incubation. CS
=
présence de chaux sodée
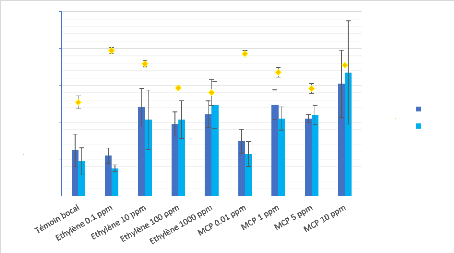
La figure 8 présente la concentration moyenne en
aflatoxines B1 et B2 et le taux de CO2 dans les différentes conditions
testées chez A. flavus. Une tendance semble se dessiner pour
les très faibles valeurs d'éthylène (0,1 ppm) et de 1-MCP
(0,01 ppm) puisqu'on remarque que la production d'AFB1 et AFB2 est
équivalente à la production retrouvée dans la condition
témoin. De plus, on observe une augmentation de la production de
mycotoxines à partir des concentrations « fortes » des gaz
(éthylène 10 ppm, 100 ppm et 1000 ppm ; 1-MCP 1 ppm, 5 ppm et 10
ppm). On remarque également qu'il semble y avoir une corrélation
entre le taux de CO2 et la production d'aflatoxines puisque dans les conditions
où on retrouve un fort taux de CO2 s'observe également une faible
production d'AFB1 et AFB2 (CO2
21
(éthylène 0,1 ppm) = 2,37 % et CO2 (1-MCP 0,01
ppm) = 2,32 %). A l'inverse, il semble que plus la teneur en CO2 est faible,
plus la production d'aflatoxines est forte (« concentrations fortes
»).
Aflatoxines (ug/L)
250.00
200.00
150.00
100.00
50.00
0.00
3.00
0.50
0.00
2.50
2.00
1.50
1.00
CO2 (%)
AFB1
AFB2
Figure 8 - Dosage de l'AFB1, AFB2 et du CO2 chez A. flavus
sans chaux sodée après 72h d'incubation. MCP =
MéthylCycloPropène.
Les premières investigations ont noté que le CO2
a la capacité de neutraliser les effets de l'éthylène dans
de nombreux cas (Burg et Burg, 1967), mais plus récemment, il est devenu
évident que l'interaction entre le CO2 et l'éthylène est
plus complexe. En effet, l'effet du CO2 sur la production et
l'efficacité de l'éthylène est dépendante de la
pression partielle de CO2 appliquée et la durée d'exposition (De
Wild et al., 2003).
Depuis le départ, nous savions que le CO2 serait un
facteur limitant à notre système expérimental. C'est
pourquoi les boîtes de Pétri ensemencées ont
été surélevées par une boîte de conserve. En
effet, le CO2 étant un gaz plus lourd que l'oxygène, celui-ci a
tendance à s'accumuler au fond du bocal. Cependant, les premières
observations ont montré que le taux de CO2 est tout de même trop
élevé puisqu'on retrouve entre 1,42 % et 2,42 % de CO2
présent dans les bocaux (Figure 8). Ce constat étant
problématique pour étudier l'effet de l'éthylène,
50 g de chaux sodée ont été ajoutés à
chacune des conditions expérimentales pour le reste de nos
expérimentations. Cela permettra de s'affranchir des artéfacts
causés par le dioxyde de carbone et par conséquent de visualiser
seulement les effets du gaz d'intérêt. De plus, les champignons
étant aérobies, la présence de CO2 peut aussi
réduire la croissance fongique. En effet, on note en figure 7, une
croissance systématiquement plus forte lorsque le CO2 est
piégé par la chaux sodée.
22
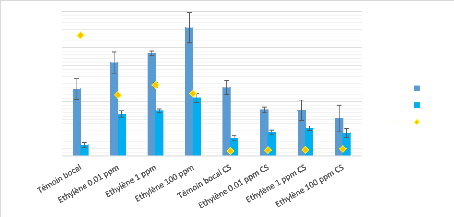
La concentration moyenne en aflatoxines B1 et B2 et le taux de
CO2 dans les différentes conditions testées chez A. flavus
en présence ou non de chaux sodée sont
représentés dans le figure 9. La première observation
montre une réduction significative du taux de CO2 présent dans
les conditions expérimentales lorsque 50 g de chaux sodée sont
ajoutés. En effet, sans chaux sodée, les teneurs de CO2
avoisinnent les 1% tandis que ces dernières sont diminuées d'un
facteur 10 lors de l'ajout de chaux sodée. On remarque également
que, en absence de chaux sodée, il semble y avoir une stimulation de la
production d'aflatoxines lors d'un traitement à
l'éthylène, plus la concentration en éthylène
appliquée est importante, plus les productions d'AFB1 et AFB2 semblent
importantes. Cependant, malgrès cela, cette figure montre bien que
l'éthylène a un effet sur la toxinogénèse fongique
puisque lorsqu'on s'affranchit de l'effet antagoniste du CO2, on observe une
diminution de la production d'aflatoxines et surtout de l'AFB1 (exemple
: [éthylène 1 ppm] = 567,64 ug/L alors que
[éthylène 1 ppm CS] = 252,59 ug/L, autrement dit, une
réduction d'un facteur 2,25).
[Aflatoxines] (ug/L)
400.00
800.00
700.00
600.00
500.00
300.00
200.00
100.00
0.00
0.80
0.60
0.40
0.20
0.00
1.60
1.40
1.20
1.00
CO2 (%)
AFB1
AFB2 CO2
Figure 9 - Dosage de l'AFB1, AFB2 et du CO2 chez A. flavus
avec et sans chaux sodée après 72h d'incubation.
CS =
présence de chaux sodée
4. Penicillium expansum
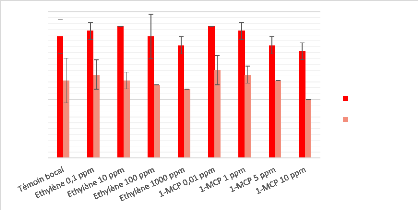
La figure 10 présente les résultats de la
croissance radiale obtenue pour P. expansum. Pareillement à
A. flavus, aucune différence significative n'a
été observée entre les conditions témoins et celles
où les gaz d'intérêts étaient testés.
L'éthylène et le 1-MCP n'ont donc aucun effet significatif sur la
croissance radiale de ce champignon avec des valeurs mesurées oscillant
entre 2,26 cm et 2,40 cm sans chaux sodée. Cependant, on observe une
diminution de la croissance (? 0,2 - 0,3 cm) dans toutes les conditions lorsque
50 g de chaux sodée sont ajoutés au système
d'expérimentation, contrairement aux expériences avec A.
flavus (Figure 7).
Diamètre (cm)
2.5
2.3
2.1
1.9
1.7
1.5
Sans chaux sodée
Avec chaux sodée
23
Figure 10 - Mesure de la croissance radiale de P. expansum
avec et sans chaux sodée après 72h d'incubation. 1-MCP =
MéthylCycloPropène
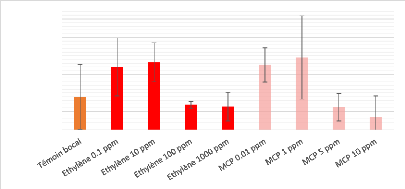
La figure 11 présente la concentration moyenne de
patuline dans les différentes conditions de culture. On remarque que la
production de patuline est augmentée d'un facteur 1,3 pour les petites
concentrations de gaz testées (éthylène : 0,1 ppm (369,9
ug/L) et 10 ppm (382,5 ug/L) ; 1-MCP : 0,01 ppm (375,6 ug/L) et 1 ppm (395,7
ug/L)) par rapport à celle du témoin (288,9 ug/L), tandis que les
fortes concentrations de ces mêmes gaz ne semblent pas modifier la
production de patuline en comparaison à la condition de culture
contrôle (témoin bocal). Ces observations sont en
adéquation avec les résultats précédemment obtenus
par Kepczynski et Kepczynska (1977), qui ont montré que la germination
des spores de P. expansum était augmentée lors d'une
exposition à faibles doses d'éthylène et diminuée
lors d'une exposition à de fortes doses d'éthylène. On
peut donc supposer que la diminution de la concentration en patuline
observée pour les fortes doses d'éthylène et de 1-MCP est
due à une diminution de la germination initiale des spores conduisant
à une réduction de la croissance fongique.
[Patuline] (ug/L)
450.00
400.00
500.00
350.00
300.00
250.00
200.00
Figure 11 - Dosage de la patuline chez P. expansum
après 72h d'incubation sans chaux sodée. MCP
=
MéthylCycloPropène
24
5. Aspergillus parasiticus
De manière similaire aux deux précédents
champignons étudiés, les résultats obtenus pour A.
parasiticus ne semblent pas montrer d'effet de l'éthylène et
du 1-MCP sur sa croissance. En effet, les valeurs mesurées oscillent
entre 3,20 cm et 3,27 cm (? = 0,07). Par manque de temps, nous n'avons pas pu
expérimenter l'utilisation de la chaux sodée sur ce
champignon.
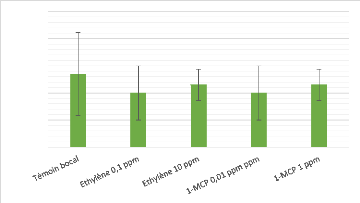
3.5
3.4
Diamètre (cm)
3.3
3.2
3.1
3
Figure 12 - Mesure de la croissance radiale de A.
parasiticus sans chaux sodée après 72h d'incubation. 1-MCP =
1-MéthylCycloPropène
Les figures 13 et 14 représentent la concentration
moyenne en aflatoxines (AFB1, B2, G1 et G2) présente dans les
différentes conditions testées chez A. parasiticus. De
manière surprenante, il semblerait qu'un traitement à
l'éthylène ou au 1-MCP favoriserait la production d'aflatoxines
sous toutes ses formes. En effet, sauf pour l'AFB1 où chaque condition
testée reste très similaire à celle du témoin, on
remarque que les aflatoxines B2, G1 et G2 ont vu leur production augmenter d'un
facteur allant de 1,3 à 1,5 lors d'un traitement à 0,1 ppm
d'éthylène et d'un facteur de 1,5 à 2 lors d'un traitement
à 10 ppm de ce même gaz. A l'inverse, bien que la production
d'aflatoxines totales reste supérieure à celle du témoin,
en présence de 1-MCP la concentration en aflatoxines diminue avec
l'augmentation de la teneur en 1-MCP. Cette dernière observation semble
logique puisque ce dernier étant un antagoniste compétitif de
l'éthylène et si l'éthylène favorise la production
d'aflatoxines, alors le 1-MCP aura tendance à diminuer cette
production.

600.00
[Aflatoxines] (ug/L)
500.00
400.00
AFG1
AFG2
300.00
200.00
45.00
40.00
[Aflatoxines] (ug/L)
35.00
30.00
AFB1
AFB2
25.00
20.00
15.00
10.00
700.00
100.00
Figure 13 - Dosage de l'AFB1 et AFB2 chez A. parasiticus
après 72h d'incubation sans chaux sodée. 1-MCP =
1-MéthylCycloPropène
Figure 14 - Dosage de l'AFG1 et AFG2 chez A. parasiticus
après 72h
d'incubation sans
chaux sodée. 1-MCP =
1-MéthylCycloPropène
25
| 


