
Cycle érythrocytaire: Les
mérozoïtes issus de la phase hépatique, présents dans
la circulation sanguine, envahissent les globules rouges. Dans ces derniers,
les mérozoïtes se développent d'abord en anneau, puis en
trophozoïte. Pendant ce stade, une intense activité
métabolique (approvisionnement en acides aminées, synthèse
nucléique et protéique) se réalise; le parasite peut
dégrader jusqu'à 75% d'hémoglobine de la cellule
hôte pour se nourrir et former le pigment malarique. Au bout d'une
trentaine d'heures après l'invasion, le parasite commence sa division
nucléaire: c'est la schizogonie érythrocytaire.
L'éclatement des schizontes mûrs libère, dans le sang, des
mérozoïtes et des déchets métaboliques (pigments et
débris cellulaires pyrogènes responsables des accès de
fièvre). Ceci s'accompagne également d'un relargage
d'antigènes parasitaires dans le sang. Cette nouvelle
génération de mérozoïtes réinfecte rapidement
les érythrocytes. La phase érythrocytaire qui dure environ 48
heures induit un spectre de symptômes chez l'homme responsable de la
morbidité et de la mortalité associés à
l'infection. Après quelques cycles érythrocytaires, des
gamétocytes se différencient en gamétocytes mâles et
femelles, lesquels ne pourront poursuivre leur évolution que chez le
moustique. Ils restent vivants une vingtaine de jours chez l'hôte humain
puis disparaissent. Ces éléments n'évolueront plus, mais
ils persisteront dans le sang de l'homme qui est alors le
« réservoir du parasite ». Avec P. falciparum, et
lui seul, toute la fin de la schizogonie se fait dans les capillaires
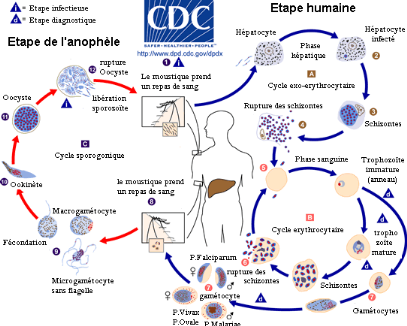
Figure 2: Cycle de développement du
Plasmodium'[10]
1.5. Physiopathologie du paludisme
1.5.1. L'infection asymptomatique :
L'infection asymptomatique ou paludisme d'infestation se
définit comme étant l'absence de manifestations cliniques chez un
individu présentant des formes asexuées du parasite à
l'examen du sang périphérique. Un tel sujet est un porteur sain
et constitue un important réservoir du parasite en zone
d'endémie. Ce portage asymptomatique peut évoluer à tout
moment vers un paludisme clinique simple ou grave.[11].
1.5.2. Paludisme simple :
C'est l'expression d'une infection symptomatique sans signes
de gravité et/ de dysfonctionnement des organes vitaux. [12]. La
période d'incubation de la maladie varie de 9 à 30 jours, selon
l'espèce plasmodiale, son mode de transmission, le statut immunitaire de
l'hôte, la chimio-prophylaxie antipaludique utilisée et la
densité des inocula parasitaire. Une période d'incubation courte
(9 à 14 jours) est typique de P. falciparum [13].
Les manifestations cliniques courantes du paludisme simple ne
sont pas spécifiques, et imitent ceux d'autres maladies telles que le
syndrome pseudo-grippal. Elles comprennent, fièvre, frissons, sueurs,
nausées et vomissements, courbatures, myalgies, céphalées,
troubles digestifs, sensation générale de faiblesse.
L'hypertrophie de la rate ou du foie, l'augmentation de la fréquence
cardiaque ou respiratoire, le jaunissement des yeux, peuvent s'ajouter. Le
syndrome fébrile reste cependant un symptôme clé dans le
diagnostic du paludisme simple.
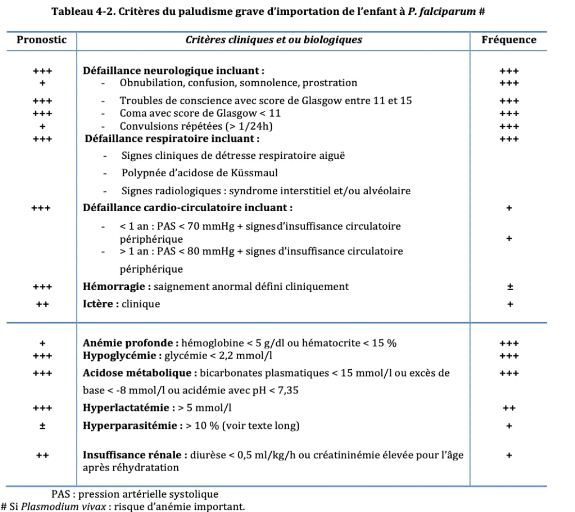
1.5.3. Paludisme grave
Selon l'OMS, le paludisme grave se définit par la
présence de formes asexuées de P. falciparum à
l'examen microscopique du sang périphérique, associée
à une ou plusieurs des manifestations cliniques telles que
l'altération de l'état de conscience, les convulsions
généralisées et répétées,
l'anémie sévère, l'insuffissance rénale,
loedème aigu du poumon, l'hypoglycémie, collapsus circulaire,
etc. [14]:
Tableau 1 : Critères de gravité du
paludisme
Le neuropaludisme et l'anémie
grave sont les complications majeures du paludisme à
P. falciparum. Plusieurs théories probablement
complémentaires sont actuellement retenues, notamment la
séquestration d'hématies parasitées par des formes matures
de Plasmodium, adhérant aux cellules endothéliales des
microvaisseaux, et l'intervention de cytokines ou autres
médiateurs.
Primum movens : la cytoadhérence: elle
existe entre les globules rouges parasités par les stades asexués
« matures » (trophozoïtes âgés, schizontes) et les
cellules endothéliales vasculaires. et est responsable :
· d'un ralentissement du flux sanguin dans les
capillaires (phénomène mécanique) ;
· d'une réaction inflammatoire tissulaire
cytokinique (phénomène inflammatoire).
La Séquestration consiste chez les
hématies parasitées par les stades trophozoïtes
âgés et schizontes de P. falciparum
qui ont, contrairement aux autres espèces, la
capacité de se fixer aux cellules endothéliales des capillaires
(cerveau, avec risque de coma par neuropaludisme, mais aussi reins, foie,
poumons...). Ces formes matures sont donc absentes de la circulation sanguine
périphérique. Cette séquestration est due à des
phénomènes d'adhérence cellulaire
(cytoadhérence)[15] entre les hématies
parasitées et les cellules endothéliales de ces capillaires, sous
la dépendance d'interactions entre des récepteurs
moléculaires plasmodiaux présents à la surface des
hématies parasitées (en particulier PfEMP1) et
des récepteurs spécifiques des cellules endothéliales (en
particulier ICAM1). Le blocage des hématies
parasitées dans les capillaires provoque un ralentissement
circulatoire, directement proportionnel au nombre d'hématies
parasitées (phénomène mécanique). Cette
séquestration est de plus amplifiée par une
déformabilité moindre des hématies parasitées et
par la formation de « rosettes » (agrégats constitués
d'une hématie parasitée à laquelle adhèrent
plusieurs hématies non parasitées). Le ralentissement de la
circulation capillaire provoque une hypoxie tissulaire, qui active le
métabolisme cellulaire de glycolyse anaérobie avec pour
conséquence l'acidose lactique et des
dysfonctions organiques. Une autre conséquence de cette
cytoadhérence est la mort par apoptose des cellules
endothéliales qui présentent à leur surface les
antigènes plasmodiaux exposés après la rupture du
schizonte, les restes de la membrane du globule rouge éclaté
restent « collés » à la cellule endothéliale.
Lorsque la parasitémie est élevée, la résultante de
cette apoptose intense est la perméabilisation de la
paroi des microvaisseaux avec apparition de micro-hémorragies
tissulaires (visibles à l'observation du fond d'oeil).
Contrairement aux étapes précédentes, ce
phénomène n'est pas réversible et, dans ce cas,
l'évolution est très souvent défavorable
(séquelles, décès)[16]
La pénétration et le développement
intraérythrocytaire de Plasmodium déterminent des
modifications des cellules-hôtes, et constituent la cause principale de
l'anémie palustre. Bien que non expliquées, les
modifications des érythrocytes parasités ont été
abondamment décrites Nous rappellerons l'existence de << knobs ))
ou excroissances, localisées sur le plasmalemme des hématies
parasitées Ces excroissances sont responsables de l'adhésion des
érythrocytes parasités aux endothéliums capillaires et
peuvent expliquer la séquestration des hématies parasitées
dans les capillaires viscéraux .
:1.6 Les marqueurs de
virulence de Plasmodium falciparum
La
virulence
d'un agent infectieux mesure sa capacité à se développer
dans un organisme (pouvoir invasif) et à y
sécréter des toxines (pouvoir toxique ) [17]. Dans notre
cas, c'est donc la capacité du Plasmodium falciparum à
infecter l'Homme et à induire ensuite une pathologie. La
présentation clinique de l'infection plasmodiale causée par
P.falciparum. va de l'infection asymptomatique à l'infection
fébrile aiguë modérée à l'infection grave et
compliquée avec insuffisance organique [18]. Bien que les facteurs
contribuant à ce large spectre de symptômes n'aient pas encore
été bien caractérisés, certains auteurs pensent que
la virulence parasitaire est un facteur contributeur important[19], [20]. De ce
fait, il serait donc nécessaire de déterminer les souches de
Plasmodium responsables ou pas de la symptomatologie clinique. Pour
ainsi mettre en évidence ces différentes souches et en
déterminer le lien avec la virulence du parasite, plusieurs
études ont été menées sur certains gènes
tels que le Pfmsp1, Pfmsp2, ama1, Pfmp1 etc. Or, un lien clair entre
ces gènes et la symptomatologie clinique n'a pas encore
été bien établi d'où la nécessité de
caractériser la virulence de Plasmodium en utilisant ces
marqueurs.
Pfmsp1 et 2 sont parmi les cibles du vaccin contre
le paludisme au stade sanguin jouant un rôle important dans
l'identification des espèces génétiquement distinctes des
sous-populations parasitaires de P. falciparum[21]. Ils sont
impliqués dans l'invasion des érythrocytes et sont ciblés
par les réponses immunitaires '''''''''''''''''''[22]. Pfmsp 1
est une protéine de surface de plus de 190 KDa situé sur le
chromosome 9 et contient 17 blocs de séquences flanqués de
régions conservées . Le bloc 2, qui est la partie la plus
polymorphe de Pfmsp 1, est regroupé en trois familles
alléliques à savoir K1, MDA20 et R033 . Pfmsp 2 est une
glycoprotéine situé sur le chromosome 2 et composé de cinq
blocs dont le bloc central est le plus polymorphe [18]. Lamsp2 les
allèles sont regroupés en deux familles alléliques, F7 et
3D7/IC1 [23]
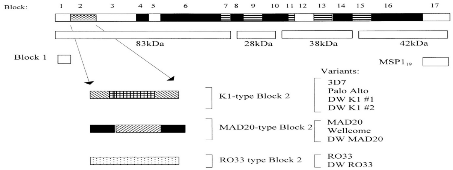
Figure 3:
Représentation schématique du gène Pfmsp 1 de P.falciparum
montrant les 17 domaines [24]

Figure 4: Diagramme
schématique du gène Pfmsp 2 illustrant les blocs 1 à 5
[24]
Figure 4:
Diagramme Schématique du gène msp-2 illustrant
les bloc 1 à 5
Autres marqueurs
D'autres marqueurs tels que ;Apical Membrane
Antigene 1, PfEMP1, Pfmsp 3, Eba 175 pourraient jouer un
rôle important dans la virulence et le polymorphisme de
P .falciparum.
1.6. Paludisme au Gabon
1.6.1. Epidémiologie
Le Gabon est un pays d'Afrique Centrale situé en zone
équatoriale, sa population est estimée à 2119000
habitants, il est limité à l'ouest par l'Océan Atlantique,
à l'est, au sud-est et au sud par la
République
du Congo, au nord-ouest par la
Guinée
équatoriale et au nord par le
Cameroun.
Figure 5: Carte du Gabon
[25]
Le climat chaud et humide que l'on retrouve au Gabon est
favorable au développement de l'anophèle. C'est une zone
où la transmission est encore hyper-endémique-----------[26],
[27]. P. falciparum est l'espèce parasitaire
prédominante au Gabon, suivie de Plasmodium malariae
------------[26]-[28]. D'après le Programme National de Lutte
contre le Paludisme (PNLP), le
paludisme est responsable de la consultation médicale
de 45% des enfants et 71% des femmes enceintes au Gabon[29].
Mais, peu de données existent sur la géographie de cette maladie
meurtrière
1.6.2. Marqueurs de virulence au Gabon
Le lien entre la virulence de Plasmodium et les
marqueurs de virulence étudiés au Gabon n'est pas clairement
établi. Cependant, des études sur le polymorphisme
génétique de P. falciparum ont permis de décrire
la diversité génétique de ce parasite dans
différentes régions au Gabon, aussi bien chez les patients
présentant un paludisme simple à sévère que chez
les enfants asymptomatiques-----[30], [31].
Ces études basées sur l'amplification des
gènes msp-1 et msp-2 avaient pour objectif de
caractériser le profil génétique des isolats de
Plasmodium dans le but ultime d'une possible élimination du
paludisme. L'étude de msp-1 montre une grande diversité
allélique de ce gène, qui serait compatible avec le niveau
élevé de transmission du paludisme au niveau de
Libreville-----[30]. Cette diversité génétique de P.
falciparum est cependant très variable d'une région
à une autre.-----[30], [31]. De plus une prédominance de
l'allèle K1 a été signalée au niveau du
Gabon[31].
II. LES OBJECTIFS DE L'ETUDE
2.1. Objectif général
L'objectif général de cette étude est de
déterminer les différents allèles associés au
statut clinique chez les enfants infectés vivants dans notre zone
d'étude..
2.2. Objectifs spécifiques
Ø Déterminer la prévalence de l'infection
plasmodiale chez les asymptomatiques et les symptomatiques ,
Ø Déterminer la prévalence des
différentes espèces plasmodiales chez les asymptomatiques et les
symptomatiques
Ø Déterminer la prévalence des
coïnfections plasmodiales chez les asymptomatiques et les symptomatiques
Ø Comparer la distribution de Pfmsp 1 et 2 des
différentes espèces plasmodiales en fonction du statut
clinique
III. MATERIELS ET METHODES
3.1. Caractéristiques de l'étude
| 


