CONCLUSION PARTIELLE
Les données obtenues dans cette étude ont
été possible grâce à l'usage d'un nombre important
de matériels. Certains matériels ont été
utilisés sur le terrain et d'autres au laboratoire. L'extrait aqueux qui
a été utilisé comme biofertilisant est un matériel
innovant et facile d'accès.
22
CHAPITRE IV : METHODES
Tous travaux de recherche nécessitent l'adoption d'une
méthodologie. Ce chapitre abordera donc les différentes
méthodes utilisées dans le cadre de notre travail.
IV.1 PREPARATION DU BIOFERTILISANT
IV.1.1 Collecte du costus afer
La matière fraiche de Costus non encore mature
(sans fleur) a fait l'objet d'échantillonnage au sécateur. Ces
échantillons étaient constitués de feuilles et de tiges.
Les tiges entières ont été sectionnées à la
base et conditionnées dans un sac en plastique et mises à l'abri
du soleil. Elles ont par la suite été lavées à
l'eau de robinet pour les débarrasser des poussières et autres
éléments potentiellement contaminants. La biomasse a
été utilisée directement pour la réalisation de
l'extrait aqueux.
IV.1.2 Extraction aqueuse
La technique a consisté à broyer le Costus
récolté, dans un mortier, jusqu'à l'obtention du
broyat. Au total deux (02) kilogrammes de broyat ont été
dilué dans un (01) litre d'eau de robinet ; la solution aqueuse obtenue
a été agitée manuellement en malaxant les résidus
solides dans l'eau. A l'aide d'un tissu propre, la solution a été
filtrée en essorant les résidus dans le tissu servant de filtre.
Cette manipulation a été répétée
jusqu'à l'obtention d'un filtrat limpide, soit quatorze (14) dilutions.
Un échantillon de 500 cc de chacune des quatorze dilutions a
été prélevé ; puis le tout a été
mélangé dans un grand bidon pour former un échantillon
composite. Plusieurs échantillons composites ont été
constitués et laissés en fermentation durant quatre mois.
IV.1.3 Conditionnement
L'échantillon composite de l'extrait aqueux de
Costus afer Ker Gawl a été conditionné à
différents volumes : 250 cc ; 500 cc ; 750 cc et 1000 cc pour une
application sur une superficie de 15 m2. Deux conditionnements de
1000 cc ont été réalisés pour deux méthodes
d'application.
IV.2 DOSE D'ENGRAIS
Les doses d'engrais NPK et d'urée ont été
faites selon la pratique conventionnelle en riziculture. Soit, 150 kg/ha pour
le N-P-K et 80 kg/ha pour l'urée.
IV.3 MISE EN PLACE DE L'ESSAI
IV.3.1 Mise en culture
La semence (La variété de riz VA6) a
été séchée pendant 24 heures pour lever la dormance
avant d'être trempée dans l'eau avec l'emballage durant 24 heures
à nouveau. C'est à la suite que la semence a été
essorée et séchée sous abri durant 24 heures pour aboutir
à une pré germination de la semence.
Cette semence a été légèrement
enfouie dans le sol sous un paillage de protection. Apres la germination, la
pépinière a duré 11 jours et le repiquage s'est
effectué au 12ème jour dans un écartement de 20
cm X 20 cm.
IV.3.2 Mise en place du dispositif
Une surface de 418 m2 a été
défrichée et délimitée en 21 micros parcelles de 15
m2 réparties en trois (03) blocs de 7 micros parcelles. Dans
un dispositif expérimental en blocs complets randomisés (figure
2), différentes doses d'extrait aqueux fermentés et d'engrais
minéraux ont été apporté. Chaque traitement a
été répété trois fois. Une distance d'un
mètre a été laissée entre les
répétitions. A l'intérieur d'une même
répétition, les micros parcelles ont été
séparées de 0,5 mètre.
23
T0 : Témoin à blanc
|
T1 : 250 cc
T2 : 500 cc
|
T3 : 750 cc
T4 : 1000 cc
T5 : 1000 cc
|
T6 : N-P-K et Urée
|
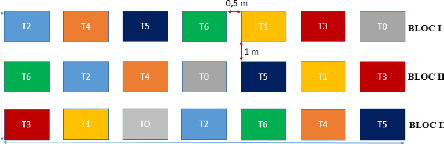
Figure 2 : Dispositif expérimental
IV.3.3 Application des fertilisants
Chaque fertilisant a été apporté à
la dose ainsi qu'à la période indiqué selon un dispositif
en bloc de Fischer constitué de sept (07) traitements avec trois (03)
répétitions (tableau III).
24
Tableau III : Doses et périodes d'application des
fertilisants
|
TRAITEMENT
|
DOSE A
|
QUANTITE
|
PERIODE
|
TYPE
|
|
L'HECTARE
|
APPLIQUEE
|
D'APPLICATION
|
D'ENGRAIS
|
|
(litre/ha)
|
(cc)
|
|
|
|
T0
|
0
|
0
|
|
|
|
T1
|
166,66
|
250
|
Labour
|
|
|
T2
|
333,32
|
500
|
Labour
|
|
|
T3
|
499,98
|
750
|
Labour
|
|
|
166,6
|
250
|
Labour
|
|
|
T4
|
166,6
|
250
|
Repiquage
|
|
|
166,6
|
250
|
Tallage
|
|
|
166,6
|
250
|
Montaison
|
|
|
T5
|
666,66 kg/ha
|
1000 g/15m2
|
Labour
|
|
|
150
|
250
|
Avant repiquage
|
NPK
|
|
T6
|
40
|
97,83
|
Tallage
|
Urée
|
|
40
|
97,83
|
Montaison
|
Urée
|
T0 : Traitement témoin ; T1
: 250 cc au labour ; T2 : 500 cc au labour ;
T3 : 750 cc au labour ; T4 : 250 cc au labour
; 250 cc au repiquage ; 250 cc au tallage ; 250 cc à l'épiaison ;
T5 : 1000 cc au labour ; T6 : 250 g avant
repiquage ; 97,83 g au tallage ; 97,83 g à la montaison
IV.4 COLLECTE DES DONNEES
Les données ont été obtenues sur le terrain
ainsi qu'au laboratoire.
IV.4.1 Paramètres agromorphologiques du
riz
La hauteur des plantes et le nombre de talles ont
été notés aux différents stades d'évolution
du riz : Au tallage, à l'épiaison et à la maturité.
La hauteur (H) des plantes de riz a été mesurée depuis la
surface du sol jusqu' à l'extrémité de la feuille la plus
haute à l'aide d'un décamètre. Le nombre de talle sur 1
m2 (unité expérimentale) a été
déterminé afin de connaitre la densité de tallage.
IV.4.2 Paramètres de rendement du riz
A la maturité, le riz a été
récolté manuellement avec des faucilles sur 8 m2 en
laissant 2 lignes de bordure. Après séchage et battage, les
grains de riz ont été vannés. Les pailles et les grains
ont été séchés au soleil puis pesés
séparément. Le taux d'humidité des grains de riz a
été déterminé après
25
séchage à l'étuve à 70 °C
pendant 24 heures et le rendement en grain a été calculé
par rapport à l'humidité standard de 14 p.c. Les rendements en
grains (RDG) et en paille (RDP), la matière sèche totale (MST)
ainsi que l'indice de récolte (IR) ont été calculés
selon les formules suivantes :
Soit RDG = rendement en grain et MST = matière
sèche totale ; RDP = rendement en paille ;
RDG (t/ha) = (poids sec grain (kg)/ 8 (m2)) X
(10000/1000) X ((100-H)/86) équation (1)
RDP (t/ha) = (poids sec paille (kg) / 8 (m2)) X
(10000/1000) X (100/86) équation (2)
Avec H (p.c. humidité) = [M. initiale - M. finale / M.
initiale] X 100 équation (3)
avec M = masse d'une quantité de riz
prélevée pour chaque micro-parcelle.
MST (t /ha) = RDG + RDP équation (4)
JR = (RDG/MST) X 100 équation (5)
IV.5
PRELEVEMENT ET PREPARATION DES ECHANTILLONS
Les échantillons ont été
prélevés dans chaque micro parcelle puis séchés au
soleil. Après séchage ces échantillons ont
été pillés puis tamisés avec un tamis de maille 2
mm afin d'obtenir la fraction fine. Toutes les analyses en laboratoire ont
portées sur cette fraction fine. Toutefois, des mottes de sol ont
été laissées la détermination de la
stabilité structurale.
IV.6 DETERMINATION DU TAUX DE MATIERE
ORGANIQUE
Un sous échantillon de 5 g a été mis au
four à une température de 600 °c pendant cinq heures. Une
fois l'échantillon retiré du four, la différence de masse
obtenue a permis de calculer le pourcentage de matière organique
à l'aide de la formule ci-dessous.
|
Mi-Mf
%MO = Mi-Mt
|
X 100. équation (6)
|
avec Mt : masse de la tasse vide ; Mi : masse de la tasse
contenant l'échantillon ; Mf : masse de la tasse contenant
l'échantillon après le retrait du four
26
IV.7 DETERMINATION DE LA STABILITE STRUCTURALE DU
SOL
Une motte de terre de masse connue (M) a été
placée dans un tamis avant d'être immergée dans de l'eau de
robinet pendant 72 heures. Pendant ces 72 heures les mottes ont
été régulièrement agitées. Une fois les 72
heures écoulées, les mottes ont été retiré
et l'eau a été filtrée. Les débris obtenus ont
été pesés après séchage (m). La
stabilité structurale (SS) a été évaluée par
la proportion de terre recueillie dans l'eau (Le Bissonnais, 1996). Soit la
formule suivante :
|
M-m
???? = M
|
X 100. équation (7)
|
IV.8 DENOMBREMENT DES MICROORGANISMES DU SOL
Dans le cadre de notre étude, la technique des
suspensions dilutions de sol a été utilisée pour la mesure
des densités microbiennes. Cette méthode est facile à
réaliser, économique, et elle donne des résultats fiables
et reproductibles.
IV.8.1 Préparation des suspensions
dilutions
Les préparations des suspensions dilutions consistent
à disposer sur un portoir une série de 6 tubes
stérilisés, contenant chacun 9 ml d'eau physiologique. Puis,
peser 1 g du sol et le mettre dans le premier tube : c'est la suspension
dilution 10-1. Cette suspension a été agitée
pendant 30 minutes puis laissée reposée pendant 10 minutes.
Ensuite, nous avons transféré 1 ml de cette solution dans le
deuxième tube contenant déjà 9 ml d'eau physiologique ; il
s'agit de la suspension dilution 10-2. Agiter vigoureusement et
recommencer l'opération pour le restant des tubes en transférant
1ml de solution d'un tube à l'autre, afin de préparer les
suspensions dilutions 10-3, 10-4, 10-5 et
10-6 (figure 3).
1 g de sol 1 ml 1 ml 1 ml 1 ml 1 ml
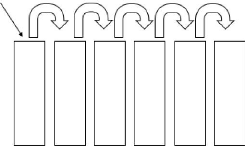
10-1 10-2 10-3 10-4
10-5 10-6
Figure 3 : Procédure de dilution
27
IV.8.2 Bactéries
Pour obtenir la densité microbienne du sol après
culture, les microplaques ont été ensemencées à
l'aide d'une micropipette en commençant par les dilutions les plus
faibles. Ceci, dans le but d'éviter les contaminations. Nous avons
ensemencé 72 puits de chaque microplaque en raison de 24 puits par
dilution. Toutefois, une colonne de huit puits a été
laissée vide entre chaque dilution toujours dans le but d'éviter
les contaminations. Dans chaque puit nous avons mis 180 ml du milieu de culture
NB puis ajouter 20 ìl de suspension. Les microplaques sont ensuite
incubées à 28 °C, à l'étuve pendant 7 jours.
Après incubation, la croissance des bactéries a été
mesurée au lecteur de microplaque à 620 nm de densité
optique correspondant, soit à l'apparition d'un trouble bactérien
ou d'un changement de couleur. Les résultats ont été
traités par un programme statistique déterminant le Nombre le
Plus Probable (NPP) de bactéries présentes dans
l'échantillon.
IV.8.3 Champignons
La méthode des suspensions dilutions, mise au point
pour le dénombrement des bactéries, est également
utilisable pour les champignons. 100 ìl de la suspension de chaque
dilution (10-1 à 10-3) de sol ont
été utilisés pour ensemencer les boîtes de
Pétri contenant le milieu Sabouraud de composition suivante : 10
g.l-1 de peptone, 40 g.l-1 de glucose et 20
g.l-1 d'Agar est stérilisé dans un autoclave à
120 °C pendant 20 minutes. Une fois tiédi, un antibiotique, le
chloramphénicol est ajouté à la dose 500 mg.l-1
afin d'inhiber la croissance bactérienne. Après trois jours
d'incubation à l'étuve à 28 °C, la
détermination du nombre le plus probable de propagules a
été faite par comptage des colonies et est exprimée en UFC
(nombre d'Unités Formant Colonies) /g de sol selon la formule
mathématique ci-dessous. Seules les boîtes contenant entre 15 et
150 colonies au niveau de deux dilutions successives ont été
retenues pour le dénombrement.
N = ? colonie / (V (ml) X (n1+0,1n2) X d1) équation
(8)
Où : N : Nombre d'UFC par gramme de sol ; ? colonies :
Somme des colonies des boîtes interprétables ; V : Volume de
solution déposée (100 ul) ; n1 : Nombre de boîtes
considéré à la première dilution retenue ; n2 :
Nombre de boîtes considéré à la seconde dilution
retenue ; d1 : Facteur de la première dilution retenue.
IV.9 DETERMINATION DU pHeau DU SOL
Le pHeau a été déterminé à
l'aide d'un rapport de 1/2,5 (m/v). De façon plus pratique nous avons
prélevé un sous échantillon de 10 g. Par la suite nous y
avons ajouté 25 cc d'eau distillée et l'ensemble a
été agité (30 minutes) puis laissé reposer pendant
30 minutes. Nous avons procédé à la lecture du
28
pH en plongeant l'électrode du pH mètre dans la
solution de sol obtenue. Cette manipulation a été
répétée trois fois de suite et la moyenne obtenue a
été considérée comme la valeur du pHeau.
IV.10 ANALYSES STATISTIQUES
IV.10.1 Analyse de variance
Les données obtenues ont été saisies avec
Excel. Les données de la hauteur moyenne (HAUT), de la densité de
tallage (TAL/m2) ont été soumises à l'analyse
de variances (ANOVA) au seuil á = 0,05 à l'aide du logiciel SAS
version 9 pour tester l'effet des traitements appliqués sur le
développement végétatif des plants de riz. La
classification des valeurs moyennes par la méthode de Newman et Keuls a
permis d'identifier les traitements pour lesquels les niveaux de
développement végétatif sont significativement
différents. Les données de rendements en paille (RDP) ont
également été soumises à l'ANOVA pour tester
l'effet des traitements. La classification des valeurs moyennes par la
méthode de Newman et Keuls a permis d'identifier les traitements pour
lesquels les performances agronomiques sont significativement
différentes.
IV.10.2 Mixed model
Les données de rendements en grain (RDG) et les indices
de récoltes (IR) ont été analysées en tenant compte
des dégâts observés. Dans ce model on considère les
dégâts observés comme le facteur aléatoire. Cette
analyse permet de tenir compte des dégâts et de donner une
estimation des rendements ainsi que des indices de récoltes. Avec ce
model on peut mieux évaluer l'effet des traitements. A l'aide du t-test
nous avons également comparé la différence entre les
rendements pris deux à deux.
IV.11 ETUDE ECONOMIQUE
Pour justifier l'adoption du Costus afer, il fallait
vérifier si son utilisation nous permettait d'avoir un
bénéfice au moins similaire au bénéfice
engendré par l'utilisation des engrais. Pour ce faire, nous avons
calculé le coût de production et le prix de vente puis des deux
nous avons déduire les différents gains. Pour le coût de
production nous avons tenu compte que du prix d'achat des fertilisants.
Coût de production (FCFA/t) = Prix d'achat des engrais X
Quantité d'engrais utilisée équation (9)
Prix de vente (FCFA/t) = RDG (kg/t) × Prix du kg de paddy
équation (10)
Bénéfice (FCFA /t) = Prix de vente (FCFA/t) -
Coût de production (FCFA/t) équation (11)
| 


