I.2.3.Voie des pentoses phosphate
Le rôle général de la voie des pentoses
phosphate est la synthèse de précurseurs des acides
nucléiques tels que le ribose-5-phosphate et de permettre l'utilisation
des pentoses ou du gluconate comme source de carbone. Elle est
constituée de sept enzymes interagissant avec la voie de la glycolyse.
Elle ravitaille la glycolyse au niveau du fructose 6P et de
glycéraldéhyde 3P.
-Les trois premières enzymes, la glucose-6-phosphate
déshydrogénase, la 6-phosphogluconolactonase et la
6-phosphogluconate déshydrogénase constituent une voie oxydative
irréversible dans laquelle le glucose-6P est converti en ribose-5-P
(Ru5P) avec la formation de 2 moles de NADPH par mole de Ru5P.
- Les réactions suivantes sont catalysées par la
transaldolase, la transacétolase et la ribose 5-P-phosphate constituent
une voie non oxydative et réversible.
Chapitre I Etude bibliographique
11
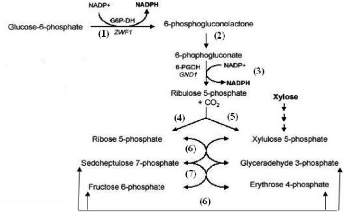
Fig. I.7. la voie des pentoses phosphates chez
Corynebacterium glutamicum: (1)
:glucose-6-phosphate
déhydrogénase, (2) :
6-phosphogluconolactonase , (3) : 6- phosphogluconate
déhydrogénase , (4) :ribose-5-
phosphate isomérase (5), ribulose-5-phosphate
epimérase , (6) : transcétolase et (7) : transaldolase .
I.2.4. Cycle de Kreps
Généralement, l'approvisionnement du cycle de
Kreps en acétyl-CoA previent de pyruvate quand les cellules poussent sur
des sources de carbone à 5 ou 6 carbone ou du lactate.
Chez C. glutamicum, la pyruvate
déshydrogénase catalyse la décarboxylation oxydative du
pyruvate en acétyl-CoA en aérobiose.
L'acétate kinase (AK) et la
phosphotransacétylase (PTA) sont deux activités combinés
pour former l'acétyl-CoA lorsque l'acétate est utilisé
comme source de carbone par C. glutamicum. (Reinscheid et
al., 1999 ; Chiio et al., 1969).
L'acétyl-CoA est condensé avec
l'oxaloacétate pour former du citrate qui sera ensuite
isomérisé en isocitrate. Au lieu d'être
décarboxylé, isocitrate est clivé par l'isocitrate lyase
en succinate et glyoxylate.(boulahya, 2010) . L'une des enzymes clés du
cycle de Krebs impliquées dans la production du glutamate est le
2-oxoglutarate déshydrogénase (ODH). Elle
catalyse la décarboxylation irréversible de 2-oxoglutarate en
succinyl-CoA avec libération d'une molécule de NADH. Nakamura et
al. (2007) ont montré que l'activité de ce complexe
enzymatique diminue au cours de la production du glutamate par induction.
Chapitre I Etude bibliographique
12
I.2.5.Voie de biosynthèse du glutamate
Chez les microorganismes, le glutamate est
synthétisé par deux voies métaboliques :
-soit par le glutamate déshydrogénase (GDH).
-soit par la glutamine synthétase (GS) couplée avec
glutamine amide á-cétoglutarate amino transférase
GOGAT.

Fig. I.8. Voies de biosynthèse du
glutamate. GDH : glutamate déhydrogénase, GS :
glutamine
synthétase, GOGAT : glutamine amide á-cétoglutarate
amino-transférase.
La biosynthèse du glutamate chez Corynebacterium
est principalement dépendante de l'activité GDH. Celle-ci
catalyse la réaction réversible de la synthèse du
glutamate et de NADP+ à partir d'á-
cétoglutarate , de NADPH et d'ammonium lorsque ce dernier est
présent à de fortes concentrations (> 1 mM).
L'activité GS est une réaction
indésirable lors de la fermentation glutamique car elle utilise une
partie du glutamate en synthétisant la glutamine.
La synthèse du GS/GOGAT chez C. glutamicum est
induite lorsque la concentration d'ammonium diminue dans le milieu de culture
(Tesch et al., 1998; Elke et al., 1993; Börmann et
al., 1992).
Chapitre I Etude bibliographique
13
| 


