(De Bruyne A. et al., 2006; Dupouy-Camet et al., 2002 ; Gamble
H.R. et al, 2004)
Le diagnostic sérologique consiste en la recherche
d'anticorps anti Trichinella dont la détection a une bonne
valeur diagnostique.
Les anticorps peuvent être détectables à
partir du 15e jour suivant l'infestation, (délai de
positivité des anticorps: de 15 à 30 jours, atteignant le taux
maximal en 4 mois). La recherche d'IgA spécifiques dirigées
contre les larves L1NN pourrait permettre une détection précoce
de l'infection : plus de 80 % des sujets sont séropositifs après
3 semaines (Mendez-Loredo B, 2001).
Le délai d'apparition des anticorps dépend de
l'espèce de Trichinella et de la dose infestante (plus celle-ci
est faible, plus les anticorps apparaissent tardivement).
Une sérologie négative associée à
des signes fortement évocateurs ne doit pas faire éliminer
définitivement le diagnostic, et il ne faut pas hésiter à
renouveler cet examen quelques jours plus tard.
Les IgG atteignent un maximum en 4 mois et persistent ensuite
plusieurs années (Harms G, 1993).
Flusieurs techniques ont été décrites pour
la détection de la trichinellose chez l'homme, l'hémagglutination
indirecte (HAI), la floculation bentonite, l'agglutination au latex,
l'immunofluorescence indirecte et l'ELISA sont les tests les plus couramment
utilisés pour le dépistage de la parasitose surtout, le dernier
étant le plus sensible (Murrell et Bruschi, 1994;. Dupouy-Camet et al,
2002).
Actuellement, la technique ELISA est la méthode la plus
couramment utilisée pour le dépistage de la trichinellose chez
l'homme, car elle est économique, fiable, facilement standardisée
et fournit un équilibre acceptable entre sensibilité et
spécificité. Récemment, il semblerait, que la technique du
Western Blot, pourrait apporter une aide au diagnostic de la trichinellose, en
confirmant ou infirmant les résultats de l'ELISA .
Nous avons employé lors de notre étude
séro-épidémiologique une technique ELISA
anti-Trichinella, que nous allons décrire ci-après :
· Source d'antigenes -technique ELISA- :
(Gamble H.R. et als, 2004) Dans les années 1970 les
antigènes somatiques préparés à partir d'extraits
de corps entiers de larves musculaires ont été utilisés
pour la technique ELISA dans la détection des anticorps anti-
Trichinella chez les porcs (Ruitenberg et al, 1974.; Ruitenberg et
als, 1977).
Cet extrait brut de larves, produit à partir des larves
musculaires L1 recueillies par digestion artificielle, ne doit pas être
utilisé pour les tests sérologiques chez les animaux ou les
humains en raison d'une forte probabilité de réactions
croisées avec d'autres agents pathogènes.
Par exemple, des réactions croisées se
produisent avec des échantillons de sérum provenant d'individus
infestés par Loa loa, Toxocara sp, et
Anisakis (J. DupouyCamet, communication personnelle; E. Pozio,
données non publiées).
Au cours des années 1980, la spécificité du
test ELISA a été améliorée par l'utilisation des
antigènes d'excrétion-sécrétion (ES) obtenus
à partir de l'incubation in vitro de larves musculaires L1 de
Trichinella (Gamble et al., 1983).
Ces antigènes, provenant de sécrétions
larvaires, sont de structure glycoprotéique. Les informations concernant
les antigènes de Trichinella ont été
résumées par Appleton et al. (1991) et Ortega-Pierres et al.
(1996).
L'épitope immuno-dominant de l'antigène reconnu
par les animaux et les humains infestés par Trichinella
spiralis, ou par d'autres espèces de Trichinella
actuellement connue, est le groupe TSL-1.
Les antigènes TSL-1 se trouvent dans les cellules des
stichocytes et sur la surface de la cuticule du parasite; ils sont activement
sécrétés par les larves musculaires L1.
Ces antigènes sont produits pour usage diagnostique par
culture in vitro de larves musculaires isolées ou par des
méthodes biochimiques de récupération de ce même
stade parasitaire.
Les Méthodes de préparation de ces
antigènes ont été publiés(Gamble et al, 1983;.
Seawright et al, 1983;. Grencis et al, 1986;. OIE, 2000) (pour une description
détaillée des méthodes).
Comme indiqué précédemment, les
épitopes antigéniques TSL-1 reconnus par les anticorps
anti-Trichinella des animaux et humains infestés sont communs
à toutes les espèces encapsulées et non encapsulé
(Appleton et al., 1991).
Par conséquent, l'antigène Trichinella
peut être systématiquement préparés à partir
de larves musculaires de T. spiralis, car cette espèce est
facilement maintenue sur des souris de laboratoire, et utilisé pour
détecter une infection par des espèces de Trichinella
par ELISA.
Les antigènes TSL-1 partagent un épitope
glucidique commun (le tyvelose), qui a été
synthétisé (Reason et al, 1994;.. Wisnewski et al, 1993).
Le Tyvelose synthétique est disponible dans le commerce
(Safe-Path Laboratoires, LLC, Carlsbad, CA), et a été
évalué dans plusieurs projets de recherche, où ses
performances se comparaient favorablement avec les antigènes ES lors de
tests sur les humains, les porcs et d'autres animaux (Gamble et al, 1997;
Bruschi. et al, 2001;. Owen et al,
2001;. Pozio et al,.2002a).
L'antigène carbohydrate synthétique offre les
avantages de la stabilité et de la standardisation. Il a
été démontré qu'il offre une plus grande
spécificité, chez de nombreuses espèces, mais peut
sacrifier de la sensibilité.
Des rapports récents sur d'éventuelles
réactions croisées obtenues avec l'antigène tyvelose et la
preuve que des glycanes contenant du tyvelose dans d'autres oeufs de
nématodes, soutiennent qu'il faudra d'autres études pour mieux
définir sa spécificité (Dea-Ayuela et al, 2001;.. Pozio et
al, 2002a).
L'immunofluorescence indirecte (IFI) (Figure n°16)
et surtout la méthode ELISA sont alors les deux méthodes les
plus utilisées pour le dépistage, mais de nombreuses
méthodes sérologiques ont été décrites.
L'IFI utilise comme antigène soit des coupes de muscles
de rats trichinés (diaphragme) soit des larves extraites de leur kyste
par digestion chlorhydropepsique des muscles.
L'inconvénient réside dans le fait qu'il y a une
possibilité de réaction croisée, à des taux
faibles, avec d'autres helminthes.
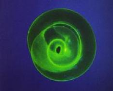
Figure n°16 : Larve de Trichinella en
immunofluorescence indirecte
La méthode la plus largement utilisée reste alors
la méthode ELISA qui est beaucoup plus récente.
Elle a donné des résultats très prometteurs
(spécificité : 77-87%) (J. Dupouy-Camet, communication
personnelle).
Cette dernière permet de détecter plus
précocement les anticorps IgG que l'IFI. Les tests ELISA sont
très sensibles mais ont une spécificité plus faible.
Le Western Blot permet donc la distinction des réactions
croisées (sensibilité : 99%) (Figure n°17) et donc
la confirmation des méthodes de dépistage.
Il utilise comme antigènes un extrait larvaire de T.
spiralis.
L'interprétation du test (présence de 3 bandes
spécifiques : 43, 44 et 64 kDa) tient compte de la présence
d'anticorps spécifiques dirigés contre les antigènes de la
famille du groupe TSL-1.

Figure n°17: Aspect d'immunoempreinte (Western
Blot). (De Bruyne et al., 2006) Profil 1 : profil
négatif chez un patient avec un test de dépistage (ELISA)
positif. Profil 2 : profil positif (présence de 3 bandes à 43, 44
et 64kDa).
Profil 3 : profil négatif.
· Diagnostic de laboratoire de
l'échantillon étudié:
Les échantillons de sang ont été
analysés pour vérifier l'éventuelle présence
d'anticorps anti-Trichinella.
Le diagnostic de laboratoire a consisté en une
sérologie par la technique immunoenzymatique (ELISA) pour la
détection des anticorps IgG anti-Trichinella (IVD Inc.) (Annexe
(3)).
Le diagnostic parasitologique de certitude n'a pas pu
être réalisé au cours de notre étude,
néanmoins, nous avons jugé utile de le rappeler.



