Chapitre III matériels et méthodes de
travail
III - 1 - Matériel
III - 1 - 1 - Matériel utilisé sur le
terrain
Pour la capture des Orthoptères nous avons
utilisé un filet fauchoir. Il comprend un manche solide en roseau d'un
mètre et demi de longueur portant sur l'une de ses
extrémités un cercle métallique de 0,4m de
diamètre. Un sac en toile est placé sur ce cercle
métallique. Il est d'une profondeur de 0,5m (Figure 6b). Pour
l'échantillonnage des criquets, nous avons délimité
à l'aide d'une ficelle, des carrés de 3m de coté (Figure
6a). Les Caelifères récoltés sont placés dans des
boites de Pétri chaque boite porte nécessairement une
étiquette indiquant le lieu, la date et le numéro de la station.
Les échantillons sont ramenés au laboratoire pour la
détermination. Durant les sorties nous avons utilisé un carnet de
prospection, dont lequel tous les renseignements concernant la sortie à
savoir la date, le lieu, l'altitude, la pente, la température et la
végétation, ainsi que toutes sortes d'informations sur le
comportement des insectes sont notés.
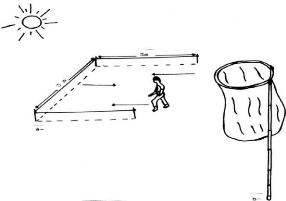
Figure 6. Méthode des quadrats : a)-
carré d'échantillonnage ; b)- filet fauchoir
III - 1 - 2 - Matériel employé au
laboratoire
III - 1 - 2 - 1 - Matériel utilisé pour la
détermination des Orthoptères
Pour la détermination des espèces
Orthoptéroloqiques nous avons utilisé la clé dichotomique
de Chopard (1943) et les boites de collection des Orthoptères de
l'insectarium du département de zoologie agricole de l'Institut National
Agronomique d'El Harrach. Une loupe binoculaire est utilisée pour
examiner avec précision les espèces acridiennes.
28
III - 1 - 2 - 2 - Matériel utilisé pour
l'étude du régime alimentaire
Pour l'analyse des fèces nous avons utilisé 5
verres de montre. Ces derniers servent à contenir les différents
produits pour l'étude du régime alimentaire. Des pinces pointes
fines et lisses sont nécessaires à la trituration des
fèces. Nous avons employé différents liquides de
l'éthanol absolu de l'eau de javel, de l'eau distillée et du
liquide de Faure. Les montages des épidermes sont réalisés
entre lame et lamelle. Une plaque chauffante est nécessaire pour
éliminer les bulles d'air existant entre lame et lamelle. Enfin pour
pouvoir observer les différentes cellules végétales on
doit utiliser un microscope photonique.
III - 2 - Méthode de travail
III - 2 - 1 - Méthodes utilisées sur le
terrain
III - 2 - 1 - 1 - Choix des stations
d'étude
Il convient de choisir la station ou site de prospection dans
un biotope homogène suffisamment vaste de façon à
éviter les effets de bordure et les interférences avec les
biotopes voisins. Le site choisi doit être représentatif d'une
catégorie de biotope largement représenté dans la
région. Par ailleurs, il est impératif de suivre
simultanément l'évolution des populations acridiennes dans
plusieurs biotopes écologiquement contrastés en vue de faire des
comparaisons. En effet, les peuplements acridiens seront différents et
certaines espèces ne pourront être suivies que dans certains
milieux car trop peu abondantes ou absentes dans les autres. L'humidité
constitue, ainsi que nous l'avons vu, le principal facteur discriminant de la
distribution des acridiens dans cette région. C'est pour cela nous avons
choisi 3 stations dans des milieux d'humidités différentes,
milieu non cultivé, milieu cultivé et une palmeraie. Pour
représenter la physionomie de la végétation, nous avons
jugé utile d'établir des transects végétaux pour
chaque type de station. Nous avons délimité une aire
d'échantillonnage de 10m sur 50m soit une surface de 500m2
La parcelle-échantillon de 500m2 est
représentée suivant une projection orthogonale et en vue de
profil. La projection verticale fournit des renseignements sur l'occupation du
sol et sur la structure de la végétation. Ces notions sont
complétées grâce à la représentation de
profil qui donne une idée sur la physionomie du paysage. Celui-ci est de
ce fait soit ouvert, semi fermé ou fermé. La connaissance de la
physionomie du paysage est importante sachant que les Orthoptères qui
sont assez héliophiles ne peuvent vivre en milieu fermé. Le taux
de recouvrement des espèces végétales sur le terrain est
estimé selon la méthode donnée par Duranton et al.,
(1982), qui consiste à estimer la surface de chaque espèce
végétale en
29
calculant la surface occupée par la projection orthogonale
du végétal. La surface est déterminée grâce
à la formule suivant :
it (d /2)2 x N
T = x 100
S
T est taux de recouvrement d'une espèce
végétale donnée
d est le diamètre moyen de la plante en projection
orthogonale
S est la surface du transect végétal soit
500m2
N est le nombre de touffes d'une espèce
végétale donnée
Tableau 8 : Taux de recouvrement des
espèces végétales dans le milieu non cultivé pour
un
transect de 500m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Aristida pungens
|
3
|
1,10
|
0,57
|
|
Aristida obtusa
|
79
|
0,15
|
0,30
|
|
Colocynthis vulgaris
|
2
|
0,75
|
0,20
|
|
Pituranthos
|
7
|
0,60
|
0,40
|
|
chloranthus
|
4
|
0,85
|
0,45
|
|
Pergularia
|
2
|
0,55
|
0,09
|
|
tomentosa
|
9
|
0,80
|
0,14
|
|
Peganum harmala
|
|
|
|
|
Arthrophytum scoparium
|
|
|
|
|
Total
|
2,15
|
Tableau 9 : Taux de recouvrement des
espèces végétales dans le milieu cultivé pour un
transect de 500m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Vitis vinifera
|
12
|
1,10
|
2,30
|
|
Citrus sinensis
|
4
|
1,20
|
0,10
|
|
Olea europea
|
9
|
1,60
|
3,60
|
|
Capsicum annuum
|
16
|
0,30
|
0,20
|
|
Mentha pulegium
|
450
|
0,30
|
6,35
|
|
Lycopersicum esculentum
|
15
|
0,35
|
0,30
|
|
Lageneria vulgaris
|
12
|
0,45
|
0,40
|
|
Cynodon dactylon
|
275
|
0,20
|
1,20
|
|
Cyperus rotundus
|
25
|
0,25
|
0,20
|
|
Setaria verticillata
|
110
|
0,25
|
1,01
|
|
Echinops spinosus
|
7
|
0,35
|
0,10
|
|
Aristida obtusa
|
11
|
0,15
|
0,04
|
|
Amaranthus hybridus
|
20
|
0,20
|
0,12
|
|
Tribulus terrester
|
15
|
0,25
|
0,14
|
|
Total
|
17,06
|
Tableau 10 : Taux de recouvrement des
espèces végétales dans la palmeraie pour un transect de
500 m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Phoenix dactylifera
|
8
|
1,60
|
3,20
|
|
Setaria verticillata
|
460
|
0,25
|
4,50
|
|
Cynodon dactylon
|
195
|
0,20
|
1,20
|
|
Convolvulus arvensis
|
55
|
0,35
|
1,05
|
|
Peganum harmala
|
4
|
0,60
|
0,20
|
|
Total
|
10,15
|
III - 2 - 1 - 2 - Transect végétal en
milieu non cultivé
Le milieu non cultivé est situé à environ
5Km de Béni Isguen. C'est un reg encombré de cailloux, de sables
grossiers et de limons plus fins. La végétation très
éparse, est constituée principalement par une Chenopodiaceae
arbustive à rameaux articulés. Il s'agit d'Arthrophytum
scoparium. Le milieu non cultivé est caractérisé par
son altitude, son exposition et sa pente :
- Altitude : 530 m
- Exposition : Sud
- Pente : 0 %
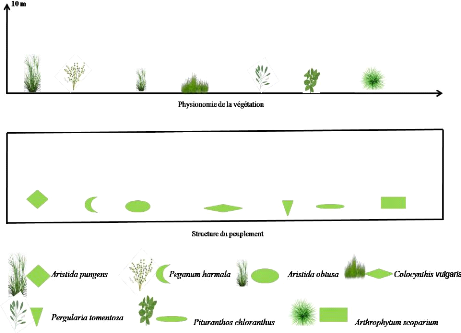
Figure 7. Transect végétal en
milieu non cultivé
30
Le transect végétal doit sa structure à
une Chenopodiaceae arbustive précédemment citée.
Le calcul du taux de recouvrement végétal donne une valeur faible
de l'ordre de 2,157. (Fig.7, Tableau 8).
III - 2 - 1 - 3 - Transect végétal en
milieu cultivé
Le milieu cultivé est situé à environ 7Km
de Béni Isguen. C'est un terrain qui est mis en valeur. Les cultures
sont installées sur des sols sablo-limoneux. Il y a comme cultures des
arbres fruitiers tels que la vigne. L'oranger, le citronnier et l'olivier. Les
Cultures maraichères sont représentées principalement par
le piment, la courge, l'aubergine et la tomate. On y retrouve quelques plantes
adventices comme le chiendent pied-de-poule. Cette station a les mêmes
caractéristiques d'altitude, d'exposition et de pente que la station
précédente
- Altitude : 530 m
- Exposition : Sud
- Pente : 0 %
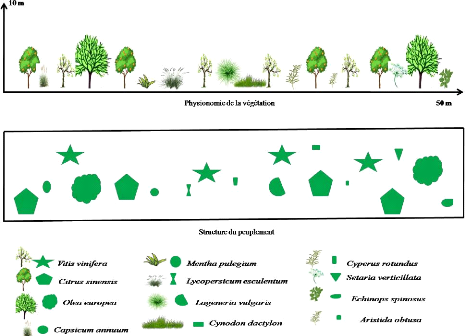
Figure 8. Transect végétal en
milieu cultivé
31
Le transect végétal donne un profil à
deux niveaux, un niveau occupé par les arbres et un autre par les plants
de tomate, piment, courge et par les plantes adventices (Figure 8). La strate
arbustive a une hauteur variant entre 1,5m et 2m. La strate herbacée
quant à elle a une hauteur variant entre 0,1 et 0,5m. Le taux de
recouvrement est estimé à 17,1 %, dû surtout à la
menthe et à l'olivier qui présentent des valeurs respectives de
6,4% et 3,6% (Tableau 9). Pour les plantes adventices le taux de recouvrement
le plus élevé est enregistré pour le chiendent-pied de
poule avec une valeur égale à 1,3%.
III - 2 - 1 - 4 - Transect végétal dans une
palmeraie
La palmeraie est située 5Km de Ghardaïa. La
culture présente est le palmier dattier. Cette dernière est
installée sur un sol sablo-limoneux. Au voisinage du palmier on trouve
des plantes adventices dont la mieux représentée est la setaire
verticillée, Setaria verticillata. La palmeraie d'étude
diffère des deux stations précédentes par son
exposition
- Altitude : 530
- Exposition : Nord
- Pente : 0 %
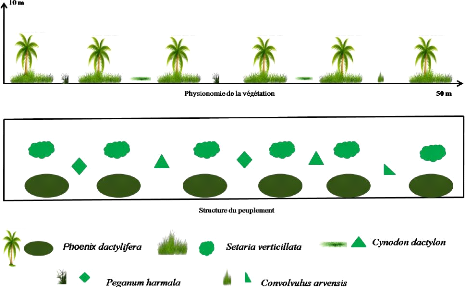
32
Figure 9. Transect végétal en
palmeraie
33
Le transect végétal montre que le terrain est
occupé uniquement par le palmier dattier et les mauvaises herbes (Figure
9). Le taux de recouvrement global de la station est égal à 10,2
% dont 4,5 % est celui de Setaria verticillata et 3,2 % du palmier
dattier (Tableau 10).
III - 2 - 1 - 5 - Méthode des
quadrats
Le but de l'échantillonnage est d'obtenir à
partir d'une surface donnée, aussi restreinte que possible, une image
fidèle de l'ensemble du peuplement (Lamotte et al, 1969).
Plusieurs méthodes sont utilisées pour le dénombrement des
populations d'Orthoptères. La méthode des quadrats est la plus
pratique et qui donne des données exploitables. Selon Chessel et
al., (1975) et Barbault (1981) le principe de cette méthode
consiste à compter le nombre d'individus présents sur une surface
déterminée pour obtenir une estimation satisfaisante de la
diversité de la population. La surface d'échantillonnage dans
laquelle nous intervenons est estimée à un hectare par station.
Cinq prélèvements sont réalisés à
l'intérieur de chaque station, dans des carrés de 9m2
chacun pris au hasard. Les prélèvements selon Voisin (1986)
permettent de connaître la composition spécifique d'un peuplement
d'Orthoptères.
III - 2 - 1 - 6 - Méthode d'étude du
régime alimentaire sur le terrain
III - 2 - 1 - 6 - 1 - Caractérisation de la
végétation
Pour l'étude du régime alimentaire
d'Acrotylus patruelis nous avons choisi le milieu cultivé
décrit plus haut. Le taux de recouvrement des espèces
végétales présentes dans un transect de 500m2
est calculé pour montrer l'importance de chaque espèce
végétale (Tableau 9). De plus nous avons estimé
l'abondance-dominance des espèces végétales
présentes (Tableau 11). D'après Guinochet (1973),
l'abondance-dominance est une expression de l'espace relatif occupé par
l'ensemble des individus de chaque espèce, espace qui est
déterminé à la fois par leur nombre et leurs dimensions.
L'échelle la plus couramment utilisée est celle de
Braun-Blanquet:
+ Simplement présent ou recouvrement très
faible
1 Recouvrement faible de O à 5 %
2 Recouvrement de 5 à 25 %
3 Recouvrement de 25 à 50 %
4 Recouvrement de 50 à 75 %
5 Recouvrement de 75 à 100 %
34
Tableau 11. Abondance dominance des
espèces végétales présentes dans le milieu
cultivé
|
Espèces végétales
|
Abondance-dominance
|
Espèces végétales
|
Abondances
dominance
|
|
Vitis vinifera
|
1
|
Mentha pulegium
|
2
|
|
Citrus sinensis
|
1
|
Echinops spinosus
|
+
|
|
Olea europea
|
1
|
Sonchus oleraceus
|
+
|
|
Capsicum annuum
|
1
|
Erigeron canadensis
|
+
|
|
Lycopersicum esculentum
|
1
|
Launaea resedifolia
|
+
|
|
Lageneria vulgaris
|
1
|
Salsola vermiculata
|
+
|
|
Cynodon dactylon
|
1
|
Chenopodium album
|
+
|
|
Setaria verticillata
|
1
|
Amaranthus hybridus
|
+
|
|
Aristida obtusa
|
+
|
Portulaca oleracea
|
+
|
|
Cyperus rotundus
|
1
|
Tribulus terrester
|
+
|
III - 2 - 1 - 6 - 2 - Prélèvement des
fèces
Les prélèvements des fèces ont lieu dans
le milieu cultivé pendant deux années. Durant les mois allant de
juillet à octobre de l'année 1992 nous avons effectué les
premiers prélèvements. D'autres prélèvements ont
été réalisés durant les mois de Juillet à
septembre au cours de l'année suivante. Les criquets sont
capturés entre 12 et 13 heures. Nous avons placé chaque insecte
dans une boîte de Pétri. La durée suffisante pour que les
acridiens vident leur tube digestif est variable selon les auteurs. Ben Halima
et al., (1984), notent qu'il faut 7 heures pour
récupérer les fèces après le repas d'un insecte.
Par contre Launois (1976), signale que l'insecte doit jeûner 1 à 2
heures. Au contraire nous avons remarqué qu'il faut 24 heures pour vider
le tube digestif d'Acrotylus patruelis. Les fèces de chaque
individu sont conservées dans des cornets en papier, sur lesquels on
inscrit le nom de l'espèce d'Orthoptère, le sexe de l'individu,
la date et le lieu de capture.
III - 2 - 2 - Méthodes employées au
laboratoire
III - 2 - 2 - 1 - Détermination des espèces
capturées
Les échantillons ramenés du terrain font l'objet
d'une détermination spécifique par le Professeur Doumandji
à l'aide des clefs dont notamment celle des Orthoptères de
l'Afrique du Nord de Chopard (1943). Voisin (1980), signale que contrairement
aux imagos, les larves sont les plus souvent difficiles à identifier
spécifiquement, même s'il existe de bons tableaux de
détermination pour certains groupes.
III - 2 - 2 - 2 - Détermination des stades
larvaires
La détermination des stades larvaires des
différentes espèces est nécessaire pour l'étude de
la dynamique de la population. Le nombre de stades larvaires n'est pas
35
généralement facile à déterminer.
Selon Duranton et al., (1982), le nombre réel de stades
larvaires varie de 4 à 8 suivant les espèces. Le nombre le plus
fréquent est de 5 à 6. Les 5 stades larvaires de la lignée
mâle sont classés selon les étapes de développement
des ébauches alaires : La larve de premier stade est
caractérisée par une petite taille celle de l'oeuf et par
l'absence d'ébauches alaires. Celle de deuxième stade a des
ébauches alaires A1 et A2, séparées et ne
présentant pas de nervures. Chez la larve du troisième stade les
ébauches alaires sont présentes, ne se recouvrent pas et montrent
à ce moment là des nervures. Par contre les ébauches
alaires de première paire A1 des larves du quatrième stade L4
recouvrent tout ou partie des ébauches alaires de seconde paire A2.
Elles atteignent le quart ou le tiers de la longueur de l'abdomen Chez la larve
du cinquième stade les ébauches alaires atteignent la
moitié de la longueur de l'abdomen. La lignée femelle compte un
stade larvaire supplémentaire. Les caractères de la larve L6
correspondent à ceux de la larve L5 futur mâle.
III - 2 - 2 - 3 - Conservation des
échantillons
Les échantillons d'Orthoptères qui sont
destinés à la collection sont tués dans un flacon
contenant du coton imbibé d'acétate d'éthyle. Puis on les
place sur des étaloirs en les fixant avec des épingles
entomologiques au niveau du thorax, les ailes A2 et les élytres A1 sont
maintenus dans une position horizontale, le bord postérieur des
élytres faisant 90° avec l'axe du corps. Les étaloirs sont
placés dans l'étuve à 45°C pendant quelques jours
pour dessécher les Orthoptères. Après cela, ils sont
retirés et placés dans une boite de collection. Une collection de
référence est constituée au cours du déroulement
des prospections Son but est de conserver un ou plusieurs individus de chaque
espèce capturée dans les stations étudiées,
généralement un mâle et une femelle par espèce.
Cette collection sert de référence pour toute la durée des
études et permet de vérifier les déterminations
ultérieures.
III - 2 - 2 - 4 - Etablissement du catalogue des
végétaux de référence
Dans le but d'établir un catalogue de
référence on peut distinguer principalement deux méthodes.
Celles-ci consistent à récolter à préparer et
à photographier les fragments d'épidermes présents dans
les fèces d'un animal nourri exclusivement sur une espèce
végétale (Launois,1976), ou bien à prélever
directement les épidermes des différentes parties de la plante et
à les photographier (Chapuis, 1979; Butet, 1985; Ben Halima,1983) Nous
avons employé la deuxième méthode citée qui offre
l'avantage d'être rapide et qui permet surtout de savoir à quelle
partie de la plante correspond l'épiderme étudié. Selon
Butet (1985) l'obtention des épidermes peut se faire selon deux
principes la séparation chimique et la
séparation physique des épidermes. La
séparation chimique des épidermes consiste à plonger des
fragments végétaux dans des liquides de macération qui
permettent de décolorer et de séparer les épidermes des
tissus, tel que l'acide lactique. La deuxième méthode consiste en
une séparation mécanique des épidermes. Les
épidermes sont détachés délicatement des tissus
sous-jacents avec de fines pinces ou quand cela n'est pas possible en
plaçant l'épiderme à étudier en contact avec une
lame de verre et en éliminant l'autre épiderme et les tissus
internes par grattage. L'épiderme va passer dans de l'eau de Javel
pendant 15 secondes. On fait passer l'épiderme dans de l'eau
distillée pendant 2 minutes. Enfin les fragments épidermiques
subissent des bains dans l'éthanol à concentrations progressives
(70°, 90° et 100°). Les fragments épidermiques sont alors
mis entre lame et lamelle dans du liquide de Faure pour l'observation au
microscope photonique au grossissement 125x10. La collection de
référence doit être la plus complète possible, tant
au point de vue espèces, qu'organes de la plante, tige, feuille et
inflorescence Nous signalons que c'est cette méthode que nous avons
utilisée pour l'étude du régime alimentaire.
III - 2 - 2 - 5 - Analyse des fèces
La reconnaissance des débris végétaux
contenus dans les fèces est facilitée par le ramollissement de
celles-ci dans l'eau pendant 24 heures. L'ensemble passe ensuite dans une
série de bains, dans de l'eau de javel, de l'eau distillée et de
l'éthanol à différentes concentrations 70°, 90°
et 100° Les montages se font dans une goutte de liquide de Faure entre
lame et lamelle et sont examinés au microscope photonique (Figure 10).
Selon Chara et al., (1986) l'analyse des contenus de fèces
présente l'avantage de ne pas sacrifier les animaux ce qui peut
être un inconvénient lorsque l'étude de l'alimentation est
associée à une étude démographique de population,
ou qu'elle concerne une espèce rares.
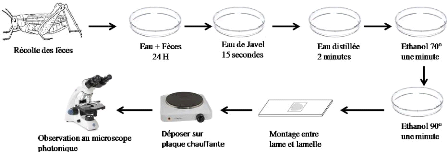
Figure 10. Démarche à suivre
pour l'analyse des fèces
36
37
III - 2 - 3 - Méthodes d'expression des
résultats
Les divers peuplements qui constituent une biocénose
peuvent se définir quantitativement par un ensemble de descripteurs qui
prennent en considération l'importance numérique des
espèces qu'ils comportent (Ramade, 1984). Selon Voisin (1980), les
individus d'une espèce donnée sont d'autant plus nombreux que les
conditions écologiques auxquelles ils sont soumis, température,
humidité et nourriture leur sont plus favorables.
III - 2 - 3 - 1 - Analyse statistique
III - 2 - 3 - 1 - 1 - Analyse factorielle des
correspondances
C'est une méthode d'analyse multidimensionnelle qui
permet d'établir un diagramme de dispersion unique dans lequel
apparaissent à la fois chacun des caractères
considérés et chacun des individus observés. Le
résultat est obtenu grâce à une méthode
particulière de codification et par un calcul de valeurs propres, qui
assurent une parfaite symétrie entre les caractères et les
individus, c'est à dire entre les lignes et les colonnes de la matrice
des données initiales (Dagnelie, 1975). D'après Daget (1976),
l'observation du graphique peut donner une idée sur
l'interprétation des facteurs et montrer quelles variables sont
responsables de la proximité entre telle ou telle observation.
III - 2 - 3 - 1 - 2 - Fréquence
relative
C'est le pourcentage d'individus d'une espèce par
rapport au total des individus. La fréquence relative peut être
calculée pour un prélèvement ou pour l'ensemble des
prélèvements d'une biocénose (Dajoz, 1971). Elle est
représentée par La formule suivante :
Nombre d'individus de l'espèce
F = * 100
Nombre d'individus total
III - 2 - 3 - 1 - 3 - Constance
C'est le rapport exprimé sous forme de pourcentage (Dajoz,
1982) : C = P * 100 / R dans
lequel, P est le nombre de relevés contenant
l'espèce étudiée et R le nombre de relevés
effectués. En fonction de C on distingue :
- Les espèces constantes présentent dans plus de 50
% de relevés
- Les espèces accessoires présentes dans 25
à 50 % de relevés
- Les espèces accidentelles trouvées dans moins de
25 % de relevés.
38
III - 2 - 3 - 2 - Analyse par indices
écologiques
III - 2 - 3 - 2 - 1 - Indice de diversité et
équirépartition
De nombreux indices de diversité sont proposés,
et selon Frontier (1982), l'indice le plus communément utilisé
aujourd'hui est celui de Shannon-Weaver, dérivé de la
théorie de l'information.
i = s
H' = - ? pi* log2 pi
i =1
Où S est le nombre d'espèces et pi
représente la probabilité de rencontre de l'espèce de
rang
i. On peut écrire pi = ni/N, où ni est
l'effectif de chaque espèce dans l'échantillon et N la somme des
ni toutes espèces confondues. H' est l'indice de diversité de
l'échantillon. Il est exprimé en unités d'information par
individu, ou bits par individus. Le logarithme utilisé est de base 2. On
démontre que H' est bien maximal, pour un nombre d'espèces S
donné quand toutes ces espèces sont également
fréquentes. Cette valeur maximale est H'max = log2 S. Enfin la
connaissance de H' et H'max permet de déterminer
l'équitabilité E.
H' H'
E = =
H'max log2 S
E varie entre 0 et 1. Quand E est inférieur à 0,5,
ceci traduit un déséquilibre au sein d'un
peuplement où une ou deux espèces pullulent par
rapport aux autres. Si E est supérieur à 0,5 il s'établit
un équilibre entre les différentes populations composant un
peuplement. Selon Dajoz (1985), un indice de diversité
élevé correspond à des conditions de milieu favorables
permettant l'installation de nombreuses espèces. Une diversité
élevée révèle alors une stabilité plus
grande. Une équitabilité élevée est l'indice d'un
peuplement équilibré.
III- 2- 3- 2- 2- Indice de dispersion des espèces
acridiennes dans le temps et dans l'espace
L'étude de la répartition ou dispersion permet
de déterminer le mode de distribution des Orthoptères dans les
différentes stations en fonction du temps. Selon Bachelier (1978), si N
est le nombre total d'observations, m la moyenne des comptages et X le
résultat d'un comptage quelconque, la variance peut s'écrire :
? (X - m)
S2 =
N - 1
Si m > S2 on a une distribution
régulière
Si m = S2 on a une distribution au hasard ou
aléatoire
Si m < S2 on a une distribution en agrégats
dite encore distribution contagieuse
Si S2 = O la distribution est uniforme (Dajoz,
1971).
39
III - 2 - 3 - 3 - Méthodes de quantification
relative de la nourriture ingérée
Butet (1985), a recensé diverses méthodes de
quantification relative de la nourriture ingérée par des
phytophages; elles sont basées sur le dénombrement ou la mesure
des surfaces des fragments épidermiques présents sur les lames
échantillons. Nous pouvons distinguer les principaux cas suivants :
- Tous les fragments présents sur la
lame-échantillon sont dénombrés (Launois, 1976)
- Un nombre prédéterminé de fragments est
recensé par un balayage méthodique continu de la
lame-échantillon (Chapuis, 1979).
- Les surfaces d'un nombre prédéterminée
de fragments sont mesurées (Nel et al, 1973 in Butet, 1985).
- Le dénombrement ou la mesure des surfaces des
épidermes sont effectués dans des zones définies sur la
lame grille d'observation espace entre deux lignes, champs de microscope,
etc....
Pour l'expression des résultats du régime
alimentaire d'Acrotylus patruelis nous avons utilisé deux
méthodes.
III - 2 - 3 - 3 - 1 - Méthode des
fréquences
Butet (1985), définit une fréquence relative (F
%) d'apparition d'un item donné dans les échantillons :
ni
F % item i = x 100
N
Où ni est le nombre d'échantillons où l'item
i est présent et N est le nombre total
d'échantillons pris en compte.
III - 2 - 3 - 3 - 2 - Méthode des
surfaces
Le principe de la méthode consiste à calculer la
surface ingérée en millimètres carrés pour chaque
espèce végétale. Pour cela nous avons utilisé un
carré, Fenêtre d'un millimètre carré. Le papier
millimétré est collé sur le plateau du microscope
photonique, de façon à ce que l'objectif soit en face du
carré. On place le montage des fèces sur le papier
millimétré, puis on procède à un balayage de toute
la surface de la lamelle. On note la surface des fragments
végétaux qui occupent chaque carré. Pour montrer l'aspect
quantitatif des espèces végétales ingérées
nous avons utilisé les formules suivantes proposées par Doumandji
et al., (1993).
|
n n
Ss = ? xi
i=1 n'
|
|
n
? Ss i=1
S =
N
|
|
S
T =
n
? S i=1
|
T
IA =
RG
40
Ss : est la surface d'une espèce végétale
donnée rejetée dans les fèces et calculée pour un
individu.
Xi : est la surface des fragments du végétal de
l'espèce i notée dans les fèces d'un individu. n : est le
nombre de mm2 de la lamelle soit 576 mm2.
n' : est le nombre de mm2 observés sur la
lamelle vides ou occupés par les fragments végétaux. Le
rapport n/n' délimite le champ de travail et permet de diminuer les
erreurs de manipulation.
S : est la surface moyenne d'une espèce
végétale consommée par N individus. n
? S : est la somme des surfaces moyennes des
végétaux rejetées par individu toutes
i=1 végétales confondues.
N : est le nombre d'individus pris en considération.
T : est le taux de consommation pour une espèce
végétale par rapport à l'ensemble des surfaces
végétales rejetées.
IA : est l'indice d'attraction d'une espèce
végétale donnée.
RG : est le recouvrement global pour une espèce
végétale présente dans la station d'étude.
41
Chapitre IV: Bioécologie des principales
espèces d'Orthoptères dans la région de
Ghardaïa
IV - 1 - Inventaire
IV - 1 - 1 - Inventaire concernant la faune
Orthoptérologique de la région de Ghardaïa
Le prélèvement des données pour
l'étude bioécologique est réalisé sur une
période allant du 28 janvier au 26 décembre 1992 à raison
d'une sortie par mois dans chacune des stations. Nous avons recensé 29
espèces d'Orthoptères que nous avons déterminé avec
l'aide du Professeur Doumandji en utilisant des clefs dont l'ouvrage de Chopard
(1943), les collections de l'insectarium du département de zoologie
agricole et forestière de l'Institut National Agronomique d'El-Harrach,
l'ouvrage de Dirsh (1965) et le catalogue des Orthoptères Acridoidea de
l'Afrique du Nord-Ouest proposé par Louveaux et Ben Halima (1987).
IV - 1 - 1 - 1 - Résultats : Le
tableau n° 8 met en évidence les résultats recueillis lors
de l'inventaire.
Tableau 12. Faune des Orthoptères
Caelifères de la région de Ghardaïa.
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pamphagidae
|
Akicerinae
|
Tuarega insignis (Lucas, 1851).
|
|
Pyrgomorphidae
|
Chrotogoninae
|
Tenuitarsus angustus (Blanchard, 1837).
|
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
|
Pyrgomorpha conica (Olivier, 1791).
|
|
Acrididae
|
Dericorythinae
|
Dericorys millierei (Finot et Bonnet, 1884).
|
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836).
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889).
|
|
|
Heteracris annulosa (Walker, 1870).
|
|
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linne, 1764).
|
|
|
Schistocerca gregaria (Forskal, 1775).
|
|
Acridinae
|
Acrida turrita (Linne, 1758).
|
|
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus longipes (Charpentieri, 1843).
|
|
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
|
Hyalorrhipis calcarata (Vosseler, 1902).
|
|
|
Pseudosphingonotus azurescens (Rambur, 1838).
|
|
|
Pseudosphingonotus savignyi (Saussure, 1884).
|
|
|
Sphingonotus caerulans (Linne, 1767).
|
|
|
Sphingonotus obscuratus lameerei (Fi., 1902).
|
|
|
Sphingonotus rubescens (Walker, 1870).
|
|
|
Wernerella pachecoi (Bolivar, 1913).
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Ochrilidia geniculata (Bolivar, 1913).
|
|
|
Omocestus lucasii (Brisout, 1851)
|
|
|
Omocestus raymondi (Harz, 1970).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
42
IV - 1 - 1 - 2 - Discussion
D'après le tableau 12, nous constatons que les 29
espèces d'Orthoptères notés appartiennent au sous ordre
des Caelifères. De même Zergoun (1991), Douadi (1992) et Babaz
(1992), ont recensé respectivement 31, 27 et 28 espèces
d'Orthoptères dans la région de Ghardaïa. Parmi les
espèces mentionnées par Douadi (1992) et Babaz (1992), 14 d'entre
elles ne sont pas présentes dans les présentes stations
d'études. Nous n'avons pas trouvé d'Ensifères durant les
échantillonnages de 1992. Par contre en 1991 un Ensifère
Phaneroptera nana (Bruner1878) est observé (Zergoun, 1991).
Louveaux et Ben Halima (1987) citent 140 espèces de Caelifères en
Algérie. La région de Ghardaïa englobe 20,7 % de ces
espèces. De même au Sahara, ces auteurs notent 68 espèces.
La faune d'Orthoptères Caelifères de la région de
Ghardaïa représente 42,6 % des espèces Caelifères
signalées au Sahara. Chopard (1943) note une espèce acridienne
caractérisant les oasis il s'agit d'Ochrilidia gracilis. Elle
est retrouvée lors des différentes études sur les
peuplements acridiens dans la région de Ghardaïa. Nous avons
noté la présence de 12 sous famille et 18 genres. La sous famille
des Oedipodinae est la mieux représentée en
espèces dans la région de Ghardaïa, ce qui confirme les
observations faites par Zergoun (1991) et Babaz (1992). Les Oedipodinae
englobent plus de 31 % des espèces recensées dont les genres
Sphingonotus et Pseudosphingonotus représentent plus
de 55 %. Nous avons également les sous familles des Gomphocerinae
avec 13,8 %, des Eyprepocnemidinae et des Acridinae avec
10,3 % chacune, et 6,9 % pour les Pyrgomorphinae et les
Cyrtacanthacridinae. Par contre les sous familles des
Akicerinae, des Chrotogoninae, des Dericorythinae,
des Calliptaminae, des Truxalinae, et la famille des
Acrydiidae correspondent à peine à 3.5 % chacune.
IV - 1 - 1 - 3 - Conclusion
Le nombre important de 29 d'espèces
d'Orthoptères Caelifères recensées, soit 42,6 % de
l'Orthoptérofaune saharienne dans la région de Ghardaia, montre
la richesse de la zone d'étude en peuplements acridiens. Bien qu'on
retrouve certaines espèces d'acridiens dans les endroits humides, la
très grande majorité de ces insectes ont des formes
xérophiles et thermophiles (Chopard, 1949). En effet le nombre
d'espèces d'Orthoptères augmente au fur et à mesure qu'on
s'éloigne des régions humides.
IV - 1 - 2 - Inventaire concernant les stations
d'étude IV - 1 - 2 - 1 - Résultats
43
Tableau 13. Faune des Orthoptères
Caélifères en milieu non cultivé à Béni
Isguen.
|
Familles
|
Sous Famille
|
Espèces
|
|
Pamphagidae
|
Akicerinae
|
Tuarega insignis (Lucas, 1851).
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
Acrididae
|
Dericorythinae
|
Dericorys millierei (Finot et Bonnet, 1884).
|
|
Cyrtacanthacridinae
|
Schistocerca gregaria (Forskal, 1775).
|
|
Oedipodinae
|
Hyalorrhipis calcarata (Vosseler, 1902).
|
|
|
Pseudosphingonotus azurescens (Rambur, 1838).
|
|
|
Pseudosphingonotus savignyi (Saussure, 1884).
|
|
|
Sphingonotus caerulans (Linne, 1767).
|
|
|
Sphingonotus obscuratus lameerei (Fi., 1902).
|
|
|
Sphingonotus rubescens (Walker, 1870).
|
|
|
Wernerella pachecoi (I.Bolivar, 1913).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
6
|
12
|
Tableau 14. Faune Orthoptérologique du
milieu cultivé à Béni Isguen.
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pyrgomorphidae
|
Chrotogoninae
|
Tenuitarsus angustus (Blanchard, 1837).
|
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
Acrididae
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836).
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889).
|
|
|
Heteracris annulosa (Walker, 1870).
|
|
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linne, 1764).
|
|
Acridinae
|
Acrida turrita (Linne, 1758).
|
|
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus longipes (Charpentieri, 1843).
|
|
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Ochrilidia geniculata (Bolivar, 1913).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
10
|
16
|
Tableau 15. Faune Orthoptérologique de la
palmeraie à Ghardaïa
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
|
Pyrgomorpha conica (Olivier, 1791).
|
|
Acrididae
|
Eyprepocnemidinae
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Acridinae
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Omocestus lucasii (Brisout, 1851)
|
|
|
Omocestus raymondi (Harz, 1970).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
7
|
11
|
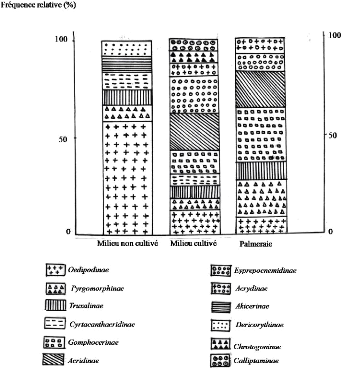
44
Figure 11. Fréquence relative des sous
familles d'Orthoptères dans les stations d'études de la
région de Ghardaïa
IV - 1 - 2 - 2 - Discussion
Chaque station ou milieu est caractérisée par un
nombre d'espèces d'Orthoptères. En effet, la faune
Orthoptérologique du milieu cultivé est composée de 16
espèces, soit 55,2 % de la faune totale des Caelifères de la
région d'étude. Par contre, Douadi (1992) a recensé dans
le milieu cultivé 23 espèces de Caelifères parmi les 27 ce
qui représente 85 % des espèces existant dans la zone
d'étude. Babaz (1992), quant à lui a trouvé presque le
même nombre d'espèces acridiennes dans le milieu cultivé et
le milieu non cultivé avec 19 dans le premier et 16 dans le second. Nous
avons noté dans le milieu non cultivé et dans la palmeraie des
nombres d'espèces de Caelifères qui sont respectivement de 12 et
11 espèces, soit 41,4 % et 37,9 % de la faune Orthoptérologique
globale de la région d'étude. Dans le milieu cultivé, le
sou ordre des Caelifères est subdivisé en dix sous-familles qui
sont classées par ordre d'importance en Eyprepocnemidinae avec
10,3 %, en Acridinae, Oedipodinae et en
45
Gomphocerinae avec 6,9 % chacune. Enfin les
sous-familles des Chrotogoninae, des Pyrgomorphinae, des
Calliptaminae, des Cyrtacanthacridinae, des Truxalinae
et des Acrydinae sont mentionnés chacune avec un taux de
3,5 %. Le milieu non cultivé et la palmeraie sont
représentés respectivement par 6 et 7 sous-familles (Tableaux 13,
14. 15 et la figure 11). Nous remarquons aussi que certaines espèces ne
se retrouvent que dans le milieu cultivé. C'est le cas par exemple
d'Acrotylus longipes. Par contre Zergoun (1991) et Babaz (1992),
citent cette espèce dans les milieux non cultivés. Cela est
dû probablement au fait que cet acridien préfère les
milieux sablonneux et secs. Dans le milieu non cultivé on trouve des
espèces xérophiles. Nous citons entre autres Tuarega insignis
et les genres Sphingonotus et Pseudosphingonotus. Ces
derniers peuvent étendre leur répartition jusqu'aux milieux
cultivés et la palmeraie, surtout durant les Journées très
chaudes d'été. C'est pour cette raison que Zergoun (1991) et
Douadi (1992) les ont cités dans ces deux milieux. La palmeraie est
caractérisée par la présence d'Omocestus raymondi
et d'Omocestus lucasii, ce qui confirme les observations faites
par Babaz (1992). D'autres parts il existe deux espèces communes aux
trois types de milieux, Ce sont Truxalis nasuta et Pyrgomorpha
cognata.
IV - 1 - 2 - 3 - Conclusion
Nous pouvons enfin conclure que chaque type de milieu favorise
le développement de certaines espèces acridiennes. En effet, la
répartition des Orthoptères Caelifères dans les
différentes stations est conditionnée par plusieurs facteurs tels
que le sol, la végétation et le microclimat. Des résultats
obtenus, il ressort que le milieu cultivé à Béni-Isguen
compte le plus grand nombre d'espèces de Caelifères soit 16
contre 12 pour le milieu non cultivé et 11 dans la palmeraie à
Ghardaïa. Par rapport aux 29 espèces recensées dans la
région d'étude, le taux d'Orthoptères communs aux 3
stations est de 6,9 %. Par contre le milieu cultivé et la palmeraie ont
un taux commun de 27,6 %.
IV - 2 - Bioécologie des principales
espèces acridiennes
IV - 2 - 1 - Biologie et Ecologie d'Acrotylus
patruelis
IV - 2 - 1 - 1 - Biologie
Acrotylus patruelis est une espèce commune
dans la région de Saria de zone soudanienne en Afrique de l'Ouest,
particulièrement pendant la saison des pluies. Les études et
observations faites dans cette région ont montrées, l'existence
de 3 générations annuelles chez A. patruelis avec une
diapause imaginale (Lecoq, 1978). Au Mali, Kone (1990) parle de reproduction
continue avec quatre générations par an. En Algérie selon
les travaux de Hamdi
46
(1989,1992) sur le littoral algérien, Guecioueur (1990)
dans la région de Lakhdaria, Bourahla (1990) dans la région de
Chréa et Ould El Hadj (1991) dans le Sahara septentrional, cette
espèce est à l'état imaginal durant une longue partie de
l'année et ne possède qu'une seule génération par
an. D'après Zergoun (1991), Douadi (1992) et Babaz (1992), A.
patruelis semble avoir 2 ou 3 générations annuelles dans la
région de Ghardaïa.
Tableau 16. Nombre de larves et d'imagos
d'Acrotylus patruelis par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
1
|
0
|
0
|
|
29 février
|
2L3 - 1L5
|
1
|
0
|
0
|
|
30 mars
|
1L5
|
1
|
1L4
|
2
|
|
30 avril
|
0
|
2
|
1L5
|
1
|
|
15 mai
|
0
|
3
|
0
|
1
|
|
15 juin
|
0
|
3
|
1L4
|
1
|
|
16 juillet
|
0
|
2
|
0
|
2
|
|
14 aout
|
0
|
4
|
0
|
1
|
|
14 septembre
|
1L4 - 1L5
|
4
|
1L5
|
1
|
|
18 octobre
|
1L5
|
3
|
1L5
|
2
|
|
15 novembre
|
2L4
|
4
|
1L5
|
1
|
|
26 décembre
|
1L2 - 1L3
|
1
|
0
|
0
|
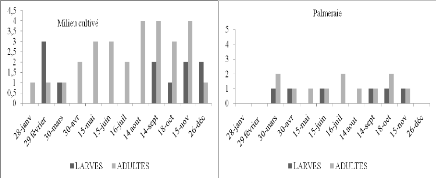
Figure 12. Nombre de larves et d'imagos
d'Acrotylus patruelis par 45m2 en fonction du temps dans
deux stations d'étude
Selon les histogrammes (Figure 12) obtenus à partir du
tableau 16, nous constatons que dans le milieu cultivé, l'espèce
est présente durant toute l'année à l'état imaginal
Les larves apparaissent de février à mars et de septembre
à décembre. Nous avons observé des pontes durant les mois
de juillet et août. C'est la ponte de la première
génération. En septembre, des L4 et L5 sont présentes,
cela veut dire que durant les mois précédents les L1, L2 et L3
ont
47
échappées à notre attention. De
même en palmeraie il y a des L4 en mars. Ainsi en février les L1,
L2, et L3 ont échappé également à notre attention.
Cela peut être dû soit à la faiblesse de la fréquence
des échantillonnages, soit aux déplacements des populations d'une
culture à l'autre ou d'un milieu à l'autre. Briki (1991) a
noté le même phénomène. Les différentes
observations spatio-temporelles montrent qu'A. patruelis semble
présenter une ou deux générations par an.
IV - 2 - 1 - 2 - Ecologie
Acrotylus patruelis semble avoir une large
distribution géographique affectant surtout les types de bioclimats
humides, sub-humides, semi-arides et arides, Sa répartition ne
dépend pas de l'altitude, puisque l `espèce est notée
aussi bien dans les stations littorales de basse altitude qu'à haute
altitude notamment à Tikjda. Au Sahara selon Ould El Hadj (1991) A.
patruelis a une grande répartition. Elle est observée jusque
dans l'extrême Sud du Sahara entre les 18ème et le
19èmeparallèle Nord. Cet Oedipodinae
préfère les endroits ensoleillés à faible taux
de recouvrement herbacé (Anonyme 1982; Kone, 1990; Zergoun, 1991;
Beggas, 1992). Ayant un régime alimentaire mixte, cette espèce a
une certaine importance économique dans le Sahara. Elle cause des
dégâts principalement sur les cultures maraichères (Ould El
Hadj, 1991). A. patruelis est capturée dans le milieu
cultivé et dans La palmeraie. Elle fréquente les endroits
sablonneux. Durant toutes les prospections nous n'avons jamais observé
cette espèce sur la végétation. Elle préfère
par conséquent les endroits ensoleillés. Un quart des effectifs
des espèces acridiennes du milieu cultivé est
représenté par Acrotylus patruelis. Ceci explique sa
grande importance dans ce milieu.
IV - 2 - 2 - Biologie et Ecologie d'Ochrilidia
gracilis
IV - 2 - 2 - 1- Biologie
Les adultes d'Ochrilidia gracilis apparaissent au
Nord du Sahara depuis mars Jusqu' en août et en novembre Par contre en
Arabie Saoudite les adultes sont observés uniquement en automne et au
printemps (COPR, 1982). Dans la région de Ghardaïa Douadi (1992) et
Babaz (1992), notent que les adultes de cette espèce sont
présents Jusqu'en novembre puis ils disparaissent durant l'hiver, pour
réapparaître à nouveau au printemps Selon ces auteurs
l'espèce hiverne à l'état larvaire et possède une
génération annuelle. Durant la période 19901991 les larves
de cette espèce sont présentes presque tout au long de
l'année tandis que les adultes sont observés durant
l'été seulement. Ces données ont permis de conclure
48
qu'O.gracilis pourrait avoir une seule
génération avec une diapause larvaire automno-hivernale (Zergoun,
1991).
Tableau 17. Nombre de larves et d'imagos
d'Ochrilidia gracilis par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
1
|
3L2 - 6L3
|
0
|
|
29 février
|
1L4
|
0
|
6L2 - 4L4
|
0
|
|
30 mars
|
1L5
|
1
|
3L4 - 1L5
|
3
|
|
30 avril
|
0
|
1
|
2L5
|
3
|
|
15 mai
|
0
|
3
|
0
|
3
|
|
15 juin
|
1L4 - 1L5
|
1
|
1L3 - 3L4 - 5L5
|
1
|
|
16 juillet
|
0
|
2
|
2L5
|
8
|
|
14 aout
|
0
|
3
|
2L5
|
5
|
|
14 septembre
|
1L4 - 1L5
|
2
|
1L4 - 1L5
|
7
|
|
18 octobre
|
0
|
2
|
2L3 - 2L4 - 1L5
|
6
|
|
15 novembre
|
0
|
2
|
4L3 - 2L4 - 1L5
|
6
|
|
26 décembre
|
0
|
0
|
1L2 - 7L3
|
0
|
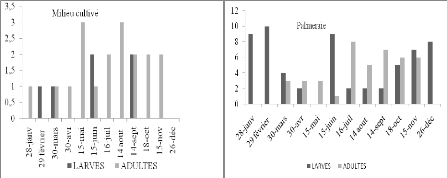
Figure 13. Nombre de larves et d'imagos
d'Ochrilidia gracilis par 45m2 en fonction du temps dans
deux stations d'étude.
D'après les histogrammes de la figure 13 obtenus
à partir du tableau 17 il est à constater qu'O. gracilis
semble présenter dans le milieu cultivé des larves
hivernantes. En effet les L4 de février confirment cette
hypothèse. D'ailleurs leurs effectifs sont trop faibles pour avoir une
autre explication. Vu que cette espèce fréquente les endroits
à végétation herbacée dense, il est difficile
d'observer les accouplements et les pontes de cette espèce. Il est
probable que cet acridien présente une seule génération
avec non seulement une hivernation larvaire mais également une
estivation larvaire. Dans la palmeraie nous avons trouvé des L2 durant
les mois
49
de janvier et février, des L3 en juin et durant la
période s'étalant d'octobre à décembre. De
même il semble que les larves subissent une hivernation et une
estivation. Il semble qu'Ochrilidia gracilis présente une
à deux générations annuelles.
IV - 2 - 2 - 2 - Ecologie
Ochrilidia gracilis est abondante dans les endroits
les plus humides particulièrement dans les plaines inondées par
les rivières. Elle se trouve aussi dans les marécages
salés littoraux de la Lybie (COPR, 1982). Vu qu'elle est toujours
capturée par des pièges lumineux, elle doit être
probablement très mobile. Chopard (1938) a classé le genre
Ochrilidia parmi les acridiens caractéristiques des
régions subdésertiques ou désertiques. Nous avons
capturé ce Gomphocerinae dans deux types de milieux, le milieu
cultivé et la palmeraie. Il est plus abondant dans la palmeraie milieu
caractérisé par une humidité élevée due
à une irrigation régulière. Par conséquent on
assiste à un développement très dense d'une
végétation graminéenne caractérisée
essentiellement par Setaria verticillata. Cet acridien peut se
dissimuler facilement dans les touffes d'herbes. Dans la palmeraie plus de 66 %
des individus acridiens sont représentés par Ochrilidia
gracilis.
IV - 2 - 3 - Biologie et Ecologie d'Aiolopus
strepens
IV - 2 - 3 - 1 - Biologie
En France Aiolopus strepens présente une seule
génération annuelle. Les individus deviennent adultes la fin de
l'été, la maturité et la ponte des oeufs ont lieu au
printemps. En Afrique du Nord, les adultes sont notés tout au long de
l'année (COPR, 1982). D'après les travaux de Hamdi (1989) dans la
région médio-septentrionale de l'Algérie, de Benrima
(1990) dans la région de Koléa de Guecioueur (1990) dans la
région de Lakhdaria, de Fellaouine (1989) dans la région de
Sétif de Zergoun (1991) et de Douadi (1992) dans la région de
Ghardaïa ; Aiolopus strepens est présente à
l'état adulte pendant presque toute l'année. Les larves quant
à elles commencent a apparaître au mois d'avril. Ces auteurs
notent que A.strepens présente une seule
génération annuelle et passe l`hiver à l'état
imaginal. D'après les histogrammes de la figure 14 obtenus à
partir du tableau 18, les larves de cet Acridinae commencent à
apparaître dans le milieu cultivé à partir de mars. Durant
ce mois nous avons trouvé des L5. Vu les conditions difficiles du milieu
durant la période de janvier à février, les autres stades
larvaires ont dû se cacher pour échapper aux intempéries.
Des L3 ont été trouvées pendant les mois allant de Juillet
à novembre. Cette espèce n'est pas très commune dans la
palmeraie. C'est pour cette raison que nous 1`avons trouvé uniquement
trois fois
50
pendant l'année. Nous avons noté dans la
palmeraie la présence des L4 en mai et des L5 en novembre.
D'après ces observations, il est probable que cet Orthoptère
présente une seule génération annuelle.
Tableau n° 18 : Nombre de larves et
d'imago d'Aiolopus strepens par 45m2 en fonction du temps
dans deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
0
|
0
|
|
30 mars
|
1L5
|
0
|
0
|
0
|
|
30 avril
|
1L4
|
0
|
0
|
0
|
|
15 mai
|
1L5
|
0
|
1L4
|
2
|
|
15 juin
|
1L4
|
1
|
0
|
0
|
|
16 juillet
|
1L3
|
1
|
0
|
0
|
|
14 aout
|
1L5
|
2
|
0
|
1
|
|
14 septembre
|
1L5
|
3
|
0
|
0
|
|
18 octobre
|
1L5
|
4
|
0
|
0
|
|
15 novembre
|
0
|
3
|
1L5
|
0
|
|
26 décembre
|
0
|
1
|
0
|
0
|
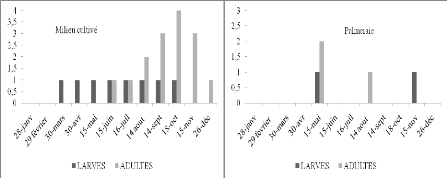
Figure 14. Nombre de larves et d'imago
d'Aiolopus strepens par 45m2 en fonction du temps dans deux
stations d'étude.
IV - 2 - 3 - 2 - Ecologie
Aiolopus strepens est une espèce commune dans
les endroits incultes (Chopard, 1943 ; 1965). En Algérie divers auteurs,
Hamdi (1989), Guecioueur (1990), Tamzait (1990), et Bourahla (1990) notent
qu'A. strepens a une préférence pour les endroits
humides et supporte des températures moyennes Elle est vue
particulièrement dans les milieux à recouvrement herbacé
moyen ou dense. A.strepens est très mobile, car des
individus ont été observés faisant
51
plusieurs kilomètres de vol (COPR, 1982). Benrima
(1990) mentionne qu'A.strepens habite divers biotopes : maquis, friche
et milieu cultivé. Nous avons trouvé cet Acridinae dans
le milieu cultivé et dans la palmeraie. Cette espèce
présente une grande importance numérique dans le milieu
cultivé après A.patruelis. Cet acridien fréquente
les endroits un peu humides comme les parcelles de menthe. Il est rarement vu
dans les endroits nus.
IV - 2 - 4 - Biologie et Ecologie de Sphingonotus
rubescens
IV - 2 - 4 - 1 - Biologie
A Sétif (Fellaouine, 1989) et à Ghardaïa
(Babaz, 1992) notent que Sphingonotus rubescens présente une
seule génération par an avec une diapause embryonnaire
automno-hivernale.
Tableau 19. Nombre de larves et d'imagos de
Sphingonotus rubescens par 45m2 en fonction du temps dans
le milieu non cultivé.
|
Prélèvements durant 1992
|
Nombre d'individus
|
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
|
29 février
|
0
|
0
|
|
30 mars
|
0
|
0
|
|
30 avril
|
1L2
|
0
|
|
15 mai
|
1L2 - 1L3
|
0
|
|
15 juin
|
1L3 - 1L4
|
1
|
|
16 juillet
|
0
|
1
|
|
14 aout
|
0
|
1
|
|
14 septembre
|
0
|
1
|
|
18 octobre
|
0
|
1
|
|
15 novembre
|
0
|
1
|
|
26 décembre
|
0
|
0
|
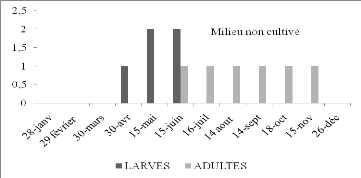
Figure 15. Nombre de larves et d'imagos de
Sphingonotus rubescens par 45m2 en fonction du temps dans
le milieu non cultivé.
52
Les premières larves de S.rubescens, selon
Zergoun (1991) apparaissent au mois de mars. L'espèce est
présente à l'état adulte à partir du mois de
juillet à décembre. Elle semble avoir une seule
génération annuelle. D'après l'histogramme (Figure 15)
obtenu à partir du tableau n°15 nous pouvons constater que les
larves de cet Oedipodinae commencent à apparaître
à partir du mois d'avril ce qui nous amène à penser que
l'éclosion a eu lieu probablement au mois de mars. Nous avons
capturé les premiers adultes durant le mois de juin. De ces
résultats il apparaît que l'espèce présente le cycle
typique d'une espèce à une seule génération
annuelle et hiverne à l'état embryonnaire.
IV - 2 - 4 - 2 - Ecologie
Selon Chopard (1943), Sphingonotus rubescens ne se
trouve guère que dans les endroits à peu près
désertiques. Elle est très vive et vole rapidement au soleil. Sa
capture est signalée aussi durant la nuit attirée par la
lumière des lampes. Elle semble fréquenter des milieux
très arides et dénudés où les températures
estivales sont élevées et où la pluviométrie est
inférieure à 500mm par an (Fellaouine, 1989). Beggas (1992), note
que cet Oedipodinae préfère les milieux salés.
Selon Zergoun (1991) cette espèce est très mobile. En effet 40
individus ont été capturés en dessous d'une lampe
allumée pendant la nuit durant une demi-heure au mois d'août de
l'année 1990. Sphingonotus rubescens a pullulé en 1986
dans la région de Ghardaïa et a causé d'importants
dégâts aux pâturages (Chara, 1987). Nous avons
capturé cette espèce uniquement au niveau du milieu non
cultivé, caractérisé par un sol rocailleux,
extrêmement sec et chaud en été. Cet acridien peut envahir
les milieux cultivés et les palmeraies durant les chaleurs estivales. Il
semble que le genre Sphingonotus, présente une grande
tolérance vis à vis de la chaleur.
IV - 2 - 5 - Biologie et Ecologie de Pyrgomorpha
cognata
IV - 2 - 5 - 1 - Biologie
Au Mali selon Kone (1990) et au Togo d'après Kabassina
(1990). P. cognata est une espèce à reproduction
continue avec trois générations annuelles. Les larves et les
adultes sont présents durant toute l'année. Les
développements embryonnaires et larvaires sont plus longs en saison
sèche qu'en saison des pluies. Babaz (1992), note que
P.cognata présente dans la région de
Ghardaïa une seule génération annuelle avec une diapause
larvaire automno-hivernale. Dans la région de Ghardaïa Zergoun
(1991) a signalé que durant la période 19901991 à
l'exception du mois de Janvier où l'espèce est capturée
seulement à l'état larvaire le restant de l`année elle est
capturée aussi bien aux états larvaires qu'à l'état
adulte. Elle semble
53
avoir une reproduction continue. D'après les
histogrammes (Figure 16) obtenus à partir du tableau 20, il est à
constater que P.cognata est présente dans le milieu
cultivé trois fois pendant l'année à l'état
larvaire seulement.
Tableau 20. Nombre de larves et d'imagos de
Pyrgomorpha cognata par 45m2 en fonction du temps dans
trois stations d'étude.
|
Prélèvements durant 1992
|
Nombres d'individus
|
|
Milieu non cultivé
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
1L3
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
1L4
|
0
|
0
|
0
|
|
30 mars
|
0
|
1
|
0
|
1
|
1L3
|
1
|
|
30 avril
|
0
|
0
|
1L5
|
1
|
0
|
0
|
|
15 mai
|
0
|
0
|
1L4 - 1L5
|
0
|
1L4
|
0
|
|
15 juin
|
0
|
0
|
0
|
1
|
1L5
|
0
|
|
16 juillet
|
0
|
0
|
1L4
|
1
|
0
|
1
|
|
14 aout
|
1L5
|
0
|
0
|
2
|
0
|
0
|
|
14 septembre
|
0
|
0
|
0
|
1
|
0
|
1
|
|
18 octobre
|
0
|
0
|
0
|
1
|
0
|
0
|
|
15 novembre
|
1L3
|
0
|
0
|
0
|
1L4
|
0
|
|
26 décembre
|
1L3
|
0
|
1L4
|
0
|
0
|
0
|
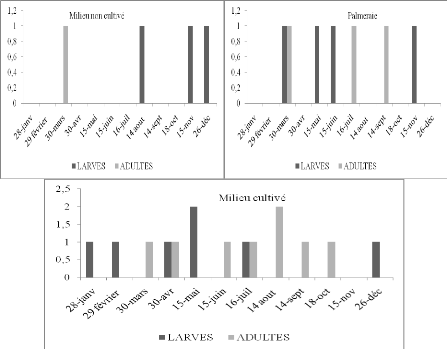
Figure 16. Nombre de larves et d'imagos de
Pyrgomorpha cognata par 45m2 en fonction du temps dans
trois stations d'étude.
54
Nous avons trouvé les L3 au mois de janvier et les L4
au mois de février, puis des L5 en avril, enfin des L4 en
décembre. De même la palmeraie présente aussi des larves en
mars, en mai et juin et enfin en novembre. Par contre le milieu non
cultivé où l'espèce semble être rare, nous avons
trouvé cette espèce 4 fois pendant toute l'année. Les
larves ont été trouvées en août puis en novembre et
en décembre. Les imagos sont plus fréquents dans le milieu
cultivé. Par contre ils sont rares dans les deux autres milieux. Compte
tenu de la faiblesse des effectifs, il est difficile de conclure.
D'après les résultats il est possible que P. cognata
développe 2 générations annuelles.
IV - 2 - 5 - 2 - Ecologie
Pyrgomorpha cognata préfère les
habitats secs où elle peut se nourrir d'arbustes du désert (COPR,
1982). Au Togo, Kabassina (1990), note que cette espèce peut s'attaquer
à plusieurs plantes : coton, arachide et le blé. Les principaux
dégâts sont notés sur le mil et sur les cultures
maraîchères. Dans la région de Ghardaïa Babaz (1992) a
capturé cette espèce dans trois types de stations en milieux
cultivé et non cultivé et en palmeraie. Dans le milieu
cultivé elle fréquente les parcelles de menthe à fort
recouvrement. Dans le milieu non cultivé elle est observée sur
les sols sablonneux nus à proximité des touffes de Thymelaea
microphylla et Oudneya africana. Dans la palmeraie elle est
essentiellement capturée au niveau des endroits ensoleillés
caractérisés par un très faible recouvrement
herbacé à base de Cynodon dactylon. Nous avons
signalé P.cognata dans les trois milieux d'étude avec un
effectif moins important par rapport à la période 1990-1991
où nous avons enregistré 170 individus tandis que pour
l'année 1992 nous avons capturé uniquement 26 individus. Cela est
dû probablement aux conditions du milieu qui tantôt gênent ou
tantôt favorisent la pullulation de cette espèce. P.cognata
tolère des milieux très variés, puisqu'elle supporte
les alternances des variations de température et
d'hygrométrie.
IV - 2 - 6 - Biologie et Ecologie de Truxalis
nasuta
IV - 2 - 6 - 1 - Biologie
A Sétif comme à Lakhdaria, T. nasuta
présente une seule génération annuelle (Fellaouine,
1989 ; Guecioueur. 1990). Dans la région de Ghardaïa les adultes de
cette espèce sont capturés durant une grande période de
l'année de septembre à mai. T. nasuta est univoltine
avec une diapause larvaire automno-hivernale (Babaz, 1992). Elle est
présente pendant une grande partie de la période 1990-1991
à l'état larvaire dans la région de Ghardaïa. Les
adultes de cet Orthoptère commencent à apparaître
dès la fin du mois d'avril.
55
Ils sont présents jusqu'au mois d'août. La
dissection d'une femelle au cours de ce mois montre la présence
d'ovocytes mûrs. Donc la ponte a probablement eu lieu en
août-septembre. Quant au développement larvaire il s'étend
Jusqu'au mois d'avril (Zergoun, 1991).
Tableau 21. Nombre de larves et d'imagos de
Truxalis nasuta par 45m2 en fonction du temps dans trois
stations d'étude
|
Prélèvements durant 1992
|
Nombres d'individus
|
|
Milieu non cultivé
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
0
|
0
|
|
29 février
|
1L3
|
0
|
1L4
|
0
|
0
|
0
|
|
30 mars
|
0
|
0
|
1L5
|
0
|
0
|
0
|
|
30 avril
|
0
|
0
|
1L5
|
1
|
0
|
1
|
|
15 mai
|
0
|
0
|
0
|
1
|
0
|
1
|
|
15 juin
|
0
|
0
|
1L5
|
0
|
0
|
0
|
|
16 juillet
|
0
|
0
|
0
|
1
|
0
|
0
|
|
14 aout
|
0
|
1
|
0
|
1
|
0
|
0
|
|
14 septembre
|
0
|
1
|
0
|
1
|
0
|
0
|
|
18 octobre
|
0
|
0
|
1L3
|
0
|
1L2
|
0
|
|
15 novembre
|
1L3
|
0
|
0
|
0
|
1L2
|
0
|
|
26 décembre
|
0
|
0
|
0
|
0
|
0
|
0
|
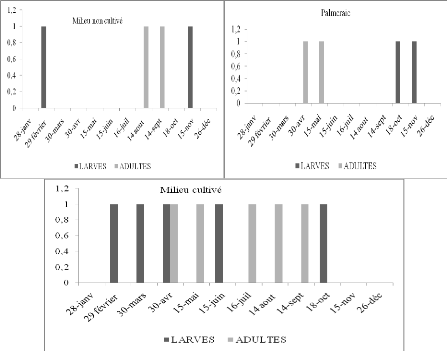
Figure 17. Nombre de larves et d'imagos de
Truxalis nasuta par 45m2 en fonction du temps dans trois
stations d'étude
56
D'après les histogrammes (Figure 17) obtenus à
partir du tableau 21 des L3 de ce Truxalinae ont été
capturées dans le milieu cultivé et non cultivé durant le
mois d'octobre. Dans la palmeraie nous avons noté des L2 durant les mois
d'octobre et novembre. Les accouplements et les pontes ont sûrement
échappé notre attention. Nous avons trouvé
également des larves dans le milieu cultivé durant les mois de
février à avril et de Juin. Durant les mois d'août et de
septembre nous avons noté des imagos dans les milieux cultivés et
non cultivé. Il est difficile de conclure sur le nombre de
générations annuelles de Truxalis nasuta, vu la
faiblesse des effectifs.
IV - 2 - 6 - 2 - Ecologie
Dans la région de Lakhdaria, Guecioueur (1990), a
capturé Truxalis nasuta dans deux types de stations, au niveau
du milieu cultivé où elle occupe les bordures infestées de
mauvaises herbes et au niveau du maquis où elle présente un
effectif assez important. T.nasuta fréquente tous les milieux
de la région de Ghardaïa ; milieu cultivé, milieu non
cultivé et palmeraie (Babaz, 1992; Douadi, 1992). D'après Chopard
(1943) cette espèce est signalée dans les différentes
localités, des plaines côtières jusqu'au Sud
Algérien. Lors de nos prospections nous avons capturé cet
acridien dans toutes les stations d'étude. Elle est présente
aussi bien dans les endroits humides que dans les endroits secs. Au niveau du
milieu cultivé ce Truxalinae fréquente les endroits
à végétations sèches. Nous avons également
constaté que T.nasuta change de couleur en fonction de son
milieu ce qui nous amène à dire que cet acridien présente
le phénomène d'homochromie.
IV - 2 - 7- Biologie et Ecologie d'Heteracris
harterti
IV - 2 - 7- 1 - Biologie
Les adultes du genre Heteracris apparaissent à
partir de la fin de mai et au début de juin. Ils sont observés
durant le reste de l'été (COPR, 1982). Dans la région de
Ghardaia, les adultes de cette espèce sont présents du mois de
juillet jusqu'en décembre. Quant aux larves, elles sont observées
au mois de janvier (Zergoun, 1991). D'après les histogrammes (Figure 18)
obtenus à partir du tableau 22, il est à constater que les larves
d'Heteracris harterti apparaissent dès le mois de juin dans le
milieu cultivé. Cette espèce est absente pendant la mauvaise
saison à l'état embryonnaire. Les imagos ont été
capturés de juillet à novembre. H.harterti est
accidentelle dans la palmeraie. Nous l'avons trouvé une seule fois
pendant toute l'année d'étude. De ces résultats il semble
qu'Heteracris harterti ne présente qu'une seule
génération annuelle.
57
Tableau 22. Nombre de larves et d'imagos
d'Heteracris harterti par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
0
|
0
|
|
30 mars
|
0
|
0
|
0
|
0
|
|
30 avril
|
0
|
0
|
0
|
0
|
|
15 mai
|
0
|
0
|
0
|
0
|
|
15 juin
|
1L3
|
0
|
0
|
0
|
|
16 juillet
|
1L2 - 1L3
|
1
|
0
|
0
|
|
14 aout
|
1L5
|
1
|
0
|
1
|
|
14 septembre
|
1L4
|
2
|
0
|
0
|
|
18 octobre
|
0
|
2
|
0
|
0
|
|
15 novembre
|
1L4 - 1L5
|
2
|
0
|
0
|
|
26 décembre
|
0
|
0
|
0
|
0
|
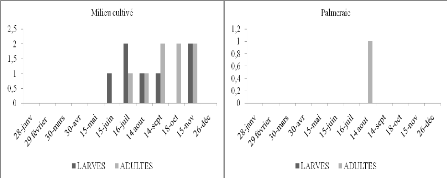
Figure 18. Nombre de larves et d'imagos
d'Heteracris harterti par 45m2 en fonction du temps dans
deux stations d'étude.
IV - 2 - 7- 2 - Ecologie
Heteracris harterti fréquente
généralement les buissons denses et t es arbustes dans lesquels
elles s'abritent en cas de danger (Mestre, 1988). Cet Eyprepocnemidinae
est présent aussi bien dans les zones semi désertiques que
dans les Oasis (COPR, 1982). Nous avons trouvé H.harterti dans
la palmeraie et le milieu cultivé. Cette espèce fréquente
uniquement les parcelles de tomate, d'aubergine et de courge. Les
dégâts dûs au genre Heteracris sont très
bien connus dans les parcelles de courge où nous avons observé en
1992 une superficie de 40m2 entièrement endommagée.
58
IV - 2 - 8 - Biologie et Ecologie d'Anacridium
aegyptium
IV - 2 - 8 - 1 - Biologie
Chopard (1965) note que Anacridium aegyptium est
adulte au mois de septembre, hiverne à cet état et pond au
printemps. Cette espèce a été observée à
l'état adulte au mois de mars dans la région de la Mitidja par
Benarbia (1990) et dans la région de Tizi-Ouzou par Mezreb (1993). Selon
Guecioueur (1990), A. aegyptium est capturé dans la
région de Lakhdaria à l'état adulte dès le mois
d'octobre. Des individus ont été observés en accouplement
en février. La ponte, quant à elle est notée à la
fin de mars. L'éclosion commence probablement en fin printemps
début été, et le développement larvaire s'effectue
durant la période estivale. A. aegyptium est une espèce
univoltine à hivernation imaginale (Fellaouine ,1989). D'après
COPR (1982), les adultes de cette espèce apparaissent souvent et
seulement à la fin de l'été. Ils hivernent sur les hautes
plantes et dans les arbres.
Tableau 23. Nombre de larves et d'imagos
d'Anacridium aegyptium par 45m2 en fonction du temps dans
le milieu cultivé.
|
Prélèvements durant 1992
|
Nombre d'individus
|
|
Larves
|
imagos
|
|
28 janvier
|
0
|
1
|
|
29 février
|
0
|
1
|
|
30 mars
|
0
|
1
|
|
30 avril
|
0
|
0
|
|
15 mai
|
0
|
0
|
|
15 juin
|
1L4 - 1L5
|
0
|
|
16 juillet
|
1L3 - 1L4
|
0
|
|
14 aout
|
2L4 - 1L5
|
0
|
|
14 septembre
|
2L5
|
1
|
|
18 octobre
|
1L5
|
1
|
|
15 novembre
|
0
|
1
|
|
26 décembre
|
0
|
2
|
Figure 19. Nombre de larves et d'imagos
d'Anacridium aegyptium par 45m2 en fonction du temps dans
le milieu cultivé.
59
L'histogramme (Figure 19) obtenu à partir du tableau
23, montre que A. aegyptium est à l'état larvaire
pendant la période estivo-automnale s'étalant de juin à
octobre. Les premiers adultes apparaissent dès le mois de septembre
jusqu'au mois de mars. On remarque l'absence des individus de cette
espèce durant les mois d'avril et de mai. Les faits observés
révèlent l'existence, chez A. aegyptium d'une seule
génération annuelle. Cet acridien passe l'hiver à
l'état imaginal.
IV - 2 - 8 - 2 - Ecologie
Anacridium aegyptium préfère les
endroits cultivés, surtout les haies et les arbustes, il est très
commun dans les Oasis (Chopard, 1943). Selon Fellaouine (1989), cette
espèce fréquente les jeunes forêts, les buissons, les
arbustes près des Oueds et les jardins, près des habitations. Ces
lieux sont généralement plus ou moins humides où la
température est tamponnée par la végétation. Nous
avons capturé cet Orthoptère dans le milieu cultivé ainsi
qu'en dehors des stations d'étude, spécialement dans les
Oasis.
IV - 2 - 9 - Conclusion
Il est difficile de conclure à propos du nombre de
génération par an. Cela est dû au fait que nous avons eu
des effectifs trop faibles. A la lumière de ces résultats il faut
penser à changer les méthodes d'investigation utilisées.
Etant donné que nous avons échantillonné dans 5 quadrats
de 9m2 par station, et nous avons réalisé une sortie
seulement par mois, il est évident que plusieurs aspects concernant le
cycle biologique des différentes espèces acridiennes
étudiées ont dû échapper à notre attention.
Donc nous proposons à ce que l'aspect biologique soit
étudié avec beaucoup plus d'attention en modifiant le protocole
expérimental. Il faut augmenter le nombre de quadrats et la
fréquence des échantillonnages. L'examen de l'état des
ovarioles des femelles tout au long de l'année peut aussi
préciser les observations faites sur le terrain. Il est
préférable également d'effectuer des élevages au
laboratoire pour mieux contrôler les conditions de développement
des espèces d'Orthoptères. Il vaut mieux faire 2 sorties sur le
terrain par station et par mois et 10 quadrats de 9m2 chacun au lieu
de 5 quadrats à chaque fois. Malgré ces précautions il est
possible que des lacunes apparentes demeurent prouvant que la plupart des
espèces changent de milieu au cours de l'année, Les larves et les
imagos n'ayant pas les mêmes exigences bioécologiques,
température, humidité et nourriture.
60
CHAPITRE V : Analyse statistique et écologique des
résultats V - 1 - Analyse statistique des résultats
V - 1 - 1 - Analyse factorielle des
correspondances
V - 1 - 1 - 1- Résultats
Pour l'interprétation de l'analyse factorielle des
correspondances, nous nous
sommes basés sur les espèces et les relevés
à forte contribution relative.
Tableau 24. Contribution à l'inertie
totale ou pourcentage expliqués par les axes principaux.
|
Axes
|
1
|
|
2
|
|
3
|
|
4
|
|
|
Contribution à l'inertie totale
|
71,0
|
%
|
29,0
|
%
|
0,0
|
%
|
0,0
|
%
|
Les deux premiers axes 1 et 2 totalisent 100 % de l'inertie
totale. La prise en considération des axes 3 et 4 est inutile.
Tableau 25. Contributions relatives aux
espèces d'Orthoptères ou variables sur l'axe 1 et 2
|
Espèces
|
Code
|
Axe 1
|
Axe 2
|
|
Tuarega insignis
|
TUI
|
6 ,2
|
0,0
|
|
Tenuitarsus angustus
|
TEA
|
1,8
|
5,6
|
|
Pyrgomorpha cognata
|
PYG
|
0,0
|
0,4
|
|
Pyrgomorpha conica
|
PYC
|
0,6
|
15,8
|
|
Dericorys millierei
|
DEM
|
6,3
|
0,0
|
|
Calliptamus barbarus
|
CAB
|
1,6
|
5,6
|
|
Heteracris harterti
|
HEH
|
3,7
|
0,9
|
|
Heteracris annulosa
|
HEA
|
1,8
|
5,6
|
|
Heteracris adspersa
|
HED
|
1,7
|
5,6
|
|
Anacridium aegyptium
|
ANE
|
1,6
|
5,6
|
|
Schistocerca gregaria
|
SCG
|
6,3
|
0,0
|
|
Acrida turrita
|
ACT
|
1,6
|
5,7
|
|
Aiolopus strepens
|
AIS
|
3,7
|
0,9
|
|
Aiolopus thalassinus
|
AIT
|
3,7
|
0,9
|
|
Acrotylus patruelis
|
ACP
|
3,7
|
1,3
|
|
Acrotylus longipes
|
ACL
|
1,6
|
5,6
|
|
Hyalorrhipis calcarata
|
HYC
|
6,3
|
0,0
|
|
Sphingonotus caerulans
|
SPC
|
6,3
|
0,0
|
|
Sphingonotus azurescens
|
SPA
|
6,3
|
0,0
|
|
Sphingonotus obscuratus lameerei
|
SPO
|
6,3
|
0,0
|
|
Sphingonotus rubescens
|
SPR
|
6,2
|
0,0
|
|
Pseudosphingonotus savignyi
|
SPS
|
6,2
|
0,0
|
|
Wernerella pachecoi
|
WEP
|
6,2
|
0,0
|
|
Ochrilidia geniculata
|
OCE
|
1,6
|
5,6
|
|
Ochrilidia gracilis
|
OCG
|
3,7
|
1,3
|
|
Omocestus raymondi
|
OMR
|
0,6
|
15,8
|
|
Omocestus lucasii
|
OML
|
0,6
|
15,8
|
|
Truxalis nasuta
|
TRN
|
0,0
|
0,4
|
|
Paratettix meridionalis
|
PAM
|
3,7
|
1,3
|
Il convient de ne fonder l'interprétation d'un axe que
sur les éléments qui apportent à cet axe les plus fortes
contributions suffisantes pour expliquer le maximum de l'inertie de cet axe. Or
les éléments qui contribuent le plus à la construction de
l'axe sont ceux qui s'écartent do son origine donc ceux qui
présentent les coordonnées les plus élevées. C'est
ainsi que sur les quatre axes que nous donnent le programme utilisé,
nous ne retenons que le premier et le deuxième axe, qui nous semble
être les seuls axes interprétables sur le plan écologique,
d'autant plus que leur somme est de 100 % (Benzekri, 1973). Nous avons
consigné nos résultats dans les tableaux 24 et 25 suivants.




61
Figure 20. Carte factorielle axe (1-2) des
espèces d'Orthoptères.
V - 1 - 1 - 2- Discussion
Il ressort de la figure 20 que les trois stations 001, 002 et
003 se retrouvent dans 3 quadrants différents. Cela s'explique par les
différences de composition en espèces des peuplements
Orthoptérologiques de ces stations. La contribution à l'inertie
totale des peuplements Orthoptérologiques à la formation de l'axe
1 est de 71 % (tableau 24). Cet axe correspond à la
caractéristique écologique majeure du peuplement acridien de la
région de Ghardaïa. En effet une nette différence
apparaît du côté positif (droite) vers le côté
négatif (gauche). Le deuxième axe absorbe 29 % de l'inertie
totale. Dans cet axe on note une
62
séparation entre le peuplement acridien
caractérisant la palmeraie et le peuplement acridien
caractérisant les milieux cultivés et non cultivés. Si
l'on considère l'ensemble des espèces acridiennes sur le plan
défini par les axes 1 et 2 de la figure 19 on observe cinq groupements
de Caelifères. Le groupement Pyrgomorpha conica (PYC),
Omocestus raymondi (OMR) et Omocestus lucasii (OML) (tableau
25). Ces espèces caractérisent la palmeraie car on ne les trouve
uniquement qu'à ce niveau. De même Babaz (1992) note que le genre
Omocestus forme un ensemble à part qui a une affinité
envers les palmeraies. Il a donc une tendance d'après le même
auteur vers les milieux couverts et légèrement
ensoleillés. Par contre Douadi (1992) signale Aiolopus thalassinus
comme étant une espèce caractérisant les milieux
très humides à végétation dense comme la palmeraie.
Le groupement B colonise le milieu cultivé et la palmeraie. Ces
espèces sont Acrotylus patruelis (ACP), Ochrilidia gracilis
(OCG), Heteracris harterti (HEH), Aiolopus strepens
(AIS), A. thalassinus (AIT) et Paratettix meridionalis
(PAM). Le groupement C groupe les espèces acridiennes qui se trouvent
uniquement dans le milieu cultivé. Ces espèces sont Acrotylus
longipes (ACL) Tenuitarsus angustus (TEA), Ochrilidia
geniculata (OCE), Calliptamus barbarus (CAB), Heteracris
adspersa (HED), Heteracris annulosa (HEA), Anacridium
aegyptium (ANE) et Acrida turrita (ACT). Par contre Babaz (1992)
cite les deux premières espèces du groupement C parmi les
acridiens qui se trouvent dans les milieux secs. Cela est dû probablement
au fait que Tenuitarsus angustus et Acrotylus longipes
préfèrent les endroits sablonneux. Le groupement D
caractérise les espèces d'Orthoptères qui se trouvent
uniquement dans le milieu non cultivé, Ces espèces sont
Tuarega insignis, Dericorys millierei, Schistocerca gregaria,
Hyalorrhipis calcarata, Sphingonotus caerulans, S. azurescens, S. obscuratus
lameerei, S. rubescens, Pseudosphingonotus savignyi et Wernerella
pachecoi. Enfin le groupement E englobe les espèces qui
fréquentent divers biotopes, il s'agit de Pyrgomorpha cognata
(PYG) et Truxalis nasuta (TRN). Ces deux espèces sont
aussi signalées par Ould El Hadj (1991), Babaz (1992) et Douadi (1992)
comme étant des acridiens qui tolèrent les conditions de
différents milieux. Selon l'axe 1, les acridiens se répartissent
en fonction de leurs affinités écologiques. La position de chaque
espèce sur cet axe exprime son degré vis-à-vis d'un
ensemble de facteurs écologiques tels que l'humidité, la
luminosité, et le couvert végétal. En effet, les
espèces qui préfèrent l'humidité vivent dans les
endroits moins ensoleillés et fréquentent les parcelles à
recouvrement herbacé dense sont situées du côté
positif de l'axe 1, telles Paratettix meridionalis et Ochrilidia
gracilis. Du côté négatif de l'axe 1 on retrouve les
espèces xérophiles c'est à dire celles qui
préfèrent vivrent dans les endroits secs. Ces derniers sont
caractérisés par une végétation très
éparse et une très forte luminosité Nous pouvons citer
63
entre autre Tuarega insignis et Dericorys
millierei. Les différents gradients qui sont le gradient
d'humidité, le gradient de luminosité et le gradient de
végétation varient de gauche à droite du milieu le plus
sec, le plus ensoleillé et à végétation
dispersée vers le milieu le plus humide, le moins ensoleillé et
à végétation plus dense. Au voisinage de l'origine se
trouve un groupe d'espèces qui tolèrent les différents
types de milieux telles que Truxalis nasuta et Pyrgomorpha
cognata. Ould El Hadj (1991) signale Aiolopus strepens et
Heteracris adspersa dans les milieux plus ou moins secs. Par contre
nos résultats et ceux de Douadi (1992) les classent dans les endroits
plus ou moins humides. Au voisinage de l'origine se trouve un groupe
d'espèces qui sont relativement indifférentes vis-à-vis du
facteur humidité, C'est encore le cas de Truxalis nasuta et de
Pyrgomorpha cognata. Sur l'axe 1 et 2 les espèces se
répartissent en fonction de leur présence dans les milieux
d'études. Ainsi sur la partie positive de l'axe 2 nous retrouvons les
espèces qui fréquentent la palmeraie telle Pyrgomorpha
conica, sur la partie négative nous avons les espèces du
milieu cultivé telle Acrotylus longipes, espèce qui a
été signalée par Babaz (1992) dans les milieux non
cultivés et par Ould El Hadj (1991) comme étant une espèce
qui fréquente les différents biotopes. De plus nous avons aussi
dans la partie négative de l'axe 2 les espèces
caractérisant le milieu non cultivé, telle que Tuarega
insignis. Près de l'origine des 2 axes se retrouvent toujours les
deux espèces peu exigeantes Truxalis nasuta et Pyrgomorpha
cognata présentes dans Les trois milieux. La position des
espèces acridiennes sur l'axe 2 semble donc renseigner sur leur
degré d'affinité vis-à-vis des biotopes. Ainsi
l'importance de la composition floristique des milieux est également un
facteur très important dans la distribution des acridiens dans les
différents biotopes.
V - 1 - 1 - 3- Conclusions
Les stations 001, 002 et 003 appartiennent à 3
quadrants différents parce qu'elles sont différentes en
espèces Orthoptériennes. Les espèces sont réparties
selon un gradient horizontal de gauche à droite horizontal
d'hygrométrie et de végétation croissante, ainsi que de
luminosité décroissante. Dans le groupe de Tuarega insignis
et de Dericorys millierei, les espèces sont
xérophiles. A l'opposé Paratettix meridionalis et
Ochrilidia gracilis sont hygrophiles. A l'origine on retrouve
Pyrgomorpha cognata et Truxalis nasuta, deux acridiens
mésohygrophiles.
64
V - 1 - 2 - Fréquence relative
Selon Voisin (1980), la fréquence permet de dire si une
espèce est commune, rare ou très rare. La fréquence a
déjà été employée dans de nombreux travaux,
dont ceux de Dreux (1962), Voisin (1996; 1990) et Eulalia et al
(1985).
V - 1 - 2 - 1 - Résultats
Tableau 26. Fréquences relatives des
espèces d'Orthoptères dans le milieu cultivé à Beni
Isguen en fonction du temps.
|
Mois Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
25
|
50
|
28,5
|
15,4
|
25
|
21,4
|
12,5
|
17,9
|
25
|
21
|
33,3
|
50
|
|
Acrotylus longipes
|
0
|
12,5
|
0
|
7,7
|
0
|
7,1
|
6,2
|
4,3
|
4,2
|
5,3
|
0
|
0
|
|
Aiolopus strepens
|
0
|
0
|
14,3
|
7,7
|
8,3
|
14,3
|
12,5
|
13
|
16,6
|
26,3
|
16,6
|
16,6
|
|
Aiolopus thalassinus
|
0
|
0
|
0
|
15,4
|
8,3
|
7,1
|
6,2
|
4,3
|
8,3
|
5,3
|
11,1
|
0
|
|
Acrida turrita
|
0
|
0
|
0
|
7,7
|
8,3
|
0
|
12,5
|
0
|
0
|
0
|
0
|
0
|
|
Anacridium aegyptium
|
0
|
0
|
0
|
0
|
0
|
7,1
|
6,25
|
4,35
|
0
|
0
|
0
|
0
|
|
Calliptamus barbarus
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4 ,3
|
0
|
0
|
0
|
0
|
|
Heteracris harterti
|
0
|
0
|
0
|
0
|
0
|
7,1
|
12,5
|
8.7
|
12,5
|
10,5
|
22,2
|
0
|
|
Heteracris adspersa
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
8,3
|
5,3
|
5,5
|
0
|
|
Heteracris annulosa
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
0
|
0
|
0
|
0
|
|
Ochrilidia gracilis
|
25
|
12,5
|
14,3
|
7,7
|
25
|
21,4
|
12,5
|
13
|
16,6
|
10,5
|
11,1
|
0
|
|
Ochrilidia geniculata
|
0
|
0
|
0
|
7,7
|
0
|
0
|
0
|
4,3
|
0
|
5,3
|
0
|
0
|
|
Paratettix meridionalis
|
25
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
16,6
|
|
Pyrgomorpha cognata
|
25
|
12,5
|
14,3
|
7,7
|
16,6
|
7,1
|
12,5
|
8,7
|
4,1
|
5,3
|
0
|
16,6
|
|
Truxalis nasuta
|
0
|
12,5
|
14,3
|
15,4
|
8,3
|
7,1
|
6,2
|
4,3
|
4,2
|
5,3
|
0
|
0
|
|
Tenuitarsus angustus
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
0
|
0
|
0
|
0
|
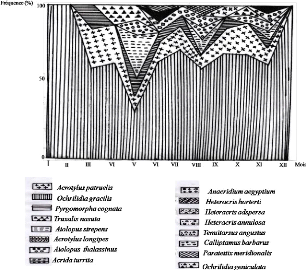
Figure 21. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans le milieu
cultivé.
65
Tableau 27. Fréquences relatives des
espèces d'Orthoptères dans la palmeraie de Ghardaïa en
fonction du temps.
|
Mois Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
0
|
0
|
25
|
25
|
10
|
12,5
|
14,3
|
8,3
|
15,4
|
18,7
|
9,6
|
0
|
|
Aiolopus strepens
|
0
|
0
|
0
|
0
|
30
|
0
|
0
|
8,3
|
0
|
0
|
4,7
|
0
|
|
Aiolopus thalassinus
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
8,3
|
0
|
6,2
|
4,7
|
0
|
|
Heteracris harterti
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
8,3
|
0
|
0
|
0
|
0
|
|
Ochrilidia gracilis
|
100
|
100
|
58,3
|
62,5
|
30
|
62,5
|
71,4
|
85,3
|
69,2
|
68,7
|
61,9
|
100
|
|
Omocestus lucasii
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
7,7
|
0
|
0
|
0
|
|
Omocestus raymondi
|
0
|
0
|
0
|
0
|
0
|
6,2
|
0
|
0
|
0
|
0
|
4,7
|
0
|
|
Paratettix meridionalis
|
0
|
0
|
0
|
0
|
0
|
6,2
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Pyrgomorpha conica
|
0
|
0
|
0
|
0
|
0
|
6,2
|
7,1
|
8,3
|
0
|
0
|
4,7
|
0
|
|
Pyrgomorpha cognata
|
0
|
0
|
16,6
|
0
|
10
|
6,2
|
7,1
|
0
|
7,7
|
0
|
4,7
|
0
|
|
Truxalis nasuta
|
0
|
0
|
0
|
12,5
|
10
|
0
|
0
|
0
|
0
|
6,2
|
4,7
|
0
|
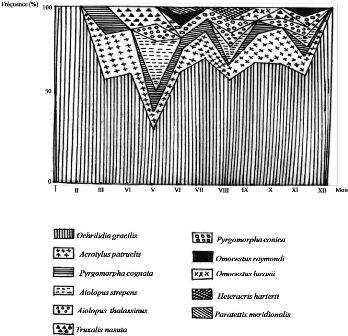
Figure 22. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans la
palmeraie
66
Tableau 28. Fréquences relatives des
espèces d'Orthoptères dans le milieu non cultivé à
Beni Isguen en fonction du temps.
|
Mois
Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Dericorys millierei
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Hyalorrhipis calcarata
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Pyrgomorpha cognata
|
0
|
0
|
100
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
50
|
100
|
|
Pseudosphingonotus savignyi
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Sphingonotus azurescens
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
10
|
0
|
0
|
0
|
0
|
|
Sphingonotus caerulans
|
0
|
0
|
0
|
50
|
50
|
50
|
28,6
|
20
|
33,3
|
33,3
|
50
|
0
|
|
Sphingonotus obscuratus lameerei
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Sphingonotus rubescens
|
0
|
0
|
0
|
50
|
50
|
33,3
|
14,3
|
10
|
33,3
|
33,3
|
0
|
0
|
|
Schistocerca gregaria
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Truxalis nasuta
|
0
|
100
|
0
|
0
|
0
|
0
|
0
|
10
|
33,3
|
33,3
|
0
|
0
|
|
Tuarega insignis
|
0
|
0
|
0
|
0
|
0
|
16,6
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Wernerella pachecoi
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
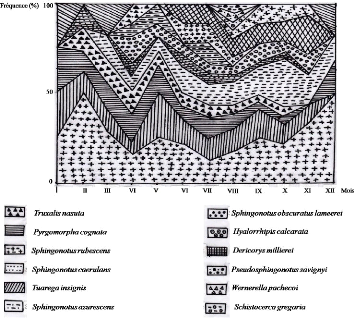
Figure 23. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans le milieu
non cultivé
V - 1 - 2 - 2 - Discussion
Il ressort des résultats obtenus que chaque milieu est
caractérisé par un peuplement particulier d'Orthoptères
Cælifères. Le milieu cultivé présente des
espèces très communes. Il s'agit d'Acrotylus patruelis,
Aiolopus strepens, Aiolopus thalassinus et Ochrilidia
gracilis. Nous observons ces espèces durant presque toute
l'année. La fréquence de chaque espèce est
67
variable selon les mois. La majorité des espèces
apparaissent durant le mois d'août soit 87.5 % des acridiens
présents dans le milieu cultivé Acrotylus patruelis est
l'espèce la plus fréquente dans ce milieu. Sa fréquence
est de 50 % durant les mois de février et de décembre (Fig. 21,
Tableau 26). Cela est dû au fait qu'elle a pu résister aux
mauvaises conditions climatiques du milieu car la température moyenne
mensuelle durant cette période est de 11.9°C en février et
11.4°C en décembre. Durant les autres mois la fréquence des
espèces acridiennes est en dessous de 50 %. Parmi les espèces qui
présentent une fréquence faible nous pouvons citer
Calliptamus barbarus avec 4.3 % en août et Tenuitarsus
angustus avec la même valeur. Zergoun (1991) note que
Pyrgomorpha cognata présente une fréquence
élevé dans le milieu cultivé. Par contre cette même
espèce est trouvée en 1992 avec une faible fréquence. La
plus Faible valeur a été enregistrée en septembre avec 4.1
%. Quant à la palmeraie on y retrouve une espèce très
fréquente dans ce milieu. Il s'agit d'Ochrilidia gracilis. La
fréquence de cet acridien atteint 100 % durant les mois de janvier,
février et décembre (Fig. 22, Tableau 27). A l'exception du mois
de mai où nous avons enregistré une fréquence de 30 %,
O. gracilis est considéré comme une espèce
très fréquente dans la palmeraie. Selon Chopard (1943) cette
espèce préfère les oasis. D'autres espèces moins
importantes sont aussi présentes dans la palmeraie. C'est le cas
d'Acrotylus patruelis, Pyrgomorpha cognata, Pyrgomorpha
conica et Aiolopus strepens. Ainsi que Heteracris harteti,
Omocestus raymondi et Omocestus lucasii sont les espèces
les moins fréquentes dans la palmeraie. Dans le milieu non
cultivé on note une fréquence de 100 % chez Pyrgomorpha
cognata en mois de mars et décembre. De même Truxalis
nasuta présente une fréquence de 100 % en mois de
février. On note aussi l'existence de deux espèces qui
présentent des fréquences comprises entre 10 % et 50 %. Il s'agit
de Sphingonotus caerulans et S. rubescens. Par contre
Dericorys millierei et Schistocerca gregaria
présentent chacune une très faible fréquence (Fig.
23, Tableau 28).
V - 1 - 2 - 3 - Conclusion
La variation de la fréquence des Orthoptères est
liée aux conditions climatiques. En effet Chopard (1943)
considère que la distribution géographique des acridiens est
conditionnée avant tout par la température. Etant donné
que la fréquence est le pourcentage d'individus d'une espèce par
rapport au total des individus, nous avons enregistré de faibles
fréquences durant les mois les plus chauds et de fortes
fréquences durant les mois les plus froids. La fréquence
d'Acrotylus patruelis dans le milieu cultivé par exemple passe
de 50 % au mois de décembre à 12,5 % au mois de juillet. Cela
s'explique par le fait que lorsque la température
68
de l'air est élevée, le nombre d'espèces
augmente dans la station. Cette augmentation influe sur la fréquence de
chaque espèce. De même les conditions défavorables
favorisent un développement d'une ou deux espèces au
détriment des autres acridiens. C'est le cas par exemple
d'Ochrilidia gracilis qui a enregistré dans la palmeraie une
fréquence de 100 % durant les mois de janvier, février et de
décembre.
V - 1 - 3 - La constance
Selon Dajoz (1982), la constance permet de dire si une
espèce est constante, accessoire ou accidentelle dans un milieu
donné.
V - 1 - 3 - 1 - Résultats
Les résultats des différentes stations sont
consignés dans le tableau 29. Tableau 29. La constance
en % des Cælifères dans trois stations d'étude
|
Espèces
|
Milieu cultivé
|
Palmeraie
|
Milieu non cultivé
|
|
Acrida turrita
|
25
|
-
|
-
|
|
Acrotylus longipes
|
58,33
|
-
|
-
|
|
Acrotylus patruelis
|
100
|
75
|
-
|
|
Aiolopus strepens
|
83,33
|
25
|
-
|
|
Aiolopus thalassinus
|
66,67
|
33,33
|
-
|
|
Anacridium aegyptium
|
25
|
-
|
-
|
|
Calliptamus barbarus
|
8,33
|
-
|
-
|
|
Dericorys millierei
|
-
|
-
|
8,33
|
|
Heteracris adspersa
|
33,33
|
-
|
-
|
|
Heteracris annulosa
|
8,33
|
-
|
-
|
|
Heteracris harterti
|
50
|
8,33
|
-
|
|
Hyalorrhipis calcarata
|
-
|
-
|
8,33
|
|
Ochrilidia geniculata
|
25
|
-
|
-
|
|
Ochrilidia gracilis
|
91,67
|
100
|
-
|
|
Omocestus lucasii
|
-
|
8,33
|
-
|
|
Omocestus raymondi
|
-
|
16,67
|
-
|
|
Paratettix meridionalis
|
50
|
8,33
|
-
|
|
Pyrgomorpha cognata
|
91,67
|
50
|
33,33
|
|
Pyrgomorpha conica
|
-
|
33,33
|
-
|
|
Pseudosphingonotus savignyi
|
-
|
-
|
8,33
|
|
Sphingonotus azurescens
|
-
|
-
|
16,67
|
|
Sphingonotus caerulans
|
-
|
-
|
66,67
|
|
Sphingonotus obscuratus lameerei
|
-
|
-
|
8,33
|
|
Sphingonotus rubescens
|
-
|
-
|
58,33
|
|
Schistocerca gregaria
|
-
|
-
|
8,33
|
|
Truxalis nasuta
|
75
|
33,33
|
33,33
|
|
Tuarega insignis
|
-
|
-
|
16,67
|
|
Wernerella pachecoi
|
-
|
-
|
8,33
|
|
Tenuitarsus angustus
|
8,33
|
-
|
-
|
V - 1 - 3 - 2 - Discussion
Il ressort des valeurs de la constance obtenues (Tableau 29)
que ces dernières varient en fonction du milieu et des espèces de
Cælifères. Le milieu cultivé englobe six espèces
constantes telles que A. patruelis, O. gracilis, P. cognata, T. nasuta, A.
thalassinus et A. longipes. Les valeurs les plus
élevées de la constance sont notées chez A. patruelis
avec 100 %, chez O. gracilis avec 91,66 % et enfin chez
P.cognata avec 91,66 %. (Tableau 29).
69
Ould El Hadj (1991) signale A. Strepens, A.
thalassinus et A. longipes comme étant des espèces
constantes dans toutes les parcelles de la région de Béni Abbes.
Dans la palmeraie de Ghardaïa O. gracilis est très
constante. Le même cas a été noté par Zergoun (1991)
pour Pyrgomorpha cognata en milieu cultivé. Le milieu non
cultivé est caractérisé par la présence de deux
espèces acridiennes qui tolèrent les conditions hostiles du
milieu. Il s'agit de S. caerulans et de S. rubescens. Ces
deux espèces présentent des valeurs respectives de constance de
66,7 % et 50, 3 %. Un quart des espèces acridiennes présentes
dans le milieu cultivé sont accessoires. Parmi elles nous pouvons citer
A. turrita et A. aegyptium. Quant à la palmeraie
presque la moitié de son acridofaune sont accessoire. Cela est dû
au fait que le microclimat humide de la palmeraie favorise le
développement d'un nombre restreint d'espèces
d'Orthoptères. Comme espèces accessoires nous pouvons citer
A. strepens, P. conica et T. nasuta. Par contre le milieu non
cultivé ne renferme que deux espèces accessoires qui sont P.
cognata et T. nasuta. Un quart des acridiens du milieu
cultivé sont accidentelles. C'est le cas par exemple de C.
barbarus. Cette espèce présente une valeur de constance
égale à 8.33 %. Dans la palmeraie plus d'un tiers des
espèces d'Orthoptères sont accidentelles. Nous citons comme
exemple H. harterti. Par contre dans le milieu non cultivé nous
trouvons 8 espèces accidentelles, soit deux tiers des espèces
Cælifères présentes dans cette station. Selon Guecioueur
(1990) une espèce peut être constante dans un milieu et
accidentelle dans un autre. Pour ce qui nous concerne A. strepens et
T. nasuta sont constantes dans le milieu cultivé et accessoire
dans la palmeraie.
V - 1 - 3 - 3 - Conclusion
D'après les résultats obtenus, il est à
constater que chaque espèce est caractérisée par sa
constance, différente d'un milieu à l'autre. Dans le milieu
cultivé 7 espèces sur 16 sont constantes, soit 43,8 % contre 18.8
% pour les espèces accidentelles. Ce taux des espèces
accidentelles du milieu cultivé double dans la palmeraie (36,4 %) et
quadruple presque dans le milieu non cultivé (66,7 %). A.patruelis
en tant qu'espèce constante elle caractérise le milieu
cultivé. Il en est de même pour O.gracilis dans la
palmeraie.
V - 2 - Analyse des résultats par les indices
écologiques
V - 2 - 1 - Indice de diversité de Shannon Weaver
et équitabilité
Selon Frontier (1982) la méthode la plus simple lorsqu
on se trouve en présence d'une récolte d'insectes ou de plancton,
d'une énumération d'oiseau ou d'un débarquement de
poissons consiste à se fonder Sur l'indice de diversité de
Shannon Weaver de l'échantillon.
70
Ainsi l'indice de diversité de Shannon Weaver est la
quantité d'information, apportée par un échantillon sur
les structures du peuplement dont provient l'échantillon et sur la
façon dont les individus y sont répartis entre diverses
espèces (Daget, 1976).
V - 2 - 1 - 1 - Résultats
Les résultats concernant l'indice de diversité de
Shannon Weaver et équitabilité sont consignés dans le
tableau 30.
Tableau 30. Indice de diversité de
Shannon Weaver et équitabilité dans chaque milieu et pour chaque
sortie.
|
Milieu
Sortie
|
Cultivé
|
Non cultivé
|
Palmeraie
|
|
H
|
E
|
H
|
E
|
H
|
E
|
|
28 - I - 1992
|
2
|
1
|
/
|
/
|
0
|
0
|
|
29 - II - 1992
|
2
|
0,86
|
0
|
0
|
0
|
0
|
|
30 - III - 1992
|
2,51
|
0,97
|
0
|
0
|
1,38
|
0,87
|
|
30 - IV - 1992
|
3,08
|
0,97
|
1
|
1
|
1,30
|
0,82
|
|
15 - V - 1992
|
2,62
|
0,93
|
1
|
1
|
1,37
|
0,92
|
|
15 - VI - 1992
|
2,98
|
0,94
|
1,46
|
0,92
|
1,05
|
0,40
|
|
16 - VII - 1992
|
3,25
|
0,98
|
2,51
|
0,97
|
1,02
|
0,51
|
|
14 - VIII - 1992
|
3,58
|
0,94
|
3,12
|
0,94
|
1,95
|
0,75
|
|
14 - IX - 1992
|
3,80
|
0,83
|
1,58
|
1
|
1,35
|
0,67
|
|
18 - X - 1992
|
2,97
|
0,89
|
1,58
|
1
|
1,32
|
0,66
|
|
15 - XI - 1992
|
2,37
|
0,92
|
1
|
1
|
0,96
|
0,32
|
|
20 - XII - 1992
|
1,79
|
0,89
|
0
|
0
|
0
|
0
|
\ : Espèce absente
0 : La valeur zéro indique que le peuplement est
monospécifique.
V - 2 - 1 - 2 - Discussion
Le tableau 30 donne une idée sur la diversité
des peuplements acridiens dans trois types de milieux de la région de
Ghardaïa. Le milieu cultivé est le plus favorable par rapport au
développement de nombreux Orthoptères. En effet il est
caractérisé par une mésothermie et une
mésohygrophie, raisons pour lesquelles nous avons recensé 16
espèces de Cælifères parmi les 29 espèces existant
dans la région d'étude. Les valeurs de l'indice de
diversité maximale enregistrées durant les mois de juillet,
août et septembre sont respectivement de 3,2, 3,6 et 3,8 (Tableau 30).
Pendant cette période la température du milieu est très
favorable pour les pullulations des acridiens. Chopard (1943) note que les
Orthoptères sont des insectes thermophiles et sténothermes. Leur
développement exige presque toujours une température
élevée et une insolation prolongée. Nous avons
capturé durant le mois d'août 14 espèces
d'Orthoptères, soit plus de 82 % des acridiens recensés dans le
milieu cultivé et plus de 48 % de la faune Orthoptérologiques
recensée dans la région de Ghardaïa. Il est aussi à
signaler que le cycle phénologique de nombreuses espèces
végétales plus particulièrement celui des graminées
coïncide avec le développement des espèces acridiennes. Il
ressort des observations faites sur le terrain que chaque espèce ou
groupe d'espèces acridiennes est inféodé à une
ou
71
plusieurs espèces végétales. C'est le cas
par exemple d'Heteracris harterti qui fréquente uniquement les
parcelles de courge, de tomate et d'aubergine. Les indices de diversité
les plus faibles sont notés durant les mois de décembre (1,79),
janvier (2) et de février (2). Ces valeurs indiquent que les conditions
du milieu sont défavorables pour le développement des acridiens.
En effet cette période est la plus mauvaise pour les Orthoptères
dans la région de Ghardaïa. C'est durant cette époque de
l'année que la température moyenne atteint son minimum. Durant le
mois de décembre par exemple nous avons capturé uniquement quatre
espèces d'acridiens. Elles correspondent à 25 % des
espèces inventoriées dans le milieu cultivé et à
13,8 % de la faune Orthoptérologiques de la région de
Ghardaïa. L'équitabilité E ne varie pas beaucoup dans le
milieu cultivé; elle se trouve dans un intervalle de 0,83 à 1,
cela signifie que le milieu est stable, donc les espèces sont
distribuées d'une manière équitable. Le milieu non
cultivé est colonisé par les espèces acridiennes qui ont
une préférence pour les endroits secs et dénudés.
Nous avons capturé dans ce milieu 12 espèces d'Orthoptères
Cælifères. Durant les mois de juillet, août et septembre
nous avons enregistré respectivement des valeurs de l'indice de
diversité de 2,5, 3,1 et 1,6. Le maximum d'espèces est
signalé au mois d'août avec 9 espèces sur les 12
Cælifères recensées dans le milieu non cultivé soit
75 % des espèces présentes dans le milieu non cultivé et
31 % de la faune Orthoptérologiques de la région d'étude.
La plus faible valeur de l'indice de diversité est égale à
1. Elle est enregistrée durant les mois d'avril, de mai et de novembre.
Cette valeur est due au fait que le milieu ne contient que deux espèces
d'Orthoptères en nombre égal. Il s'agit de Sphingonotus
caerulans et S.rubescens. Chacune d'elles est
représentée par deux individus. L'équitabilité dans
le milieu non cultivé est très élevée. Elle varie
de 0,92 à 1. Nous pouvons dire alors que le milieu non cultivé
est très homogène car il permet une distribution
équilibrée des espèces d'Orthoptères dans l'espace
et dans le temps. La palmeraie crée un microclimat très humide
permettant le développement en nombre d'une espèce telle
Ochrilidia gracilis et limite la pullulation d'autres espèces
telles Acrotylus patruelis et Aiolopus strepens. Selon
Frontier (1982) une communauté comprenant un petit nombre
d'espèces très abondantes relativement, les autres rares,
apparaît moins diversifiée qu'une communauté comprenant au
total le même nombre d'espèces, mais avec des fréquences
plus équitablement réparties. Dans le cas de la palmeraie, il
semblerait que nos résultats concordent le plus avec la première
idée du raisonnement de Frontier (1982). En effet, les valeurs
enregistrées montrent la faiblesse des indices de diversité dans
la palmeraie. Dans ce milieu le plus faible indice de diversité est
enregistré le mois de novembre 0,96. Cette valeur montre que sur les
huit espèces acridiennes capturées durant cette période,
seule Ochrilidia gracilis présente un nombre d'individus
très
72
importants. Les autres espèces telles Truxalis
nasuta, Aiolopus strepens et Pyrgomorpha cognata sont
très rares. Cela se traduit aussi au niveau de
l'équitabilité. En effet la plus faible valeur de
l'équitabilité enregistrée durant le mois de novembre est
de 0,3. Cette valeur est la plus faible enregistrée dans les trois
milieux. Ceci est dû au développement d'une
végétation graminéenne dense caractérisée
essentiellement par Setaria verticillata. Cette dernière abrite
en effet un nombre considérable d'individus d'Ochrilidia
gracilis.
V - 2 - 1 - 3 - Conclusion
Il est donc évident que les variations de l'indice de
diversité peuvent s'expliquer par deux aspects, soit par un changement
des conditions climatiques affectant profondément la fréquence
des espèces d'Orthoptères, soit par l'abondance et la composition
floristique du milieu et en parti culier les graminées. En effet nous
avons noté une valeur de l'indice de diversité qui est
égale à zéro durant les mois les plus froids, Des valeurs
élevées de l'indice de diversité sont enregistrées
durant les mois les plus chauds. Ainsi le milieu cultivé, le milieu non
cultivé et la palmeraie présentent des valeurs respectives de
3,6, 3, 1 et 1.9 durant le mois d'août.
V - 2 - 2 - Indice de dispersion
V - 2 - 2 - 1 - Résultats
Les résultats concernant l'indice de dispersion en milieu
cultivé à Béni Isguen sont consignés
dans le tableau 31.
Tableau 31. Indice de dispersion des
espèces Cælifères en milieu cultivé à
Béni Isguen
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus longipes
|
-
|
H
|
-
|
H
|
H
|
H
|
H
|
H
|
H
|
H
|
-
|
-
|
|
Acrotylus patruelis
|
H
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
|
Aiolopus strepens
|
-
|
-
|
H
|
H
|
H
|
C
|
C
|
C
|
C
|
C
|
C
|
H
|
|
Aiolopus thalassinus
|
-
|
-
|
-
|
R
|
H
|
H
|
H
|
H
|
C
|
H
|
C
|
-
|
|
Anacridium aegyptium
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
-
|
-
|
|
Acrida turrita
|
-
|
-
|
-
|
H
|
H
|
H
|
C
|
-
|
-
|
-
|
-
|
-
|
|
Calliptamus barbarus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Heteracris adspersa
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
C
|
H
|
H
|
-
|
|
Heteracris annulosa
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Heteracris harterti
|
-
|
-
|
-
|
-
|
-
|
H
|
C
|
C
|
C
|
C
|
C
|
-
|
|
Ochrilidia geniculata
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
H
|
-
|
H
|
-
|
-
|
|
Ochrilidia gracilis
|
H
|
H
|
H
|
H
|
C
|
C
|
R
|
C
|
C
|
R
|
R
|
-
|
|
Paratettix meridionalis
|
H
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
|
Pyrgomorpha cognata
|
H
|
H
|
H
|
C
|
C
|
H
|
R
|
R
|
H
|
H
|
-
|
H
|
|
Tenuitarsus angustus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Truxalis nasuta
|
-
|
H
|
H
|
R
|
H
|
H
|
H
|
H
|
H
|
H
|
-
|
-
|
H : au hasard, R : régulière, C : contagieuse
73
Les individus qui constituent un peuplement
d'Orthoptères peuvent présenter divers types de
répartitions spatiales qui traduisent leurs réactions vis
à vis de diverses influences telles que les conditions climatiques, le
tapis végétal et la recherche de la nourriture. Ainsi le cycle
biologique des acridiens joue un rôle important dans leur dispersion.
Tableau 32. Indice de dispersion des
espèces Cælifères en palmeraie à Ghardaïa
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
-
|
-
|
C
|
R
|
H
|
R
|
C
|
H
|
R
|
C
|
C
|
-
|
|
Aiolopus strepens
|
-
|
-
|
-
|
-
|
C
|
-
|
-
|
H
|
-
|
-
|
H
|
-
|
|
Aiolopus thalassinus
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
H
|
-
|
H
|
H
|
-
|
|
Heteracris harterti
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Ochrilidia gracilis
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
|
Omocestus lucasii
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
|
Omocestus raymondi
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
H
|
-
|
|
Paratettix meridionalis
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Pyrgomorpha cognata
|
-
|
-
|
R
|
-
|
H
|
H
|
H
|
-
|
H
|
-
|
H
|
-
|
|
Pyrgomorpha conica
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
H
|
-
|
|
Truxalis nasuta
|
-
|
-
|
-
|
H
|
H
|
-
|
-
|
-
|
-
|
H
|
H
|
-
|
H : au hasard, R : régulière, C : contagieuse
Tableau 33. Indice de dispersion des
espèces Cælifères en milieu non cultivé à
Béni Isguen
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Dericorys millierei
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Hyalorrhipis calcarata
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Pyrgomorpha cognata
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
H
|
H
|
|
Pseudosphingonotus savignyi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Sphingonotus azurescens
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
-
|
-
|
-
|
-
|
|
Sphingonotus caerulans
|
-
|
-
|
-
|
R
|
R
|
R
|
R
|
R
|
H
|
H
|
H
|
-
|
|
Sphingonotus obscuratus lameerei
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Sphingonotus rubescens
|
-
|
-
|
-
|
R
|
C
|
C
|
H
|
H
|
H
|
H
|
-
|
-
|
|
Schistocerca gregaria
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Tuarega insignis
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Truxalis nasuta
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
|
Wernerella pachecoi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
|
-
|
-
|
-
|
H : au hasard, R : régulière, C : contagieuse
V - 2 - 2 - 2 - Discussion
La répartition spatiale et temporelle des
espèces d'Orthoptères dans la région de Ghardaïa
varie d'un milieu à un autre. Dans le milieu cultivé la plupart
des espèces acridiennes ont une répartition de type
aléatoire (Tableau 31). Dans ce cas la valeur de l'indice de dispersion
est égale à 1. Nous citons comme exemple A.longipes,
T.nasuta, A.aegyptium. Quant à A.patruelis
elle présente une répartition contagieuse de février
à décembre en 1992. Cette contagion est très forte durant
la période s'étalant d'août à octobres. Cela
s'explique par le fait que durant cette période les rapprochements
sexuels et les accouplements ont lieu. Les individus d'A.patruelis se
rassemblent peut être aussi attirés par des plantes hôtes
particulièrement appétissantes en milieu cultivé. La
même explication peut être donnée aussi pour O. gracilis
en palmeraie. Cette espèce acridienne est présente en
agrégats durant toute
74
l'année 1992 (Tableau 32). Zergoun (1991) a
constaté le même fait pour P.cognata en milieu
cultivé. A.thalassinus, O.raymondi, P.conica
et T.nasuta présentent une répartition au hasard
dans la palmeraie. La répartition régulière a
été signalée 4 fois dans la palmeraie, trois fois chez
A.patruelis aux mois d'avril, juin et septembre. Ainsi une seule fois
chez P.cognata au mois de mars. Dans le milieu non cultivé,
S.rubescens est la seule espèce qui présente une
répartition contagieuse pendant une très courte période de
l'année correspondant à la reproduction (Tableau 33). Cette
contagion s'est manifestée aux mois de mai et juin. Cette période
correspond à l'éclosion des oeufs et au fait que les larves se
développent tout en restant groupées. De même Douadi (1992)
a signalé une contagion chez Sphingonotus carinatus et
Tenuitarsus angustus. Des répartitions régulières
sont observées chez S.caerulans du mois d'avril à
août. De même une seule répartition régulière
a été notée pour S.rubescens en avril. Le reste
des espèces Caelifères présentes dans le milieu non
cultivé ont une répartition aléatoire. Cela est dû
probablement au fait que le milieu est très homogène.
V - 2 - 2 - 3 - Conclusions
Au terme de cette étude sur le type de
répartition des Orthoptères dans la région de
Ghardaïa, il est à signaler que la dispersion des acridiens est
liée essentiellement à certains facteurs. Dans le milieu
cultivé A.patruelis a une répartition de type contagieux. Cette
contagion augmente en période estivale à cause des rapprochements
sexuels et des accouplements. O.gracilis est présente en agrégats
dans la palmeraie. Cette espèce se concentre dans les touffes de Setaria
verticillata. Le milieu non cultivé est caractérisé par
une répartition aléatoire des espèces acridiennes
fréquentant ce milieu.
75
|
|


