CHAPITRE III. Les métabolites secondaires
Les métabolites secondaires végétaux sont
des molécules essentielles à la vie des plantes et leur
interaction avec l'environnement. Ils sont également des sources
importantes pour les produits pharmaceutiques, les additifs alimentaires et les
arômes.
La concentration de ces molécules dans les
différentes parties des plantes est influencée par plusieurs
facteurs environnementaux tels que la température, l'humidité,
l'intensité lumineuse, l'eau, les sels minéraux et le CO2
(Ramakrishna et Ravishankar, 2011). A titre d'exemple, Gengmao et al., (2015)
ont observé que l'effet du stress salin est hautement significatif sur
la concentration des flavonoïdes (métabolites secondaires) au
niveau des feuilles du carthame (Figure 12) (Roumeissa et Maya, 2015; Rachedi
et al., 2018).
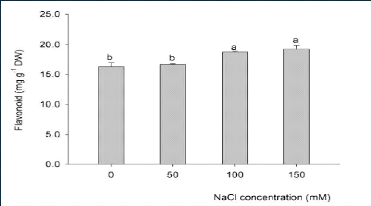
Figure 12. Effet du stress salin sur la concentration
des flavonoïdes au niveau des
feuilles du carthame (Roumeissa
et Maya, 2015)
III.1. Composés phénoliques
Les composés phénoliques sont des substances
présentes dans tous les végétaux et dans tous les organes
de la plante. Ils possèdent un noyau aromatique portant un ou plusieurs
groupements hydroxyles (Roumeissa et Maya, 2015).
Les composés phénoliques jouent un rôle
essentiel dans la structure et la protection des plantes (Stalikas, 2007). Ils
offrent également, pour la santé humaine, une protection contre
certaines maladies impliquant un stress oxydatif, comme les cancers et les
maladies cardiovasculaires et neurodégénératives (Sun et
al., 2011).
29
Les polyphénols sont caractérisés par la
présence d'au moins un noyau benzénique auquel est directement
lié au moins un groupe hydroxyle, libre ou engagé dans une autre
fonction : éther, ester, hétéroside (Boubekri, 2014a).
III.2. Flavonoïdes
Les flavonoïdes constituent un groupe de plus de 6000
composés naturels qui sont quasiment universels chez les plantes
vasculaires. Ils constituent des pigments responsables des colorations jaune,
orange, et rouge de différents organes végétaux. Tous les
flavonoïdes possèdent la même structure de base (C6-C3-C6),
ils contiennent quinze atomes de carbone dans leur structure de base: deux
cycles aromatiques A et B à six atomes de carbones (Figure 13)
liés avec une unité de trois atomes de carbone qui peut ou non
être une partie d'un troisième cycle C (Boubekri, 2014a).
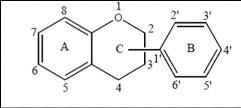
Figure 13. Structure de base des
flavonoïdes
Les flavonoïdes jouent un rôle très
important dans la croissance des plantes, la floraison, la fructification et la
défense contre les maladies et les microorganismes. Ils ont
également un rôle très important pour la santé
humaine. A titre d'exemple, ils sont efficaces pour l'inflammation chronique,
les maladies allergiques, les maladies coronariennes et le cancer. (Roumeissa
et Maya, 2015).
III.3. Les tanins
Les tanins sont des substances poly phénoliques de
structures variées, ayant en commun la propriété de tanner
la peau, c'est-à-dire de rendre imputrescible. Ces substances ont en
effet la propriété de se combiner aux protéines, ce qui
explique leur pouvoir tannant.
On distingue: les tanins hydrolysables et les tanins
condensés. Les tanins sont largement répandus dans les organismes
végétaux et plus particulièrement dans les fruits, les
graines
30
de céréales et diverses boissons. Dans
l'alimentation humaine, les sources les plus importantes de tannins sont le vin
et le thé (Boubekri, 2014b).
III.3.1. Tanins condensés
Ce sont des oligomères ou des polymères de
flavane-3-ol dérivés de la catéchine ou de son
isomère. Ils ont la propriété de coaguler les
protéines du derme, d'où leur utilisation dans le tannage des
peaux (Nadir, 2016).
Les tanins condensés (Figure 14) sont des
polyphénols de masse molaire élevée. Ils résultent
de la polymérisation auto-oxydative ou enzymatique des unités de
flavan-3,4-diol liées majoritairement par les liaisons C4-C8 (parfois
C4-C6) des unités adjacentes, et se nomment ainsi pro anthocyanidines de
type B. Lorsque la condensation se produit entre les unités adjacentes
par la liaison C4-C8 et par une liaison d'éther additionnelle entre et
C7, les pro anthocyanidines sont dits de types A (Boubekri, 2014a).
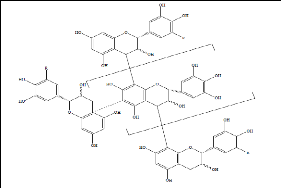
Figure 14. Exemples de tanins
condensés
III.3.2. Tanins hydrolysables
Les tanins hydrolysables (Figure 15) ou acides tanniques sont
des polymères de l'acide gallique ou de son produit de condensation ;
l'acide éllagique. Ils ont un poids moléculaire plus faible et
précipitent beaucoup moins les protéines que les tanins
condensés.
Ils peuvent diminuer la dégradation des parois dans le
rumen et être hydrolysés dans l'intestin en libérant des
produits toxiques pour le foie et le rein. Ils sont divisés en
31
éllagitannins et gallo tannins. Les gallo tannins
libèrent de l'acide gallique par hydrolyse acide, hydrolyse basique,
à l'eau chaude ou par action enzymatique (Boubekri, 2014a).
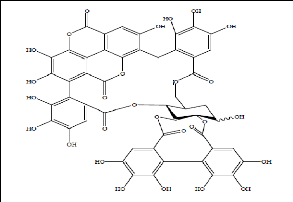
Figure 15. Exemples de tanins hydrolysables
32
IIème Partie :
ETUDE PRATIQUE
I. Introduction
Les propriétés biologiques que possèdent
un certain nombre de plantes présentent un intérêt
énorme pour l'Homme dans le domaine agroalimentaire, pharmaceutique,
médicale et même dans la recherche scientifique. Cependant des
composés phénoliques ou des coagulants sont beaucoup
utilisés dans le domaine alimentaire et médical.
Le but de notre travail pratique est de contribuer à la
valorisation de deux plantes du genre Cynara (Cynara scolymus
= artichaut cultivé) et (Cynara cardunculus = artichaut
sauvage) sur l'évaluation de l'activité coagulante des extraits
de fleurs dans le lait de vache en comparaison de celle de la présure.
Aussi, le dosage des composés phénoliques dans les fleurs et
bractées, et l'évaluation de leurs activités
antioxydantes.
Pour rendre compte des résultats de notre travail, nous
avons procédé comme suit :
1. Récolte et lyophilisation des fleurs
2. Extraction enzymatique des fleurs
3. Extraction et dosage des composés
phénoliques dans les bractées et évaluation de
l'activité anti radicalaire
4. Dosage de l'activité protéolytique et
détermination de l'activité coagulante d'extrait des fleurs
II. Matériel et méthodes
Le présent travail a été
réalisé au niveau du laboratoire de Technologie Alimentaire de
l'Institut National de Recherche Agronomique de Rabat (INRA).
La partie expérimentale se partage sur 2 volets à
savoir :
? Volet échantillonnage : inclue
l'échantillonnage du matériel végétal du
l'artichaut sauvage (Cynara cardunculus) et l'artichaut cultivé
(Cynara scolymus), celui du lait frais de bovin et de la
présure.
? Volet biochimique : inclue l'extraction des composés
phénoliques à partir des bractées de l'artichaut
cultivé et celui sauvage, dosage des polyphénols totaux, des
33
flavonoïdes, des tanins condensés et aussi de
l'activité antioxydante par deux méthodes (DPPH, ABTS).
Ce volet inclue aussi l'extraction de l'extrait coagulant du
lait à partir des fleurs de l'artichaut sauvage et de l'artichaut
cultivé, et l'évaluation de l'activité coagulante et
protéolytique de ces extraits dans le lait.
II.1. Matériel utilisé et
échantillonnage
L'échantillonnage de la partie florale de ces deux
plantes a été effectué sur les deux stades
c'est-à-dire le premier stade où il n'y a pas l'ouverture de la
fleur tandis que le second stade correspond à la présence d'une
ouverture concrète de la fleur.
Pour le premier stade, les fleurs de l'artichaut
cultivé (Figure 16) ont été récoltées dans
la région de Sidi Slimane (ville du Nord-Ouest du Maroc, située
environ à 60 km de la ville portuaire de Kénitra) au début
du mois d'avril 2019, et au mois de juin avec l'apparition nette des fleurs
(Figure 17) on a procédé à l'échantillonnage pour
le second stade. Les fleurs de l'artichaut sauvage (Figure 18) ont
été récoltées dans les montagnes d'Oulmès au
début du mois d'avril pour le premier stade et le mois de juin pour le
second stade (Figure 19).
Le matériel végétal utilisé est
constitué de la partie florale (bractées et fleurs) de
l'artichaut Cynara scolymus et Cynara cardunculus. Les fleurs
et les bractées sont séchées par lyophilisation afin de
conserver les molécules sensibles à la chaleur telle que les
enzymes, les protéines. Cette technique de déshydratation
conserve la qualité nutritionnelle et organoleptique des aliments et les
propriétés biologiques des molécules. Après
séchage, le broyage est effectué à l'aide d'un Moulinex
à café (Figure 20) ou un broyeur électrique (Figure
21).

Figure 16. Fleur de l'artichaut cultivé Figure 17.
Fleur de l'artichaut
sans ouverture (premier stade) cultivé avec
ouverture (second
stade)

|
Figure 18. Fleur de l'artichaut sauvage sans ouverture
(premier stade)
|
Figure 19. Fleur de l'artichaut sauvage
avec
ouverture (second stade)
|

34
Figure 20. Moulinex à café Figure 21.
Broyeur à sec
Le lait utilisé pour la détermination de
l'activité coagulante est le lait de vache (Figure 22) et a
été récolté dans la région de Zaër. La
présure (Figure 23) est celle utilisée par la
société Ajbane Chefchaouen spécialisée dans la
fabrication du fromage. Elle est un
35
coagulant microbien issu du mucor pepsine, produit par
fermentation en utilisant une souche sélectionnée du champignon
Rhizomucor miehei.
|
|
|
Figure 22. Lait utilisé
après
ajustement du pH
|
Figure 23. Présure utilisée
|
II.2. Extraction des composés phénoliques
II.2.1. Préparation des extraits
La méthode d'extraction suivie dans notre étude
est l'extraction par macération effectué selon le protocole
proposé par Romani et al., (2006) avec quelques modifications. Le
principe de cette méthode se base sur la macération de
matériel végétal dans un solvant d'extraction
acétone 70% suivi d'une agitation ainsi que la centrifugation pendant 20
minutes. La partie de la plante utilisée est le capitule du chardon et
d'artichaut : bractées.
Le protocole se résume comme suit (Romani et al., 2006) :
2g de poudre de fleur/bractée d'artichaut
Macération au bain marie 40°C avec agitation dans 20
ml d'acétone 70% pendant 3h
Centrifugation pendant 20 minutes (4000t/minute)
Filtration (papier wattman N° 1) Conservation de l'extrait
à -22°C
36
II.2.2. Dosage des composés phénoliques
II.2.2.1. Dosage des polyphénols totaux
Le dosage des polyphénols totaux a été
fait en utilisant le réactif de Folin-Ciocalteu. Cette méthode a
été décrite Singleton et Rossi (1965). Depuis, son
utilisation s'est largement répandue pour caractériser les
extraits végétaux d'origines plus diverses.
Le réactif de Folin-Ciocalteu est un acide de couleur
jaune constitué par un mélange d'acide phosphotungstique
(H3PW12O40) et d'acide phosphomolybdique (H3PMo12O40). Il
est réduit lors de l'oxydation des phénols, en un mélange
d'oxydes bleus de tungstène et de molybdène
(Ribéreau-Gayon et Peynaud, 1968). La coloration produite, dont
l'absorption maximum à 765nm est proportionnelle à la
quantité de polyphénols présents dans les extraits
végétaux (Boizot et Charpentier, 2006).
Les polyphénols (PP) ont été
déterminés par spectrophotométrie, suivant le protocole
appliqué par Li et al. (2007). 100 ìl d'extrait
végétal dilué 20 fois est mélangé avec 500
ìl de réactif de Folin Ciocalteu (FCR) dilué 10 fois dans
de l'eau distillée. Après 4 minutes d'incubation, 400 ìl
de carbonate de sodium (Na2CO3) à concentration de 7,5% sont
ajoutés. Après une incubation du mélange
réactionnel pendant 1 heure 30 minute à température
ambiante en l'obscurité, l'absorbance est mesurée à 765
nm.
La courbe d'étalonnage (Annexe 2) est effectuée
par l'acide gallique à différentes concentrations (0 - 50
ìg/ml), dans les mêmes conditions et les mêmes étapes
du dosage. Les résultats sont ainsi exprimés en mg/ml en se
référant à la courbe d'étalonnage d'acide
gallique.
II.2.2.2. Dosage des flavonoïdes ?
Principe
Les flavonoïdes possèdent un groupement hydroxyle
(OH) libre, en position 5 qui est susceptible de donner avec le groupement CO,
un complexe coloré avec le chlorure d'aluminium.
Les flavonoïdes forment des complexes jaunâtres par
chélation des métaux (fer et aluminium). Ceci traduit le fait que
le métal (Al) perd deux électrons pour s'unir à deux
atomes d'oxygène de la molécule phénolique agissant comme
donneur d'électrons.
37
? Protocole expérimentale
La détermination des flavonoïdes totaux a
été effectuée selon la méthode décrite par
Dehpour et al., (2009) ayant subi quelques modifications : 500 ìl de
chaque extrait à analyser sont ajoutés à 1500 ìl de
acétone 70 %, 100 ìl de AlCl3 à 10 % (m/v), 100 ìl
d'acétate de sodium 1 M et 2,5 ml d'eau distillée.
Le mélange est agité puis incubé à
l'obscurité et à température ambiante pendant 30 min. Le
blanc est réalisé par remplacement de l'extrait par
d'acétone 70% et l'absorbance est mesurée à 415 nm en
utilisant un spectrophotomètre UV (Perkin Elmer). Les résultats
sont exprimés en concentration mg/ml en se référant
à la courbe d'étalonnage de la quercétine. (Annexe 3)
II.2.2.3. Dosage des tanins condensés
Les tanins condensés sont déterminés par
la méthode de la vanilline en milieu acide décrite par
(Taouzinet, 2017). Le réactif de vanilline a été
préparé en mélangeant 4 g de vanilline dans 100 ml de
l'éthanol.
Le mélange a été maintenu à 30
°C avant le dosage. 100 ìl de chaque extrait à analyser ont
été ajoutés à 1500 ìl du réactif de
vanilline 4 % et après on ajoute 750 ìl de HCl concentré
à 37%. Le mélange a été agité puis
incubé à l'obscurité à 30°C pendant 20 min.
L'absorbance est mesurée à 550 nm par un spectrophotomètre
UV (Perkin Elmer) contre un blanc constitué d'un mélange
d'acétone 70% et de HCl (37%) à volume égal. Les
résultats sont exprimés en concentration mg/ml en se
référant à la courbe d'étalonnage du
catéchol (Annexe 4).
II.2.3. Evaluation de l'activité antioxydante des
extraits
L'activité antioxydante a été
évaluée en testant l'activité scavenging du radical DPPH,
et ABTS+.
II.2.3.1. Activité anti radicalaire au radical
DPPH
? Principe
Le test au 2,2-diphényl-2-picryl-hydrazyle (DPPH.),
permet de mesurer le pouvoir réducteur des substances antioxydantes
contenues dans un extrait.
38
Le DPPH est un radical libre de couleur violette qui devient
jaune quand il est réduit par un donneur de proton H+.
DPPH+AH DPPH-H + A.
Où AH est un composé capable de céder un
H+ au radical DPPH (Ibra et al., 2017). ?
Protocole
Le protocole expérimental utilisé est celui de
Ibra et al., (2017) avec quelques modifications. La solution de DPPH est
préparée par solubilisation de 4mg de DPPH dans 100 ml
d'éthanol. 200 ìl de l'extrait mélangé avec 1800
ìl de la solution de DPPH. Le mélange est agité puis
incubé à l'obscurité et à température
ambiante pendant 30 min. Le blanc est réalisé par remplacement de
l'extrait par d'acétone 70% et l'absorbance est mesurée à
517 nm en utilisant un spectrophotomètre UV (Perkin Elmer).
Le pouvoir anti-radicalaire de l'extrait est exprimé en
pourcentage d'inhibition du radical
DPPH :
Où : Contrôle : absorbance du témoin
Extrait : absorbance de l'extrait
II.2.3.2. Activité anti radicalaire au radical
l'ABTS.
? Principe
Ce test est basé sur le mécanisme
d'oxydoréduction de l'ABTS (sel d'ammonium de l'acide 2,2-azino
bis-(3-éthylbenzothiazoline-6-sulfonique)).Au cours de ce test, le sel
d'ABTS perd un électron pour former un radical cation (ABTS. +) de
couleur sombre (vert bleu) en solution. En présence de l'agent
antioxydant, le radical ainsi formé est réduit pour donner le
cation ABTS+, ce qui entraine la décoloration de la solution
(Owen et Johns, 1999).
L'addition d'un antioxydant à une solution de ce
radical cationique entraine la réduction de ce radical et une diminution
de l'absorbance. Cette diminution dépend de l'activité
antioxydant des composés testes, du temps et de la concentration (Re et
al., 1999)
39
Figure 24. Oxydation partielle de
l'ABTS (Owen et Johns, 1999).
? Protocole
Le pourcentage d'inhibition du radical ABTS.+ est
évalué par la méthode de (Nadir, 2016).
La solution d'ABTS. + est préparée par
mélange de 7 mM d'ABTS et de 2,45 mM de persulfate de potassium
incubé pendant 12-16h à l'abri de la lumière et à
température ambiante avant l'utilisation. La solution d'ABTS est
diluée avec l'éthanol jusqu'à l'obtention d'une absorbance
de 0,7(#177; 0,02) à 734 nm. 1,9 ml de la solution d'ABTS sont
additionnés à 100 ìl de l'extrait.
Après l'incubation pendant 7 min à
l'obscurité et à température ambiante, on mesure la
réaction de réduction de la solution d'ABTS à 734 nm. La
capacité antioxydante des extraits testée, est exprimée
par rapport aux concentrations de standard Trolox (TEAC) ; ce qui donne des
indications utiles sur le potentiel antioxydant de l'extrait de plantes.
Le pouvoir anti-radicalaire de l'extrait est exprimé en
pourcentage d'inhibition du radical ABTS+ :

Où : Contrôle : absorbance du témoin
Extrait : absorbance de l'extrait
II.2.4. Extraction du système enzymatique des
fleurs II.2.4.1. Obtention de l'extrait enzymatique des fleurs
Le système enzymatique utilisé a
été obtenu à partir des fleurs lyophilisées (Figure
26). Elles ont subi une congélation pendant trois jours suivis d'une
lyophilisation d'une semaine puis un broyage grâce à un broyeur
électrique.

40
Figure 25. Fleur avant lyophilisation Figure 26. Fleur
lyophilisée
Le protocole utilisé dans ce travail est celui
décrit par Tsouli (1974)et optimisé par (Nouani et al., 2009)
subit quelques modifications : broyage et macération (Figure 27) pendant
24h à température ambiante et à l'obscurité de 10 g
de fleurs sèches dans 100 ml du tampon d'acétate de sodium (0,1 M
à pH 5) additionné de 0,2% d'acide borique afin d'éviter
ultérieurement toute prolifération de microorganismes. Dans le
but d'extraire le maximum de matière enzymatique le tout est
congelé à -22°C pendant 48h puis décongelé
à température ambiante sous une agitation douce pendant 1h, le
liquide est ensuite centrifugé à 4200 g pendant 10 minutes, le
surnageant est ensuite filtré et l'extrait brut des fleurs de
l'artichaut est obtenu (Figure 28).

41
Figure 27. Macération des fleurs
broyées

Figure 28: Extraits enzymatiques de deux plantes:
sauvage et cultivée
II.2.4.2. Dosage de l'activité
protéolytique des extraits enzymatiques.
L'activité protéolytique est mise en
évidence par un dosage colorimétrique des groupements tyrosine
à l'aide du réactif de Folin-Ciocalteu ; conformément
à la technique décrite par Aicha (2003) cité dans Zikiou
et Zidoune (2019) avec quelques modifications. La comparaison de
l'activité protéolytique a été faite entre
l'extrait enzymatique des fleurs séchées et la présure
d'origine microbienne avec un gradient de concentration de: 25%, 50%, 75% et
100%.
42
Mode opératoire
Le dosage de l'activité protéolytique est
réalisé en deux étapes :
? La première étape étant la
réaction enzymatique, dont le mélange est constitué de : 1
ml de l'extrait! présure, 1.5 ml de tampon citrate ! sodium 0.05 M, pH
5.5 et 2.5
ml de la solution caséine à 2.5% dissoute dans du
citrate de sodium 0.02 M.
L'incubation se fait au bain marie à 40°C,
après 1 h on ajoute 5 ml de T.C.A à 4% pour arrêter la
réaction et permet la précipitation de la caséine non
hydrolysée. Les blancs réactionnels sont préparés
de la même manière que l'échantillon sauf qu'ici le TCA est
rajouté bien avant le substrat afin d'empêcher la réaction
enzymatique. La centrifugation a été faite de 3000 rpm pendant 5
minutes enfin de récupérer le surnageant.
? La deuxième étape étant le dosage
colorimétrique, après centrifugation les composés
azotés non protéiques qui se trouvent dans la phase soluble, sont
dosés selon la méthode d'Anson (1958) : 0.5 ml de surnageant avec
2.5 ml de Na2CO3 à 2% dans NaOH 0.1 N.
Après agitation et repos 10 min, on ajoute 0.25 ml de
réactif de Folin-Ciocalteu dilue au 1/2. Bien agiter et incuber 30
minutes à température ambiante. L'absorbance est lue contre le
blanc réactionnel à 750 nm au spectrophotomètre.
L'activité est calculée par
référence à une courbe d'étalonnage établie
en utilisant la tyrosine comme standard. La gamme étalon est
réalisée à partir d'une solution de tyrosine dont les
concentrations sont comprises entre 0 et 80 jig /ml. L'unité de
l'activité protéolytique correspond à 1 jig de la tyrosine
libéré par 1ml d'extrait enzymatique en une heure d'incubation.
La concentration de la tyrosine contenue dans le filtrat est déduite par
référence à une courbe d'étalonnage de la tyrosine
(Annexe 1).
L'activité protéolytique de l'extrait des fleurs
est comparée à celle de la présure, prise comme
témoin.
II.2.4.3. Détermination de l'activité
coagulante
L'activité coagulante est déterminée
selon la méthode de Berridge (1952) et tel que modifié par
Collins et al. (1977), Nouani et al. (2009) et Soumeya (2017). Cette
méthode permet d'exprimer l'activité de l'extrait enzymatique en
force coagulante. Il représente le volume
43
du lait coagulé par unité de volume de l'extrait
enzymatique en 40 min, à 35 ° C et à pH 6,4 en fonction de
la formule. Une unité Soxhlet (US) est définie comme la
quantité d'enzyme qui coagule 1 ml d'une solution de substrat de
Berridge à 30°C pendant 40minutes.
La formule de l'activité coagulante est donc :
AC= 10*V/T*V'
Où :
AC : Activité coagulante.
V : volume du lait à coaguler (10 ml).
T : temps de floculation
V' : volume de l'extrait enzymatique (1ml)
II.3. Analyse des données statistiques
L'analyse des données a été
effectuée par le logiciel Graphpad Prism 7.0 et les analyses
statistiques ANOVA ont été réalisées à
l'aide du logiciel SPSS version 23 . L'analyse de la variance a
été appliquée pour déterminer la différence
significative à p<0,05 entre plantes et stades.
44
III. Résultats et discussion
III.1.Teneur en eau du matériel
végétal
La teneur en eau est le rapport entre le poids sec et le poids
total du matériel végétal
Teneur en eau = poids sec / poids total x 100.
Après lyophilisation de l'échantillon
végétal, la perte d'eau de la fleur de deux plantes a
été considérable. De ce fait pour le premier stade nous
remarquons que la teneur en eau est supérieure à celle du second
stade quand la partie florale est mature. La teneur en eau de la partie florale
utilisée pour toutes ces deux plantes est de 80% pour le premier stade
tandis qu'elle est de 63% pour le second stade.
III.2.Dosage des composés phénoliques
III.2.1. Polyphénols totaux
D'après les analyses statistiques effectuées par
SPSS montrent une différence très significative (p<0,007)
entre le second stade plante cultivée et le premier stade plante
sauvage. Une différence significative (p<0,05) se manifeste entre le
second stade plante sauvage et second stade plante cultivée. La
comparaison des autres stades surtout entre le premier stade plante
cultivée ne montre pas des différences entre eux. Les
résultats des concentrations en polyphénols totaux sont
présentés dans la figure 29.
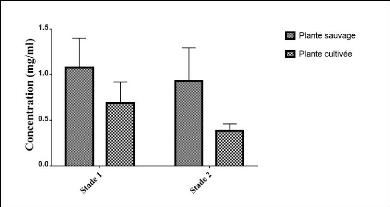
Figure 29. Concentration des polyphénols totaux
sur les deux stades.
45
D'après cette figure 29 on constate que les
concentrations des polyphénols totaux de la plante sauvage sont
supérieures à ceux de la plante cultivée sur les deux
stades. Les moyennes avec leur valeur standard sont exprimées dans le
tableau 8.
Tableau 8. Moyennes des concentrations des
polyphénols totaux
|
1er stade
|
|
Moyenne (mg/ml)
|
|
PPTs
|
1.08#177;0.15
|
|
|
PPTc
|
0.62#177; 0.08
|
|
2ème stade
|
PPTs
|
0.82#177;0.10
|
|
PPTc
|
0.37#177;0.10
|
|
PPTs : Polyphénols totaux pour extrait de la plante
sauvage ; PPTc : Polyphénols totaux pour extrait de la plante
cultivée
| 


