II.5.1 - Chlorophylle a
Pour doser les pigments chlorophylliens, 300 ml
d'échantillon d'eau sont filtrés sous vide à travers une
membrane filtrante en microfibre de verre de type WHATMAN GF/C de
porosité 1,2 um. La membrane est ensuite emballée dans du papier
aluminium et portée au dessiccateur contenant du Silicagel où
elle séjourne pendant 24 heures. Après dessiccation, l'extraction
des pigments se fait par immersion de la membrane dans 10ml de solution
d'acétone à 90 % et de carbonate de magnésium à 10
% contenus dans un tube à essai, à 4°C et à
l'obscurité pendant 24 heures.
Le tube débarrassé de la membrane est soumis
à une centrifugation à 2000 tours/min pendant 15min. La
densité optique du surnageant recueilli est lue aux longueurs d'onde
664, 665 et 750 nm au spectrophotomètre HACH DR/2000 (Anonyme, 1985).
Le calcul de la concentration en chlorophylle a est fait sur
la base de l'équation proposée par Lorenzen (1967), soit:
[Chla] (ug/l) = [ 26,7 x (
DO664-DO665 ) x V1/V2 ] x 1000
où :
V1 : volume du surnageant (extrait) 10 ml,
V2 : volume de l'échantillon d'eau
filtrée 300 ml,
DO664, 665 : densité optique aux longueurs
d'onde 664 et 665 nm.
La biomasse phytoplanctonique est chaque fois déduite
du calcul de la teneur des eaux en chlorophylle a selon la relation
présentée par Billen et al. (1999) soit : 1 ug
Chla/l correspond à une biomasse phytoplanctonique de 35 ug de carbone
par litre.
II.5.2 - Analyses bactériologiques
Les coliformes fécaux (CF) et les streptocoques
fécaux (SF) ont été identifiés et
dénombrés par la technique des membranes filtrantes.
L'isolement du type bactérien s'est fait sur la
gélose Endo pour les coliformes fécaux et sur milieu SLANETZ et
BARTLEY avec réplique sur BEA pour les streptocoques fécaux.
A partir des échantillons d'eau ramenés au
laboratoire, une série de dilutions est effectuée. Des
quantités aliquotes de chaque série de dilution sont
passées dans les conditions stériles à travers des
membranes filtrantes en ester de cellulose de type Millipore de porosité
0,45 um. Les membranes sont ensuite placées sur les milieux de culture
appropriés et incubées dans une étuve à 37 °C
ou 44 °C selon le type bactérien recherché, pendant 24
à 48 heures.
Le dénombrement se fait par comptage des colonies
à l'aide d'un compteur de colonies sur fond noir :
- les coliformes fécaux apparaissent sur la
gélose Endo comme des colonies roses à rouges foncés de 1
à 2 mm de diamètre, généralement à
éclat métallique ;
- les streptocoques fécaux apparaissent après
réplique sur BEA comme de petites colonies entourées d'un halo
noir.
Les résultats sont exprimés en unités
formatrices de colonies (UFC) par 100 ml (UFC/100 ml).
II.5.3 - Identification et dénombrement du
zooplancton
Après homogénéisation, 1ml de
l'échantillon est prélevé au moyen d'une pipette
calibrée et déposé dans une boîte de Pétri
quadrillée.
Les organismes sont déterminés sur le vivant
sous une loupe binoculaire stéréoscopique WILD M5, et à
l'aide des clés d'identification proposées par Durand &
Levêque (1981), Dragesco & Dragesco-Kerneis (1986). Un examen plus
fin au microscope s'est avéré nécessaire pour quelques
espèces.
Deux séries de comptage ont permis de déduire
pour chaque espèce la densité moyenne de peuplement pour le
prélèvement. Les résultats sont exprimés en nombre
d'individus par litre (ind./l).
II.5.4 - Identification et dénombrement des
macroinvertébrés benthiques
Les macroinvertébrés benthiques ont
été identifiés au niveau de la famille puis
dénombrés. Les spécimens fixés sur le terrain et
ramenés au laboratoire ont été examinés et
déterminés à l'aide des clés d'identification
proposées par Tachet et al. (1980), Durand & Levêque
(1981).
Les observations ont été faites sous une loupe
binoculaire stéréoscopique de type WILD M5 sur éclairage
épiscopique.
II.6 - Evaluation du degré de pollution
organique des eaux au moyen
des méthodes biologiques
II.6.1 - Méthode des saprobies
La détermination du degré de
pollution organique des eaux du Ntsomo a été faite grâce
à la méthode de Pantle & Buck (1955), selon laquelle chaque
espèce se voit attribuée une "valence saprobiale s" correspondant
à son degré de saprobiontie. L'indice saprobique de la
station :
S = 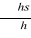 où, où,
S = indice saprobique de la station,
s = Valence saprobiale de l'espèce,
h = abondance relative estimée de chaque
espèce,
h = 1 pour les espèces peu
représentées,
h = 3 pour les espèces moyennement
représentées,
h = 5 pour les espèces très
représentées.
D'après les valeurs de l'indice saprobique, les
auteurs classent les milieux dans les quatre niveaux de saprobité
suivants :
1 = S < 1,5 milieu oligosaprobe,
1.5 = S < 2,5 milieu â - mésosaprobe,
2,5 = S < 3,5 milieu á -
mésosaprobe,
3,5 = S < 4 milieu polysaprobe.
II.6.2 - Utilisation des indices de diversité
Les indices de diversité de Shannon & Weaver
(1948) et de Menhinick (1964) ont permis d'évaluer l'impact des
pollutions sur la structure de quelques communautés aux
différentes stations. Le calcul est fait selon les formules suivantes :
- indice de diversité de Menhinick (1964) d = 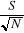 , ,
- indice de diversité de Shannon & Weaver (1948) H'
= - 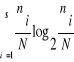 avec, avec,
S = nombre d'espèces de l'échantillon,
N = nombre total
d'individus de l'échantillon,
ni =
effectif de l'espèce i dans un échantillon.
CHAPITRE III
| 


