CHAPITRE 3 : RESULTATS
3.1 Résultats
3.1.1 Prospection, isolement et
pathogénicité
Soixante huit (68) isolats pathogènes de I.
cylindrica, répartis en 7 espèces sont identifiés
comme pathogènes durant la période de cette étude (Tableau
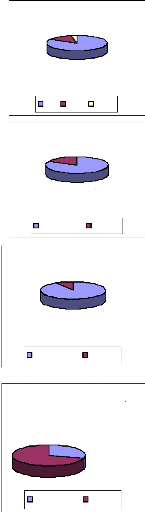
2). Le nombre de pathogènes obtenu varie selon les zones et selon les
saisons (Figure 5). Dans la ZH, 56 isolats (82% des pathogènes)
étaient collectés contre respectivement 10 isolats (15%) et 2
isolats ( 3%) dans la ZSH et la ZSA (Figure 5a). Quant aux saisons, la majeure
partie des pathogènes était collectée en saison pluvieuse
(82%), contre un nombre relativement réduit en saison sèche (18%)
(Figure 5b).
Considérant séparément les zones, tous
les 2 isolats de C. caudatum obtenus dans la ZSA sont
collectionnés en saison pluvieuse tandis que pour les deux autres zones,
les pathogènes sont différemment retrouvés au cours des
deux saisons avec une prédominance en saison pluvieuse pour la ZH et en
saison sèche pour la ZSH. En effet, 51 isolats (91% des
pathogènes) de la ZH sont collectionnés en saison pluvieuse
contre 5 isolats (9%) seulement en saison sèche (Figure 5c). Alors que
dans la ZSH, la majorité des pathogènes retrouvés
proviennent de la saison sèche, soit 7 isolats (70%) contre 3 isolat
(30%) pour la saison pluvieuse (Figure 5d). Les symptômes causés
par ces pathogènes sur I. cylindrica sont
caractérisés par:
· Des lésions sombres en forme de petites taches
(1mm) évoluant sous forme de demi-lune de 50 mm de diamètre en
bordure de la feuille (Figure 6a). Ces lésions sont surmontées de
halo jaune, et peuvent s'unir pour occuper toute la surface de la feuille.
L'observation à la loupe montre des fructifications sous forme
d'acervulles contenant des setae noirs sur la face supérieure de la
feuille. (Figures 6a). De ces types de lésions, est isolé par la
méthode directe, Colletotrichum caudatum qui présente un
mycélium gris, fin, cotonneux ou floconneux sur PDA. L'observation
microscopique présente des spores en forme de faucilles ((30-35) um x
(3,75-5) um), munies de flagelles;
· Des lésions brunes ou marron
irrégulières, observées sur les vielles feuilles des
plantes retrouvées dans les jachères qui sont
caractérisées par une nécrose peu prononcée avec de
petits nodules alignés dans les sillons du tissu foliaire (Figure
6b). L'observation à la loupe montre des
fructifications (sous formes de nodules marron), s'incrustant dans le limbe de
la feuille. Malgré la présence remarquable des fructifications,
l'isolement par la méthode directe est souvent sans succès. De
ces lésions, ont été isolés Glomerella
cingulata ou Glomerella spp qui se présente sous forme de
colonies jaune à jaune foncé, parsemées de pycnides orange
sur PDA. L'observation microscopique du contenu de ces dernières montre,
des ascospores de 15-20 um.
· Des brûlures longitudinales, de dimensions
variables et coalescentes de couleurs brunes à marrons ont
été aussi observées sur les feuilles (Figure 6c).
L'isolement par la méthode de stérilisation de surface a permis
d'isoler Bipolaris sacchari, Drechslera gigantea,
Exserohilum longirostratum, ou Exserohilum rostratum. La
différenciation de ces espèces uniquement par les symptômes
foliaires n'est pas aisée. Cependant, les lésions dues à
Drechslera gigantea se présentent comme des traces
longitudinales marron et sombre sur le limbe de la feuille tandis que les
autres espèces se caractérisent par des brûlures
longitudinales marron moins sombres en bordure de la feuille. 1). Les colonies
de B. sacchari sont d'un gris- clair sur PDA, et sont de dimensions
variant entre 64,5 et 85 mm après 7 jours. L'observation microscopique
montre des spores marrons, fusiformes et segmentées de dimensions
(20-110) x (5-15) tm. 2). Les colonies de D. gigantea sont d'un gris
surmonté d'une touffe claire sur PDA, et sont de diamètres
réduits (36 - 51,5 mm en 7 jours). L'observation microscopique montre
des spores marron rectilignes ou courbées selon les isolats avec des
segmentations claires ou sombres selon les isolats et mesurent (20-125) tm x
7,5-10) tm. 3). Les colonies de E. longirostratum sont de couleur
gris-clair avec une bordure claire. Elles remplissent la boîte de PDA (85
mm) en 6 jours. L'observation microscopique montre des spores fusiformes de
couleur marron à marron sombre de dimensions (20-110) tm x (7,5-10) tm.
Quant aux isolats de E. rostratum, leurs colonies sur PDA sont d'un
gris-clair à gris foncé avec des micelia fins, cotonneux, ou
floconneux. L'observation microscopique montre des spores fusiformes à
segment sombres et de dimensions (20 - 135) tm x (5-9) tm.
Les différences entre isolats de mêmes
espèces sont exprimées en 3.1.2.3.
Des 68 isolats, 45 sont identifiés comme C.
caudatum, 6 comme G. cingulata, 9 comme Glomerella
Spp., 2 comme E. longirostratum, 3 comme E.
rostratum, 2 comme B. sacchari et un seul comme D.
gigantea (Tableau 3.). Leur répartition varie suivant les zones et
les départements. C. caudatum est distribué dans toutes
les 3 zones, G. cingulata et Glomerella spp. sont
répartis dans la ZH et la ZSH tandis que E. longirostratum,
E. rostratum, B. sacchari et D. gigantea sont
seulement localisés dans la ZH (Figure 7).
Il faut signaler que les différentes espèces
pathogènes isolées étaient le plus souvent
associées à des champignons saprophytes. Il s'agit de
Pestalotia sp, Alternaria sp, Phoma sp, Botryodiplodia et Nigrospora.
Les tests de pathogénicité in vivo n'ont montré
aucun symptôme pour aucune de ces espèces.
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
1
|
BISBEN1
|
625
|
B. sacchari
|
ZH
|
Oueme
|
Adjohoun (Gbada)
|
60 38,76 N 20 31,23 E
|
2
|
BISBEN2
|
629
|
B. sacchari
|
ZH
|
Mono
|
Come (Bohoue-gbedji)
|
60 27,83N 10 54,99E
|
3
|
COCBEN1
|
451
|
C. caudatum
|
ZH
|
Oueme
|
Kouti
|
60 35,35N 20 39,23E
|
4
|
COCBEN10
|
494
|
C. caudatum
|
ZH
|
Atlantique
|
Tori Dognonko
|
60 30,19N 20 11,20E
|
5
|
COCBEN1 1
|
45
|
C. caudatum
|
ZH
|
Mono
|
Adjahonmey
|
70 2,56N 10 47,3 8E
|
6
|
COCBEN12
|
513
|
C. caudatum
|
ZH
|
Atlantique
|
Iiita-Cotonou
|
60 25,24N 20 19,68E
|
7
|
COCBEN13
|
521
|
C. caudatum
|
ZH
|
Mono
|
Agatogbo
|
60 24,07 N 10 55,53 E
|
8
|
COCBEN14
|
522
|
C. caudatum
|
ZH
|
Mono
|
Adjido
|
60 50,51N 10 47,43E
|
9
|
COCBEN15
|
530
|
C. caudatum
|
ZH
|
Mono
|
Kpovidji
|
60 34,43N 10 52,17E
|
10
|
COCBEN16
|
531
|
C. caudatum
|
ZH
|
Mono
|
Ayivedji
|
60 40,28N 10 43,07E
|
11
|
COCBEN17
|
523
|
C. caudatum
|
ZH
|
Mono
|
Ayivedji
|
60 40,28N 10 43,07E
|
12
|
COCBEN18
|
514
|
C. caudatum
|
ZH
|
Couffo
|
Toviklin
|
60 53,61N 10 50,01E
|
13
|
COCBEN19
|
515
|
C. caudatum
|
ZH
|
Couffo
|
Ayahohoue
|
60 57,59N 10 49,42E
|
14
|
COCBEN2
|
452
|
C. caudatum
|
ZH
|
Mono
|
Aveganmey
|
702,27N 10 68,76E
|
15
|
COCBEN20
|
516
|
C. caudatum
|
ZH
|
Couffo
|
Toviklin
|
60 53,61N 10 50,01E
|
16
|
COCBEN21
|
517
|
C. caudatum
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
17
|
COCBEN22
|
518
|
C. caudatum
|
ZH
|
Couffo
|
Lokogba
|
60 52,21N 10 51,9E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
18
|
COCBEN23
|
519
|
C. caudatum
|
ZH
|
Couffo
|
Meganhoue
|
60 53,47N 20 39,28E
|
19
|
COCBEN24
|
524
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
20
|
COCBEN25
|
526
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
21
|
COCBEN26
|
527
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
22
|
COCBEN27
|
528
|
C. caudatum
|
ZH
|
Couffo
|
Fonkome
|
60 46,67N 10 46,37E
|
23
|
COCBEN28
|
520
|
C. caudatum
|
ZH
|
Couffo
|
Meganhoue
|
60 53,47N 20 39,28E
|
24
|
COCBEN29
|
535
|
C. caudatum
|
ZH
|
Atlantique
|
Toffo (Ague)
|
60 43,57N 20 16,12E
|
25
|
COCBEN3
|
453
|
C. caudatum
|
ZH
|
Atlantique
|
Kpomasse
|
60 27,49N 20 1,04E
|
26
|
COCBEN30
|
538
|
C. caudatum
|
ZH
|
Oueme
|
Bonou
|
60 47,24N 20 29,01E
|
27
|
COCBEN31
|
539
|
C. caudatum
|
ZSA
|
Atacora
|
Agboute
|
100 15,14N 00 59,43 E
|
28
|
COCBEN32
|
594
|
C. caudatum
|
ZSA
|
Borgou
|
Bouay
|
100 22,33N 20 46,43E
|
29
|
COCBEN33
|
595
|
C. caudatum
|
ZH
|
Mono
|
Come
|
60 28,23N 10 54,44E
|
30
|
COCBEN34
|
597
|
C. caudatum
|
ZH
|
Zou
|
Saclo
|
708,23N 2012,07E
|
31
|
COCBEN35
|
598
|
C. caudatum
|
ZH
|
Zou
|
Avokanzoun
|
7012,95N 202,41E
|
32
|
COCBEN36
|
599
|
C. caudatum
|
ZH
|
Zou
|
Avlame
|
707,37N 208,50E
|
33
|
COCBEN37
|
600
|
C. caudatum
|
ZH
|
Mono
|
Zoungbonou
|
60 13,19N 10 47,60E
|
34
|
COCBEN38
|
618
|
C. caudatum
|
ZSH
|
Collines
|
Dassa (Atagui)
|
70 49,96N 20 11,20E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
35
|
COCBEN39
|
619
|
C. caudatum
|
ZSH
|
Collines
|
Bante )Gouka)
|
80 10,49N 20 58,67E
|
36
|
COCBEN4
|
454
|
C. caudatum
|
ZH
|
Zou
|
Pouto
|
7013,75N 2027,60E
|
37
|
COCBEN40
|
620
|
C. caudatum
|
ZSH
|
Collines
|
Glazoue (Gbanli)
|
80 1 1,10N 20 11,20E
|
38
|
COCBEN41
|
621
|
C. caudatum
|
ZH
|
Plateau
|
Ketou (Odometa 1)
|
70 12,59N 20 38,80E
|
39
|
COCBEN43
|
623
|
C. caudatum
|
ZH
|
Oueme
|
Adjara (Honvie)
|
60 36,07N 20 39,95E
|
40
|
COCBEN44
|
626
|
C. caudatum
|
ZH
|
Mono
|
Houyogbe (Se)
|
60 31,14N 10 48,72E
|
41
|
COCBEN46
|
628
|
C. caudatum
|
ZH
|
Couffo
|
Kluekanmey (Lanta)
|
70 6,20N 10 52,47E
|
42
|
COCBEN47
|
646
|
C. caudatum
|
ZH
|
Couffo
|
Kluekanmey (Carder)
|
60 59,15N 10 51,15E
|
43
|
COCBEN5
|
455
|
C. caudatum
|
ZH
|
Plateau
|
Onigbolo
|
709,46N 2039,28E
|
44
|
COCBEN6
|
456
|
C. caudatum
|
ZH
|
Mono
|
Se (Gbadagri)
|
60 31,14N 20 12,07E
|
45
|
COCBEN7
|
457
|
C. caudatum
|
ZH
|
Mono
|
Zoungbonou
|
60 13,19N 10 47,60E
|
46
|
COCBEN8
|
458
|
C. caudatum
|
ZSH
|
Borgou
|
Gorou
|
80 58,58N 20 47,38E
|
47
|
COCBEN9
|
459
|
C. caudatum
|
ZSH
|
Borgou
|
Axe Tchaorou-Beterou
|
80 54,32N 2033,8E
|
48
|
DRGBEN1
|
536
|
D. gigantea
|
ZH
|
Plateau
|
Adjaouere
|
60 59,44N 20 36,47E
|
49
|
EXLBEN1
|
640
|
E. Longirostratum
|
ZH
|
Couffo
|
Lalo
|
60 53,21N 10 58,50E
|
50
|
EXLBEN2
|
648
|
E. Longirostratum
|
ZH
|
Couffo
|
Kluekanmey (Carder)
|
60 59,15N 10 5 1,15E
|
51
|
EXRBEN1
|
537
|
E. rostratum
|
ZH
|
Oueme
|
Bonou
|
60 47,24N 20 29,01E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés de I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
52
|
EXRBEN2
|
596
|
E. rostratum
|
ZH
|
Mono
|
Come (Bohoue-gbedji)
|
60 27,83N 10 54,99E
|
53
|
EXRBEN3
|
624
|
E. rostratum
|
ZH
|
Oueme
|
Avrankou(Ounho)
|
60 32,14N 20 39,42E
|
54
|
GLCBEN1
|
450
|
G. cingulata
|
ZH
|
Collines
|
Paouian
|
70 39,67N 20 14,19E
|
55
|
GLCBEN2
|
504
|
G. cingulata
|
ZH
|
Atlantique
|
Tokan
|
60 27,57N 20 19,10E
|
56
|
GLCBEN3
|
505
|
G. cingulata
|
ZH
|
Mono
|
Yehoumey
|
60 56,84N 10 42,29E
|
57
|
GLCBEN4
|
525
|
G. cingulata
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
58
|
GLCBEN5
|
614
|
G. cingulata
|
ZSH
|
Collines
|
Glazoue (Gbanli)
|
80 1 1,10N 20 11,20E
|
59
|
GLCBEN6
|
615
|
G. cingulata
|
ZSH
|
Collines
|
Hoco
|
70 52,91N 20 56,12E
|
60
|
GLSPBEN1
|
442
|
Glomerella spp
|
ZH
|
Mono
|
Kpinnou
|
60 34,95N 10 46,25E
|
61
|
GLSPBEN2
|
36
|
Glomerella spp
|
ZH
|
Zou
|
Koguede
|
7012,5N 2010,51E
|
62
|
GLSPBEN3
|
506
|
Glomerella spp
|
ZSH
|
Collines
|
Oougui
|
807,17N 3033,55
|
63
|
GLSPBEN4
|
507
|
Glomerella spp
|
ZH
|
Atlantique
|
Houegbo
|
60 39,06N 20 4,66E
|
64
|
GLSPBEN5
|
529
|
Glomerella spp
|
ZH
|
Mono
|
Ouedeme-Pedah
|
60 29,47N 10 55,75E
|
65
|
GLSPBEN6
|
533
|
Glomerella spp
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
66
|
GLSPBEN7
|
534
|
Glomerella spp
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
67
|
GLSPBEN8
|
616
|
Glomerrela spp
|
ZSH
|
Collines
|
Dassa (Atagui)
|
70 49,96N 20 11,20E
|
68
|
GLSPBEN9
|
617
|
Glomerrela spp
|
ZSH
|
Collines
|
Save (Atchakpa)
|
7059,45N 2023,61E
|
|
1 .5

15% 3%
a
18%
b
82%
ZH ZSH ZSA
82%
PLUVIEUSE SECHE
c
9%
91%
PLUVIEUSE SECHE
d
30%
70%
PLUVIEUSE SECHE

38
c
b
a

Figure 6: Lésions dues à C. caudatum
(a), lésions dues à G. cingulata et Glomerella
spp.(b) et lésions causées par B. sacchari, D.
gigantea E. rostratum ou E. longirostratum (c)


Figure 7: Carte de distribution des espèces
retrouvées sur I. cylindrica au Bénin. BIS = B.
sacchari, COC = C. caudatum, DRG = D. gigantea, EXL =
E. longirostratum EXR = E. rostratum, GLC = G. cingulata
et GLSP = Glomerella spp.
Tableau 3: Nombre d'isolats obtenus par zone et par
département
|
|
|
|
ISOLATS
|
|
|
|
|
ZONES
|
DEPARTEMENTS
|
BIS
|
COC
|
DRG
|
EXL
|
EXR
|
GLC
|
GLSP
|
Total
|
|
ATLANTIQUE
|
0
|
4
|
0
|
0
|
0
|
1
|
1
|
6
|
|
COUFFO
|
0
|
13
|
0
|
2
|
0
|
1
|
2
|
18
|
|
MONO
|
1
|
12
|
0
|
0
|
1
|
1
|
2
|
17
|
ZH
|
OUEME
|
1
|
3
|
0
|
0
|
2
|
0
|
0
|
6
|
|
PLATEAU
|
0
|
2
|
1
|
0
|
0
|
0
|
0
|
3
|
|
ZOU
|
0
|
4
|
0
|
0
|
0
|
0
|
1
|
5
|
|
BORGOU
|
0
|
2
|
0
|
0
|
0
|
3
|
3
|
8
|
ZSH
|
COLLINES
|
0
|
3
|
0
|
0
|
0
|
0
|
0
|
3
|
|
DONGA
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
ATACORA
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
ZSA
|
ALIBORI
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
TOTAL
|
|
2
|
45
|
1
|
2
|
3
|
6
|
9
|
68
|
|
Tableau 4:
|
Résultats du test de pathogénicité
des41 isolats choisis, sur Jeunes plants de I. cylindrica
|
Isolats
|
Lab code
|
Moyennes #177; Ecarts types
|
1
|
BISBEN2
|
4,7 #177; 1,2
|
2
|
EXRBEN1
|
4,3 #177; 1,5
|
3
|
EXRBEN3
|
4,3 #177; 0,6
|
4
|
BISBEN1
|
4,0 #177; 1,0
|
5
|
EXLBEN1
|
4,0 #177; 1,0
|
6
|
EXLBEN2
|
4,0 #177; 0,0
|
7
|
COCBEN46
|
3,7 #177; 0,6
|
8
|
DRGBEN1
|
3,3 #177; 1,5
|
9
|
EXRBEN2
|
3,3 #177; 1,5
|
10
|
COCBEN11
|
3,3 #177; 1,2
|
11
|
COCBEN8
|
3,3 #177; 1,2
|
12
|
COCBEN41
|
3,0 #177; 0,0
|
13
|
COCBEN4
|
2,0 #177; 0,0
|
14
|
COCBEN15
|
1,7 #177; 1,2
|
15
|
GLSPBEN5
|
1,7 #177; 1,2
|
16
|
COCBEN12
|
1,7 #177; 0,6
|
17
|
COCBEN32
|
1,7 #177; 0,6
|
18
|
COCBEN36
|
1,7 #177; 0,6
|
19
|
COCBEN44
|
1,7 #177; 0,6
|
20
|
COCBEN5
|
1,7 #177; 0,6
|
21
|
GLSPBEN1
|
1,7 #177; 0,6
|
22
|
GLSPBEN8
|
1,7 #177; 0,6
|
23
|
GLSPBEN8
|
1,7 #177; 0,6
|
24
|
GLSPBEN6
|
1,3 #177; 1,5
|
25
|
COCBEN1
|
1,3 #177; 0,6
|
26
|
COCBEN18
|
1,3 #177; 0,6
|
27
|
COCBEN2
|
1,3 #177; 0,6
|
28
|
COCBEN30
|
1,3 #177; 0,6
|
29
|
COCBEN47
|
1,3 #177; 0,6
|
30
|
GLCBEN2
|
1,3 #177; 0,6
|
31
|
GLSPBEN4
|
1,3 #177; 0,6
|
32
|
COCBEN31
|
1,0 #177; 0,0
|
33
|
COCBEN40
|
1,0 #177; 0,0
|
34
|
COCBEN43
|
1,0 #177; 0,0
|
35
|
GLCBEN1
|
1,0 #177; 0,0
|
36
|
GLCBEN3
|
1,0 #177; 0,0
|
37
|
GLCBEN4
|
1,0 #177; 0,0
|
38
|
GLCBEN6
|
1,0 #177; 0,0
|
39
|
GLSPBEN2
|
1,0 #177; 0,0
|
40
|
GLSPBEN3
|
1,0 #177; 0,0
|
41
|
COCBEN29
|
0,3 #177; 0,6
|
|
*Moyenne sur 3 répétitions
BIS = B. sacchari, COC = C. caudatum ,
DRG = D. gigantea, EXL = E. longirostratum EXR = E.
rostratum, GLC = G. cingulata et GLSP = Glomerella spp, BEN =
Bénin Les chiffres = ordre d'isolement
3.1.2 Etude des caractéristiques physiques
différentiels entre les isolats 3.1.2.1 Choix des isolats
Afin de réduire le nombre des isolats pour la suite
des essais seuls les isolats ayant présentés des classes de
symptôme supérieur à 3 % pour le test de
pathogénicité sont retenus (en gras dans le Tableau 4).
· Aucun des isolats de Glomerella n'a
été choisi parce que ne présentant pas de symptômes
> 3% comme indiqué dans la méthodologie. D'ailleurs ces
symptômes sont caractéristiques des vieilles plantes
retrouvées dans les jachères et ne montrent pas d'effets
sensibles sur les feuilles.
· Parmi les isolats de C. caudatum, seuls
COCBEN8, COCBEN1 1, COCBEN41 et COCBEN46 ont présenté des
lésions foliaires supérieures à 3%, et ont
été choisis pour la suite des essais ;
· Tous les isolats des autres espèces (B.
sacchari, D. gigantea et Exserohilum spp.) ont produit des
symptômes supérieurs à 3% et sont choisis pour la suite des
essais (Tableau 4).
3.1.2.2 Caractéristiques physiques et croissances
radiales sur milieu artificiel PDA des isolats choisis
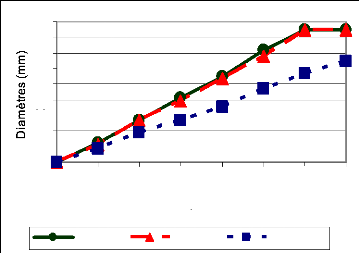
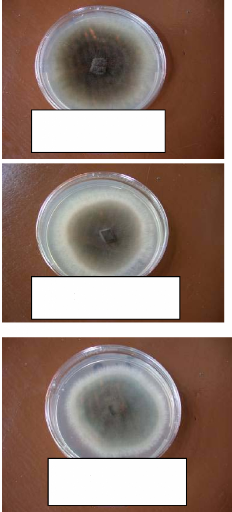
Les isolats indigènes de B. sacchari (BISNEB1
et BISBEN2) sont similaires du point de vue de l'aspect des mycélia et
de leur croissance alors que l'isolat exogène BISFLOR1 a eu une
croissance nettement inférieure (Figure 8). En effet, les isolats
indigènes ont rempli la boîte de pétri (85 mm) après
6 jours tandis que 7 jours après culture, (JAC) BISFLOR1 a encore une
moyenne de croissance de 65 mm (Figure 9).
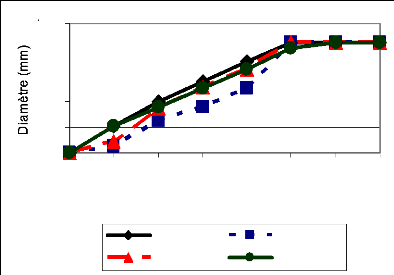
La couleur des mycélia est variable chez C.
caudatum selon les isolats (Figure 11). COCBEN1 1 et COCBEN8 ont un
mycélium gris aérien et cotonneux (Figure 1 1a), COCBEN46
présente un mycélium gris foncé et adhésif (Figure
1 1c), tandis que COCBEN41 a un mycélium gris clair avec une coloration
orange diffuse (Figure 1 1b) provenant de la pigmentation en arrière de
la boîte. COCBEN8, COCBEN41 et COCBEN46 ont une croissance similaire
tandis que celle de COCBEN1 1 est plus

BISBEN (a)
BISFLOR (b)

retardée. Ce dernier atteint sa croissance maximale (85
mm) à 6 JAC tandis tous les trois autres isolats ont atteint cette
croissance maximale à 5 JAC (Figure 10).
40
90
80
60
50
30
20
70
10
0
0 1 2 3 4 5 6 7
BISBEN1 BISBEN2 BISFLOR1
Jours après culture

1 .5
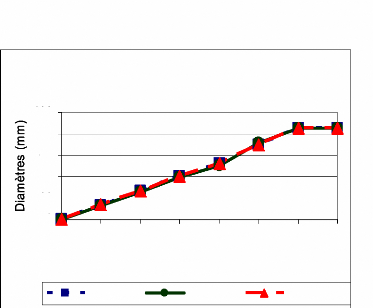
Figure 9: Croissances radiales sur PDA des 3 isolats
de B. sacchari en 7 jours (moyenne de 3
répétitions)
100
40
60
20
80
0
0 1 2 3 4 5 6 7
COCBEN8 COCBEN11
COCBEN41 COCBEN46
Jours après culture

1 .5
Figure 10: Croissances radiales sur PDA des 4 isolats
de C. caudatum en 7 jours (moyenne de 3
répétitions)

a
b
c
1 .5
Figure 11: Différents aspects
présentés par les colonies de C. caudatum sur PDA
après 7 jours
45

b
a
DRGFLOR
DRGBEN
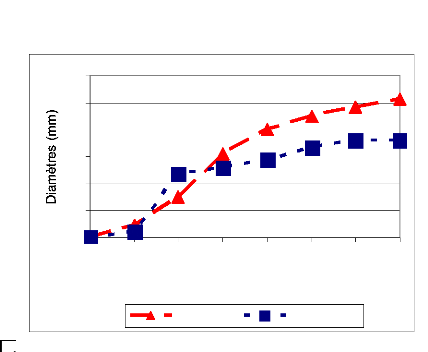
DRGBEN1 (Figure 12a) a un mycélium cotonneux gris
sombre surmontée par une touffe plus claire avec un arrière de
boîte clair tandis que l'isolat indigène DRGFLOR1 montre un
mycélium gris sombre adhésif (Figure12b) avec un arrière
de boîte sombre. Ici également l'isolat exogène DRGFLOR1 a
présenté une croissance plus lente avec un maximum de 36 mm
à 7 JAC contre 51 mm pour l'isolat indigène DRGBEN1 (Figure
13).
47
1 .5
60
50
40
30
20
10
0
0 1 2 3 4 5 6 7
DRGBEN1 DRGFLOR1
Jours après culture
Figure 13: Croissance radiale sur PDA de DRGBEN1 et de
DRGFLOR1 en 7 jours (moyenne de 3 répétitions)
Les isolats de E. longirostratum ont les mêmes
caractéristiques physiques (Figure 14) et même croissance radiale
(Figure 15) quelle que soit leur origine. Leurs mycélia forment des
colonies adhésives, d'une couleur grise claire avec une bordure
blanchâtre. Leurs croissances radiales sont superposables avec un maximum
de 85 mm à partir de 6 JAC (Figure 15).
Pour ce qui concerne les isolats de E. rostratum,
EXRBEN1, EXRBEN2 et EXRBEN3, ils ont présenté un mycélium
abondant gris clair à gris sombre (Figure 16). EXRBEN2 et EXRBEN3 sont
un peu plus épais (Figure 16b et 16c) alors que EXRBEN1 est moins
épais (Figure 1 6a). L'isolat exogène EXRFLOR1 a
présenté un mycélium fin adhésif gris avec une
bordure claire (Figure 1 6d). Tous les quatre isolats ont une croissance
similaire avec une croissance radiale maximale de 85 mm à partir de 6
jours (Figure 17).
EXLBEN1 (a)
EXLFLOR1 (b)
EXLBEN2 (c)

49
100
80
60
40
20
0
0 1 2 3 4 5 6 7
Jours après culture
EXLBEN1 EXLBEN2 EXLFLOR1


EXRBEN1 (a)
EXRBEN3 (c)
EXRBEN2 (b)
EXRFLOR1 (d)

1 .5
1 .5
Figure 15: Croissances radiales des 3 isolats de E.
longirostratum sur PDA en 7 jours (moyenne de 3
répétitions)

50
1 .5
100
80
60
40
20
0
0 1 2 3 4 5 6 7
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Jours après culture
Figure 17: Croissance radiale des isolats de E.
rostratum (moyenne de 4 répétitions) 3.1.2.3 Production de
spores
- Identification du meilleur substrat pour la production
de spores
Le bouillon salé de pomme de terre est seulement
favorable à la production de spores des isolats de C. caudatum
(COCBEN8, COCBEN11, COCBEN41 et COCBEN46). COCBEN8 a montré une
meilleure performance sur substrat de rhizome à 4,6 x107
contre 3,5 x107 spores pour le bouillon (Tableau 5). Ce substrat de
rhizome est aussi le meilleur pour la production des spores de EXLBEN2 mais la
production reste relativement faible (1,6 x107 spores par flacon) de
100 g de substrat.
Le substrat de riz entraîne la meilleure production de
spores de BISFLOR1 (4,4 x107), DRGFLOR1 (6,0 x 107 ) et
EXLBEN1 (3,1 x107).
Le V8 Agar est un milieu producteur de spores pour la plupart
des isolats sauf pour C. caudatum. Il est le seul milieu qui a permis
de produire les spores de BISBEN1 (0,3 x1 07) et DRGBEN1 (1,1 x1
07) et est le meilleur milieu pour la production des spores de
EXLFLOR1 (0,7 x107), EXRBEN2 (0,3 x107), EXRBEN3 (1,8
x107) et EXRFLOR1 (0,7 x107) (Tableau 5).
Ces résultats ont permis de choisir différentes
méthodes de production de spores, en se basant sur la capacité de
production de spores, la disponibilité et le coût des substrats
pour la suite des travaux.
Tableau 5: Nombre (X 107) de spores produites
par flacon par chaque type de milieu ou substrat
|
ISOLAT
|
LIQUIDE
|
RHIZOME
|
RIZ
|
|
V8AGAR
|
|
BISBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,3
|
#177; 0,1
|
|
BISBEN2
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,1
|
0,1
|
#177; 0,0
|
0,1
|
#177; 0,1
|
|
BISFLOR1
|
0,0
|
#177;0,0
|
2,7
|
#177; 0,7
|
4,3
|
#177; 0,0
|
3,6
|
#177; 0,2
|
|
COCBEN11
|
1,7
|
#177; 0,2
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
COCBEN41
|
0,3
|
#177;0,1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
COCBEN46
|
1,1
|
#177; 0,0
|
0,0
|
#177;0,0
|
0,0
|
#177;0,0
|
0,0
|
#177;0,0
|
|
COCBEN8
|
3,5
|
#177; 0,4
|
4,6
|
#177; 0,2
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
DRGBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177;0,0
|
1,1
|
#177; 0,2
|
|
DRGFLOR1
|
0,0
|
#177; 0,0
|
3,7
|
#177; 0,5
|
6,0
|
#177; 0,4
|
4,9
|
#177; 0,3
|
|
EXLBEN1
|
0,0
|
#177; 0,0
|
1,9
|
#177; 0,3
|
3,1
|
#177; 0,3
|
0,1
|
#177; 0,0
|
|
EXLBEN2
|
0,0
|
#177; 0,0
|
1,6
|
#177; 0,2
|
0,7
|
#177; 0,2
|
0,6
|
#177; 0,0
|
|
EXLFLOR1
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,0
|
0,1
|
#177; 0,1
|
1,4
|
#177; 0,1
|
|
EXRBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,1
|
|
EXRBEN2
|
0,0
|
#177; 0,0
|
0,2
|
#177; 0,1
|
0,1
|
#177; 0,1
|
0,3
|
#177; 0,1
|
|
EXRBEN3
|
0,0
|
#177; 0,0
|
0,3
|
#177; 0,1
|
0,5
|
#177; 0,1
|
1,8
|
#177; 0,3
|
|
EXRFLOR1
|
0,0
|
#177; 0,0
|
0,2
|
#177; 0,1
|
0,1
|
#177; 0,1
|
0,7
|
#177; 0,1
|
* Moyennes pour 4 répétitions
BIS = B. sacchari, COC = C. caudatum ,
DRG = D. gigantea, EXL = E. longirostratum EXR = E.
rostratum, GLC = G. cingulata et GLSP = Glomerella spp, BEN =
Bénin Les chiffres = ordre d'isolement
- Formes et dimensions des spores produites par les
isolats
Pour ce qui concerne les dimensions et formes des spores,
elles sont pour la plupart similaires pour les isolats de la même
espèce à l'exception des isolats exogènes qui ont
présenté des différences par rapport aux isolats
indigènes (Tableau 6).
Les isolats de B. sacchari ont tous montré des
spores de couleur marron, fusiformes et segmentées. BISFLOR1 a eu des
spores plus longues et effilées [20-110 x 7.5-10] um tandis que celles
des isolats indigènes (BISBEN1 et BISBEN2) ont produit des spores plus
courtes et plus larges ((20-60) x (5-15)) um. Quant aux isolats de C.
caudatum, elles sont toutes identiques avec des spores en forme de
faucilles munies de flagelles claires. Les spores de DRGBEN1 sont de couleur
marron, rectiligne avec des segments clairs, alors que celles de DRGFLOR1 sont
aussi marron mais courbées avec des segments sombres. On ne note pas de
différences remarquables entre leurs tailles (Tableau 6).
EXLBEN1 et EXLBEN2 qui sont indigènes ont montré
des spores plus longues, fusiformes ((20-1 10)x(7.5-10))tm de couleur sombre
tandis que l'isolat exogène EXLFLOR1 a produit des spores plus courtes
((20-90)x(7,5-10))tm, fusiformes et rectilignes de couleur marron claire
(Tableau 6).
Pour ce qui concerne les isolats de E. rostratum, les
spores sont toutes fusiformes de couleur marron clair avec des segments sombres
mais celles des isolats indigènes (EXRBEN1, EXRBEN2, EXRBEN3) sont plus
longues et effilées (20-135)x(5-9)tm que celles de l'isolat
exogène (EXRFLOR1) qui sont plus courtes (20-90)x(7.5-10)tm (Tableau
6).
Tableau 6: Dimensions et formes des spores
|
Isolats
|
Tailles (um)
|
Formes
|
Couleur
|
Segmentation
|
|
BISBEN1
|
(20-60)x(5-15)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
|
BISBEN2
|
(20-60)x(5-15)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
|
BISFLOR1
|
(20-110)x(7,5-10)
|
Fusiforme
|
Marron claire
|
Segment clair
|
|
COCBEN1 1
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Pas de segment
|
|
COCBEN41
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Pas de segment
|
|
COCBEN46
|
----
|
----
|
----
|
----
|
|
COCBEN8
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Segment clair
|
|
DRGBEN1
|
(20-110)x(7,5-10)
|
Droite
|
Marron claire
|
Segment clair
|
|
DRGFLOR1
|
(20-125)x(7,5-10)
|
Courbée
|
Marron claire
|
Segment sombre
|
|
EXLBEN1
|
(20-1 10)x(7,5-10)
|
Fusiforme
|
Marron sombre
|
Segment sombre
|
|
EXLBEN2
|
(20-1 10)x(7,5-10)
|
Fusiforme
|
Marron sombre
|
Segment sombre
|
|
EXLFLOR1
|
(20-90)x(7,5-10)
|
Fusiforme et rectiligne
|
Marron claire
|
Segment sombre
|
|
EXRBEN1
|
(20-135)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRBEN2
|
(20-135)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRBEN3
|
(20-130)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRFLOR1
|
(20-100)x(5-9)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
3.1.3 Etude comparée de la virulence des isolats
Les symptômes observés sur les pièces de
feuilles (pour les tests in vitro) et sur les
feuilles des plants en pots (pour les tests in vivo)
sont similaires à ceux observés au champ lors des
prospections.
3.1.3.1 Virulence in vitro
Pour les isolats de B. sacchari, l'isolat exogène
BISFLOR1 a développé de symptôme, à
1 jour après inoculation (JAI), comparé aux
isolats indigènes BISBEN1 et BISBEN2 qui
n'ont
développé de symptôme qu'à partir de 2 JAI. De plus
BISFLOR1 est resté
nettement plus virulent que les isolats
indigènes durant la durée de l'essai (Figure 18). A
6 JAI il cause des lésions dont la moyenne des classes est
de 4,5 contre respectivement 2,75 et 2,25 pour BISEN2 et BISBEN1.
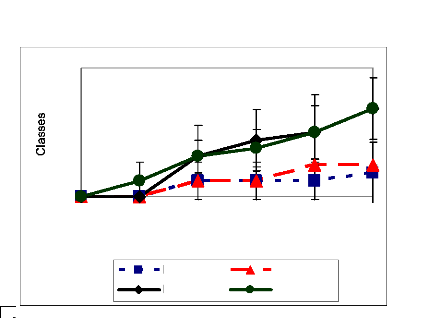
Pour les isolats de C. caudatum (Figure 19), l'isolat
COCBEN8 a très tôt développé de symptôme (1
JAI) comparé aux isolats COCBEN41 et COCBEN46 qui n'ont
développé de symptôme qu'à partir de 3 JAI, tandis
que COCBEN1 1 n'a présenté aucune lésion avant la fin de
l'essai. De plus COCBEN8 est resté nettement virulent avec une moyenne
de classe de 3,75 contre 0,75 pour COCBEN41 et COCBEN46.
Des deux isolats de D. gigantea, l'isolat
exogène DRGFLOR1 est resté nettement plus virulent (5,25 de
moyenne de classe) que l'isolat indigène DRGBEN1 (2,25 de moyenne de
classe), cependant ces deux isolats ont très vite
développé de lésions à partir de 1 JAI (Figure
20).
Des trois isolats de E. longirostratum, l'isolat
exogène EXLFLOR1 a très tôt développé de
lésions (1 JAI) comparativement aux isolats indigènes EXLBEN1 et
EXLBEN2 qui ont commencé un jour plus tard. Mais les lésions
causées par EXLBEN2 ont rapidement évolué à partir
de 2 JAI, pour finalement surpasser le degré de lésions de
l'isolat exogène (5,5 contre 3,25) entre 5 JAI et 6 JAI (Figure 21).
Des quatre isolats de E. rostratum, l'isolat
exogène EXRFLOR1 a très tôt développé de
symptôme (1 JAI) par rapport aux isolats indigènes EXRBEN1 et
EXRBEN2 et EXRBEN3 (Figure 22). Mais les symptômes causés par
EXRBEN3 ont rapidement évolué à partir de 2 JAI, pour
finalement atteindre le degré des lésions de EXRFLOR1 (2,75) de 4
JAI à 6 JAI. Quant à EXRBEN2 et à EXRBEN1,
l'étendue de leur lésion est restée nettement
inférieure (respectivement 1 et 0,75) à celle causée par
EXRFLOR1 et EXRBEN3 (Figure 22).

Figure 18: Evolution des lésions causées
in vitro, par les isolats de B. sacchari.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
4
5
3
2
0
1
1 2 3 4 5 6
COCBEN8 COCBEN11
COCBEN41 COCBEN46
Jours après inoculation
1 .5
Figure 19: Evolution des lésions causées
in vitro, par les isolats de C. caudatum.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
54
1 .5
6
5
4
3
2
1
0
1 2 3 4 5 6
BISBEN1 BISBEN2 BISFLOR1
Jours après inoculation

7
6
5
4
3
2
1
0
1 2 3 4 5 6
DRGBEN1 DRGFLOR1
Jours après inoculation
1 .5
Figure 20: Evolution des lésions causées
in vitro, par les isolats de D. gigantea.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)

4
2
7
6
5
3
0
1
1 2 3 4 5 6
EXLBEN1 EXLBEN2 EXLFLOR1
Jours après inoculation
1 .5

Figure 21: Evolution des lésions causées
in vitro, par les isolats de E. longirostratum
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
56
4
3.5
3
2.5
2
1.5
1
0.5
0
1 2 3 4 5 6
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Jours après inoculation
1 .5
Figure 22: Evolution des lésions causées
in vitro, par les isolats de E. rostratum Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4 répétitions avec les écarts
types)
L'analyse de variance de l'étendue des lésions
causées par les isolats à la fin de l'essai (6 JAI) montre une
différence significative au seuil de 5% (Tableau 7). EXLBEN2 avec une
classe de 5,5 est le meilleur isolat pour le test in vitro, suivi des
isolats DRGFLOR1 (5,25), BISFLOR1 (4,50).
Tableau 7: Classification des isolats suivant leur
virulence in vitro
|
ISOLATS
|
Moyennes #177; Ecarts types
|
|
EXLBEN2
|
5,5 #177; 0,6a
|
|
DRGFLOR1
|
5,2 #177; 0,5a
|
|
BISFLOR1
|
4,5 #177; 0,6ab
|
|
COCBEN8
|
3,7 #177; 0,5bc
|
|
EXLFLOR1
|
3,2 #177; 0,9cd
|
|
BISBEN2
|
2,7 #177; 0,5cd
|
|
EXRFLOR1
|
2,7 #177; 0,9cd
|
|
EXRBEN3
|
2,7 #177; 0,9cd
|
|
EXLBEN1
|
2,5 #177; 0,6cd
|
|
DRGBEN1
|
2,5 #177; 0,6cd
|
|
BISBEN1
|
2,2 #177; 0,9d
|
|
EXRBEN2
|
1,0 #177; 0,0e
|
|
COCBEN41
|
0,7 #177; 0,5e
|
|
COCBEN46
|
0,7 #177; 0,5e
|
|
EXRBEN1
|
0,7 #177; 0,9e
|
|
COCBEN11
|
0,0 #177; 0,0e
|
TEMOIN 0,0 #177; 0,0e
*Moyennes de 4 répétitions
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Studen
Newman Keuls(SNK)
3.1.3.2 Virulence in vivo
- Evolution des lésions sur feuille
Sur les graphes présentés ici, les
étendues de lésions représentent les mêmes variables
que les classes précédemment inscrites en ordonnées. La
différence est que les observations sont faites in vivo et sur une plus
longue période.
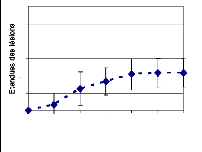
Les isolats indigènes BISBEN1 et BISBEN2 n'ont pas
produit suffisamment de spores pour le test in vivo. Seules les spores
de l'isolat exogène BISFLOR1 sont inoculées. Mais
l'évolution des lésions causées par ces dernières
(Figure 23a) est restée inférieure à l'évolution
des lésions lorsque l'inoculum est fait à partir de suspension
mycélienne (Figure 23b). En effet, à la 6ème
semaine après inoculation (SAI), la suspension mycélienne a
produit près de 1,5 fois plus de lésions que la suspension de
spore (Figure 23). De même pour ce qui concerne l'utilisation de la
suspension de mycélium, les lésions provoquées in
vivo par l'isolat exogène BISFLOR1 sont restées nettement
supérieures à celles des isolats indigènes BISBEN1 et
BISBEN2 qui n'ont présenté aucune différence significative
entre eux.
4
6
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après
inoculation
a

4
6
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
BISBEN1 BISBEN2 BISLFLOR1
Semaines après inoculation
b

Figure 23: Evolution des lésions causées
in vivo par les isolats de B. sacchari après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. BISBEN =
B. sacchari originaire du Bénin, BISFLOR = B. sacchari
originaire des Florides, chiffre (1, 2) = ordre d'isolement.
Parmi les isolats de C. caudatum, COCBEN41 est le
moins virulent pour les lésions
causées à partir de la
suspension de mycélium. De plus il n'a pas produit suffisamment
de
spores pour que ces dernières soient utilisées en
suspension, comme inoculum (Figure
24a). Quant aux isolats COCBEN1 1, COOBEN8 et COCBEN46,
l'ordre de virulence est le même qu'on utilise une suspension de spore ou
de mycélium (COCBEN46 suivi de COCBEN8 puis après COCBEN1 1).
Mais la différence entre les capacités d'infection est plus
remarquée quand on utilise la suspension de spore comme inoculum. En
effet à la 6ème semaine COCBEN8 reste nettement inférieur
(2,3 de classe) à COCBEN46 lorsque les spores sont inoculées (3,3
de classe) tandis qu'ils se confondent (respectivement 3,3 et 3,6 de classe) en
cas d'utilisation de suspension de mycélium comme inoculum (Figure
24b).
Lorsque les suspensions de spore sont utilisées,
DRGBEN1 et DRGFLOR1 ne montrent pas de différence remarquable. A la
6ème semaine, ils montrent respectivement 1,8 et 2,1 comme
moyenne de classe (Figure 25a). Mais l'isolat exogène est plus de deux
fois virulent (3,8 de classe) que l'isolat indigène (1,8 de classe)
lorsque la suspension de mycélium est pulvérisée (Figure
25b).

4
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après inoculation
COCBEN11 COCBEN46 COCBEN8
a

4
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
Semaines
après inoculation
b
COCBEN11 COCBEN41
COCBEN46 COCBEN8

Figure 24: Evolution des lésions causées
in vivo par les isolats de C. caudatum après
utilisation de suspension de spore à 106 de spore/ml (a) et
de suspension de mycélium à 5% p/v (b) comme inoculum. COCBEN =
C. caudatum originaire du Bénin, chiffre 8,11,41,48 = ordre
d'isolement

4
6
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
a
Semaines après inoculation
DRGBEN1 DRGFLOR1

4
6
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
b
Semaines après inoculation
DRGBEN1 DRGLFLOR1
Figure 25: Evolution des lésions causées
in vivo par les isolats de D. gigantea après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. DRGBEN =
D. gigantea originaire du Bénin, DRGFLOR= D. gigantea
originaire des Florides, chiffre 1 = ordre d'isolement
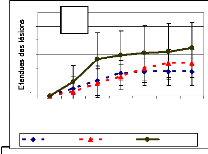
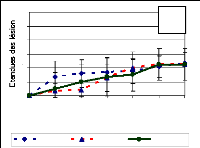
Les trois isolats de E. longirostratum ont
provoqué des lésions d'étendues semblable lorsque la
suspension de mycélium est pulvérisée. A la
6ème semaine, ils ont tous eu 2,3 de moyennes de classe. Mais
les spores de l'isolat exogène EXLFLOR1 sont plus virulentes que son
mycélium (Figure 26a). A la 6ème semaine, ces
dernières montrent une nette supériorité (3,5) contre
respectivement 2,4 et 1,7 comme moyenne de classe pour EXLBEN2 et EXLBEN1
lorsque les spores sont utilisées comme inoculum (Figure 26b).
4
2
6
5
3
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après
inoculation
EXLBEN1 EXLBEN2 EXLFLOR1
a
6
5
4
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
Semaines
après inoculation
EXLBEN1 EXLBEN2 EXLFLOR1
b
Figure 26: Evolution des lésions causées
in vivo par les isolats de E. longirostratum après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. EXLBEN =
E. longirostratum originaire du Bénin, EXLFLOR= E.
longirostratum originaire des Florides, chiffre 1 et 2 = ordre
d'isolement
EXRBEN1 et EXRBEN2 qui n'ont pas produit suffisamment de
spores pour l'inoculation ont nettement provoqué plus de lésion
que EXRBEN3 et EXRFLOR1 pour les suspensions de mycélium (Figure 27b). A
la 6ème semaine, ces derniers ont montré comme moyenne
de classe pour les lésions, respectivement 2,1 et 0,6 contre
respectivement 3,8 et 3 pour EXRBEN1 et EXRBEN2, lorsque la suspension de
mycélium est utilisée. L'utilisation de suspension de
mycélium a diminué les performances de EXRBEN3 et EXRFLOR1 en ce
sens qu'à la 6ème semaine, on obtient respectivement
2,1 et 0,6 de moyenne de classe lésion pour la suspension de
mycélium contre respectivement 2,9 et 2,7 pour la suspension de spore
(Figure 27a).

4
6
5
3
2
0
1
a
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines apres inoculation
EXRFLOR1 EXRBEN3

4
2
6
5
3
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
b
Semaines après inoculation
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Figure 27: Evolution des lésions causées
in vivo par les isolats de E. rostratum après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. EXRBEN =
E. rostratum originaire du Bénin, EXRFLOR= E.
rostratum originaire des Florides, chiffre 1, 2 et 3 = ordre
d'isolement
L'analyse des variances qui a porté sur les
lésions à 6 SAI, a montré une différence
significative entre les isolats. La suspension de mycélium est
généralement de loin plus virulente que la suspension de spores
(Tableau 8). On peut classer par ordre de virulence BISFLOR1 (3,9), DRGFLOR1
(3,8), EXRBEN1 (3,8), COCBEN46 (3,6), COCBEN8 (3,3), EXRBEN2 (3,0), BISBEN2
(2,5) et EXLBEN2 (2,3). Il faut noter cependant que l'ordre des virulences peut
changer qu'il s'agisse de suspension de spore ou de suspension de
mycélium (Tableau 8). En effet, les 5 isolats les plus virulents
après inoculation de suspension de mycélium ne sont pas les
meilleurs lorsque la suspension de spore est utilisée. Par exemple, le
Tableau 8 montre que BISFLOR1 est le plus virulent pour la suspension de
mycélium (3,9) alors qu'il ne se retrouve même pas parmi les 5
meilleurs isolats (2,2) pour la suspension de spore (Tableau 8). De même
EXRFLOR1 qui est en 4ème position pour la suspension de spore
(2,7) a occupé la dernière place pour la suspension de
mycélium (0,6). La performance de COCBEN46 est relativement stable en ce
sens qu'il se retrouve dans les 5 meilleurs isolats pour les deux types
d'inoculum, mais aussi il a provoqué des lésions
d'étendues similaires pour les deux types d'inoculum soit,
respectivement 3,6 et 3,3 moyenne de classe pour la suspension
mycélienne et la suspension de spores (Tableau 8).
Tableau 8 : Moyennes des étendues des
lésions 6 semaines après pulvérisation in vivo,
de suspension de mycélium à 5% p/v et de spore suspension
à 106 de spore/ml
ISOLATS
BISLFLOR1
DRGLFLOR1
EXRBEN1
COCBEN46
COCBEN8
EXRBEN2

BISBEN2
EXLBEN2 EXLFLOR1 EXLBEN1 BISBEN1 COCBEN11 EXRBEN3
DRGBEN1 COCBEN41 EXRFLOR1 TEMOIN
|
Suspension de mycélium
|
Suspension de spore
|
|
3,9 #177; 1.4a
3,8 #177; 1,5a
3,8 #177;
1,5a
|
2,2 #177; 0,8ab 2,1 #177; 0,8ab .
|
|
3,6 #177; 0,5ab
|
3,3
|
#177; 0,9a
|
|
3,3 #177; 1,0abc
|
2,4 #177; 0,5ab
|
|
3,0 #177; 1 ,5abcd
|
.
|
|
2,5 #177; 1 ,3bcd
|
.
|
|
2,3 #177; 1,1bcd
|
2,4 #177; 1,1ab
|
|
2,3 #177; 1,1bcd
|
3,5
|
#177; 1,8a
|
|
2,3 #177; 0,8bcd
|
1,7
|
#177; 1,0b
|
|
2,2 #177; 1,2bcd
|
.
|
|
|
2,2 #177; 1,0bcd
|
1,5
|
#177; 0,9b
|
|
2,1 #177; 1,1cd
|
2,9 #177; 1,1ab
|
|
1,8
|
#177; 0,6d
|
1,8
|
#177; 1,1b
|
|
1,8
|
#177; 0,5d
|
.
|
|
|
0,6
|
#177; 0,9e
|
2,7 #177; 1,6ab
|
|
0,0
|
#177; 0,0e
|
0,0
|
#177; 0,0c
|
*Moyennes de 4 répétitions avec les
écarts types
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Student
Newman Keuls(SNK).
Dans le groupe des B. sacchari, l'isolat le plus
virulent est BISFLOR1 avec 3,9 comme classe contre 2,2 pour BISBEN1 qui est
l'isolat indigène qui le suit immédiatement.
Dans le groupe des C. caudatum, COBEN46 (3,6) et
COCBEN8 (3,3) sont les plus virulents. Il faut ajouter que la performance de
COCBEN46 est restée stable quel que soit le type d'inoculum
utilisé soit 3,3 pour la suspension de spore mais il a fait un score
très bas par rapport à COCBEN8 lorsque le test est
déroulé in vitro.
Dans le groupe des D. sacchari l'isolat exogène
DRGFLOR1 (3,3) est deux fois plus virulent que l'isolat indigène DRGBEN1
(1,8).
Pour le groupe des E. longirostratum, tous les
isolats ont la même performance (2,3) lorsque la suspension de
mycélium est inoculée mais l'isolat exogène EXLFLOR1 s'est
le mieux comporté (3,5) en cas d'utilisation de suspension de spore.
Pour les E. rostratum l'isolat indigène
EXRBEN1 (3,8) s'est le mieux comporté en cas d'utilisation de suspension
de mycélium et maintient un score relativement bon (2,1) lorsqu'on
utilise la suspension de spore.
- Influence des infections sur la croissance et le
développement de I. cylindrica
La croissance est l'ensemble des augmentations en dimensions
et en masse (hauteur poids secs) alors que le développement est
lié au changement d'état de la plante (production de feuilles, de
fleurs et de repousse).
Durant les deux tests in vivo aucune production de
fleurs n'a été observée par contre les productions de
rejets et de nouvelles feuilles ont été remarquables sans la
moindre contamination croisée.
Les différents traitements n'ont pas eu d'effets
significatifs sur la production de rejet quel que soit le type d'inoculum
utilisé. Par contre, pour la production de nouvelles feuilles, quelques
différences sont remarquables lorsque la suspension de mycélium
est utilisée. La production de nouvelles feuilles est nettement
réduite lorsque l'isolat COCBEN46 est inoculé avec la suspension
de mycélium, soit en moyenne de 0,7 feuille contre une production de 2,0
feuilles pour le témoin (Tableau 9).
Pour ce qui concerne les poids secs, les différents
isolats n'ont pas eu d'effets significatifs sur les poids secs ni sur ceux des
rejets.
Tableau 9: Comparaison de la production de nouvelle
feuilles 6 semaines après Pulvérisation in vivo, de
suspension de mycélium et de spore
|
ISOLATS
|
Suspension de mycélium
|
Suspension de spore
|
|
COCBEN11
|
3,3 #177; 1,5a
|
0,5 #177; 0,6a
|
|
EXRBEN3
|
2,2 #177; 0,5ab
|
0,5 #177; 0,6a
|
|
EXLBEN1
|
2,0 #177; 1,4ab
|
0,2 #177; 0,5a
|
|
BISBEN1
|
2,0 #177; 0,8ab
|
.
|
|
BISBEN2
|
2,0 #177; 0,8ab
|
.
|
|
EXLBEN2
|
2,0 #177; 0,0ab
|
0,7 #177; 0,5a
|
|
EXRBEN2
|
2,0 #177; 0,0ab
|
.
|
|
EXRFLOR1
|
2,0 #177; 0,0ab
|
1,0 #177; 0,8a
|
|
TEMOIN
|
2,0 #177; 0,0ab
|
0,5a #177; 0,0
|
|
COCBEN41
|
2 #177; 0,8ab
|
.
|
|
BISLFLOR1
|
1,7 #177; 0,9ab
|
0,7 #177; 0,5a
|
|
DRGLFLOR1
|
1,7 #177; 0,9ab
|
0,7 #177; 0,5a
|
|
COCBEN8
|
1,7 #177; 0,5ab
|
1,2 #177; 0,5a
|
|
EXRBEN1
|
1,7 #177; 0,5ab
|
.
|
|
EXLFLOR1
|
1,5#177; 0,6ab
|
0,7a #177; 0,5a
|
|
DRGBEN1
|
1 ,0b#177; 0,0b
|
1,0 #177; 0,8a
|
|
COCBEN46
|
0,7 #177; 0,5b
|
1,2 #177; 1 ,0a
|
Moyennes de 4 répétitions avec les
écarts types
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Studen
Newman Keuls(SNK)
a
|
|


