III.2.1.4.1.1. Analyse de la liaison des transposase de
type mariner aux ITRs :
Ce test sera assuré par une technique appelée
l'analyse de retard sur gel (In Halaimia Toumi, 2006), cette
technique mis en évidence la liaison d'une protéine à une
séquence d'acide nucléique marqué, la migration des
complexes ADNmarqué/protéine, sur un gel de polyacrylamide non
dénaturant, sera retardée par rapport à celle de l'ADN
seul (In turner et al., 2002) (Figure 15). Cette technique est
basée sur l'incubation de la transposase mariner
indépendamment avec les ITR3' et 5' marqué avec du dATP
(ãP 32), soit par le marquage de l'ADN double brin en
effectuant une phosphorylation avec la T4 nucléotide kinase, ou par le
marquage des ITRs monocaténaires puis leur hybridation pour l'obtention
d'une structure bicaténaire. Les complexes ITR3'/Tnp, ITR5'/Tnp,
seront formés dans un milieu contenant du tampon de colonne,
glycérol (pour le maintien de la stabilité), de l'ADN du sperme
de Saumon (compétiteur non spécifique), tous ça en
présence ou absence d'EDTA (chélateur de cations) et de
Mg2+. La séparation sera réalisée sur un gel
composé de deux gels de polyacrylamide superposés : un gel de
séparation au dessus d'un gel de résolution, la migration doit
s'effectuer à des températures adaptées aux conditions de
vie des organismes hôtes (In Halaimia Toumi, 2006).

ITR seul
(Sonde libre)
Figure 15 : Principe de la technique de retard
sur gel (d'après Halaimia Toumi,
2006)
Différents
Complexes
Produit de coupure

Figure 16 : Analyse de la liaison de la
transposase
Mos1 (d'après Augé Gouillou et
al., 2005)
Produits de clivage
En effet, il a été montré par
Augé-Gouillou et al, 2001 que la transposase de Mos1
reconnaît et se fixe spécifiquement à ses ITRs en
présence de cations Mg2+. Ces auteurs ont observé
aussi que l'ajout d'EDTA, qui chélate les ions Mg2+ dans le
milieu réactionnel au cours des expériences de retard sur gel
diminue légèrement le taux de liaison Tnp/ITR, ce qui
suggère que la transposase Mos1 utilise les ions
Mg2+ dans la catalyse. De plus, ils ont pu visualiser les
différents complexes formés par la transposase
Mos1 grâce à la technique du retard sur gel (Figure
16).
III.2.1.4.1.2. Test de spécificité de
liaison des transposases de type transposase mariner aux ITRs
:
Le principe de ce test est la vérification de la
spécificité de la liaison d'une protéine à son
ligand, dans ce cas, de la transposase mariner aux ITR3' et 5'. Cette
vérification peut être réalisée par l'addition d'ADN
compétiteur dans le milieu réactionnel (Figure 17). Sur un gel de
polyacrylamide homologue à celui de l'analyse de retard sur gel, cette
spécificité sera analysée c'est-à-dire s'il existe
une spécificité, le même profil de migration sera obtenu en
présence ou absence d'un ADN compétiteur, pour la confirmation,
la transposase doit être incubée avec un ITR radioactif et un
autre non radioactif mis en excés ; alors en cas de
spécificité, la fixation de la transposase avec l'ITR froid sera
plus importante qu'avec l'ITR radioactif. (Figure 17). Un exemple d'une telle
spécificité est fournit par l'élément
Bytmar issu du crabe Bythograea thermydron qui provient des
sources hydrothermales océaniques, le test de spécificité
de sa transposase a montré une spécificité satisfaisante
à ses ITR car le profil de migration n'a pas été
changé au cours de l'addition de l'ADN compétiteur non
spécifique, aussi la réaction a été
légèrement déplacée en présence des ITR non
radioactif (Figure 18) (In Halaimia Toumi, 2006).

Cas 1 Cas 2 Cas 3
Figure 17 : Schéma explicatif du
principe de l'analyse de spécificité : Dans le premier cas la
transposase est incubée avec l'ITR radioactif, dans le deuxième
cas la transposase est incubée avec l'ITR radioactif et un ADN
compétiteur mis en excès et dans le troisième cas la
transposase est incubée avec de l'ITR radioactif et de l'ITR non
radioactif mis en excès. (D'après Halaimia Toumi, 2006).

Avec l'ITR5' Avec l'ITR3'
Figure 18 : Analyse de la
spécificité de la fixation de la transposase Bytmar avec
leurs ITRs (Conditions expérimentales 30°C-2h)
3 : Tnp + ITR marqué + ITR non marqué mis en
excès (D'après Halaimia Toumi, 2006).
2 : Tnp + ITR marqué + ADN compétiteur mis en
excès
1 : Tnp + ITR marqué
III.2.1.4.1.3. Test de coupure des transposases de type
mariner :
Pour l'analyse des phénomènes de coupure, un
test de coupure peut être réalisé. La transposase
mariner sera mise en contact avec 3 plasmides contenant un
pseudotransposon indépendamment, le premier porte à ses
extrémités des ITR3' et 5' (appelé construction 5T3), le
deuxième porte à chaque extrémité un ITR5'
(construction 5T5) et le troisième porte à chaque
extrémité un ITR3' (construction 3T3). Chaque construction sera
additionnée à un milieu réactionnel permettant sa coupure
par la transposase. L'ADN coupé sera ensuite analysé dans un gel
d'agarose. 3 formes plasmidiques seront attendues (Figure 19) :
· La forme surenroulée << SC pur Super Coiled
>> : elle migre plus vite et elle est normalement la forme la plus
présente au début de l'expérience.
· La forme Open Circle << OC >> : elle est
obtenue après une coupure simple brin.
· La forme linéaire << L >> : cette
forme révèle une coupure double brin.

Plasmide linéaire contenant le pseudo
transposon
Plasmide surenroulé
(Super coiled)
pBC+ pseudotrans psonTet
ITR
Plasmide circulaire ouvert à un seul
brin
ouvert (Open circle)
Figure 19 : Schéma explicatif du test de
coupure
(D'après Halaimia Toumi, 2006)
Tnp
Plasmide linéaire sans pseudotrans
poson
Pseudo transposon
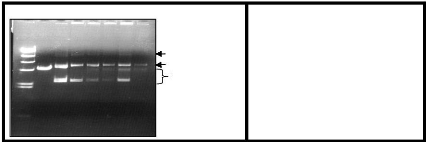
M T1 T2 t0 t1 t2 t4 t6
OC (Open Circle) Lin (Linear)
SC (Super Coiled)
Figure 20 : Analyse en test de coupure de la
transposase Alvcmar avec la construction 5T5. M : marqueur de Taille,
T1 : témoin de linéarisation, T2 : témoin de test de
coupure, t0h à t6h : les incubations faites en cinétique de temps
0h à 6h (D'après Halamia Toumi, 2006)
Dans le cas de la transposase d'Alvcmar, ce test a
montré une spécificité assez satisfaisante. Ceci a
été confirmé par la dominance de la forme linéaire
avec la construction 5T5, en plus les trois formes plasmidiques ont
été observées avec une
hétérogénéité des pourcentages avec les deux
autres constructions (Figure 20) (In Halaimia Toumi, 2006).

1
Figure 21 : Test de transposition in vivo
: Un plasmide permettant l'expression de la transposase (pMAL ou pBAD Tnp)
et un plasmide portant un mini-transposon constitué du gène de
résistance à la tétracycline (rectangle mauve), sans son
promoteur (pBC Tet) sont cotransformées dans une bactérie
(rectangle bleu) (1). La transposase (rond noir) se fixe sur les ITR
(flèches roses) du mini-transposon (2) et permet l'excision du
minitransposon (3) qui se réintegrera soit dans un plasmide, soit dans
l'ADN génomique (4) (D'après Halaimia Toumi, 2006).
3
Chl r
Tet r
Chl r
Tet r
Tet r
Tnp
Tnp
2
4
Chl r
Tet r
Tet r
Tet r
ou
Tnp
| 


