4 Nanothéragnostique
Beaucoup d'efforts ont été faits pour
améliorer le traitement traditionnel du cancer par le
développement de Nanotheranostic, ils combinent le diagnostic non
invasif simultané et le traitement de maladies avec la
possibilité de suivre la libération du médicament en temps
réel et la distribution, ainsi prévoir et valider
l'efficacité de la thérapie.
Grâce à ces caractéristiques
extrêmement attrayant. L'étape suivante est la tentative pour
effectuer une véritable médecine personnalisée qui mesure
le traitement à chaque patient, en tenant compte de la
variabilité individuelle. L'application clinique de nanotheranostics
permettrait l'évaluation précoce de la maladie, Ce concept permet
d'élaborer des protocoles thérapeutiques personnalisés
pour atteindre le bénéfice maximal avec un profil de
sécurité élevé [16].
? Les Nanotheranostics pour une médecine
personnalisée
Univ Paris-Sud France S. Mura, P. Couvreur 2012
[41].
Des NP d'oxyde de fer thermiquement superparamagnétique
chargé en DOX (DOX @ TCL-SPION) ont été modifié par
la conjugaison de surface avec l'antigène spécifique de(PSMA)
pour la reconnaissance spécifique des cellules cancéreuses de la
prostate sur-exprimant le PSMA (DOX @ Apt-hybr-TCL-SPION).
L'Imagerie et propriétés thérapeutiques
ont été évaluées in vivo dans un
modèle murin de cancer de la prostate LNCaP humain.
? Après 2 h, un assombrissement important a
été observée dans la zone e la tumeur avec une
amélioration du signal de 53% dans la région
d'intérêt avec une forte accumulation.
? L'activité thérapeutique a été
évaluée par l'évaluation de la vitesse de croissance de la
tumeur dans les groupes traités avec DOX @ Apt-hybr-TCL-SPION par
rapport au libre-DOX, 5% de glucose, Apthybr-TCL-SPION ou brouillés DOX
@ scrApt-hybr-TCL-SPION comme groupe témoin. DOX@ Apt-hybr-TCL-SPION
montrait une inhibition supérieure de la croissance de la tumeur et,
à la fin du traitement, le volume de la tumeur était environ 54%
de ceux des groupes témoins (Fig 56.B). La réduction du volume de
la tumeur a été validé également par IRM
enregistrés à la fin de le traitement, ce qui confirme clairement
la possibilité d'un non-invasive suivi longitudinal de
l'efficacité de la thérapie (Fig56).

66
Chapitre III Essais
Précliniques

Figure 56: (a) T2-weighted fast-spin echo
images at the level of the LNCaP tumor on the right side of the mouse taken at
0, 2, 24, and 48 h after injection of Apt-hybr-TCL-SPIONs
orscrApt-hybr-TCL-SPIONs. The dashed circle indicates the xenografted tumor
region. (b) Antitumor activity of DOX@Apt-hybr-TCL-SPIONs in the LNCaP
xenograft animal model (*Pb0.05, n=6).
|
Un autre exemple intéressant, a été
proposé récemment (2009) par Arias et al. Dans cette
construction, des nanoparticules magnétiques ultrafines d'oxyde de fer,
qui répondent à un champ magnétique extra corporel. (D'une
taille de quelques nano mètres) ont été
piégées dans une nanomatrice (270nm) constituée d'un
lipide naturel (le squalène) couplé à la Gemcitabine USPIO
/ SQgem IP (Fig57).
|
|
Figure 57: Représentation
schématique de la méthode appliquée par l'équipe de
Arias et al., Submitted, 2009.
Ces nano constructions sont injectées par voie iv
pendant qu'un aimant est placé au niveau de la tumeur. L'inhibition de
la croissance tumorale est spectaculaire et peut être suivie par imagerie
en résonance magnétique nucléaire (RMN).
L'efficacité de cette approche a été
démontrée in vivo sur un modèle de tumeur solide
(leucémie murine L1210).
? Après injection IV de USPIO / SQgem IP, une
accumulation au site de la tumeur a été visualisés par
IRM.
? Après l'administration d'USPIO sans SQgem et
application du champ magnétique, une mise en valeur inférieure du
contraste de l'image a été observée.
Chapitre III Essais
Précliniques
En outre, les NP USPIO / SQgem magnétiquement
guidé conduit à une activité anticancéreuse
significativement plus élevé par rapport aux groupes
témoins, offrant ainsi à nouveau la preuve que la visualisation
simultanée de la tumeur et de traitement sont possibles. Les mêmes
auteurs ont déjà obtenu des résultats prometteurs en
élargissant cette stratégie à d'autres agents de contraste
(Gd3 +) et d'autres anticancéreux (paclitaxel, la Doxorubicine et
cisplatine) confirmant ainsi la polyvalence de cette nanoplatform (Fig58).
Des Micelles polymériques pour le suivi in vivo
par imagerie par résonance magnétique et l'administration de
médicaments ont été proposées par Blanco et al.
PEGPLA (Acide polylactique) micelles chargées avec la Doxorubicine et
SPIO NP ont été fonctionnalisé avec le cRGD de ligand de
ciblage (cRGDDOX- SPIO micelles). L'efficacité de cette nanoconstruction
comme agents théranostic a été évaluée
in vivo utilisant un modèle orthotopic H1299 de carcinome du
poumon à petites cellules.
? Après injection i.v. de cRGD-DOXSPIO
micelles permettant d'observer un
assombrissement
significatif dans la zone tumorale qui ont confirmé l'accumulation des
micelles dans ce tissu.


67
Figure 58: Examples of T2-weighted images of
the tumors obtained at 2 h-postinjection of USPIO/SQgem NPs (a) in the absence
of an external magnetic field and (b) guided by an external magnetic field (c)
Percentage of the hypo-intensity tissues with T2b36 ms (white column), and with
T2b20 ms (gray column). Mouse 2 was injected with nanocomposites without
exposition to magnetic field. Mice 1, 3, and 4 were injected with USPIO/SQgem
NPs with 2 h exposure to 1.1 T magnetic field. (d) In vivo anticancer
activity of USPIO/SQgem NPs (with extracorporeal magnetic field) (5 mg/kg
equivalent of gemcitabine) compared with placebo-treated group (drug unloaded
USPIO/squalene nanocomposites), USPIO/SQgem NPs (no extracorporeal magnetic
field applied), with SQgem NPs and with gemcitabine free in L1210 subcutaneous
tumor bearing mice.Untreated (.), placebo USPIO/squalene NPs (), gemcitabine
(0), SQgem NPs (A), USPIO/SQgem composite NPs (no extracorporeal magnetic
field) (A), USPIO/SQgem composite NPs (with extracorporeal magnetic field) (.).
Statistical analysis was performed using Student's t-test to compare the
statistical significance of USPIO/SQgem composite NPs independently with
gemcitabine and SQgem NPs. Data with **pb0.05and ***pb0.001 were considered as
significant and very significant, respectively.
Chapitre III Essais
Précliniques

68
Le colorant NIR Cy5.5 a été utilisé par
Kim et al pour étiqueter le Paclitaxel à base de chitosane NP
(PXT-CNPS). Imagerie et l'évaluation de l'efficacité
thérapeutique a été effectuée sur des souris
porteuses SCC7 murine les tumeurs de carcinome épidermoïde.
En NIR fluorescence images in vivo (NIRF) a
montré des tumeurs bien délimitées en raison de
l'accumulation des NP dans ce domaine. L'intensité du signal de
fluorescence a été corrélée à la
concentration des NP administrés et à la fréquence des
injections, par rapport à la teinture libre, NIRF images ont
montré
? Une augmentation rapide de la taille des tumeurs chez les
souris témoins tandis qu'une inhibition progressive de la croissance
tumorale a été observée chez les souris traitées.
montrant ainsi clairement une amélioration de l'activité
thérapeutique du médicament (Fig59).
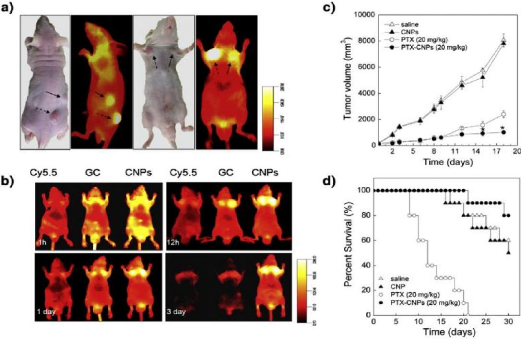
Figure 59: In vivo imaging of
Cy5.5-labeled CNPs in SCC7 tumor-bearing mice. (a) The early-stage tumor models
were generated by injecting subcutaneously SCC7 cells into the pectoral and
dorsal sides of C3H-HeJ nude mice. After eight days, different size of tumors
had grown to 2.6#177;0.3 mm (solid arrow) and 6.2#177;0.5 mm (dotted arrow).
NIRF images were recorded 1-day post-injection of 3.3 ìmol of
Cy5.5-labeled CNPs (5 mg/kg), (b) Time-dependent tumor targeting specificity of
free Cy5.5, Cy5.5-labeled GC polymers, and Cy5.5- labeled CNPs, all with
equimolar amounts of Cy5.5 (0.16 ìmol), in SCC7 tumor-bearing mice.
Comparative therapeutic efficacy studies of PTX-CNPs: (c) tumor size; (d)
survival curves.
Chapitre III Essais
Précliniques

69
L'Imagerie de tissus et d'organes profonds peut être
atteinte en utilisant également NIR quantum dots. Ces nanocristaux
semi-conducteurs sont extrêmement intéressants comme agents
d'imagerie fluorescente haute et sensibles, en raison de leur grand spectre
d'excitation et la possibilité de moduler l'émission, en fonction
de la taille des NV et la composition chimique.
Nurunnabi et al Ont combiné l'Herceptin, un anticorps
monoclonal IgG qui cible les récepteurs du facteur de croissance
épidermique surexprimé dans les cellules de cancer du sein et de
la prostate à la surface et les points quantiques dans le noyau de ces
micelles. Le potentiel du NIR QD-micelles chargées de réduire la
croissance tumorale a été étudiée sur des souris
HER-2 positif MDA-MB-231 portant cancer du sein humain. Plus
précisément adressée à ces cellules, les micelles
QD-chargés ont réussi à bloquer la fonction de HER2
surexprimé, donc provoquant une inhibition significative de la
croissance tumorale 77,3% par rapport à la solution saline (Fig60).
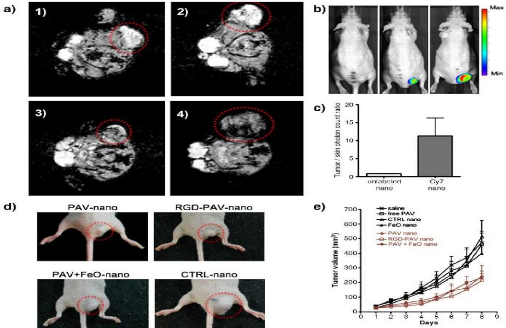
Figure 60: (a) (1, 2) Selected MR images of
PAV nanoemulsion and CTRL nanoemulsion injected mice; (3, 4) MR images of PAV
FeO nanoemulsion and FeO nanoemulsion injected mice. Red circles indicate the
tumors. In (1) and (2), tumors appeared bright compared to surrounding muscle
tissue. In (3) and (4), tumor areas appeared hypointense, indicative of FeO
accumulation. (b) In vivo NIRF images of mouse injected with unlabeled
nanoemulsions (left) and mice (two different sized tumors) injected with Cy7
nanoemulsion (middleand right) at the end of the study. (c) tumor/skin photon
ratio at the same time point. Therapeutic effect of nanoemulsions: (d)
photographs of typical tumors of mice injected with PAV nanoemulsion, RGD-PAV
nanoemulsion, PAVþFeO nanoemulsion, and CTRL nanoemulsion; (e) tumor
growth profiles.
Chapitre III Essais
Précliniques

70
La combinaison de l'imagerie photo-acoustique et optique
« photothermique », Une autre approche novatrice qui a
été récemment proposé par Lovell et al.
Dans cette étude, des porphysomes ont été
préparés, ils sont des vésicules sphériques
formée par l'assemblage d'auto conjugués
porphyrine-phospholipides.
? Porphysomes montrent une forte absorption de la
lumière et de fluorescence NIR.
? En outre, porphysomes irradiés convertissent
l'énergie laser en chaleur donc être attractif non seulement pour
la formation d'image, mais aussi pour les traitements photothermique.
La preuve du concept a été faite in vivo
après administration intradermique à des rats :
? Lorsqu'elle est injectée par voie iv chez des souris
porteuses de cellules tumorales, le signal a affiché une fluorescence
élevée dans la tumeur, mais pas immédiatement
? L'efficacité thérapeutique des porphysomes a
été démontrée chez la souris irradiée par un
laser 658 nm 24 h après l'injection. La température
contrôlée atteint 60 O C dans des tumeurs traitées par tout
porphysomes.
? Il n'était que de 40 O C pour les souris
témoins
En conséquence, les tumeurs ont été
complètement détruites, alors qu'aucune inhibition de la tumeur
n'a
été observée pour les souris témoins
(Fig61).
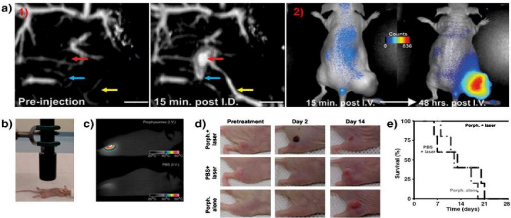
Figure 61: (a) (1) Photoacoustic tomography
imaging before and after intradermal injection of porphysomes; (2) fluorescence
imaging after i.v. injection of porphysomes in a KB xenograft-bearing mouse.
(b) Photothermal therapy set-up showing laser and tumor-bearing mouse; (c)
representative thermal response in KB tumor-bearing mice injected intravenously
24 h before with 42 mg/kg porphysomes or PBS; (d) photographs showing
therapeutic response to photothermal therapy using porphysomes; (e) survival
plot of tumorbearingmice treated with the indicated conditions.
Chapitre III Essais
Précliniques
| 


