Bibliographie
[1] D.R. Nelson, T. Piran, S. Weinberg,
éditeurs, Statistical Mechanics of Membranes and Surface, World
Scientific, Singapore, 1989.
[2] C. Fradin, A. Abu-Arish, R. Grank, M. Elbaum,
Biophys. J. 84, 2005 (2003).
[3] P.G. Dommersnes, J.-B. Fournier, Europhys. Lett. 46,
256 (1999).
[4] S. Safran, Statistical Thermodynamics of
Surfaces, Interface and Membranes, Addision-Wesly, Reading,
1994.
[5] D. Bartol, J.-B. Fournier, Eur. Phys. J. E 11, 141
(2003).
[6] H. Kaïdi, T. Bickel, M. Benhamou, Eur. Phys.
69, 15 (2005).
[7] T. Bickel, M. Benhamou, H. Kaïdi, Phy. Rev. E
70, 051404 (2004).
[8] A. Bendouch, H. Kaïdi, T. Bickel, et M.
Benhamou, J. Stat. Phys. : Theory and Experiment P01016, 1 (2006).
[9] A. Bendouch, M. Benhamou, et H. Kaidi, E. J.
Theoretical Physics 5, 17, 215230. (2008).
[10] H. Lodish, A. Berk, S.L. Zipursky, P. Matsudaira,
D. Baltimore, J. Darnell, Molecular Cell Biology, Freeman &
Company, New York, 2002.
[11]
Résumé. 20
S. Safran, Statistical Thermodynamics of Surface,
Interfaces and Membranes, Addison-Wesley, Reading, MA, 1994.
[12] E. Evans, D. Needham, J. Phys. Chem. 91, 4219
(1987).
[13] R. Lipowsky, S. Sasckmann, éditeurs,
Structure and Dynamics of Membranes : From Cells to Vesicles, Volume 1A,
Elsevier Science B.V., 1995.
[14] P.B. Canham, Theoret. Biol. J. 26, 61
(1970).
[15] W. Helfrich, Z. Naturforsch. 28, 693
(1973).
[16] S. Safran, Statistical Thermodynamics of
Surfaces, Interface and Membranes, Addision-Wesly, Reading,
1994.
[17] F. Brochard, J.-F. Lennon, J. Physique
(Paris) 36, 1035 (1975).
[18] V.I. Marchenko, C. Misbah, Eur. Phys. J. E 8,
477 (2002).
[19] K. Elhasnaoui, Y. Madmoune, H. Kaidi, M. Chahid,
M. Benhamou, African Journal of Mathematical Physics 8, 101 (2010).
[20] Y. Madmoune, K. El Hasnaoui, A. Bendouch, H.
Kaidi, M. Chahid, M. Benha-mou, African Journal of Mathematical Physics 8, 91
(2010).
[21] M. Benhamou, K. Elhasnaoui, H. Kaidi, M. Chahid,
Physica A 389, 3465 (2010).
[22] M. Benhamou, K. El Hasnaoui, H. Kaidi, M.
Chahid, à paraître dans African Journal of Mathematical
Physics, 2011.
[23] M. Benhamou, I. Joudar, H. Kaidi, K. Elhasnaoui,
H. Ridouane, H. Qamar, Phys. Scr. 83, 065801 (2011).
Chapitre 2
Composition et fonction des
membranes biologiques.
Dans ce premier chapitre, à caractère
bibliographique, nous rappelons, dans un premier temps, la
représentation des membranes biologiques, ensuite, les
découvertes et les premières observations de la cellule, enfin,
la structure et les propriétés des membranes biologiques,
principalement pour leurs capacités de séparer deux milieux
aqueux l'un de l'autre. Plus exactement, nous explorons la composition des
cellules biologiques. En particulier, nous mettons l'accent sur le rôle
de chacune de ses composantes. Nous terminons en précisant quelques
intérêts et applications des vésicules.
2.1 Représentation des biomembranes.
saires pour le maintien de la vie. La cellule est donc
l'unité structurale et fonction-
21
La cellule est la plus petite unité vivante,
capable d'accomplir les fonctions néces-
hapitre 1 : Composition et fonction des membranes
biologiques. 22
nelle fondamentale des organismes vivants. Sa taille
est de l'ordre du micromètre. C'est d'ailleurs l'une des raisons qui
laisse cette brique élémentaire de tous les êtres vivants
un objet d'une extrême complexité. La découverte des
cellules était intervenue avec la mise au point du
microscope.
Ainsi, en 1665, Robert Hooke
[1] observa, pour la première fois, des cellules
à l'aide d'un microscope à deux lentilles. En
1838, M. Schleiden et Theodor Schwann [2]
s'étaient mis d'accord sur la même conclusion. C'est que
tous les organismes se composent de cellules, qui y sont décrites comme
des petite chambres limitées par une paroi ou encore membrane
cellulaire. Cette dernière est alors considérée comme
une simple enveloppe renfermant différents constituants de la cellule.
En 1847, Théodore Nicolas Gobley [45]
isola la lécithine du jaune d'oeuf et découvrit les
phospholipides. Singer et Nicolson [11] partirent du
modèle de bicouche lipidique de Gorter et Grendel et utilisèrent
les découvertes de Frye et Edidin [10], en
matière de fluidité de la membrane et de mobilité des
protéines. Ce modèle de fluide mosaïque
[11] reste le modèle de référence,
même s'il a subi quelques aménagements. Dans ce modèle, la
membrane plasmique est décrite comme une bicouche lipidique fluide, dans
laquelle flottent des protéines, et où les molécules de
lipide et protéines sont distribuées plus ou moins
aléatoirement. Les protéines sont insérées
profondément dans la bicouche lipidique, sous forme compacte. Les
protéines peuvent être intégrales (protéines
transmembranaires) ou adsorbées à la surface de la bicouche. Les
chaînes polypeptidiques, le plus souvent organisées sous forme
d'hélices á [12] et contenant de nombreux
résidus d'acides aminés hydrophobes, prennent la place des
lipides et assurent ainsi la continuité de la partie hydrophobe de la
membrane. Alors que es parties les plus hydrophiles des protéines
émergent sur au moins une
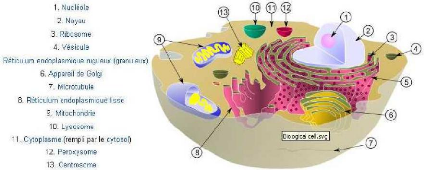
hapitre 1 : Composition et fonction des membranes
biologiques. 23
FIG. 2-1 -- Schéma d'une cellule
eucaryote.
des deux faces de la bicouche. La face externe de la
membrane est rendue encore plus hydrophile, par la présence de
résidus osidiques (Fig.
1.1).
L'agitation thermique est responsable de la diffusion
et de la rotation de toutes les molécules dans le plan de la
membrane.
Des études récentes
[13, 14] révélèrent que
les lipides et les protéines ne diffusent pas aussi librement. Ce qui
contredit alors les prédictions du modèle original de Singer et
Nicolson. En effet, les structures membranaires observées à
l'aide de techniques nouvelles, comme les pièges optiques, le SPT
(Simple Particle Tracking) et le SMT (Simple Molecule
Tracking). Cette technique relativement récente a permis le suivi
du déplacement de molécules individuelles par
vidéomicroscopie couplée à l'analyse d'images. Les sondes
utilisées sont soit des particules submicrométriques (particules
de latex, nanocristaux ou colloïdes d'or, couplés à la
molécule d'intérêt
hapitre 1 : Composition et fonction des membranes
biologiques. 24
par un anticorps), et l'on parle alors de suivi de
particule unique ou SPT [15, 16], soit des
molécules fluorescentes (suivi de molécule unique ou SMT
[17]). En fait, la résolution spatiale est de l'ordre
du manomètre et la résolution temporelle,
généralement imposée par la cadence vidéo, peut
atteindre la centaine de Hertz. A partir des trajectoires des molécules,
le calcul du déplacement quadratique moyen de la position en fonction du
temps permet de déterminer les modes de diffusion.
La méthode de FRAP (Fluorescence Recovery
After Photobleaching ) réalise une mesure moyenne sur un grand
nombre de molécules. La FCS (Fluorescence Correlation
Spectroscopy) effectue une mesure moyenne sur un petit nombre de
molécules et nécessite de ce fait un certain nombre de
répétitions pour obtenir une valeur finale significative.
L'avantage de cette technique de FCS réside dans l'utilisation d'un
faible marquage : une faible suppression des molécules
d'intérêt est suffisante et même nécessaire pour
réaliser des mesures. En effet, la FCS est sensible à l'amplitude
des variations de fluctuation d'intensité et donc aux fluctuations du
nombre de molécules présentes dans le volume confocal qui a une
taille de l'ordre du femtolitre
(10-i5L) , ceci correspond
à une concentration volumique de l'ordre de quelques dixièmes de
nanomolaires (10-9M) à un
micromolaire (10-6M).
Les SPT et SMT permettent alors une
caractérisation plus fine des sous-populations. Au contraire, ces trois
dernières techniques autorisent la mise en évidence de
phénomènes qui auraient pu être masqués par l'effet
de moyenne de la FRAP. Dans certaines situations ce sont donc des techniques
complémentaires.
Malgré la diversité des êtres
vivants, les cellules ont des caractères anatomiques, biochimiques et
fonctionnels communs.
hapitre 1 : Composition et fonction des membranes
biologiques. 25
| 


