I/ Synthèse bibliographique :
1.1- Définition du paracétamol :
Le paracétamol, de formule brute << C8H9NO2
», est la dénomination commune internationale (DCI) de la substance
active de plusieurs spécialités pharmaceutiques de la classe des
antalgiques-antipyrétiques.
Son nom chimique systématique est <<
para-acétamido-phénol » (Figure 1). Il est néanmoins
désigné par plusieurs autres noms tels que : <<
N-(4-hydroxyphényl)-acétamide », <<
N-acétyl-para-aminophénol (en abrégé NAPAP ou
APAP), << acétylaminophénol », <<
phydroxyacétanilide », << 4'-hydroxy-acétanilide
», << acétaminophène » ou encore <<
N-paraacétyl-aminophénol ».
Quant à son nom commun << paracétamol »,
il est dérivé de la contraction de son nom chimique
systématique.
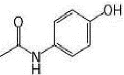
Figure 1 : Formule développée du
paracétamol.
1.2- Origine :
Le paracétamol est d'origine synthétique. Il
peut être obtenu par l'acylation (Figure 2) du para-amino-phénol
en solution dans l'acide éthanoïque (acide acétique), par
l'action de l'anhydride acétique à 100 °C (CLAYDEN et
al, 2003 ; MESPLEDE et SALUZZO, 2004).
Cette réaction d'acylation dépend du rapport des
concentrations des réactants : à concentrations
équivalentes en anhydride acétique et paraaminophénol, le
produit obtenu est exclusivement mono-acétylé,
c'est-à-dire du paracétamol pur. Mais en présence d'un
excès d'anhydride acétique, le produit obtenu est doublement
acétylé et ne correspond pas au paracétamol. Dans ce
dernier cas néanmoins, l'hydrolyse suffit pour la transformation du
composé doublement acétylé en composé
mono-acétylé, donc, en paracétamol.
Page 6

Figure 2 : Schéma de la réaction
d'acylation du
paraaminophénol en paracétamol.
Le paracétamol peut être aussi obtenu suivant une
autre voie comprenant d'abord une acylation de l'aniline (appelée aussi
phénylamine) au moyen de l'anhydride acétique (ou anhydride
éthanoïque) (Figure 3), suivie d'une hydroxylation de
l'acétanilide obtenu sous l'action de l'acide ascorbique (LE MAREC,
2005).
Aniline anhydride acétique acétanilide
Figure 3 : Schéma de la réaction
d'acylation de l'aniline en
acétanilide.
1.3- Historique :
Le paracétamol est une molécule qui comme
l'aspirine est plus que centenaire, mais qui malheureusement n'a à son
actif qu'une cinquantaine d'années d'activité
thérapeutique (LE MAREC, 2005).
Elle représente une découverte providentielle,
née d'une erreur de livraison de produit qui c'était produite en
1886, à l'université de Strasbourg, où les deux assistants
du professeur KUSSMAUL, ARNOLD CAHN et PAUL HEPP, qui réalisaient des
essais thérapeutiques
Page 7
avec du naphtalène (Figure 4a) sur les parasitoses
intestinales, reçurent de l'acétanilide (Figure 4b) à la
place du naphtalène et ne s'aperçurent de cette erreur
qu'après observation d'une baisse inhabituelle de température
chez leurs patients (LE MAREC, 2005 ; QUENEAU, 2006).
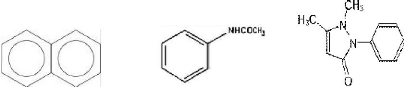
(a) (b) (c)
Figure 4 : Formules développées
du naphtalène (a), de l'acétanilide
(b) et de l'antipyrine (c)
(LE MAREC, 2005).
Ainsi ces deux auteurs (ARNOLD CAHN et PAUL HEPP)
découvrirent l'activité antipyrétique de
l'acétanilide appelé aussi phényl-acétamide, qui
est une amine aromatique de formule C8H9NO.
Ils s'empressèrent alors de publier leur
découverte et d'ouvrir leur propre fabrique pour concurrencer
l'analgésique mais aussi l'antipyrétique en vogue à
l'époque : « l'antipyrine » (Figure 4c), appelé aussi
« phénazone » ou encore « analgésine », le
premier médicament au monde entièrement synthétisé
(VIBES, 2001), et donnèrent au nouveau médicament le nom
d'antifébrine.
Mais étant donné que l'acétanilide est un
dérivé de l'aniline (matière première dans
l'industrie des colorants extraite à partir de l'huile de goudron de
houille, ou de l'indigo) (LE MAREC, 2005), les chercheurs
s'intéressèrent alors aux autres dérivés de
l'aniline notamment la phénacétine (Figure 5) pour laquelle on
découvrît des vertus antalgique et antipyrétique (LE MAREC,
2005 ; QUENEAU, 2006).
C'est ainsi aussi, selon LE MAREC (2005), que MORSE a
réussi, en 1888, à obtenir un autre dérivé portant
les mêmes propriétés analgésiques et
antipyrétiques que l'acétanilide : il s'agit du
para-acétamido-phénol communément appelé «
paracétamol ».
Page 8
Hélas ! en 1893, JOSEPH VON MERING, un médecin
allemand, comparant les propriétés antalgiques et
antipyrétiques du paracétamol et de la phénacétine
ainsi que leurs toxicités respectives, conclu que le paracétamol
est beaucoup plus toxique pour le rein des malades que la
phénacétine et donna la préférence à cette
dernière, qui va, aux cotés de l'aspirine, jeter de l'ombre sur
le paracétamol un demi-siècle durant (QUENEAU, 2005).
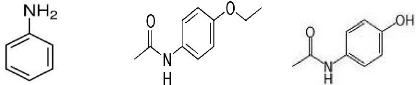
(a) (b) (c)
Figure 5 : Formules développées
de l'aniline (ou phénylamine) (a), de la
phénacétine
(b) et du paracétamol (c) (LE MAREC, 2005).
Cela a duré jusqu'en 1948, année où l'on
s'aperçût de l'importante néphrotoxicité de la
phénacétine chez des consommateurs chroniques (QUENEAU, 2005).
Par la suite, selon LE MAREC (2005) et QUENEAU (2006),
d'autres études toxicologiques furent concluantes, preuves à
l'appui, vis-à-vis des propriétés antalgique et
antipyrétique et montrèrent une bonne tolérance de
l'organisme au paracétamol.
Ainsi le docteur VON MERING avait commis une erreur et
celle-ci est aujourd'hui attribuée à une contamination du
paracétamol étudié par ce médecin, par une
espèce chimique douée d'une forte néphrotoxicité
(LE MAREC, 2005 ; QUENEAU, 2006).
Enfin en 1955, la Food and Drugs Administration (FDA) permit
la commercialisation, et pour la première fois, du paracétamol
aux États-Unis. À partir de ce moment, l'utilisation du
paracétamol connu un tel essor qu'il est considéré
aujourd'hui comme le plus populaire et le plus utilisé des antalgiques
et antipyrétiques (QUENEAU, 2006).
Page 9
| 


