V.3. Extraction des flavonoïdes :
Les méthodes d'extraction des flavonoïdes
dépendent aussi bien du matériel végétal que du
type de flavonoïde à extraire. L'extraction proprement dite est
réalisée par des solvants de polarité croissante. Un
traitement préalable de la plante par un solvant apolaire (hexane ou
éther de pétrole) la débarrasse des graisses, des
stérols et des pigments (chlorophylle et caroténoïdes).un
solvant chloré, le benzène, l'acétate d'éthyle ou
l'éther diéthylique permet de récupérer les
aglycones libres peu moyennement polaires. L'acétone, le
méthanol, l'eau ou leur mélanges permet d'extraire les aglycones
polyhydroxylés et la plupart des glycosides.
Les rendements d'extraction dans toutes les fractions
flavonoidiques à partir de Centaurea microcarpa Coss et Dur.
sont exprimées en pourcentage de matière sèche
(%Ms) dans le tableau 13
Tableau 13: Rendement en flavonoïdes totaux
de Centaurea microcarpa Coss et Dur.
1 ENuU- 43I l'exNrEIN 7 IP S1prENu11143'1pIESRrENiRn
Rendement (%)
Extrait choloroformique 45° C 6,5925
Extrait d'acétate d'éthyle 45° C 7,0475
Extrait aqueux 45° C 14,536
Les résultats de l'extraction (figure19), selon la
méthode de Makbary et Makhram (1982), montrent que Centaurea
microcarpa Coss et Dur. contient différentes fractions de
flavonoïdes. Les rendements obtenus varient entre et 14,536%
dont le meilleur est celui de l'extrait aqueux avec 14,536%,
puis de l'extrait d'acétae d'éthyle avec 7,0475%, quant au plus
faible est celui obtenu par l'extrait chloroformique avec un pourcentage de
(6,5925%).
On remarque que les flavonoïdes extraits de l'espèce
Centaurea microcarpa Coss et Dur.
sont beaucoup plus polaires qu'apolaires, ce qui explique le
rendement élevées de l'extrait aqueux (14,536%) par rapport aux
deux autres extraits, choloroformique et d'acétate d'éthyle,
alors que les flavonoïdes apolaires sont mois présents, deux fois
moins abondants que les flavonoïdes polaires, du fait du faible
pourcentage obtenus avec l'extrait choloroformique.
L'ajout du chloroforme provoque la séparation des
flavonoïdes en fractions glycosylées et aglycones, on constate que
les flavonoïdes glycolysés sont plus abondants que les
flavonoïdes aglycones car l'extraits cholorformique, dont le quels ils
sont solubles, possède le plus faible rendement.
Rendement en flavonoides
16
|
14 12 10 8 6 4 2 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rendemant
|
|
|
|
|
|
|
|
|
|
|
Extrait chloroformiqueExtrait d'acétate
d'éthyleExtrait aqueux
Figure 19: Rendement en flavonoïdes totaux
chez Centaurea microcarpa Coss et Dur.
D'autre part, l'ajout de l'acétate d'éthyle,
pour extraire les flavonoïdes mono et di -glycolysés, donne un
rendement de (7,047%) inférieur à celui de l'extrait aqueux
(14,536%) contient le reste des flavonoïdes, à savoir les di, tri
et tétra glycosylés. Ce dernier montre la richesse de
Centaurea microcarpa Coss et Dur. en flavonoïdes di, tri et
tétra glycosylées par rapport au flavonoïdes mono et di
glycosylés, ceci peut être expliqué par la grande
solubilité des hétérosides, augmentant ainsi la
polarité dans l'eau ce qui permet d'entrainer les flavonoïdes qui
sont entrainés dans la phase aqueuse d'où leur présence
dans l'extrait aqueux (figure20).
En outre, on observe la présence des flavonoïdes
di glycosylées dans les deux extraits aqueux et l'acétate
d'éthyle , du peu itre aux différences de masse molaires entre la
partie hétérosidique et le reste du flavonoïdes (partie
aglycone) ; si la partie hétérosidique du flavonoïde
diglycosylées domine (son poids moléculaire est plus
élevé par rapport a la partie aglycone) ce dernier sera plus
soluble dans l'eau ,en l'occurrence, retrouvé dans l'extrait aqueux ,
alors que si la partie aglycone prédomine sur
l'hétéroside, donnant ainsi une solubilité moins
marqué au flavonoïde di glycosylée, ce dernier se retrouvera
dans l'extrait d'acétate d'éthyle. On peu dire que la
solubilité des flavonoïdes dépend aussi de la la fraction
hétérosidique.
D'une manière générale, le protocole
d'extraction des flavonoïdes de Centaurea microcarpa Coss et Dur.
suivi montre que cette espèce est riche en flavonoïdes, dont ceux
glycosylées (polaires) sont plus abondants que ceux non
glycosylées (apolaires), possédant des degrés de
solubilités très hétérogènes
résultant de leurs différences de structure. En effet, les
travaux de Mishiso et son équipe (2006), sur 80 espèces
Centaurea démontre que ce genre botanique renferme des
flavonoïdes, flavones et flavonols en grande majorités, et leurs
dérivées glycosidiques.
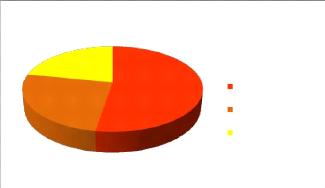
25%
22%
53%
flavonoides di,tri et tetra glycosylées flavonoides mono
et di glycosylées flavonoides aglycones
Figure 20: Répartition des
différentes fractions flavonoides de Centaurea microcarpa Coss
et Dur.
V.4. Extraction des HE :
Le rendement en HE est défini comme étant le
rapport de la masse en HE sur la masse de la matière sèche
végétale (partie aérienne), exprimé en % (P /P).
Les résultats de l'extraction par hydrodistilation,
montrent que la plante d'étude posséde un pourcentage en HE,
estimé à 1,213%(figure21).
La teneur en HE chez la nigelle (Nigella sativa L.)
est de 0,03-0,04%, et celle de l'origan (Origannum glandulosum Desf.)
atteint les 2,62% (Bousbia, 2004). On remaque que la teneur en HE de notre
espèce se situe entre les deux pourcentages (1,213%) et prend une valeur
moyenne.
En se référent aux études
précédentes et en comparent le rendement obtenu chez
Centaurea microcarpa Coss et Dur. avec d'autre espèces, on peu
dire que cette espèce présente une teneur en HE moyenne.
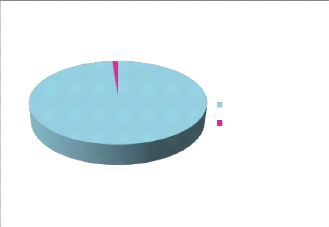
1,213%
98,787%
matiére végétale séche HE
Figure21: Pourcentage en HE de Centaurea
microcarpa Coss et Dur.
V.5. Caractérisation des extraits bruts
polyphénoliques :
V.5.1. Recherche de quelques substances actives
:
Les résultats des tests phytochimiques sont
regroupés dans le tableau 14.
Les extraits de la partie aérienne de Centaurea
microcarpa Coss et Dur. contient des PP, la phase aqueuse
ayant viré au rouge après ajout du HCl.
L'anneau bleu ou bande bleu formé après ajout
d'ammoniaque à l'infus, indique la présence d'anthocyanes.
D'après la coloration noire obtenue avec FeCl3, la partie
aérienne de Centaurea microcarpa et Dur. contient des tanins
galliques et catéchiques.
La formation de mousse après agitation de l'infus et
l'eau distillé, et sa persistance après 15min de repos est due
à la présence de saponosides dans la plante mais à un
faible degré du car la hauteur de la mousse obtenus n'a pas
dépassé les 0,3cm.
Après exposition aux vapeurs de NH3 et visualisation sous
UV, les fluorescences jaunâtres observées, indique l'existence de
coumarines.
Tableau 14: Résultats des tests
phytochimiques.
|
Composée
|
PP
|
Anthocyanes
|
Tanins
|
Saponoside
|
Coumarine
|
|
Réactifs
|
HCl
|
NH4
|
Fe2Cl3
|
Eau distillé
|
NaOH
|
|
Présence
|
+
|
+
|
+
|
+
|
+
|
|
Coloration
|
Rouge
|
Bande bleu
|
Bleu nuit
|
0,3 cm
|
Jaune fluo
|
|
Photo :
|
Témoin Extrait
|
|
Témoin
|
|
Extrait
|
|
|
Témoin
Extrait
|
Témoin Extrait
|
|
|
V.6. Chromatographie sur couche mince (CCM) :
La chromatographie sur couche mince de silice qui est à
la fois une méthode de séparation et d'identification de
divers constituants d'un mélange. Pour ce qui est de notre analyse,
on se sert de la CCM pour mettre en évidence les différentes
familles de PP, en fonction de leur façon de migrer dans les conditions
données. On à utilisées huit systèmes solvants de
polarités différentes, en présence de deux substances
standards ; la quercitine et l'acide gallique.
Les plaques CCM observées, après élution par
les différents systèmes solvants, montrent des taches de nombres,
de couleurs et de distances de migrations différents (figure15).

Chapitre V : Résultats et interprétations.
Tableau : Résultats de la CCM :



En se basant sur la comparaison des RF des standards et des
taches de l'extrait méthanolique, la présence de GAE et de QER en
même temps est confirmée dans les systèmes: SII, SIV, SVI,
SVII et SVIII, dont les RF sont respectivement: 0,479, 0,875, 0,051,
0,82 et 0,76 pour GAE et sont 0,683, 0,927, 0,091, 0,87 et 0,853 pour QER.
En revanche, la présence de la quercétine seule
est observée dans les systèmes SI, SIII et SV dont les
RF sont respectivement: 0,466, 0,906 et 0,091. Ces trois systèmes n'ont
pas permis l'élution de GAE cela est du à sa faible
solubilité dans les solvants apolaires a cause de sa structure complexe
et son poids moléculaire élevé (tableau 16).
Tableau 16: Propriétés
physicochimiques des étalons utilisées en CCM.
|
Composés
|
Structure
|
Masse molaire(gmol-1 )
|
Famille
|
|
|
Quercétine
|
|
170,1195
|
flavonoïde
|
|
L'acide gallique
|
|
302,2357
|
Tanin
|
Les polyphénols sont une famille de composés
très hétérogène 9000 composés,
classés en 12 classes, dont la classe majeure est celle des
flavonoïdes. Les tableaux 17 et 18 donnent les caractéristiques des
composés phénoliques et des flavonoïdes observés sous
UV après séparation par CCM.
Tableau 17: composés phénoliques
identifiés par CCM (Markham, 1982).
Couleurs sous UV Composés probables
Rouge Anthocyanidine 3 glucoside
Rose Anthocyanidine 3,5 di glucoside
Orange Anthocyanidine 3 glucoside
Orange pale Anthocyanidine 3glucoside
Jaune Flavonols
Jaune pale Flavonols
Vert Rutine
Bleu sombre Flavonols, flavonones, aurones
Bleu vif Hydroquinones
Bleu pale Acide phénol
Bleu blanc fluo Acide phénol
Mauve Flavonols, flavonones, isoflavonones, flavones
Flavones
Violet Flavonols, flavonones, isoflavonones, flavone
Pourpre sombre chalcones.
Tableau 18: Révélation des
flavonoïdes après séparation CCM (Markham, 1982).
UV 366 nm AlCl3/UV 366 nm Type de phénols ou
flavonoïdes
|
Couleur Couleur
|
possibles.
|
|
Rouge
Jaune
Jaune pale
Bleu blanc fluo
Bleu blanc
fluo
Pourpre sombre
|
Orange Orange Jaune pale orange Bleu clair
jaune
|
Anthocyanidine 3 glucoside
Flavonols
Falvonols
Acide
phénolique
Flavonols, flavonones, flavones
Isoflavonones.
|
Flavonols, isoflavonones, flavones,
chalcones.
Après observation des plaques dans une chambre noire d'une
CCM à haute performance (HPTLC, Camag) et en s'appuyant sur les
données de la bibliographie quant à la séparation des
composés phénoliques par CCM et leur observation sous UV (tableau
17 et 18) on peut éventuellement prédire les composés ou
les familles de composés les plus probables qui peuvent entrer dans la
composition de l'extrait méthanolique de Centaurea microcarpa
Cross et Dur., l'ensemble des observations et des résultats sont
regroupés dans le tableau 19.
Tableau 19: Composés phénoliques
probables identifiés par CCM .
UV
Système 254nm spot 366nm Composés
probables
SI 07 taches sombres S1 Marron foncé Pigments
S2 Marron foncé Pigments
S3 Rouge Anthocyanidine 3,5 di glucoside
Q Sombre
|
SII 04 taches sombres S1
S2
S3 Q
AG
|
Claire
Marron claire
Rouge
Orange
Vert bleu fluorescent
|
-
Pigments
Anthocyanidines 3,5 di glucosides
|
SIII 05 taches sombres S1 Bleu fluorescent Flavonols, flavonones,
isoflavonone
Marron sombre flavones
S2 Pigments
S3 Orange foncé
S4 Orange foncé Anthocyanidine3 glucoside
S5 Orange foncé
Q Orange foncé
|
SIV 04 taches sombres S1
S2
S3
S4
S5
S6
S7
Q AG
|
Violet
Vert clair
Marron
Bleu fluorescent
Rouge
Violet
Vert clair
Rouge fluorescent
Violet fluorescent
|
Anthocyanidine3 glucoside Flavonols, flavones, aurones
Pigments
Flavonols, flavonones, isoflavonone flavones
Anthocyanidine3 glucoside Anthocyanidine3 glucoside Flavonols,
flavones, aurones
|
|
SV S1
S2
S3 Q
AG
|
Marron foncé Orange
Clair
Orange clair
Orange clair
|
Pigments
Anthocyanidine 3 glucoside
-
|
|
SVI Une seule tache sombre S1
S2
S3
S4
S5 Q
|
Orange clair Rose
Bleu
Orange
Orange clair Rose fluorescent
|
Anthocyanidine3 glucoside Anthocyanidine 3,5 di glucoside Acide
phénol
Anthocyanidine3 glucoside Anthocyanidine3 glucoside
Anthocyanidine 3,5 di glucoside
|
|
SVII 04 taches sombres S1
S2
S3
S4
S5
|
Vert jaunâtre Sombre
Vert jaunâtre Rouge
Clair
|
Flavonols, flavones, aurones Pigments
Flavonols, flavones, aurones Anthocyanidine3 glucoside -
|
Q Vert clair
AG Rose clair
|
SVIII 02 taches sombres S1
S2
S3
S4
S5
S6 Q
AG
|
Marron foncé Vert fluorescent Rose orangé Gris
foncé
Clair
Clair
Orange foncé orange
|
Pigment
Flavonols, flavones, aurones
Anthocyanidine3, 5 di glucoside
-
-
-
|
D'après les résultats de ce tableau, le
système qui a donné la meilleure séparation est celui de
l'acétate d'éthyle/acide formique/eau (8/1/1, v/v/v), par ce
qu'il a permis la séparation de 09 taches y compris les étalons,
ce qui explique la solubilité différentielle des composés
phénoliques dans le système IV.
.Observation sous UV à 254 nm:
A 254nm, le système SI a permis de séparer 07
taches sombres de taille moyenne et de forme plus ou moins circulaire, tan
disque le système SIII n'a pu séparer que 05 taches
sombres, par contre les systèmes SII, SIV, SVI et
SVII ont permis la séparation de 04 taches de grandes tailles et
de formes plus ou moins fusitives et les systèmes SII
et SVIII n'ont permis que l'apparition d'une et de deux taches
respectivement.
.Observation sous UV à 366 nm:
A 366nm, le système SI a permis le fractionnement de
l'extrait méthanolique en 03 taches, présentant les couleurs:
marron et rouge pouvant indiquer respectivement la présence des pigments
et des anthocyanidines 3,5 di glucosides.
De même le système SII n'a permis que
la séparation de 03 taches dont les couleurs sont: le marron clair, le
clair et le rouge, correspondant respectivement à des pigments et
à des anthocyanidines 3,5 di glucosides.
Après une simple comparaison entre le premier et le
deuxième système, il apparaît clair et évident que
la tache rouge, qui correspond aux anthocyanidines 3,5 di glucosides, est
commune, et vue la présence du méthanol dans ces deux
systèmes, on constate que le méthanol est le responsable de son
élution.
Le système SIII a permis le fractionnement
de l'extrait méthanolique en 05 taches de couleurs: bleu fluorescent,
marron et orange foncé, pouvant indiquer respectivement la
présence des flavonols et/ou des flavonones et/ou des isoflavonones
et/ou des flavones, des pigments et des anthocyanidine3 glucoside.
Pour ce qui est du système SIV qui a
donné 07 taches de couleurs : vert clair, marron, bleu fluorescent et
rouge, le violet indiquant respectivement des Flavonols et/ou des flavones
et/ou des aurones, des Pigments et des anthocyanidines 3 glucosides.Ce dernier
système présente 02 taches communes avec le système
précédent (bleu, marron), ce qui explique que l'acétate
d'éthyle, présent dans les 02 systèmes
SIII et SIV, est responsable de leur
séparation.
Le système SV a permis le fractionnement de l'extrait
méthanolique en 03 taches de couleurs: marron foncé, orange et
clair correspondant respectivement à des pigments et des
anthocyanidines3 glucosides.
Le tableau 14 montre que le système SVI a
permis la séparation de 06 taches dont les couleurs sont : l'orange
clair; le rose, le bleu, l'orange et le rose fluorescent, pouvant indiquer la
présence des anthocyanidines 3 glucosides pour les couleurs orange et
orange clair, les anthocyanidines pour le rose et le rose fluorescent et
l'acide phénol pour le bleu.
La tache orange est commune dans les plaques
éluées par les systèmes solvants SV et SVI, ce qui prouve
que l'acétate d'éthyle est le responsable de sa
séparation, tan disque, la tache marron est spécifique à
l'éther di éthylique et les taches: rose, rose fluorescent, bleue
sont spécifiques au dichlorométhane.
En outre, le système SVII a permis
l'apparition de 05 taches, dont les couleurs sont: le vert jaunâtre, le
sombre, le rouge et le clair pouvant indiquer respectivement la présence
des flavonols et/ou des flavones et/ou des aurones, des pigments et
anthocyanidine3 glucoside.
En fin, le système SVIII a permis la
séparation de 06 taches dont les couleurs sont: le marron foncé,
le vert fluorescent, le rose orangé et le gris foncé,
correspondant respectivement à des pigments, des flavonols et/ou des
flavones et/ou des aurones et des anthocyanidine3, 5 di glucoside.
Aprés l'analyse des résultats obtenus, la CCM
confirme la présence et la richesse de la plante en poly phénols,
en tanins et en flavonoïdes déjà mis en évidence
préalablement par des tests phytochimiques. La bonne séparation
apparaît dans les systèmes polaires prouve que les polypheols, les
tanins et les flavonoïdes existants sont de nature beaucoup plus
polaire.
V.7. Spéctrophotométrie UV-visible
:
L'analyse spectrophopotométrique UV-visible de
l'extrait brut méthanolique (figure22) indique la présence de
quatre pics, de longueurs d'ondes et d'absorbances différentes, avec
trois pics qui absorbent dans l'UV (pics 2,3 et 4) dont le plus
élevé est le pic 4 (ëmax=203nm, Abs=1,0021) ;
enfin, une faible valeur de l'absorbance est observé (0,0035) à
663nm.
L'absorption à des longueurs d'ondes différentes
(de 203nm à 663nm) (figure21) indique la présence de familles de
composées très variées, du point de vue structure
chimique, présence de fonctions ou double liaisons.
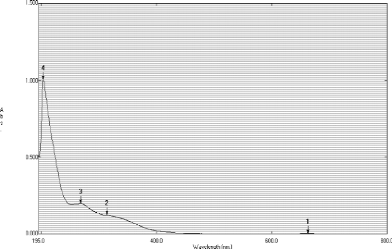
Figure 22: Spectre d'absorption de l'extrait
méthanolique obtenu par la méthode d'Owen et Johns, 19
L'analyse du spectre d'absorption de l'extrait brute
méthanolique (tableau20) à permis de constater la
différence de composition de l'extrait et le pouvoir d'absorption de ces
composées, soit dans l'UV soit dans le visible.
Tableau 20: Résultats de l'analyse
spectrale.
|
Les pics :
|
1
|
2
|
3
|
4
|
|
Longueurs d'ondes
|
663,00
|
341,00
|
268,50
|
203,00
|
|
Absorbance :
|
0,0035
|
0,1234
|
0,1997
|
1,0021
|
Une simple lecture du spectre montre que (Silverstein et al.,
1998) :
· Le pic1 (663 nm) correspond à l'absorption des
pigments chlorophylliens (a et b).
· Une absorbance à 341nm montre la présence
de tryptophane et d'acides aromatiques.
· L'absorption à une longueur d'onde de 268,5 nm est
due à la présence d'acides gras insaturées,
d'ethylebenzéne et de certaines huiles.
· Le pic 4 indique la présence de benzène qui
absorbe à 203nm.
| 


