Quelques goutes d'une solution de FeCl3 à 5% sont
ajoutées à 5 ml d'infuser la réaction donne une coloration
bleue noir en présence des tanins.
IV.5.1.3. Mise en évidence des
anthocyanes:
Quelques goutes d'ammoniaque (1/2) sont ajoutées à
5 ml d'infuser la réaction donne une coloration bleu en présence
d'anthocyanes (Mamyrbékova-Békro et al., 2008).
IV.5.1.4. Mise en évidence des coumarines
:
Mettre environ 1g d'un échantillon de la plante humide
dans un tube à essai, couvrir. le tube avec du papier filtre
imbibé avec une solution de NaOH diluée, papier filtre est
examiné sous lampe UV (254nm) .une coloration de jaune fluorescent
indique la présence des coumarines (Dohou et al ,2003).
IV.5.1.5. Mise en évidence des saponosides :
Leur présence est déterminée
quantitativement par le calcul de l'indice de mousse. Ajouter 2ml d'eau
distillée jà 5ml d'infuser, bien agiter le tout pendant
2min. Après un repos de 15 min en position verticale,
on relève la hauteur de la mousse persistante en cm. (Dohou et al.,
2003).
IV.6.Séparation des extraits méthanoliques
brutes par Chromatographie sur couche mince(CCM):
V.6.1. Principe de la méthode:
La séparation et la purification des différents
composés phénoliques sont fondées sur des techniques
chromatographiques sur polyamide, Cellulose, gel de Sephadex, etc.....
Pour ce qui est de notre analyse, on se sert de la
chromatographie sur couche mince (CCM) pour identifier les substances en
fonction de leur façon de migrer dans les conditions données .La
migration est en fonction de la polarité des substances, de la
polarité de l'éluant et du pouvoir d'adsorption de la phase
stationnaire. La méthode CCM est efficace et rapide et associe la
sensibilité à la simplicité (Kolai et al, 2006)
(figure16).
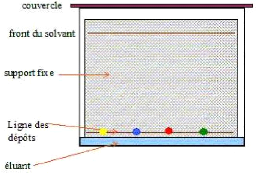
Figure 16 : Principe d'une séparation
CCM
IV.6.2. Mode opératoire :
Les deux extraits méthanoliques obtenus des deux
méthodes ont fait l'objet de la séparation par CCM
suivant les étapes décrites ci-dessous :
IV.6.2.1. Préparation de la plaque :
Les plaques de gel de silice (60 F 254, Merck), sont
découpées selon les dimensions suivantes ; 5, 5et6cm de largeur
pour 8, 10 et 12cm de hauteur.
On tracer au crayon gris, délicatement, une ligne,
appelée ligne de dépôt, à environ un
centimètre du bord inférieur de la plaque à
chromatographie. On repère la position des dépôts à
effectuer sur la ligne tracée précédemment par des lettres
qui désignent les extraits, exemples (Ex1, Ex2,...., etc.) en veillant
à les espacer régulièrement
IV.6.2.2. Préparation de la cuve :
On introduit l'éluant (système solvant) dans la
cuve à chromatographie, d'une largeur de 12 cm et de 14 cm de longueur,
de manière à ce que son niveau atteigne une hauteur d'environ un
demicentimètre. On couvre la cuve avec un couvercle
hermétique.
IV.6.2.3. Dépôt :
On dépose, à l'aide d'une micropipette sur la
ligne de dépôt une goutte de chaque extrait
à analyser ainsi que celles de référence
(quercétine et acide gallique). Les dépôts sont espacer
régulièrement afin d'éviter leur chevauchement lors de la
migration. On peut concentrer les dépôts si nécessaire en
répétant plusieurs fois les dépôts.
IV.6.2.4. Elution :
Plusieurs systèmes solvants, tirées à
partir de la bibliographie, ont été utilisées pour mieux
séparer les différents composées polyphénoliques
éventuellement présents dans l'extrait méthanolique
(Tableau 09).
L'éluant (système solvant) remonte par
capillarité le long de la plaque. Lorsqu'il arrive à environ 1 cm
du bord supérieur (front du solvant), on fait sortir la plaque de la
cuve et on la sèche.
Après ces étapes, on procède à la
révélation des chromatogrammes sous chambre UV (Camag) à
254nm et à 366nm
Tableau 09: Les différents
systèmes solvants utilisées pour la CCM.
Systémes Solvants Rapport (v/v)
Chloroform. 10
01 Methanol 2
Dichloromethane. 5
02 Methanol 1
Acétate d'éthyle. 8
03 Acide acétique. 1
Eau. 1
Acétate d'éthyle. 8
04 Acide formique. 1
Eau. 1
Acétate d'éthyle. 2
05 Ether diethylique. 8
Dichlorométhane. 9
06 Acétate d'ethyle. 1
Acétate d'éthyle. 7
07 Methanol. 1,5
Eau. 1,5
Acétate 9
08 n- butanol 1



