2. Croissance et composition biochimique du Gracilaria
gracilis
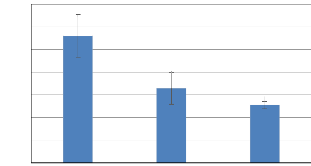
Dans les eaux de la lagune de Bizerte, le TCS
(%j-1) enregistre une baisse significative en fonction du temps. Il
passe de 5,60 #177; 0,94 % j-1 au mois d'Avril à 2,55 #177;
0,16 % j-1 au mois de Juin, avec une moyenne durant toute la
période de culture de l'ordre de 3,05 #177; 0,78 %j-1. Une
baisse sensible est observée entre le mois de Mai (3,29 #177; 0,70 %
j-1) et le mois de Juin (figure 14). La variation de la teneur en
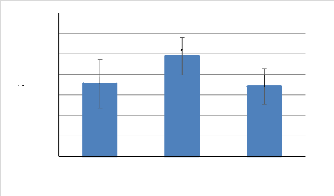
sucres solubles (%) en fonction du temps est représentée par la
figure 15. Cette dernière montre une variation importante de la teneur
en sucres solubles au cours de la période de culture. La teneur la plus
élevée a été enregistrée au mois de Mai, qui
est égale à 48,86 #177; 9,16 %, alors que la teneur la plus
faible a été enregistrée au mois de Juin (34,12 #177; 8,74
%). En moyenne, la teneur en sucres solubles est de 39,46 #177; 9,92 %. Quant
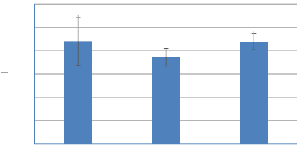
à la teneur en protéines, une variation peu importante de sa
teneur d'Avril à Juin 2019 (Figure 16). Sa valeur varie d'une moyenne de
20,26 #177; 3,52 % (Avril et Mai) à 21,92 #177; 1,74 % au mois du Juin.
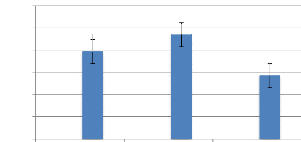
La variation de la teneur en R-phycoérythrine en fonction du temps,
exprimée en mg.g-1 est présentée par la figure
17. La teneur moyenne de RPE, produite après 90 jours de culture varie
entre 1,43 #177; 0,62 et 2,35 #177; 0,82 mg.g-1.
Les valeurs du TCS sont supérieures à ceux
obtenus par Ksouri et al. (2006), Santelices et Doty (1989), Largo
et al. (1989) et Kim (1970). En effet, pour une durée de
culture similaires (30 jours), le TCS moyen de G. gracilis auquel a
conduit notre étude est de l'ordre de 5,60 #177; 0,94 %j-1
alors que pour celle de Ksouri et al. (2006) n'atteigne pas le 1
%j-1 ainsi que ceux mentionnés par Kim (1970) et Largo et
al. (1989) dont les valeurs varient de 4,29 à 4,95 %j-1.
Par contre, nos résultats sont similaires à ceux de Ksouri et
al. (2008) dans le même milieu et avec la même méthode
de culture (4 %j-1). La différence entre les résultats
pourrait être attribuée à la richesse du milieu en
nutriments, la température et la salinité (Marinho-sorino et
al., 2006). Selon Choi et al. (2006) et Yang et al.
(2006), la plupart des espèces de Gracilaria se
développent bien quand la température est supérieure ou
égale à 20 °C. Dans notre étude l'algue s'est bien
développée car la température a été
favorable (16,50 #177; 1,70°C à 22,38 #177; 4,03°C). Nos
résultats concordent avec ceux de Mensi et al. (2012) qui
montrent que G. gracilis s'est bien développé à
une température comprise entre 15 et 26°C et qu'au-dessus de
30°C la croissance chute et il y a dégénérescence des
thalles de l'algue. De même, nos résultats, sont proches de ceux
mentionnés par Yang et al. (2015) pour G. lemaneiformis
(12 à 23°C) et Ksouri et al. (2008) pour G.
gracilis. La température et la salinité sont
considérées comme deux facteurs fondamentaux qui contrôlent
la croissance saisonnière dont il est
37
difficile de séparer leurs effets. L'algue G.
gracilis semble capable de supporter une large gamme de variation des
salinités (Cirik et al., 2006 ; Turan et al., 2006).
D'après le tableau 2, les valeurs obtenues au cours de notre travail et
qui sont comprises entre 34,6 et 35,4 psu, correspondent à celles
signalées par Simonetti et al. (1970) et McLachlan et Bird
(1985). De même, une croissance optimale entre 25 et 42 psu et une bonne
croissance avec des salinités comprises entre 5 et 23 psu sont obtenus
par Cirik et al. (2010) et Simonetti et al. (1970). Une nette
diminution de la croissance à des salinités qui varient entre 18
psu et 25 psu et une chute lorsque la salinité est inférieure
à 15 psu (Munda, 1978 ; Mensi et al., 2014).
L'ensemble des éléments nutritifs constitue un
facteur abiotique clé en relation avec les autres paramètres
environnementaux, qui influencent la croissance des algues (Harrison et Hurd,
2001). Dans notre expérience avec des taux en ammonium et en nitrates
respectivement de 94,40 ? 9,75 ?M et de 58,46 ? 13 ?M en Avril, G. gracilis
présente un TCS maximale. Cependant, lorsque les teneurs en
NH4+ diminuent et celles de NO3- augmentent, le TCS de
Gracilaria chute. Nos résultats s'accordent avec ceux de
Hanisak (1978) qui montre qu'un ajout continu de nutriments maximiserait la
croissance. Dans notre étude, la chute progressive de la teneur en
ammonium dans les eaux de la lagune entre Avril et Juin, est accompagnée
par une diminution du TCS. Ceci montre que G. gracilis a une nette
préférence pour l'ammonium par rapport aux nitrates. Nos
résultats concordent avec celui de Smit (2002) qui indique que cette
préférence peut être expliquée par le fait que
l'ammonium présente l'avantage sur les autres formes d'azote
d'être assimilé sans réduction au préalable. De
même la vitesse du vent qui diminue au cours de la période de
culture et par conséquent la diminution de la turbidité de l'eau
et du déplacement de la masse d'eau affecte la croissance de l'algue.
Ces observations sont en concordance avec celles de Mensi et al.
(2014) qui indiquent que le déplacement des masses d'eau et la
turbulence provoquée par les vents sont d'importants facteurs
susceptibles d'influencer l'absorption des éléments nutritifs et
cela en augmentant la surface de contact des thalles, ce qui améliore la
croissance et le développement de l'algue.
Le risque de pertes de touffes est un problème majeur
auquel se heurte la culture de Gracilaria sur corde. Durant toute la
période d'expérimentation, les pourcentages de perte des touffes
sont 25 %, 62,5 % et 68,75 % pour les mois d'Avril, Mai et Juin respectivement.
Ces valeurs sont similaires à celles de Ksouri et al. (1999)
qui indiquent une valeur de 54 %. Cette valeur élevée pourrait
être attribué au fait que les thalles de Gracilaria gracilis
étant fragiles, se détachent de la corde, sous l'effet
mécanique de brassage par les mouvements de l'eau. Ces
38
pertes sont aussi liées à des difficultés
d'insertion des touffes sur les cordes (Ksouri et al., 1999), à
l'épiphytisme (Fletcher, 1995) et à la faune associée
contenant plusieurs groupes zoologiques exploitant le genre Gracilaria
comme source de nourriture préférée (Smit et al.,
2003 ; Hansen et al., 2006). En conclusion, sous des conditions
de température (16,50 °C à 22,38 °C), de
salinité (34,6 à < 35 psu,) une vitesse de vent (50 à
55 km/h) et des teneurs en ammonium (94,40 ?M) et en nitrates (58,46 ?M), nous
obtenons des TCS acceptable dont la moyenne est de l'ordre de 5,60
%j-1.
Tableau 2: Croissance de Gracilaria
selon différente teneur en sel.
|
Bonne croissance
|
Croissance
maximale
|
Croissance
optimale
|
Chute de la
croissance Salinité létale
|
Munda (1978) > 18 psu 5-15 psu
Mensi (2014) 25- 30 psu > 25 psu
McLachlan et Bird (1985) > 30 psu
Simonetti et al. (1970) 5 à 23 psu = 30 psu
Cirik et al. (2010) 42 psu
La concentration moyenne en sucres solubles est proche de
celles enregistrée par Mensi et al. (2009) dans le même
milieu (34,10 #177; 0,15 %) avec la culture en mode suspendu de la même
espèce mais elle est nettement supérieure à celle
enregistrée par Nguyen (2017) sur la côte Atlantique (0,20 #177;
0,07 % MS). La différence entre les résultats pourrait être
due aux conditions du milieu. Cependant, en remarque qu'il y a une relation
entre la teneur en sucres solubles et la température de l'eau et la
salinité ainsi qu'avec la teneur en nitrate. En effet, d'avril à
mai lorsque la température, la salinité et la teneur en nitrate
augmentent, la concentration en sucres solubles augmente. Nos résultats
sont proches de ceux signalés par Burlot (2016) pour l'algue rouge
Solieria chordalis qui montre des corrélations positives entre
la teneur en sucres totaux et la température de l'eau (r = 0,49, p <
0,1) et la salinité (r = 0,47, p < 0,1).
Les teneurs de protéines sont proches de celles
trouvées par d'autres auteurs pour la même espèce
Gracilaria gracilis : 20-30 % (Mensi et al., 2009), 21,3 %
(Gómez-Ordóñez et al., 2010), 25,4 % (Marsham
et al., 2007) et 26 - 30 % signalés par Sfriso et al.
(1994) dans une partie polluée da la lagune de Venise en Italie.
Par contre, Ces teneurs sont beaucoup plus importantes que celles
enregistrées dans un milieu lagunaire peu pollué (Sfriso et
al., 1994) et
39
des milieux ouverts pour d'autres espèces de
Gracilaria et qui se situent entre 11 et 22 % (Morinho-Soriano et
al., 2006 ; Wen et al., 2006). La variabilité entre les
résultats peut s'expliquer par différents facteurs à
savoir la localisation géographique, les paramètres
physico-chimiques et environnementaux des milieux de culture et la saison de
récolte (Chye et al., 2017). Ceci est démontré
par Cirik et al. (2010) qui indiquent que les pourcentages de
protéines pour la culture de Gracilaria gracilis sous serre
varient selon les saisons. Les pourcentages les plus élevés de
protéines ont été trouvés en décembre (20,28
#177; 0,94 %) et les pourcentages les plus faibles ont été
enregistrés en mars (14,99 #177; 0,14 %). De plus, l'hypothèse
des effets des fluctuations des intensités lumineuses et des
températures qui caractérisent la lagune de Bizerte durant la
période de culture pourrait expliquer les fortes valeurs obtenues en
protéines. En effet, Mensi et al. (2009) notent que
l'augmentation de l'intensité lumineuse entraîne une augmentation
de la teneur en protéines brutes. La quantité d'azote dans la
lagune de Bizerte pourrait aussi être à l'origine des teneurs
élevés de protéines. Burlot (2016) indique que les fortes
pluies peuvent entrainer les nutriments azotés comme le nitrate et
l'ammonium. En effet, les protéines sont synthétisées
essentiellement à partir de l'azote que les algues
prélèvent de leur milieu. Durant notre expérimentation,
nous avons marqué de fortes teneurs en ammonium et en nitrate entre
Avril et Mai (figures 12 et 13). Ces observations s'accordent avec celles de
Mensi et al. (2009) qui indique que la variabilité entre les
résultats pourrait être due à la teneur en ammonium du
milieu qui est considéré comme étant un facteur limitant
très important et qui affecte positivement les teneurs en
protéines qui augmente avec l'élévation des concentrations
d'ammonium.
Les teneurs de R-phycoérythrine est supérieure
à ceux signalées par Mensi et al. (2009) pour le
même mode de culture sur corde tendue de G. gracilis dans la
lagune de Bizerte pendant une durée de 35 jours (0,86 ? 0,03
mg.g-1). Cependant, elle est nettement inférieure à la
valeur mentionnée par Francavilla et al. (2013) pour la
même espèce de G. gracilis (3,6- 7 mg) qui indiquent que
dans le milieu naturel, la teneur en RPE des algues rouges varie au cours de
l'année. Elle est maximale au printemps ; Une baisse sensible est
observée à partir du mois de Mai qui atteint un minimum à
la fin du mois de Juillet. Il parait que la variation de la teneur en RPE
pourrait être liée aux plusieurs facteurs tels que la
lumière, la température, les nutriments et le régime du
courant d'eau. Selon Mensi et al. (2009), les facteurs abiotiques de
milieu de culture, excepté la salinité, affectent
négativement la teneur de la R-phycoérythrine du G.
gracilis. Selon et Jing-Wen et Shuang-lin (2001), la forme et la
concentration de l'azote dans le milieu ainsi que l'interaction de cet
élément avec la lumière affectent les teneurs en R-
40
phycoérythrine de certaines espèces de
Gracilaria. Cependant, Nguyen (2017) montre que la concentration en
R-phycoérythrine est plus élevée en Janvier qu'en Octobre
dont elle chute de plus de la moitié. Cependant, cette baisse est due
à une destruction de la phycoérythrine suite à
l'augmentation de l'intensité lumineuse et aussi à la baisse de
la biosynthèse du fait de l'appauvrissement du milieu en ressources
azotées et de l'augmentation de la température des eaux.
Avril Mai juin
mois de culture
TCS (%.j-1)
4
7
6
3
2
0
5
1
5,60
3,29
2,55
Figure 14:Variation du taux de croissance
spécifique (TCS%.j-1) de Gracilaria gracilis
(Avril-Juin 2019).
Sucre soluble(%)
70
60
50
40
30
20
10
0
35,42
34,12
48,86
Avril Mai Juin
mois de culture
Figure 15: Variation de la teneur en sucres
solubles (%) de Gracilaria gracilis (Avril-
Juin 2019).
Avril Mai Juin
mois de culture
Proteines (%)
30
25
20
15
10
0
5
21,96
21,92
18,57
41
Figure 16: Variation de la teneur en
protéines (%) de Gracilaria gracilis (Avril-Juin
2019).
Avril Mai Juin
mois de culture
R-Phycoérythrine (mg.g-1)
2,5
0,5
1,5
3
2
0
1
2,35
1,97
1,43
Figure 17: Variation de la teneur en
R-phycoérythrine (mg.g-1) de Gracilaria
gracilis
(Avril-Juin 2019).
|
|



