2.6. Isothermes d'adsorption
Tous les systèmes
adsorbant/adsorbât ne se comportent pas de la même
manière. Les phénomènes d'adsorption sont souvent
abordés par leur comportement isotherme. Les courbes isothermes
décrivent la relation existant à l'équilibre d'adsorption
entre la quantité adsorbée et la concentration en soluté
dans un solvant donné à une température constante.
2.1.3. Classification des isothermes
d'adsorption
Expérimentalement, on distingue quatre classes
principales d'isothermes nommées :
S (Sigmoïde), L
(Langmuir), H (Haute affinité) et C
(partition Constante). La figure 4 illustre la forme de chaque type
d'isothermes.
Le solvant s'adsorbe sur les mêmes sites que le
soluté. Ceci implique l'existence d'une compétition d'adsorption
entre le solvant et le soluté.
Le nombre de sites susceptibles d'accueillir les
molécules de soluté à la surface du solide diminue quand
la quantité adsorbée augmente.
L'orientation des molécules à la surface. On
peut citer le cas où les molécules sont adsorbées
verticalement ou horizontalement sur la surface.
Enfin, les interactions attractives ou répulsives entre
les molécules adsorbées se manifestent d'une façon notable
dans le phénomène d'adsorption.
a) Classe L : les isothermes de classe L
présentent, à faible concentration en solution, une
concavité tournée vers le bas qui traduit une diminution des
sites libres au fur et à mesure de la progression de l'adsorption.
Ce phénomène se produit lorsque les forces
d'attraction entre les molécules adsorbées sont faibles. Elle est
souvent observée quand les molécules sont adsorbées
horizontalement, ce qui minimise leur attraction latérale. Elle peut
également apparaître quand les molécules sont
adsorbées verticalement et lorsque la compétition d'adsorption
entre le solvant et le soluté est faible. Dans ce cas, l'adsorption des
molécules isolées est assez forte pour rendre négligeable
les interactions latérales.
b) Classe S : Les isothermes de cette classe
présentent, à faible concentration, une concavité
tournée vers le haut. Les molécules adsorbées favorisent
l'adsorption ultérieure d'autres molécules (adsorption
coopérative). Ceci est dû aux molécules qui s'attirent par
des forces de Van Der Waals, et se regroupent en îlots dans lesquels
elles se tassent les unes contre les autres.
c) Classe H : La partie initiale de
l'isotherme est presque verticale, la quantité adsorbée
apparaît importante à concentration quasiment nulle du
soluté dans la solution. Ce phénomène se produit lorsque
les interactions entre les molécules adsorbées et la surface du
solide sont très fortes. L'isotherme de classe H est aussi
observée lors de l'adsorption de micelles ou de polymères
formées à partir des molécules de soluté.
d) Classe C : Les isothermes de cette classe
se caractérisent par une partition constante du soluté entre la
solution et le substrat jusqu'à un palier. La linéarité
montre que le nombre de sites libres reste constant au cours de l'adsorption.
Ceci signifie que les sites sont créés au cours de l'adsorption.
Ce qui implique que les isothermes de cette classe sont obtenues quand les
molécules de soluté sont capables de modifier la texture du
substrat en ouvrant des pores qui n'avaient pas été ouverts
préalablement par le solvant
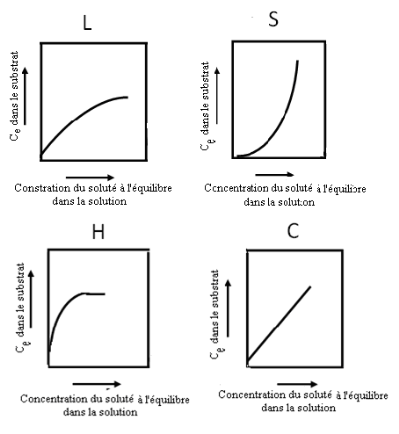
Figure 4: Classification des isothermes d'adsorption
selon Giles et al
| 


