II.4.1.2 Glycopeptides :
Les glycopeptides sont des antibiotiques naturels
découverts dans les années 50. La vancomycine est issue de la
fermentation de streptomyces et la teicoplanine de la fermentation
d'Actinoplanes. Leur action antibiotique provient de l'inhibition de la
synthèse du peptidoglycane de la paroi bactérienne .Ce sont les
antibiotiques possédant la plus grosse structure : composé d'une
partie glucidique associée à des acides aminés
[76].
? Structure chimique :
Ce sont en effet peptides macromoléculaires
tricycliques contenant une chaîne heptapeptidique : 1450 daltons pour la
vancomycine et 1890 daltons pour la teicoplanine. Il n'existe que 2
représentants : la vancomycine et la teicoplanine, qui présentent
un mode d'action identique. La vancomycine a été le premier
glycopeptide isolé, en 1956, à partir d'échantillons de
sols prélevés en Inde et en Indonésie, et contenant le
germe Streptomyces orientalis (Nocardia orientalis)
[76].
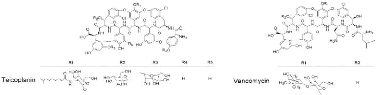
Figure 10 : Structure de la vancomycine et de la
teicoplanine
? Spectre d'activité :
Les glycopeptides et plus spécifiquement la
vancomycine, constituent le traitement de référence des
infections à cocci à Gram positif résistants aux
bêta-lactames, en particulier les infections à bactéries
résistantes, comme les SARM (Staphylococcus aureus
résistants à la méticilline) C'est pourquoi on les
appelle aussi antibiotiques anti staphylococciques et aussi ils sont
utilisés pour le traitement des infections dues à des
entérocoques comme Enterococcus faecium et Enterococcus
faecalis. Cependant, leur toxicité implique une faible marge
thérapeutique et explique leur utilisation limitée
[78].
Chapitre II : Les antibiotiques Page
31
Les bactéries hautement résistantes
émergentes
? Mécanisme d'action :
Les glycopeptides sont au même titre que les
â--lactames des inhibiteurs de la synthèse du peptidoglycane de la
paroi bactérienne. Leur action est toutefois différente;
l'inhibition est due à l'affinité de ces antibiotiques pour
l'extrémité des précurseurs monomériques de la
paroi se terminant par un dipeptide D- alanyl-D-alanine
[61].Ceux-ci, après avoir été
synthétisés dans le cytoplasme bactérien, sont
transportés à travers la membrane cytoplasmique pour finalement
être branchés par des enzymes membranaires bactériennes
(transglycosylases et transpeptidases) au peptidoglycane en cours
d'élongation. La fixation du glycopeptide sur l'extrémité
du précurseur empêche, par encombrement stérique, son
branchement au peptidoglycane. Ces antibiotiques sont lentement
bactéricides. Ils sont rarement bactéricides au bout de 24 heures
et ne le deviennent qu'après 48 heures de contact avec les
bactéries. Cette bactéricidie lente n'est pas expliquée
[78,79].
? Pharmacocinétique :
Pour la Vancomycine : une seule voie d'administration : la
voie IV. Il y a en effet un risque important de nécrose tissulaire en
cas d'administration par voie IM ou SC. Ces deux voies sont donc totalement
proscrites. Pour la teicoplanine : deux voies d'administration sont possibles:
la voie IV et la voie IM [79].
Dans le LCR, la diffusion est variable selon l'état
d'inflammation des méninges. Elle est meilleure chez l'enfant que chez
l'adulte [79].
L'élimination des glycopeptides est rénale, sous
forme active (non métabolisée) Vancomycine et teicoplanine sont
inscrites, comme tous les antibiotiques, sur la Liste I et elles sont
réservés à l'usage hospitalier [79].
? Effets indésirables - Toxicité
:
Les limites de ces molécules sont la tolérance.
On observe cependant une meilleure tolérance avec la teicoplanine
[78].
La principale manifestation d'intolérance est le
syndrome de l'homme rouge. C'est une réaction liée au relargage
d'histamine lors d'injection trop rapide. Il existe aussi d'authentiques
allergies [78].
Chapitre II : Les antibiotiques Page
32
Les bactéries hautement résistantes
émergentes
| 


