II.1.6 Biosynthèse
Guignard dans son livre intitulé « Biochimie
Végétale » indique que la synthèse des
alcaloïdes s'éffectue au niveau du réticulum endoplasmique;
les alcaloïdes se concentrent ensuite dans la vacuole. Pour ce qui est du
pavot, il s'agit des vacuoles spécialisés
développées en lactifères. De façon
générale; la production d'alcaloïdes s'observent dans les
tissus en voie de croissance (jeunes racines; jeunes feuilles) (Guignard,
1996).
La pénétration à travers le tonoplaste
se fait sous forme moléculaire neutres lipophiles. Le pH acide de la
vacuole ionise l'alcaloïde dont la capacité transmembranaire se
trouve réduite: il en résulte une accumulation intravacuolaire de
l'alcaloïde (Guignard, 1996).
Fréquemment les alcaloïdes s'accumulent en des
emplacements différents de leur lieu de synthèse. Par exemple
dans le tabac, la nicotine est synthétisée au niveau des racines;
puis elle migre vers le feuillage. Absente dans les graines, elle se forme
dès la germination de la plantule (Guignard, 1996).
Des modifications de structure peuvent se produire lors de
ces transferts. C'est ainsi que la nicotine est déméthylée
au niveau des feuilles en nornicotine (Guignard, 1996).
II.1.6.1 Précurseur des
alcaloïdes
Les alcaloïdes ont 5 principaux précurseurs qui
sont : la L-ornithine 56 et la L-lysine 55
(aminoacide diaminé) , la L- phénylalanine
58, la L-tyrosine 59 et le L-
tryptophane 57 (aminoacide aromatique). Le point de
départ de nombreux alcaloïdes; plus rarement l'asparagine; la
proline, le glutamate, l'histidine, auxquels il faut ajouter des corps de
structures voisines comprenant un carboxyle d'azote: nicotinate, anthranilate
(Guignard, 1996).
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 21
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 22
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
Acides aminés aliphatiques
H O
OH H O
H2N C C OH
CH2
HC CH3
H2C NH2
H2N C C
CH2 CH2 CH2 CH2
NH2
55 56
L-lysine
L-Ornitine
Acides aminés aromatiques
O
OH
H
H2N C C
CH2
57
OH
L-tyrosine
L-tryptophane
L-phénylalanine
H
H2N C C
CH2
O
OH
H
H2N C C
CH2
O
OH
HN
58 59
v La L-ornihine 56 (acide
aminé non protéique) et la L-lysine 55 sont
à l'origine des alcaloïdes à cycle pyrrolizidine et
quinolizidine : tels que les alcaloïdes tropaniques et la cocaïne
32 (Guignard; 1996).
v La L-tyrosine 59 et la
L-phénylalanine 58; qui sont les acides aminés
aromatiques sont précurseurs pour leur part du groupe des
alcaloïdes isoquinoléiques (Guignard, 1996).
v Le tryptophane 57 est à
l'origine de la quasi-totalité des alcaloïdes indoliques, mais
intervient rarement seul (Guignard, 1996).
Les alcaloïdes indolo-monoterpéniques sont les
plus nombreux : on les rencontre chez les Asteridae ligneuses : Loganiaceae,
Apocynaceae-Asclépiadaceae ,Rubiaceaechez ces dernières un
réarrangement tardif substitue le noyau quinoléique au noyau
indole (Guignard, 1996).
v A côté de ce trois grandes classes
d'alcaloïdes issus des précurseurs précédents, on
distingue les alcaloïdes monoterpéniques et les alcaloïdes
dérivés de la purine (caféine 54,
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 23
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
théobromine 49) que certains d'ailleurs
ne considèrent pas comme alcaloïdes véritables. (Guignard,
1996)
II.1.6.2 Principe et biosynthèse des
alcaloïdes quinoléiques
La réaction élémentaire de la
biosynthèse des alcaloïdes est la désamination et la
décarboxylation, comme le présente le schéma suivant
(Aniszewski, 2007).
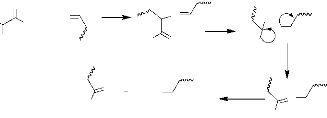
O
OH
NH2
+ O N
HO O
-CO2
H
N
H
O
H
H2N
N
H
Schéma 2 : Mécanisme
général de la biosynthèse des alcaloïdes
+H2O
Pour ce qui est des alcaloïdes quinoléiques qui
retiennent notre attention, en raison du fait que la quasi-totalité des
alcaloïdes isolés du genre Mostuea sont de cette classe,
leur biosynthèse suit le mécanisme général
précédent avec comme précurseur le tryptophane 60
comme l'indique le schéma 3 ci-dessous.
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 24
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
COOH

O
NH2
60
64
N
Tryptophane
O
N
H
Camptothecin
N
O
NH2
61
H
HO N
H
N
OH
HO
N
H
H3CO
N
Cinchonidine
NADPH
N
Décarboxylation
62
O
OH
Tryptane
N
H
Secologanine
O
O
Strictosamide
N
H
H
H
H OGly
N
H
N
O
Pumiloside
H
H OGly
H
H3CO2C
Strictosidine
H
OGly
NH
N
H
OH
N
66
Cinchonamine
N
H
H
N
H
OH
HO
N
H
N H H CHO
H
Corynantheal
H
NADPH
O N
H
N
OH
H
N
H
N
NADPH
NADPH
H3CO
70
Cinchonine N
O
63
69
65
67
68
72
71
Quinkline
Schéma3: Biosynthèse des
alcaloïdes quinoléique (Aniszewski, 2007)
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
| 


