I.1.2 Elucidation de la structure GB5 ;
Le composé GB5 précipite sous forme d'aiguille
de couleur rose dans le mélange Hex/AcOet 70%. Soluble dans le DMSO et
aussi dans l'eau. Il répond positivement au test de Molish,
caractéristique des sucres.
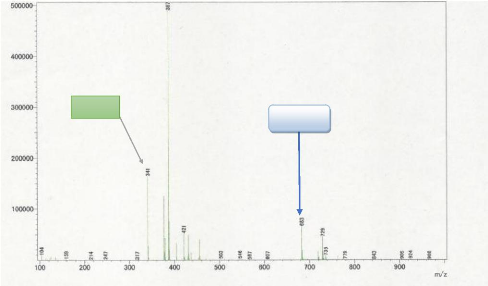
Son spectre de masse ESI en mode négatif
présente le pic de l'ion pseudomoléculaire [M-H].+.
à m/z=341 d'intensité relative égale à 31,91 ; donc
l'analyse à haute résolution nous a permit d'attribuer la formule
brute C12H21O11 , par conséquent GB5 pour formule brute
C12H22O11 comportant deux degrés d'insaturation.
[M-H]+.
[2M-H]+.
Figure 11 : Spectre de masse ESI du
composé GB5
Son spectre de RMN 13C (DMSO-d6
;125MHz) complètement découplé large bande
fait ressortir 12 signaux de carbone correspondants aux 12 atomes de carbone
présents dans la formule brute. L'analyse de ces signaux au moyen des
techniques HSQC et DEPT fait ressortir :
Deux carbones anomériques l'un quaternaire à
äC 104,1 et l'autre tertiaire à äC 91,78/ äH 5,18
suggérant que notre sucre est un dimère non symétrique
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 40
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 41
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
3 méthylènes à SC 60,5/SH 3,37 ; SC 62,1 /
SH 3,56 ; SC 62,1/SH 3,46. l'indiquant
que l'un des monomères possède un cycle à
cinq tandis que l'autre sera à six.
Le reste étant les sept signaux des méthynes
hybridés sp3 tous oxygénés.

Carbone quaternaire sp3
Figure 12 : Spectre carbone large bande
du composé GB5
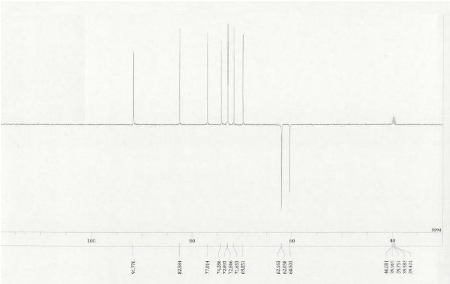
Figure 13:Spectre DEPT du
composé GB5
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
H1
C 1
Figure 14:Spectre HSQCdu composé
GB5 élargit

Groupements O-H entre äH= 4 à 5 ppm
Figure 15:Spectre HSQC du composé
GB5
Le spectre HSQC nous permet également de
déterminer les hydrogènes (non échangeables à l'eau
lourde) à leurs carbones respectivement, comme l'illustre les figures
ci-dessous :
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 42
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
5'-H
3'-H 4'-H 6'-H 3-H 2-H 4-H
3-C et 5'-H
2-C
3'-C
4-C
6'-C
Figure 16: Corrélations HSQC du
composé GB5
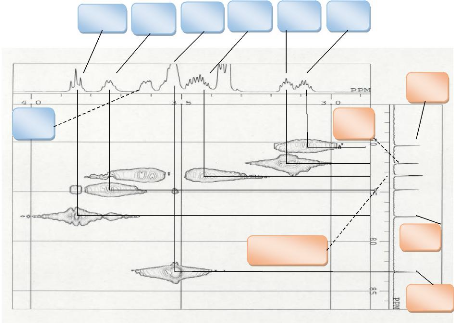
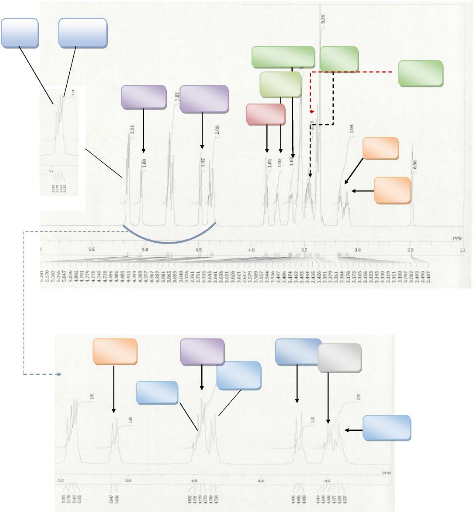
L'analyse de son spectre de RMN 1H fait apparaitre
plusieurs signaux intégrants au total 22 protons associés aux 22
protons de la formule brute. Le spectre étant enregistré dans le
DMSO-d6 à une fréquence de 500,16 MHz. Le spectre HSQC
nous permet de distinguer les protons échangeables à l'eau
lourde, confirmant ainsi l'attribution de la formule brute.Nous pouvons
observer sur ce spectre :
Les protons des hydroxyles à S= 4 à 5 (exception
pour le proton anomerique)
Les protons des méthynes entre S= 3 à 4
Les attributions peuvent être observées sur les
figures ci-dessous.
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 43
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
1-H
4'-OH
2-OH
2-OH
1'-OH
2'-OH
3-OH
4-OH
3'-H
5'-H-5H 4'-H
2'-OH
6-OH
3-H
2-H
6'-OH
4-H
1'-H
Figure 17: Spectre
RMN1H
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 44
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
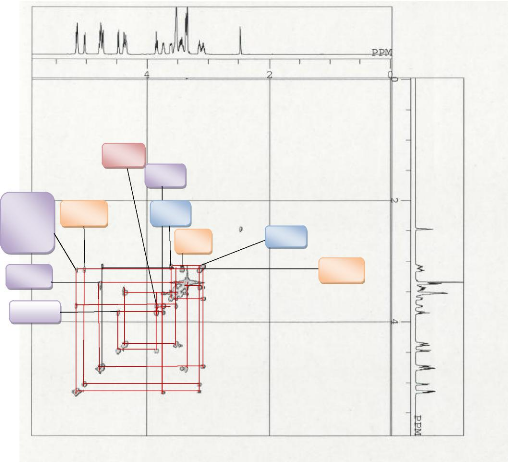
Son spectre COSY est difficilement exploitable compte tenu des
valeurs identiques de la plupart des constantes de couplage. Cependant quelques
corrélations ont pu être exploitées comme la
présente les figures ci-contre.
H-1
Et
4'-OH
3-OH
2'-OH
2-OH
3'-H
4'-H 5'-H
3-H
4-H
2-H
Figure 18 :Spectre COSY du composé
GB5
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 45
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
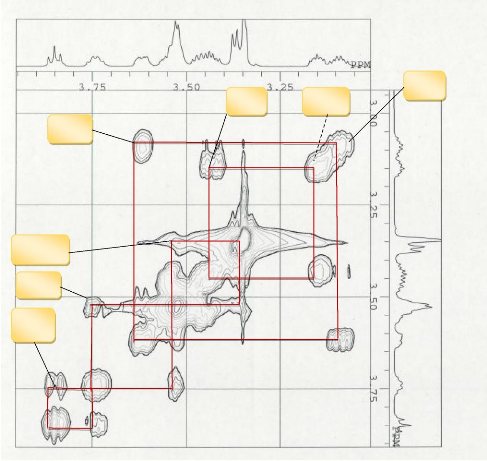
H6-H6'
4'-H
5'-H
5-H
3-H
2-H
4-H
Figure 19:Spectre COSY élargit du
composé GB5
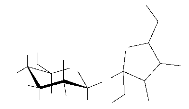
La structure GB5 a été établit d'une part
par comparaison de ses données spectrales à celle décrit
dans la littérature par Naoki et collaborateur et d'autre part au fait
que le seul dimère possible en C12 ayant 3 méthylènes et 2
insaturation n'est autre que le sucrose. La structure suivante étant
celle du saccharose ; elle a été proposée pour le
composé GB5, elle est la forme de transport qui permet les mouvements
des glucides entre les différentes zones de synthèse,
d'utilisation et de mise en réserve dans la plante.
Le spectre est difficilement exploitable parce qu'il a
été enregistré à 25°C, pour obtenir un spectre
de bonne résolution un enregistrement à 90°C serait
recommandé selon Noaki et collaborateurs.
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 46
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 47
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
H
HO
HO
O
O
OH
H OH
HO OH
H
H
HO
Schéma 8: structure du
sucrose
Tableau 7 : Données spectrales de
RMN 1H (DMSO-d6 ; 500MHz) et de RMN 13C (DMSO-d6 ; 125MHz) du composé
GB5
Positions 1H (ppm) [nH, m, J (Hz)] 13C en
ppm
|
1
|
H
|
5,18 (1H)
|
92,1
|
|
2
|
H
|
3,17 (1H, m)
|
71,7
|
|
3
|
H
|
O
OH H
3,474 (1H,m)
|
72,8
|
|
4
|
H
|
3,09 (1H, m)
|
70,0
|
|
5
|
H
|
3,62 (1H, m)
|
82,6
|
|
6
|
H
|
3,54 (2H, d, 5Hz)
|
62,1
|
1'
|
H
|
3,38 (2H, d, 6Hz)
|
62,2
|
2'
|
/
|
/
|
104,1
|
3'
|
H
|
3,87 (1H, t, 8Hz)
|
77,0
|
4'
|
H
|
3,751 (1H, q, 9Hz)
|
74,3
|
5'
|
H
|
3,641(1H, m)
|
72,9
|
6'
|
|
H
|
3,57 (2H , d, 5Hz)
|
62,1
|
|
|
Positions
|
1H en ppm [nH, m, J (Hz)]
|
13C en ppm
|
|
2
|
O-H
|
5,04 (1H,d, Hz)
|
71,7
|
|
3
|
O-H
|
4,78 (1H, d, 5Hz)
|
72,8
|
|
4
|
O-H
|
4,74 (1H, d, 5Hz)
|
70,0
|
|
6
|
O-H
|
4,41 (1H,t, 5Hz)
|
62,1
|
|
1'
|
O-H
|
4,80 (1H, t, 6Hz)
|
62,2
|
3'
|
O-H
|
4,49 (1H, d, 5Hz)
|
77,0
|
4'
|
|
O-H
|
5,16 (1H, d, 4Hz)
|
74,3
|
|
|
6'
|
O-H
|
4,37 (1H, t, 5Hz)
|
82,6
|
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 48
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
| 


