CHAPITRE II :
RESULTATS ET DISCUSSION
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 28
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 29
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
I. EXTRACTION ET ISOLEMENT DES COMPOSES
Les racines de Mostuea batesii ont été
récoltées le 3 février 2014 au Mont Eloundem dans la
localité de Mbankomo (Région du Centre Cameroun).
Après découpage, séchage et broyage,
1,048 Kg de poudre obtenue a été extraite à froid par
macération au méthanol pendant 48 h, ce qui a permis d'obtenir
après filtration et évaporation du solvant, 90 g d'extrait brut
de couleur marronne foncée.
La chromatographie sur colonne de gel de silice de cet extrait
dans le système Hexane/acétate a conduit à l'isolement de
5 composés indexés de GB1 à GB5. Dans la suite de cette
présentation, nous allons élucider la structure de deux d'entre
eux à savoir : GB1 et GB5.
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)

Racines de Mostuea batesii
Découpage Séchage Broyage

1,048 Kg de poudre
Extraction au MeOH
CC sucessives sur gel de silice dans le mélange Hexane
/Acétate

GB4
GB3
GB5
GB1
GB2

90 g d'extrait brut
Poudre résiduelle
Schéma4:Protocole d'extraction et
d'isolement des composés GB à partir des racines de
Mostuea batesii
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 30
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
I.1 Elucidation des structures de deux des composes
isolés
I.1.1 Elucidation de la structure de GB1
Le composé GB1 précipite sous forme d'aiguille
de couleur blanche dans le mélange Hex/AcOEt 45%. Soluble dans le DMSO,
il répond positivement au test de Dragendorf et de Valser-Mayer,
caractéristiques des alcaloïdes.
Son spectre de masse ESI en mode positif présente le
pic de l'ion pseudomoléculaire [M+H].+ à m/z=349 ;1
d'intensité relative égale à 54,5 Compatible avec la
formule brute C20H17O4N2, par conséquent GB1 a pour formule brute
0H16O4N2 et renferme de ce fait 14 degrés d'insaturation.
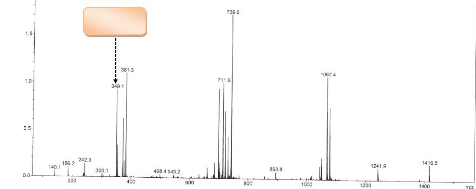
[M+H ]+.
Figure 4 : Spectre de masse ESI du
composé GB1
Son spectre de RMN 13C (DMSO -d6; 125MHz)
complètement découplé large bande fait ressortir 20
signaux correspondant aux 20 atomes de carbones présent dans sa formule
brute. L'analyse de ces signaux au moyen des techniques HSQC et DEPT met en
exergue:
> 3 méthylènes hybridés
sp3à äC 30,3/äH 1,92 ; äC 50,3/ äH 5,27;
à äC 65,3/ äH 5,41 ;
> 1 méthyle à äC 7,8/ äH 0,88 ;
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 31
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 32
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
? 6 méthynes à SC 131,6 /SH 8,67 ;SC 127,9 /SH
8,23 ;SC 127,7 /SH 7,84 ;SC=130,4 /SH 7,86 ;SC=128,5/ SH 8,28 ; SC 96,7 /SH
7,68 ; tous hybridés sp2
Parmi les dix signaux restant correspondant aux carbones
quaternaires, neuf sont hybridés sp2 parmi lesquels : deux
carbonyles des esters et des amides respectivement à SC 172,5 ; SC 156,9
; et un carbone hybridé sp3oxygené à SC
72,4.
L'ensemble de ces données indiquent que le
composé GB1 possède un squelette de base de type camptothecine,
qui est un alcaloïde quinoléique. (Long-Ze et al., 1990 ;
Jin-Rui et al., 1999)
O
N
N
O
OHO
Schéma 5 : Squelette de la
camptothecine
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 33
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)

5C= 172,5
C=O
5C= 156,9
a
c
b
Figure 5 : Spectre carbone large bande du
composé (c) DEPT 90 (a), DEPT 135 (b) de GB1
Son spectre RMN 1H fait apparaitre un ensemble de
signaux constitués :
D'un système de 4 protons appartenant à un noyau
aromatique orthodisubstitué constitué de deux doublets à
5=8,13 et à 5 = 8,18; de deux triplet à 5=7,84et à 5=7,86
;
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 34
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
D'un singulet de proton échangeable à l'eau
deutérée à SH 6,52 correspondant à un proton
alcoolique, qui compte tenu de son déplacement, serait
chélaté.
De deux singulets de méthylène à S 5,41
et à SH 5,27 fortement déblindé d'une part par un
hétéroatome et d'une autre part par le cône d'anisotropie
magnétique.
Un système d'un triplet de trois protons à S
0,88 et un doublet de quadruplet de deux protons à SH 1,92 correspondant
au groupement éthyle lié à un carbone quaternaire.
Au regard des déductions obtenus à partir du
spectre carbone, il ressort que le groupement hydroxyle de l'alcool et
l'éthyle sont à positionner sur le squelette de base. Nous y
sommes parvenu par comparaison de nos données spectrales à celle
décrit dans la littérature. Ce qui nous a permis de positionner
le groupement OH et éthyle sur le même carbone (C-20). La
structure du compose GB1 est :
10
9
8
7
6
4
5
N
O
16a
16 17
15
20 O
21
O O
H
11
12
13
N
1
2 3
14
18
19
Schéma 6 : Squelette de la
camptothecine
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
Les infomations spectrales décrites ci-dessus nous ont
permis de proposer GB1 la structure suivante qui est celle de la camptothecine,
composé anticancereux dont les données de RMN 13C ont
été publiées pour la première fois par Long-Ze en
1990. L'attribution du spectre proton est représenté dans la
figure ci-dessous.
H 12
H 14
H 10
H 11
H 7
H-O
H 17 H 5 H 19
H 9
H 18
Figure 6: Spectre RMN 1Hdu
composé GB1
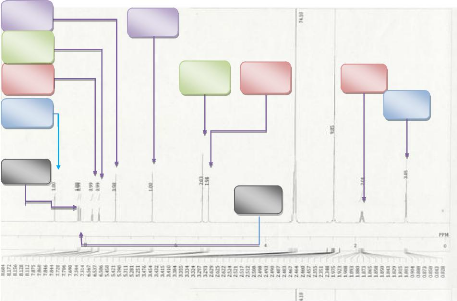
L'analyse du spectre HSQC nous permet d'attribuer les protons
non échangeables à l'eau deutérée et permet, de ce
fait, de localiser le proton alcoolique comme le décrit les spectres
suivants.
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 35
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 36
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)

Proton aloolique H 20
Figure 7 : Spectre HSQC du
composé GB1

H 19
H 18
C 18
|
Figure 8:Spectre HSQC élargi du
composé GB1
|
C 19
|
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)

H 7
H 14
C 14
C 7
Figure 9: Spectre HSQC du
composé GB1
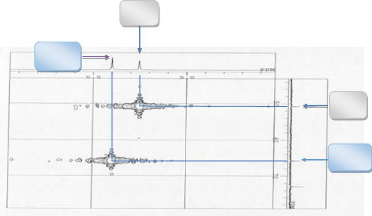
H 17
H 5
C 17
C 5
Figure 10:Spectre HSQC du composé
GB1
Le composé GB1 a été identifié
comme étant la camptothecine, isolée pour la première fois
du genre Mostuea par Jin Rui et collaborateurs, montrant ainsi
l'apport des alcaloïdes dans la chimiotaxonomie. Les corrélations
observées sont représentées dans le schéma
ci-dessous.
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 37
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 38
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)

O
H
O
H
H
H
H
H H H
9
6
4
H
10
N
8
7
5
H
16a
O
H
H
H
11
12
13
N1 2 3
16
17
14
15
O
H
H
H
20
21
18 19
Schéma 7:
Corrélations H-H sur la camptothecine
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
Tableau 6 : données spectrales de
RMN 1H (DMSO-d6, 500MHz) et de RMN 13C
(DMSO-d6 ; 500 MHz)
|
Positions
|
1H en ppm [nH, m, J
(Hz)]
|
13C en ppm (m)
|
*13C
|
|
1
|
/
|
/
|
/
|
|
2
|
/
|
152,6 (s)
|
153,9
|
|
3
|
/
|
147,5 (s)
|
146,2
|
|
4
|
/
|
/
|
/
|
|
5
|
5,27 (2H,s)
|
50,3(t)
|
51,4
|
|
6
|
/
|
129,8(s)
|
130,9
|
|
7
|
8,67 (1H,s)
|
131,6 (d)
|
133,3
|
|
8
|
/
|
129,0 (s)
|
129,9
|
|
9
|
8,13 (1H, d, 8Hz)
|
127,9 (d)
|
129,7
|
|
10
|
7,84 (1H, t, 8,8Hz)
|
127,7 (d)
|
129,1
|
|
11
|
7,86 (1H, t, 8,8Hz)
|
130,4 (d)
|
131,9
|
|
12
|
8,18 (1H, d, 8 Hz)
|
128,5 (d)
|
129,8
|
|
13
|
/
|
150,0 (s)
|
149,6
|
|
14
|
7,33 (1H,s)
|
96,7 (d)
|
101,5
|
|
15
|
/
|
147,9 (s)
|
149,2
|
|
16
|
/
|
119,1 (s)
|
122,0
|
|
16a
|
/
|
156,9 (s)
|
168,3
|
|
17
|
5,41 (2H, s)
|
65,3 (t)
|
67,8
|
|
18
|
0,88 (3H, t, 8Hz)
|
7,8 (q)
|
8,4
|
|
19
|
1,92 (2H, dq, 8 Hz)
|
30,3 (t)
|
33,9
|
|
20
|
/
|
72,4 (s)
|
79,1
|
|
6,52 (1H,s)
|
Proton alcoolique
|
|
|
21
|
/
|
172,5 (s)
|
171,1
|
*C données 13C de la littérature
dans chloroforme deutéré (Jin-Rui et al.,
1999)
MEMOIRE PRESENTE ET SOUTENU PAR TCHAPO D. C. EMAR Page 39
Constituants chimiques des racines de Mostuea batesii
Baker (Loganiaceae)
| 


