Chap. II
Matériel
et
Méthodes
II- Matériel et méthodes 8
1.Description des prélèvements 8
2.Méthodes utilisées 8
a-Calcimétrie 8
b-Dosage du carbone organique total (COT) 8
c-Traitement des échantillons meubles ou faiblement
indurés 8
d-Paramètres déterminés à l'issue du
tri 9
Chap. H : Matériel et Méthodes
II- Matériel et méthodes
1. Description des prélèvements
· Environ 3/4 des échantillons
récoltés sont marneux ou marno-calcaires, donc faiblement
indurés. Pour ces échantillons, un prélèvement
d'environ 500 g a été réalisé approximativement
tous les cinq mètres, parfois plus (par exemple faute d'affleurements),
parfois moins, notamment en cas de variations d'apparence significatives.
Chacun d'entre eux a bien entendu été prélevé
après 'rafraîchissement' de la zone de prélèvement
(afin d'éliminer les zones altérées), puis placé
dans un récipient approprié et numéroté
correctement.
· Le reste des échantillons,
représenté surtout dans la partie finale de la coupe, est
constitué de calcaire induré. Afin de pouvoir réaliser par
la suite des lames minces, un petit bloc de roche a été
dégagé et collecté.
· De plus, dans tous les niveaux fossilifères,
parfois très riches, nous n'avons pas manqué de récolter
de nombreux fossiles, qui ont été également soigneusement
numérotés.
2. Méthodes utilisées
a- Calcimétrie
Le taux de carbonate de calcium contenu dans les
échantillons a été évalué au moyen de la
méthode classique du calcimètre de Bernard. En comparant le
volume de CO2 dégagé par l'échantillon (sur lequel
quelques mL d'acide chlorhydrique ont été versés) à
celui qui serait dégagé par une quantité donnée de
calcite pure, il est possible de déterminer très simplement la
quantité de CaCO3 contenue dans l'échantillon analysé.
b- Dosage du carbone organique total (COT)
Il s'agit de rechercher, dans un échantillon
donné, le carbone ayant une origine organique (y compris donc le carbone
des os, des tests ou des coquilles), désigné par le sigle COT (ou
'TOC' en anglais). L'analyse se fait sur un échantillon broyé et
préalablement décarbonaté, à l'aide d'un
pyrolyseur, dans notre cas de type LECO IR212 (mesures réalisées
au laboratoire de Tectonique de l'Université Paris VI - Jussieu).
c- Traitement des échantillons meubles ou
faiblement indurés Pour tous les échantillons, trois
étapes principales ont été suivies :
1- Trempage :
L'échantillon (environ 100g) est mis à tremper
pendant une nuit dans de l'eau (chaude de préférence, la
réaction étant plus rapide et plus complète)
additionnée d'eau oxygénée (environ une cuillère
à soupe pour chaque échantillon).
Cette procédure est cependant souvent insuffisante pour
les échantillons les plus indurés (en général
riches en carbonate de calcium). Ceux-ci sont alors soumis, après ajout
de cristaux de sel, à un ou plusieurs cycles
congélation-décongélation : l'action du gel permet en
général de désagréger convenablement le
sédiment.
2- Lavage :

Les échantillons marneux, devenus complètement
malléables après l'étape de trempage, sont lavés au
travers de deux tamis (1), l'un de maille grossière (2 mm), et le second
de maille très fine (0.063 mm) Au final, les échantillons sont
donc débarrassés de leurs éventuels résidus
grossiers (notamment des fragments de fossiles) et de leur fraction
limono-argileuse.
Pour éviter les contaminations malencontreuses entre
échantillons, les tamis sont imprégnés avec un colorant
(ici du bleu de méthylène) qui permettra, lors de l'étape
ultérieure de tri, de repérer les 'intrus' (évidemment
colorés en bleu). Après un lavage méticuleux, le
résidu du tamis fin est mis à sécher à l'air
libre.
3- Tri :

(4)
(5)
Une fois l'échantillon parfaitement sec, l'étape
finale du tri peut débuter, et c'est là que commence
véritablement enfin le travail du micropaléontologue.
Après avoir étalé quelques mg de sédiments sur un
'plateau de tri'(2) (dans notre cas un simple carton peint en noir), le travail
minutieux de tri se fait sous l'objectif d'une loupe binoculaire') : les
microfossiles repérés sont soigneusement triés un à
un à l'aide d'une 'aiguille montée'('>, puis placés,
idéalement, dans une 'cellule de microfaune'"), sorte de boîte
miniature munie d'un couvercle.
Afin de pouvoir réaliser des études
statistiquement viables, un minimum de 200 individus doit être
isolé. Patience et longueur de temps doivent donc être les atouts
du micropaléontologue : en effet, le tri d'un seul échantillon
exige entre 2 et 5 heures (cette durée est fonction notamment de la
quantité de microfossiles présents, de leur taille, de leur
état de conservation...).
d- Paramètres déterminés à
l'issue du tri
Lors du tri, les microfossiles identifiés ont
été comptabilisés (jusqu'à atteindre un total
de 200 environ) et regroupés par populations. Nous avons
ainsi pu différencier (tableau 1):
les foraminifères benthiques (B), parmi lesquels nous
distinguerons les foraminifères benthiques calcaires (BC) et ceux
agglutinés (BA),
les foraminifères planctoniques (P), parmi lesquels nous
distinguerons les foraminifères planctoniques globuleux (PG) et ceux
carénés (PC),
les ostracodes (0).
Les rapports entre les valeurs obtenues donneront des
indications sur les paléoenvironnements (ce sera l'objet du chapitre
suivant). En plus de ces comptages, nous avons également
évalué :
- la diversité spécifique :
Nous parlerons de population peu, moyennement ou très
diversifiée (il est difficile cependant de déterminer
précisément la richesse spécifique, au vu de la
difficulté parfois grande pour la détermination exacte des
spécimens),
- la richesse en microfossiles :
Exprimé en nombre de microfossiles par gramme de
sédiment trié, ce paramètre ne reflète pas
seulement la richesse (micro)fossilistique réelle, mais dépend de
plusieurs facteurs, dont notamment la qualité du lavage (meilleur il
aura été, plus les fossiles seront concentrés dans le
résidu), la proportion en éléments fins (silts et argile),
éliminés lors du lavage, l'induration du sédiment (un
sédiment induré sera évidemment moins bien trié
qu'un sédiment tendre) et bien entendu la qualité du tri et
l'expérience du micropaléontologue.
Remarque : Pour déterminer la richesse
réelle, il aurait fallu peser précisément
l'échantillon avant et après lavage (pour ainsi évaluer
avec exactitude la proportion de fraction fine éliminée), ce qui
n'a pas été fait lors de cette étude.
|
--.
rn
.,?....)
N
o
;.-
,E2,
rn
k
e
t2
ts
4q
|
Foraminifères benthiques (B)
Vivent sur le fond, fixés ou non, enfouis dans le
sédiment (endobionte) ou à la surface (épibonte). Leur
abondance diminue progressivement en s'éloignant du littoral. Les
espèces benthiques sont beaucoup plus répandues que les
espèces planctoniques (actuellement seules 70 des 4000 espèces
vivantes décrites sont planctoniques)
|
Foraminifères benthiques calcaires
(BC)
Pourvus d'un test calcaire secrété par l'animal,
et
abondants dans les zones les plus superficielles (ex :
Nodosaria, Lagena...)
|
|
Foraminifères benthiques agglutinés =
arénacés (BA) :
Pourvus d'un test d'origine exogène, constitué
de
particules captées dans le milieu environnant. Sont
présents à toutes les profondeurs, mais sont les seuls qui
subsistent à de grandes profondeurs. Leur abondance relative augmente
donc avec l'approfondissement (ex : Ammodiscus, Textularia ...)
|
|
. e
Foraminifères planctoniques
(P)
Flottent librement dans la tranche d'eau, et sont
présents aussi bien près des côtes qu'au large. Leur
abondance relative augmente cependant avec l'approfondissement, en
rapport avec la moindre proportion d'organismes benthiques
présents dans les plus grandes profondeurs.
|
Foraminifères planctoniques globuleux (PG)
Vivent à proximité de la surface (ex :
Heterohelix, Hedbergella ...)
|
|
Foraminifères planctoniques
carénés (PC)
Formes plus complexes, munies d'une carène, vivant
à de plus grandes profondeurs (ex : Globorotalia,
Rotalipora...)
|
|
--,
rn rn
2
et N
rd ' 'è)
|
Ostracodes (0)
Groupe d'arthropodes crustacés, dont la taille peut
aller jusqu'à 10 mm. Vivent dans tous les milieux aquatiques, et sont
généralement benthiques, endobiontes (donc enfouis dans le
sédiment) ou épibiontes (sur le sédiment). Certains sont
pélagiques (et munis d'appendices servant à la nage).
L'étude des populations d'ostracodes donne de précieuses
indications en terme de paléoenvironnement (bathymétrie,
salinité notamment).
|
Tableau 1 : Type de microfossiles
observés.
La détermination de ces différents
paramètres, et surtout l'étude de leur variation, va nous
permettre d'obtenir des informations sur l'évolution des
paléoenvironnements, chacune des populations distinguées
étant spécifique d'un environnement particulier (voir l'exemple
des foraminifères en figure 6).

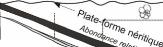

Foraminifères planctoniques
épipélagiques ...Cm.;.kigglbgr_gg!!K.11.Mugreliz)
Pet?)
·
Foraminifères planctoniques
pe,s,
E
·11F- .4e mo- à ues
ee/ce,_
'9,9 (exés
Globorotabathypélagilia.
Rotaliqpora)
n
"tee"
----
50 oeb, al ) thj,
Diversité maximale des foraminifères calcaires
benthiques
Diversité maximale des foraminifères
agglutinés
* N.M = niveau marin
N- M"
100 m
Figure 6 : Relation entre profondeur du milieu et type
de foraminifères présents
(modifié d'après
Brasier, 1980).
Chap. III
Résultats
et
Interprétations
|
a
|
|
|
III -- Résultats et interprétations
|
12
|
1. Généralités
|
12
|
a-Historique des travaux existants
|
12
|
b-Aperçu général sur le monde au
Crétacé moyen
|
12
|
c-Le log stratigraphique
|
14
|
2. Résultats
|
16
|
a-Les fossiles
|
16
|
b-Aspects minéralogiques et géochimiques
|
21
|
c-Résultats du tri des microfossiles
|
23
|
d-Etude des lames minces
|
45
|
3. Interprétations
|
|
52
|
|
|
a-Axe Biostratigraphie
|
52
|
|
b-Axe Paléoenvironnement / Paléogéographie
|
54
|
|
c-La crise cénomano-turonienne
|
62
|
|
d-Le passage Vraconnien-Cénomanien
|
65
|
|
e-Questions en suspens
|
66
|
| 


