II.1.2. Méthode
Plusieurs méthodes peuvent être utilisées
pour déshydrater l'éthanol parmi lesquelles nous pouvons citer :
l'ajout de réactifs déshydratant (tels que la chaux, la baryte,
le glycérol,...), la déshydratation sous vide, la
déshydratation extractive, la déshydratation par entrainement
azéotropique. Dans le présent travail, nous avons opté
pour la déshydratation par ajout de la chaux (CaO) à cause de sa
mise en oeuvre aisée, le faible coût du réactif et sa
possibilité à être réutiliser.
La quantité de CaO devant réagir avec l'eau
(H2O) est fonction du pourcentage d'eau contenue dans l'éthanol.
Soit `x' cette quantité (en kg) et `y' la fraction de
l'eau contenue dans l'éthanol. Partant de la réaction chimique de
la déshydratation par la CaO, on a :
H2O + CaO ? Ca(OH)2
0,018???? H2O + 0,056???? CaO ? 0,074???? Ca(OH)2 En
supposant que 1 litre d'eau pèse 1kg, on peut écrire :
Pour tenir compte de certaines incertitudes dues aux mesures,
à la qualité de la chaux et autres, il est
préférable de prendre `x' avec un excès de quelques
grammes.
Pour évaluer la masse d'un échantillon
(méch) donnée on prendra,
??é??h = ????????é?? - ????é??h????
(II. 2)
Le mode opératoire utilisé pour obtenir les
carburants E10 et E15 est le suivant :
1°) Placer le CaO (chaux vive) dans un bécher et le
chauffer à 120°C dans une étuve jusqu'à obtenir une
masse constante comme on peut le voir sur la figure II-1;
CaO dans un bécher Dessiccateur

Balance scout Pro
Figure II-1. Pesé de la CaO avant mélange
à l'éthanol
19
2°) Après qu'il soit refroidi (dans un dessiccateur),
le mélanger à l'éthanol, tel qu'illustré sur la
figure II-2, afin de le déshydrater. ;

Figure II-2. Chargement de la CaO dans le ballon afin de le
mélanger à l'éthanol
3°) Agiter puis laisser reposer (pendant 24 heures)
jusqu'à ce que le CaO puisse absorber toute l'eau contenue dans l'alcool
(figure II-3) ;

Figure II-3. Mélange Cao + éthanol
4°) Filtrer à l'aide d'un papier filtre (par
gravité ou par filtration sous vide) (figure II-4)
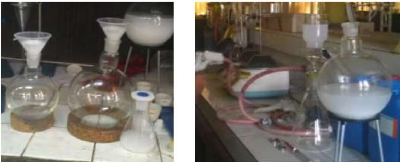
Figure II-4. De gauche à droite: Séparation
simple (par gravité) et Séparation sous vide
Se référant à la figure II-4, lors de
la filtration par gravité le mélange est simplement versé
dans un entonnoir sur lequel le papier filtre est enroulé et
l'éthanol descend à compte-goutte dans le ballon par
gravité. Le désavantage est qu'il dure plus longtemps et
occasionne plus des pertes par évaporation. Pour la filtration sous vide
une pompe à vide est utilisée pour faciliter l'extraction. La
pompe peut être manuelle ou électrique. Lorsqu'elle est manuelle
elle demande un grand effort physique. Nous avons utilisé
successivement ces différentes méthodes.

5°) Distiller l'éthanol filtré à
l'aide d'un rotary-évaporateur comme sur la figure II-5.
Ethanol recueilli après distillation
Evaporateur Heidolph
Figure II-5. Distillation dans l'évaporateur
rotatif
6°) Placer dans un pied gradué puis vérifier
le taux d'alcool à l'aide d'un alcoolimètre tel que
présenté sur la figure II-6.

Figure II-6. Vérification du taux d'alcool à
l'aide d'un alcoolimètre
Le taux d'alcool doit être supérieur à
99%. En dessous de ce pourcentage on ne peut pas faire le mélange. Il
faut alors reprendre les opérations jusqu'à obtenir le
pourcentage d'alcool acceptable.
7°) Mélanger l'alcool obtenu à l'essence
dans les proportions volumiques
souhaitées. La figure II-7
présente successivement cette étape de mélange.

20
Figure II-7. De gauche à droite : Mesure du volume de
l'essence avant mélange, Mélange de l'éthanol à
l'essence et Stockage du carburant obtenu
Les carburants obtenus (E10 et E15) sont ensuite
stockés dans des récipients (bidons) avant leur utilisation sur
le banc d'essai. Les récipients doivent être hermétiquement
fermés afin d'éviter toute perte ainsi que toute contamination
par la vapeur d'eau présente dans l'atmosphère. Des
échantillons de ces carburants sont également
prélevés pour l'analyse des paramètres physico-chimiques
dont les résultats sont présentés dans le dernier
chapitre.
21
| 


