4. Méthodes
4.1. Protocole expérimental
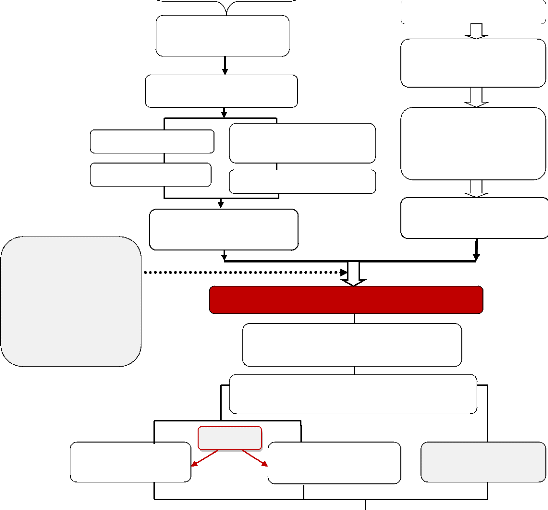
Les étapes de l'expérimentation sont
résumées dans la figure 2
|
E. coli ATCC 25922
|
|
E. coli de laboratoire
|
Bentonite de Maghnia
|
Repiquage sur gélose
Mac Conkey
Ré-Identification
Tamisage à 40 ?m
Stérilisation de la
bentonite à
1100C / 1h
Test microscopique
Test macroscopique
Tests biochimiques classiques
Galerie API 20E
Préparation d'une
solution mère (100 g
/1L)
, et agitation pendant
2h
Préparation des dilutions
de 10/0 à
100/0
Standardisation McFarland 0.5
Antibiogramme
Méthode des disques de diffusion sur
gélose
Préparation des
disques à partir de
papier
wattman
imbibés dans les
différentes
dilutions
remplaçants les
disques d'antibiotiques
Témoins
Des disques
d'antibiotiques
Ensemencer l'E.coli sur la surface de la gélose MH puis
l'ajout :
Ne rien ajouter (ni ATB ni argile)
Des disques argileux
Calcule de CMI
Figure 2 : Protocole expérimental
Chapitre II Matériel et
méthodes
Page | 9
4.2. Ré-identification des souches
4.2.1. Repiquage des souches d'Escherichia coli
Cette opération consiste d'abord à
prélever quelques colonies d'E.coli à partir de ses
milieux et à procéder ensuite à l'ensemencement des boites
de pétri contenant le milieu de culture Mac Conkey :
· Refroidir et maintenir à 44-47 °C
· Couler en boîtes de Pétri stériles
· Laisser solidifier sur une surface froide
· Ensemencer l'E.coli à la surface des
boîtes afin d'obtenir des colonies isolées par la méthode
des stries serrées. Enfin, les boites sont incubées dans
l'étuve à 37 C° pendant 24h.
- Les colonies lactose-positif présentent une
coloration rouge et sont entourées d'un halo de sels biliaires
précipités. Les colonies lactose-négatif sont incolores
(Faure, 2010). (Annexe 1).
4.2.2. Tests d'identification d'Escherichia coui
I. Etude morphologique
I. 1. Examen macroscopique
Cet examen permet de déterminer la forme, la taille,
pigmentation, contour, aspect et viscosité des colonies sur boîte
de Pétri par une observation visuelle (Mami, 2013) ;
L'aspect des colonies dépend du milieu, de la durée et
la température d'incubation.
I. 2. Examen microscopique I. 2.1. Examen à
l'état frais
- Principe
Cet examen nous permet d'apprécier la forme, la
mobilité, le mode de regroupement, et l'abondance de notre
bactérie.
- Mise en oeuvre
· Déposer aseptiquement sur une lame porte objet,
quelques gouttes d'eau physiologique.
· Prélever à l'aide d'une anse de platine
stérile une à deux colonies à partir du milieu contenant
de la gélose nutritive.
· Emulsionner dans la goutte d'eau physiologique.
· Recouvrir d'une lamelle tout en évitant la
formation des bulles d'air.
· Observer sous microscope optique grossissement
(×40).
Chapitre II Matériel et
méthodes
Page | 10
- Lecture
A l'issu de cet examen microscopique, on peut observer la
forme, le mode de regroupement et la mobilité des souches
(Labiod, 2016).
I. 2.2. Coloration de Gram - Principe
La coloration de Gram est une technique qui permet de mettre
en évidence les propriétés de la paroi bactérienne.
Elle permet de colorer les bactéries et de distinguer leur aptitude
à fixer le violet de gentiane (Gram+) ou la fuchsine (Gram-). Cette
opération se déroule en sept étapes.
-Mise en oeuvre
Réaliser un frottis sur une lame de microscope
à partir d'une suspension bactérienne, agiter la suspension afin
de l'homogénéiser et d'éviter d'avoir un culot au fond du
tube.
· Etaler une goutte de la suspension bactérienne sur
une lame propre.
· Procéder à la fixation du frottis en
faisant passer la lame trois fois dans la flamme du bec bunsen.
· Plonger La lame pendant une minute dans le violet de
gentiane, puis rincée à l'eau
déminéralisée.
· Etaler le Lugol et laisser agir une minute puis rincer
à l'eau. Cette étape à pour but de stabiliser la
coloration violette.
· Verser goutte à goutte de l'alcool sur la lame
inclinée obliquement. Surveiller la coloration (15 à 30
secondes). Le filet doit être clair à la fin de la
décoloration. Rincer avec de l'eau.
- Si l'alcool pénètre dans la bactérie,
la coloration au violet de Gentiane disparait. Les bactéries donc sont
de type Gram-, si l'alcool ne traverse pas la paroi, on est en présence
de bactéries Gram+.
· Réaliser une contre coloration avec de la
fuchsine : laisser agir 30 secondes à une minute, laver doucement
à l'eau déminéralisée. Sécher la lame entre
2 feuilles de papier buvard.
Enfin, observer à l'objectif à immersion (X100)
après dépôt d'une goutte de l'huile de cèdre.
- Lecture :
Les bactéries Gram+ apparaissent en violet
foncé, tandis que les bactéries Gram- sont colorées en
rose (Labiod, 2016).
Chapitre II Matériel et
méthodes
Page | 11
II. Etude biochimique
II. 1. Recherche des enzymes respiratoires
II. 1.1. Test de la catalase -Principe
La catalase est une enzyme ayant la propriété
de décomposer le peroxyde d'hydrogène (H2O2) avec
dégagement d'oxygène selon la réaction suivante :
(Labiod, 2016).
- Mise en oeuvre
· Déposer sur une lame de verre une ou deux gouttes
d'eau oxygénée.
· Prélever à l'aide de l'effilure de pipette
pasteur un fragment de colonies et dissocier la culture dans l'eau
oxygénée.
- Lecture
La présence d'une catalase se traduit en quelque
seconde par la formation de bulles d'oxygène (Labiod,
2016).
II. 1.2. Test d'Oxydase -Principe
Ce test permet de mettre en évidence la
phényléne diamine oxydase ou cytochrome oxydase des
bactéries à partir de leur culture en milieu
gélosé. Le réactif utilisé est un
dérivé N-méthylé du paraphénylène
diamine (composé réduit incolore) qui, en présence de
l'enzyme, est oxydé et libère un composé rose
violacé (forme oxydée semi-quinone), noircissant à l'air.
La recherche de l'oxydase est un des critères les plus discriminatifs et
les plus employés pour l'identification des bactéries, surtout
celle des bacilles à Gram négatif en particulier pour
Escherichia coui (Hennia, 2016).
-Mise en -oeuvre
Une goutte de suspension bactérienne à
étudier a été déposée à l'aide d'une
pipette Pasteur stérile sur un disque pré- imprègne du
N-diméthylparaphénylene diamine
-lecture
Si le papier demeure incolore au bout de quelques secondes la
bactérie est alors oxydase négative par contre si le papier
devient violet la bactérie est considérée comme oxydase
positive (Essodolom, 2016).
| 


