|
ÊíÈÚÔáÇ
ÊíØÇÑÞãíÏáÇ
ÊíÑÆÇÓÌáÇ
ÊíÑìåãÌáÇ
íãáÚáÇ
ËÍÈáÇ æ
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ
|
|
Mustapha Stambouli University of Mascara
ÑÜßÓÚã
áíæÈãØÓÇ
ìØÕã
ÉÚãÇÌ
Faculty of Nature and Life Sciences
ÉÇíáÍÇ æ
ÉÚíÈØáÇ
ãæáÚ Éíáß
Department of Biology
ÇíÌæáæíÈáÇ
ãÓÞ
MEMOIRE DE MASTER
Domaine : Sciences de la Nature et de la Vie
Filière : Biologie
Spécialité : Biotechnologie
microbienne
Thème
Isolement et identification Acetobacter aceti
à partir
d'un vinaigre biologique.
Présenté par : Ouis Nadjet
& Semcha Mouna. Devant le jury composé de
:
Président Examinateur Encadrant
CoEncadreur
Mmed. BenYelles Mirvette. Mmed. Belgharbi Asmaa
Remarque : Ce mémoire a été
préparé dans les conditions liées à la
pandémie du COVID-19
Année Universitaire : 2019/2020

Remerciements :
Mes remerciements vont tout d'abord à Allah.
Le tout puissant qui nous avons dirigés et soutenu notre
pas et nous avons tout donné afin de
réaliser ce travail. Il
notre particulièrement agréable d'exprimer toute
nos.
reconnaissances et gratitude ainsi que nos vifs remerciements à
:
? Med Ben Yelles. M. notre encadreur pour
avoir réalisé ce travail et pour ses
orientation et ses précieux conseils.
o Tous les enseignants qui nous ont enseigné, depuis le
primaire jusqu'au Supérieur.
o Et enfin à tous ceux qui de près ou de loin
ont contribué à la réalisation de ce
modeste travail, qu'ils trouvent à travers ce document
l'expression de nos infinie
gratitude puisse le seigneur de les combler de
tous ses bienfaits.
J'ai le grand honneur de dédier ce modeste travail
:
À mes chers parents : ma mère Moktaria, Fadila et mon
père Ben Isa et Beb Yahya,
pour leur aide et ceux qui m'ont toujours
encouragé.
À mes frères : Mostapha, Amine, Nourdine,
Abd Elkhader, Grisi, Ali,
Miloud, que dieu le tout puissant l'accueille en
son vaste
paradis.
À mes soeurs : Khaira, Hanane.
À Tous
mes oncles et toutes mes tantes et mes cousins(es).
À toute la
famille, surtout famille : Nechar, Ouis et
. A toutes mes amies (Wafaa,
Mouna, Halima, Chiema, Fatima,
Kawtar, etc......).
A toute mes
collèges étudiant de la promotion de Master
Biotechnologie
microbienne 2020/2021.
A toute personne qui occupe une place dans mon
coeur.
NADJET

Dédicace
A l'aide de dieu. Le tout puissant ce travail est
achevé. Je dédié à :
-La bougie de ma vie, la fleur de mes jours, mon adorable
mère "Saida" qui veille avec
amour et tendresse à notre
instruction.
-L'homme qui sacrifié sa vie pour notre
éducation, mon support de ma vie, qui ma appris,
ma supporté
et ma dirigé mon cher père "Abd el majid".
-mes frères "Fouad,Yasser",mes soeurs "Imene, Achouak,
Ritedj», mes soeurs en dieu "Amira,Ines,Fatima" et je leurs souhaite un
avenir radieux plein de réussite et que dieu leurs donne une longue et
joyeuse vie.
-mon fiancé "Zineddine" qui ne pas cessé de me
conseiller, encouragé et soutenu tout au long de mes études que
dieu le protège et leur offre la chance et le bonheur.
-Sans oublier mon binome "Nadjet" pour son soutien moral, sa
patience et sa compréhension tout au long de ce travail.
-Je dédié aussi ce travail à toute ma
famille "Semcha,Ferdjallah".
-A Tout la promotion BM.
-A tout qui m'aide de pré ou loin pour la
réalisation de ce travail.
Liste des figures
Figure n°01 : Schéma d'un tonneau
préparé pour l'acétification selon le
procédé
d'Orléans p05
Figure n°02: Schéma de
l'acétification à biomasse fixée sur des copeaux
dehêtre............p05
Figure n° 03:Datte et noyau du palmier
dattier p12
Figure n° 04 : Phoenix dactylifera L
p13
Figure n° 05 : Carte de répartition
géographique du genre Phoenix dans le monde p16
Figure n°06: Répartition de la
superficie de la palmeraie algérienne p16
Figure n°07: Stades d'évolution de
la datte p17 Figure n°08: Les importants changements
pendant le développement des dattes .........p17
Figure n°09 : Production de la datte en
Algérie p19
Figure n°10 : Classification de dattes
selon leurs consistances .........p21
Figure n°11 : Composition de la datte
...p22
Figure n°12 : Classification des dattes
.p22
Figure n°13 : Technologies des dattes
..p24
Figure n° 14: Conception d'un schéma
de production traditionnelle du vinaigre p27
Figure n °15 :Evolution de la production de
vignoble p31
Figure n° 16:Protocole expérimentale
de fabrication de vinaigre p34
Figure n°17:Les coproduits issus du marc de
raisin .p35
Figure n°18 : Schéma qui
représente les différents types des valorisations et des
transformations du raisin p37
Figure n°19: Micrographie
électronique à balayage d'Acetobacter acet............
.......p39
Figure n°20 : La micrographie
électronique à balayage d'Acetobacter
aceti.....................p41 Figure n°21 :
Morphologie d'Acétobacter
aceti...............................................p43
|
Figure n°22: L'oxydation de
l'éthanol par les bactéries acétiques
|
..p47
|
|
Figure n°23:Protocole de fabrication du
vinaigre par une double fermentation
|
.p59
|
|
Figure °n24: Protocole expérimentale
de la double fermentation
|
p59
|
Figure n°25: Résultats de la mesure
de l'humidité des l'échantillon étudiés A : raisin,
B :
datte .....p70
Figure n°26: les
résultats de cd : cendre(%) et MS : matière sèche(%) des
échantillons (D :
jus de datte, R : jus de raisin, VD : vinaigre de datte, VR:
vinaigre de raisin) ...p71
Figure n°27 Résultats des MS des
échantillons A:Datte (D), B: Raisin (R) après
incinération.
..p71
Figure n°28: Conductivité (CE) et
T° des sels des échantillons (D : Datte, R : Raisin, VD :
Vinaigre de datte, VR: Vinaigre de raisin) p72
Figure n°29: Les résultats du taux
d'O2 dans les échantillons (D : Datte, R : Raisin, VD :
Vinaigre de datte, VR: Vinaigre de raisin) p73
Figure n°30 : Les résultats d'indice
de réfraction (IR) des échantillons (D : Jus de datte, R :
Jus de raisin, VD : Vinaigre de datte, VR : Vinaigre de raisin)
..p74
Figure n°31: Résultats de la
densité de vinaigre des dattes (VD) et vinaigre de raisins
(VR) p76
Figure n°32: Aspect macroscopique de
l'isolat A1 sur milieu milieu Frateur p86
Liste des tableaux
Tableau 01: Composants du vinaigre p06
Tableau 02: caractéristique
physico-chimiques de l'acide acétique (vinaigre acide) ...p08
Tableau 03: Les concentrations maximales des
contaminants tolérés dans les vinaigres p09
Tableau 04: Classification botanique du palmier
dattier p12
Tableau 05:Composition moyenne pour 100g net de
dattes communes .....p16
Tableau 06 : Production mondiale de dattes
p18
Tableau 07: Principales cultivar de dattes
algériennes et leur aire de culture ....p20
Tableau 08 : Les caractères biochimiques
de quelques groupes d'acétobacters p45
Tableau 09: Présentation du de la
matière végétale (datte) p50
Tableau 10: Présentation du la
matière végétale (raisin) p50
Tableau 11 : Résultats des
caractéristiques morphologiques des dattes et raisins p68
Tableau 12: Teneur en eau des dattes et raisin
P70
Tableau 13 : Les résultats des dilutions
de mesure des sucres totaux des échantillons (D : Jus
de datte, R : Jus de raisin, VD : Vinaigre de datte, VR :
Vinaigre de raisin) p74
Tableau 14: Les résultats de
concentrations d'acide acétique et acide lactique des
échantillons (D : Jus de datte, R : Jus de raisin, VD : Vinaigre de
datte, VR : Vinaigre de
raisin) .....p75
Tableau 15: Résultats de la
viscosité des deux vinaigres . p77
Tableau 16: résultats du dosage d'alcool
par deux méthodes des deux échantillons raisins et
dattes p78
Tableau 17: Résultats des
analyses microbiologiques de la matière première jus de dattes
et
raisins et leurs vinaigres ....p81
Tableau 18:
Condition opératoires de la préparation du vinaigre de
datte et de raisin par la
méthode
traditionnelle p82
Tableau 19: caractéristiques
organoleptiques des deux vinaigres (datte et raisin) p84
Tableau 20 : les caractères culturaux des
neufs (09) isolats p85
Tableau 21: Résultats obtenus
d'observations de coloration de Gram àG100x p88
Tableau 22:Identification Biochimiques de
différentes souches isolées sur différents
milieux p91
Tableau 23: Tolérance des
bactéries acétiques à différentes
températures (les résultats sont
exprimé en UFC/g « nombres des colonies »)
p97
Tableau 24: Tolérance des bactéries
acétiques à différentes températures (les
résultats sont
exprimé en DO « turbidité ») p97
Tableau 25 : Les résultats de mannitol
-mobilité des neufs (09) isolats p101
Tableau 26: Résultat de l'identification
des espèces et sous espèces p102
Liste des abréviations
% : pourcentage.
AA : acide acétique.
Abs : Absence.
A. gluc : Formation acide gluconique.
ADH : Alcool déshydrogénase.
ALDH : Aldéhyde déshydrogénase
B° : Degré Brix
BA : Bactéries acétique.
Ba : Bactérie.
BL : Bactéries lactique.
°C : Degré Celsius.
Cat : Catalase.
Cell : cellulose.
D : densité.
D : Dattes.
DO : densité optique.
Fig : Figure
g : gramme.
HF : Bouillon HoyerFrateur.
HF+A : HoyerFrateur avec ammonium.
HF-A : HoyerFrateur sans ammonium.
Ind : Indénombrable.
IR : Indice de réfraction.
mS : milli siemens.
NAD : Nicotinamide adénine dinucléotide.
NADP : Nicotinamide adénine dinucléotide
phosphate.
PH : potentiel hydrogène.
P. cét : Pouvoir cétogène.
Pig : Pigmentation.
P.sor : Pouvoir sur oxydant.
R : Raisins.
S : Stérile.
ST : sucres totaux.
TSS : Taux du solide soluble.
V : Variable.
VD : Vinaigre des dattes
VR : Vinaigre des raisins.
Table des matières
Remerciement Liste des figures Liste des tableaux Liste des
abréviations
Introduction générale 01
Partie I
Synthèse bibliographique
Chapitre I : Généralité sur le
vinaigre traditionnel des dattes
|
I.1. Historique
I.2.Définition
Les méthodes de fabrication :
|
04
04
|
|
? Dans le procédé « d'Orléans »
|
05
|
|
? Dans le procédés « Schutzenbach »
|
05
|
|
? Le procédé en culture submergée
|
05
|
|
I.3.Composition du vinaigre
|
06
|
|
I.4. Principe chimique de fabrication du vinaigre
|
.06
|
|
1.4.1. Fermentation alcoolique
|
06
|
|
1.4.2. Fermentation acétique
|
07
|
|
I.5. Différents types de vinaigres
|
.08
|
|
I.6. Importance économique du vinaigre
|
08
|
|
1.7. Réglementation
|
08
|
|
I.8.Utilisations du vinaigre
|
09
|
|
I.8.1. Les vertus thérapeutiques du vinaigre
|
09
|
|
I.8.2.Utilisation en cuisine
|
10
|
|
I.9.Microbiologie de vinaigre
|
10
|
|
II. Vinaigre de datte
|
.11
|
|
II.1.Généralités sur le palmier dattier
|
11
|
|
II.2. Définition et stades phénologiques
|
.12
|
|
II. Taxonomie
|
12
|
|
II.3 Nom vernaculaire et synonyme
|
.13
|
|
II. Exigences écologiques du palmier dattier
|
..14
|
II. Répartition géographique du palmier dattier
14
II. Dans le monde 14
II. En Algérie 15
II.3.Composition biochimique des dattes 15
II.4.Stades d'évolution 17
II.5. Production des dattes dans le monde et en Algérie
18
II.5.1. Production des dattes dans le monde 18
II.4.2. Production de la datte en Algérie 19
|
II.4.Principales variétés cultivées
|
.19
|
|
II.5.Classification
|
20
|
|
II.5.1. Dattes molles
|
20
|
|
II.5.2. Dattes demi-molles
|
21
|
|
II.5.3. Dattes sèches
|
21
|
|
II.6. Technologie des dattes et sa valorisation
|
.23
|
|
II.7. Transformation des dattes
|
.23
|
|
II.7.1. Pâte de datte
|
23
|
|
II.7.2 .Farine de datte
|
23
|
|
II.7.3. Sirop de datte
|
23
|
|
II.7.4. Sucre de datte
|
24
|
|
II.7.5 .Alcool
|
24
|
|
II.8. Valorisation des rebuts de dattes
|
25
|
|
II.9. Vinaigre traditionnel des dattes
|
25
|
|
II.9.1. Cultivars utilisés pour la production du vinaigre
traditionnel
|
26
|
|
II.9.2. Fabrication du vinaigre traditionnel par proposition
d'amélioration
|
|
|
(Technique de double fermentation spontanée)
|
26
|
|
III. vinaigre du raisin
|
28
|
|
III.1. La vigne
|
..28
|
|
III.2. Histoire et caractérisation du raisin
|
29
|
|
III.3. Systématique
|
29
|
|
III.4. Importance de la viticulture
|
29
|
|
III.4.1. Dans le monde
|
.29
|
|
III.4.2. En Algérie
|
....... ......30
|
|
III.5. Petite analyse de la situation de la viticulture en
Algérie
|
31
|
|
III.5.1. Avantages de la viticulture
|
32
|
|
III.5.2. Superficie viticole totale
|
. 32
|
|
III.5.3. La production totale de raisin
|
....32
|
|
III.5.4. Total de variétés homologuées
|
33
|
|
III.6.Perspectives de la viticulture en Algérie
|
33
|
|
III.6.1.Orientations pour le développement de la vigne
à raisins de table
|
33
|
|
III.6.2.Orientations pour le développement de la vigne
à raisins secs
|
33
|
|
III.6.3.Orientations pour le développement de la vigne de
transformation
|
33
|
|
III.7.Vinaigre traditionnelle de raisin
|
..34
|
|
Chapitre II : Acetobacter aceti
|
|
|
II.1.Historique de la microbiologie des bactéries
acétiques
|
38
|
|
II.2.Généralité
|
38
|
|
II.3.Ecologie
|
38
|
|
II.4. Structure du génome
|
39
|
II.5. Classification
|
39
|
|
II.5.1. Classification d'Acetobacter
aceti....................................................40
II.5.2- Taxonomie
|
...41
|
II.6. Facteur de croissances des bactéries
acétiques
|
|
41
|
|
|
II.6.1-L'acide acétique
|
...41
|
|
II.6.2-Oxygène
|
.41
|
|
II.6.3-Température et pH
|
...42
|
|
II.6.4.-Concentration d'éthanol
|
42
|
|
II.6.5- Lumières
|
42
|
|
II.7.Caractères généraux des
bactéries acétiques
|
..42
|
|
II.7.1-Caractères culturaux
|
.42
|
|
II.7.2-Caractères morphologiques et structuraux
|
...43
|
|
II.8.Caractères biochimiques
|
.43
|
|
II.8.1. Transformation de l'alcool en acide acétique
|
.43
|
|
II.8.2. Réaction de la catalase
|
43
|
|
II.8.3-Pouvoir cétogène
|
44
|
|
II.8.4-Transformation du glucose en acide gluconique
|
.44
|
|
II.8.5. Production de cellulose
|
45
|
|
II.9. Caractère physiologique
|
45
|
|
II.10.Besoins nutritionnels
|
46
|
|
II.11.Métabolisme
|
..46
|
|
II.12.Mécanisme biochimique de formation d'acide
acétique
|
46
|
|
II.13.Interactions microbiennes
|
48
|
|
II.14.Patholog1ie
|
48
|
Partie II : Etude expérimentale
I. Matériels et Méthodes
|
I.1.Objectifs de l'étude
|
50
|
|
I.2. Lieu de l'étude
|
..50
|
|
I.3. Matériel et méthodes
|
50
|
|
I.3.1 Matériel végétale (date et raisin)
|
50
|
|
I.3.2. Méthodes
|
51
|
|
I.3.2.1. Analyse morphologiques et organoleptique des dates
|
51
|
|
I.3.2.2. Analyse physicochimique de la datte
|
51
|
|
I.3.2.2.1.Détermination du pH
|
..51
|
|
I.3.2.2.2.Détermination de la teneur en eau
|
.52
|
|
I.3.2.2.3. Détermination de la teneur en cendres
|
..52
|
|
I.3.2.2.4. Détermination de la matière organique
|
.53
|
|
I.3.2.2.5. Détermination de la conductivité
électrique et la salinité
|
53
|
|
I.3.2.2.5.Détermination de la teneur d'oxygène
|
54
|
|
I.3.2.2.6. Détermination du taux de solides solubles
« TSS ou Brix »
|
54
|
|
I.3.3. Analyse morphologiques et organoleptique des raisins
|
..54
|
|
I.3.3.2. Analyse physicochimiques du jus de raisins
|
54
|
|
I.3.3.2.1.Analyse des sucres
....54
|
|
|
I.3.3.2.2. Dosage d'acidité titrable
|
..56
|
|
I.3.4. Analyses microbiologiques de la matière
première
|
57
|
|
I.3.4.1.Dénombrement des germes totaux et FMAT
|
.57
|
|
I.3.4.1.Dénombrement des levures et moisissures
|
..58
|
|
I.3.4.2.Isolement des bactéries acétiques
|
..58
|
|
I.3.4.2.Dénombrement des bactéries lactiques
|
58
|
|
I.2.5.Fabrication du vinaigre de dattes et des raisins
|
58
|
|
I.2.6. Evaluation la qualité microbiologique des deux
vinaigres
|
60
|
|
I.2.7. Evaluation de la qualité physico-chimique des deux
vinaigres (dates, raisins)
|
|
|
60
|
|
I.2.7.1. Détermination du pH
|
60
|
|
I.2.7.2.Détermination de la teneur en cendres
|
60
|
|
I.2.7.3.Détermination de la teneur d'oxygène
|
........61
|
|
I.2.7.2.Détermination du taux de solides solubles
«TSS ou Brix»
|
...61
|
|
I.2.7.3.Dosage des sucres totaux
|
.61
|
|
I.2.7.4.Dosage d'acidité titrable
|
61
|
|
I.2.7.5.Détermination de la densité
|
61
|
|
I.2.7.6.Détermination de la viscosité par la loi de
Stokes
|
61
|
|
I.2.7.7. Dosage de l'alcool
|
62
|
|
1.2.8. Analyses microbiologiques
|
63
|
|
1.2.8.1. Technique d'isolements des bactéries
acétiques
|
63
|
|
? Prélèvement de colonies isolées
|
.64
|
|
? Purification des souches
|
..64
|
|
? Conservation
|
64
|
? Congélation 64
1.2.8.2. Identification des bactéries acétiques
64
· Étude macroscopique (l'aspect) des colonies
65
· Étude microscopique 65
o Identification biochimique 65
Pouvoir suroxydant 66
Catalase 66
Pouvoir cétogène 66
Culture en présence d'ammonium comme seule source d'azote
et de 3%
d'éthanol 66
Teste de pigmentation 66
Formation d'acide gluconique à partir du glucose 66
Formation d'acide cétogluconique 67
Teste de cellulose 67
Etude de la tolérance ..67
Etude de la mobilité et l'utilisation de mannitol 67
II. Résultats et discussions
|
II.2.1. Matériels biologiques (végétales)
II. 2.1.1Caractère morphologiques des dattes et des
raisins
II. 2.1.2-Analyses physicochimiques des dattes et raisins et des
deux vinaigres
|
.68
68
69
|
|
·
|
PH
|
69
|
|
·
|
La teneur en eau (humidité)
|
.70
|
|
·
|
Teneur en cendre et matière organique
|
70
|
|
·
|
Conductivité et salinité
|
72
|
|
·
|
Le taux d'oxygène
|
73
|
|
·
|
Dosages des sucres
|
74
|
|
? TSS (degré Brix)
|
74
|
|
? Courbes d'étalonnage
|
.74
|
|
·
|
L'acidité tétrable
|
75
|
|
·
|
Densité
|
76
|
|
·
|
La viscosité
|
77
|
|
·
|
Dosage d'alcool
|
78
|
II.2.1.3. Résultats des analyses microbiologiques des
matières premières (dattes et raisins) et leurs vinaigres
.....81
II.2.2. Essai préliminaire de la formulation du vinaigre
biologique à partir d'une méthode traditionnelle: Application aux
dattes variété « Hmira » et raisin (rouge
autochtone)...........82
II.2.2.1. Caractères organoleptique .....84
II.2.3. Isolement et identification d'Acetobacter aceti
à partir des deux vinaigres 86
II.2.3.1. Etude macroscopique (Caractère culturaux)
86
II.2.3.2. Etudes microscopiques 87
II.2.3.1. Etudes de la tolérance des bactéries
acétiques à différentes températures 97
II.2.3.3.Test Mannitol Mobilité 99
II.2.3.4.Résultat de l'identification des espèces et sous
espèces .102
Conclusion générale ...104
Références bibliographie 105
Annexes 01 Annexes 02 Annexes 03 Annexes 04
[INTRODUCTION GENERALE]
Introduction générale
Page 1
Introduction générale
Les matières premières les plus diverses servent
à la fabrication du vinaigre vin alcool éthylique (vinaigre
blanc), cidre a sucre, malt, vin de palme, dattes, oranges, raisins, lait de
coco.
Selon Espiard (2002), les dattes
abimées peuvent être utilisées en raison de leur forte
teneur en sucres pour la fabrication de vin, alcool ou vinaigre selon leur
état. Actuellement beaucoup de pays s'intéressent aux industries
de transformation des dattes.
L'Algérie est un des principaux pays phoenicicoles. Les
dattes constituent la matière première pour l'élaboration
d'un bon nombre de produits alimentaires, parmi les quels le vinaigre
(Benahmed. D., 2007).
Les produits à base de dattes sont nombreux et
diversifiés: le sucre liquide, les pâtes de dattes, les jus, les
sirops, l'alcool, le vinaigre traditionnel (Ould el hadj,
2001).
La vigne est une plante très anciennement
cultivée par l'homme, si bien que l'histoire de la viticulture se
confond avec l'histoire de l'homme. Elle possède de grandes
facultés d'adaptation aux conditions pédoclimatiques où
elle est cultivée dans les régions chaudes et également
sous des climats relativement froids. (Reynier, 1989;Galet,
1998).
De nos jours, les vignes couvrent près de 8 millions
d'hectares dans le monde et produisent plus de 67 millions de tonnes de raisins
(Fao stat, 2012).
En Algérie, la viticulture a connu un important
développement, notamment au cours de la dernière décennie.
En effet la superficie du vignoble algérien est passée de50000
hectares en2000 à plus de 70000 en 2012 (Alem Etsouri,
2014), elle est aussi dotée d'un patrimoine viticole
très diversifié constitué, hormis les cépages
classiques, d'un grand nombre de variétés autochtones
réparties essentiellement en zone de montagnes (Agouazi,
2013).
On fait remonter à plusieurs milliers d'année
à la découverte du vinaigre. La fabrication du vin remontre
à plus de 10.000 ans. On peut imaginer que la production du vinaigre est
aussi ancienne, puisqu'il s'agit en fait d'une maladie du vin. Le vinaigre est
décrit dans la bible et il constitue une matière première
utilisée par les alchimistes. Les romains aussi
développèrent son utilisation comme boisson additionnée
d'eau ou D'un mélange d'eau et d'oeufs. Etymologiquement de vin et
aigre, c'est du vin rendu aigre par développement de bactéries.
Par extension est appelé vinaigre tous produit obtenu par fermentation
acétique de boissons ou
[INTRODUCTION GENERALE]
Introduction générale
Page 2
de dilution alcoolique. La plupart des vinaigres sont
fabriqués à partir d'alcools divers mélangés
à de l'eau. (Divie C., 1989).
Le vinaigre contient peu de microorganismes lorsqu'il est
prélevé dans de bonnes conditions, il s'agit essentiellement des
levures, des moisissures et des bactéries acétiques
(Giraud, 1998).
Le vinaigre est un liquide préparé à
partir d'une matière appropriée contenant de l'amidon ou des
sucres, selon le procédé biologique de la double fermentation
alcoolique et acétique (Cacqe, 2002).
Les bactéries acétiques sont utilisées
depuis la plus haute antiquité pour la préparation du vinaigre
(Lambine et German, 1969).
C'est dans ce contexte que nous avons réalisé
une étude expérimental sur le thème de recherche et
pré-identification de quelque souche des bactéries
acétiques provenant du
vinaigre biologique des dattes de cultivar Hamira et des
raisins variété Rouge autochtone. Une étude
physico-chimique des matières premières (dattes, raisins) et de
deux vinaigres biologiques qui suivie successivement par des analyses
microbiologiques.
Le développement de ce sujet à été
rendu possible en faisant recourt aux différentes sources d'information,
que se soient écrites comme, les ouvrages, les publications et les
revues ainsi que toutes sources d'informations électroniques, qui
s'inscrivent dans la thématique du sujet de notre mémoire. Pour
une question d'organisation nous avons articulé notre travail au tour de
quatre chapitres dont :
Le premier, porte sur une étude bibliographique sur le
vinaigre biologique des dattes et des raisins. Le second, porte sur une
étude bibliographique sur les bactéries acétiques plus
essentiellement Acetobacter aceti. Le troisième, est
consacré pour le matérielle et la méthodologie de travail.
Dans le quatrième, se présente les résultats et la
discussion. Et enfin nous avons terminé notre étude par une
conclusion générale de ce travail.
Notre objectifs principalement c'et l'isolement des souches
des Acetobacter à partir d'un vinaigre biologique qui produire
à partir d'un valorisation des dattes et des raisins (vinaigre).
Notre région est connue par la variétés et
la déverséfier des cultures des vingt.
Page 4
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
I.1. Historique
Le vinaigre malgré son apparence banale est loin
d'être sans intérêt reconnaissable à son odeur es on
goût piquant. Ce liquide possède une longue histoire qui date de
plus de 5000 ans.
Sa découverte est intimement liée à la
fabrication de vin dont le vinaigre tire son origine.
En effet, le vin exposé à l'air pendant une
certaine période se transformera naturellement en liquide au goût
acide : c'est la naissance du vinaigre ou du « vin- aigre ».En 1822,
le Botaniste Persoon, reprenant les idées de Fabroni et de Chaptal,
attribue la production de vinaigre au voile qui se transforme à la
surface du vin laissé à l'air libre. Croyant être en
présence d'un champignon, il lui donne le nom de Mycoderma aceti
(Hyperlink, 2005).
Cependant, il faudra attendre Pasteur et son
célèbre mémoire sur la fermentation acétique
publié en 1864 pour comprendre enfin les véritables
mécanismes de son élaboration. Le vinaigre est simplement le
produit de l'oxydation de l'alcool par l'oxygène de l'air sous l'action
d'un ferment le Mycoderma aceti. Louis Pasteur identifie
scientifiquement les cinq critères indispensables à sa
production.
? Alcool: celui contenu dans le vin, le cidre ou autre boisson
alcoolisée.
? Oxygène: celui de l'air fait parfaitement l'affaire.
? Ferment: Mycoderma aceti, en fait une bactérie
qu'on renommera Acetobacter aceti.
I.2.Définition
Le vinaigre est un produit fabriqué par fermentation
acétique de vin ou alcool. Il est utilisé comme condiment ou
comme agent de conservation en raison de son acidité (pH=3). Dans la
législation française, la dénomination (vinaigre) est
réservée aux produit obtenue par la fermentation acétique
de boissons ou dilution alcoolique et referment au moins 6% d'acide
acétique (décret du 28 juillet 1908 modifié par le
décret du 28 mars 1924). La fabrication de vinaigre est due aux
bactéries acétiques (Acetobacter). Les méthodes
de fabrication sont variées :
Page 5
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
? Dans la procédé « d'Orléans »
; le vin est oxydé dans des tonneaux exposés à l'air .Il
se forme un voile de bactéries acétiques. Le soutirage du
vinaigre et l'addition de vin se font par le font du récipient.
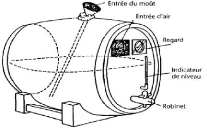
Figure n°01 : Schéma d'un tonneau
préparé pour l'acétification selon le
procédé d'Orléans (Bourgeois et Larpent,
1996).
? Dans le procédés « Schutzenbach » ;
le vin ruisselle dans des colonnes contenant des copeaux de chêne qui
fixent les bactéries acétique.
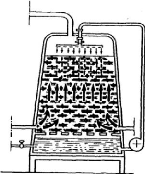
Figure n° 02: Schéma de
l'acétification à biomasse fixée sur des copeaux de
hêtre (Bourgeois et Larpent, 1996).
? Le procédé en culture submergée
s'effectue dans des fermenteurs munis d'un système d'aération
forcée (Acetator ; Cavitator).
Tous les procédés de production de vinaigre
utilisent des flores mixtes d'Acetobacter.
Aux niveaux analytiques, le vinaigre subit rarement l'analyse
microbiologique. Il peut cependant être intéressant
d'étudier la nature de la flore active ou éventuellement
Page 6
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
contaminante: les contaminants les plus gênants sont des
levures et des bactéries oxydant l'acide acétique
(Guiraud, 2012).
I.3.Composition du vinaigre
Le principal constituant du vinaigre est l'acide
acétique. Les composés secondaires, tel que l'acide tartrique,
l'acide succinique et les matières azotées, proviennent de la
matière première utilisée, des nutriments ajoutés
au milieu réactionnel et de l'eau de dilution (Follman,
1983).
Par contre, d'autres composés se forment au cours de la
fermentation acétique (produits de fermentation) ou bien
résultent de l'interaction des composant entre eux, tel que
l'acétate d'éthyle qui contribue à la flaveur du vinaigre
(Boughnou, 1988).
Tableau 01: Composants du vinaigre
Composition
Alcool résiduel 0.5 %
Acétate d'éthyle
|
Vinaigre
|
Composés volatils
|
|
Butylène
|
|
|
Glycérol
Acétone
I.4. Principe chimique de fabrication du vinaigre
La fabrication du vinaigre biologique repose sur une double
fermentation : 1.4.1. Fermentation alcoolique
Provoqué par les levures (essentiellement des
saccharomyces), cette fermentation intervient dans la fabrication du vin, de la
bière, du cidre et de diverses boisson fermentées. Son but est
essentiellement la production d'éthanol, mais de nombreux produits
intervenant dans les qualités organoleptiques sont aussi formés.
Il se constitue fréquemment des alcools supérieurs à
partir d'acides issus de la désamination d'acides aminés contenus
dans le milieu.
Page 7
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Il y a aussi formation d'acide gras, aster, d'aldéhydes
et de cétones. La teneur en alcool assure la stabilité du produit
dans les conditions de stockage apportées. Les souches et les techniques
utilisées varient d'un produit à l'autre (Guiraud,
2012).
1.4.2. Fermentation acétique
Elle intervient dans la fabrication du vinaigre et est due aux
Acetobacter. Cette fermentation nécessite une très forte
aération. L'alcool est « respiré » en acide
acétique. Les bactéries acétiques n'interviennent que si
la teneur en éthanol est faible.
Leur action peut être favorisées par intervention
de levure qui oxyde l'éthanol et font donc baisser sa concentration
(« mère de vinaigre »). Il existe différent es
techniques de fabrication : la plus ancienne se fait en tonneaux avec une large
surface d'exposition à l'aire. D'autres font intervenir un ruissellement
de la solution alcoolisée sur une garniture contenant les
bactéries. D'autres enfin font intervenir des fermenteurs industriels
fortement aérés et agités (Acetator). Le vinaigre est un
produit stabilisé par son PH ; il est utilisé comme conservateur
(Guiraud, 2012; Aka,et al .,2021)
Page 8
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Tableau 02: caractéristique
physico-chimiques de l'acide acétique (vinaigre acide)
(Brewdusud, 2004)
|
Acide acétique
|
Point de
fusion (°C)
|
Masse
volumique (Kg/m3)
|
Point
d'ébullition
(°C)
|
Pression de vapeur(Pa)
|
Solubilité (eau)
|
CHO-COOH 16.6 1.0492 117.9 11 Miscible
I.5. Différents types de vinaigres
On distingue différents types de vinaigre, le vinaigre
d'alcool le vinaigre de cidre , le vinaigre de vin, le vinaigre de glucose, le
vinaigre de betteraves(Clavet, 1992; Grelon, 2005). Le
vinaigre de malt (Bouaziz, 2008), le vinaigre de petit lait,
le vinaigre de riz, vinaigre balsamique, le vinaigre de thé
(Grelon, 2005).
I.6. Importance économique du
vinaigre
La production mondiale annuelle du vinaigre est estimée
à plus de 1600 million de litres. Depuis 1974, la production a peu
évolué (Bourgeois et al., 1996).
D'après certaines recherches, le vinaigre serait un des
aliments les plus sains au monde et reconnu très tôt pour ses
étonnantes propriétés bienfaisantes (Anonyme,
2007).
1.7. Réglementation
Selon le Journal officiel de la République
Algérienne (J.O.R.A.2002, N° 34, 2) : La teneur
totale en acide exprimée en acide acétique des vinaigres de vin
est fixée au minimum de 50 grammes par litre. Cette teneur est au
minimum de 50 grammes par litre pour les autres vinaigres. La teneur totale en
acide des vinaigres ne doit pas dépasser la quantité que l'on
peut obtenir par fermentation biologique. La teneur en alcool résiduel
des vinaigres exprimée en volume est limitée à :
Page 9
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
· 1 % pour les vinaigres de vin.
· 0,5 % pour les autres vinaigres.
· La teneur minimale en extrait sec soluble à
l'exclusion des sucres, du sel d'ajout est fixée à 1,3 g par 1000
ml pour 1% d'acide acétique pour les vinaigres de vin et à 2
grammes par 1000 ml pour 1% d'acide acétique pour les vinaigres de vin
de fruits.
-Les concentrations maximales des contaminants
tolérés dans les vinaigres sont déterminées comme
suit :
Tableau 03: Les concentrations maximales des
contaminants tolérés dans les vinaigres (JORA
.1998)
Contaminants Concentration ( mg/l)
As 1
Pb 1
Cu + Zn 10
Fe 10
I.8.Utilisations du vinaigre
Le vinaigre peut être utilisé pour ses
différentes vertus : I.8.1. Les vertus thérapeutiques du
vinaigre
L'origine du vinaigre est sans doute aussi ancienne que celle
de vin pour la simple raison que laisser à l'air libre le vin devient
rapidement acide, tourne en vinaigre, son histoire croise celle de vinaigre
d'abord produit thérapeutique, avant d'être condiment. C'est sans
doute le premier antibiotique de tous le temps. En outre les anciens
médecins arabes ont parlé du vinaigre en citant ses effets utiles
et nuisibles pour la santé, il calme les douleurs d'estomac, il est bon
pour la rate, il guérit la jaunisse, il facilite la digestion, il
améliore l'appétit, il calme les
Page 10
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
brûlures, sa consommation abusive affaiblit les nerfset
la vus et il jaunit la teinte du visage et provient les tumeurs
(Koudama,1991)
En plus de son utilisation comme condiment, antioxydant,
conservateur d'aliment, il est aussi utilisé pour soigner plusieurs
maladies et infections tel que les maux de tête et de gorge, la
constipation, les pellicules, les toux, les piqures des insectes, les
brulures... etc. (Sebihi, 1996).
Le vinaigre est un produit thérapeutique, avant
d'être condiment, c'est sans doute le premier antibiotique de tous temps.
Il est utilisé pour calme les douleurs d'estomac, il guérit la
jaunisse, il est bon pour la rate, étanche la soif, il
facilite la digestion, etc (Arab et
Guezzoun, 2003).
I.8.2.Utilisation en cuisine
Le vinaigre ne contient pas de protéines, pas de
matières grasses, pas de vitamine Il sert de condiment. Il permet
d'élaborer vinaigrettes, mayonnaises et moutarde
Le vinaigre est un ingrédient essentiel des marinades.
Les Babyloniens et les Egyptiens s'en servaient comme agent de conservation et
l'aromatisaient avec des herbs.
Il empêche l'oxydation des fruits et légumes. Il
est utilisé dans l'industrie de l'alimentation du bétail pour
tuer les bactéries et les virus avant la réfrigération.
Le vinaigre donne aux plats une saveur aigre-douce
(Dahmani
et.al.,
2009) I.9.Microbiologie de vinaigre
En 1998, Giraud dit que le vinaigre contient
peu de microorganismes lorsqu'il est prélevé dans des bonnes
conditions, il s'agit essentiellement des levures, des moisissures et des
bactéries acétiques.
Page 11
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II. Vinaigre de datte
L'industrie agro-alimentaire génère
d'importantes quantités de déchets qui constituent une nuisance
certaine pour l'environnement. Ces déchets, riches en matières
organiques, peuvent être recyclés et transformés par des
procédés biotechnologiques qui constituent une solution de choix
pour remédier aux problèmes de pollution. La palmeraie
algérienne, qui représente le pivot de l'écosystème
oasien à travers l'importance de sa production, génère
à chaque compagne des quantités importantes de déchets. En
effet, les dattes de part leur grand richesse en sucres, peuvent servir en tant
que matière première en fermentation pour la production de divers
métabolites tels que l'alcool, le vinaigre, l'acide citrique, la
vitamine B12, et d'autre substances énergétiques
(Bedrani.S et al Benziouche ; 2000).

II.1.Généralités sur le palmier
dattier
Le palmier dattier : Phoenix dactylifera L. provient
du mot « Phoenix » qui signifie dattier chez les phéniciens et
dactylifera dérive du terme grec « dactylos » signifiant
doigt, allusion faite à la forme du fruit (Djerbi.,
1994).C'est une espèce dioïque, monocotylédone,
appartenant à la famille des Arecaceae qui compte environ 235 genres et
4000 espèces (Munier., 1973).Le palmier est une
composante essentielle de l'écosystème oasien (Toutain.,
1979), grâce à sa remarquable adaptation aux conditions
climatiques, la haute valeur nutritive de ses fruits, les multiples
utilisations de ses produits (Bousdira et al., 2003 ; Bakkaye.,
2006) et sa morphologie favorisant d'autres cultures sous-jacentes
(EL Homaizi et al.,2002).Comme toutes les espèces du
genre Phoenix, il existe des arbres mâles appelés
communément dokkars ou pollinisateurs et des arbres femelles Nakhla
(CHAIBI., 2002). C'est une espèce arborescente connue pour son
adaptation aux conditions climatiques trop sévères des
régions chaudes et sèches (Bouguederi et al,
1994). En général, les palmeraies algériennes
sont localisées au Nord-est du Sahara au niveau des oasis où les
conditions hydriques et thermiques sont favorables (Ghazi et Sahraoui.,
2005). Le palmier dattier commence à produire les fruits
à un âge moyen de cinq années, et continue la production
avec un taux de 400-600 kg/arbre/an pour plus de 60 ans (Imad et al,
1995).
Page 12
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.2. Définition et stades
phénologiques
La datte est le fruit comestible sucré du palmier
dattier. C'est une baie généralement de forme allongée,
oblongue ou arrondie (Peyront, 2000). Elle est composée
d'un noyau, ayant une consistance dure, entouré de chair
(Espiard, 2002). La couleur de la datte est variable selon les
espèces : jaune plus ou moins clair, jaune ambré translucide,
brun plus ou moins prononcé, rouge ou noire (Munier,
1973). La partie comestible de la datte est constituée d'un
:
- épicarpe ou enveloppe cellulosique fine
dénommée peau.
- mésocarpe généralement charnu, de
consistance et de couleur variables selon sa teneur en sucre et de couleur
soutenue.
- endocarpe de teinte plus claire et de texture fibreuse,
parfois réduit à une membrane parcheminée entourant le
noyau.
La partie non comestible, formée par la graine ou le
noyau, a une consistance dure (Espiard, 2002; Belguedj, 2001).
Le noyau représente 10 % à 30 % du poids de la datte
(Etienne, 2002).
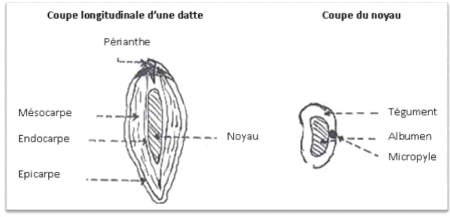
Figure n° 03:Datte et noyau du palmier
dattier (Belguedj, 2001)
II. Taxonomie
Selon (Uhl et Dransfieid., 1987 et Feldman, M.
1976.), le palmier dattier (Phoenix
Page 13
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
dactylifera L.) est une plante Angiosperme
Monocotylédone, classée comme suit : Tableau 04:
Classification botanique du palmier dattier Selon (UHL et
Dransfieid., 1987) :
Embranchement Angiospermes
Groupe Spadiciflores
Famille Arecaceae(Palmaceae)
|
Sous- famille Coryphoïdaea
|
Tribu Phoeniceae
Espèce Phoenix dactylifera L.
Le genre Phoenix comporte au moins douze espèces, dont
la plus connue est dactylifera et
dont les fruits " dattes " font l'objet
d'un commerce international important (Espiard., 2002).
II.3 Nom vernaculaire et synonyme
Palmier dattier (Français), Nakhla (Arabe), Tamar
(Hébreu), Palmadatilera (Espagnol), Palma
daterro (Italien), Manah
(Persan), Tazdait, Tanekht, Tainiout (en Berbère suivant les
régions)
(Tirichine., 2010).

Figure n° 04 : Phoenix dactylifera L
(Bougueraet al., 2003).
Page 14
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II. Exigences écologiques du palmier
dattier
Le palmier dattier est cultivé comme arbre fruitier dans
les régions chaudes arides et semi-
arides. Cet arbre s'adapte
à de nombreuses conditions grâce à sa grande
variabilité (Gilles.,
2000).
Le palmier dattier offre de larges possibilités
d'adaptation, c'est une espèce thermophile qui
exige un climat chaud.
C'est un arbre qui s'adapte à tous les sols. Il est sensible à
l'humidité
pendant la période de pollinisation et au cours de
la maturation (Munier., 1973 ; Ozenda.,
2004).
II. Répartition géographique du palmier
dattier
II. Dans le monde
Le dattier est une espèce xérophile, il ne peut
fleurir et fructifier normalement que dans les
déserts chauds
(Amorsi., 1975).Son nombre dans le monde être
estimé à 100 millions
d'arbres (Ben Abdallah.,
1990). Le palmier dattier fait l'objet d'une plantation intensive
en
Afrique méditerranéenne et au Moyen-Orient.
L'Espagne est l'unique pays européen
producteur de dattes,
principalement dans la célèbre palmeraie d'Elche
(Toutain., 1996).Aux
Etats-Unis d'Amérique, le
palmier dattier fût introduit au XVIII éme siècle. Sa
culture n'a
débuté réellement que vers les
années 1900 avec l'importation de variétés
irakiennes
(Matallah., 2004 ; Bouguedoura., 1991).Le
palmier dattier est également cultivé à plus
faible
échelle au Mexique, en Argentine et en Australie (Matallah.,
2004).
Page 15
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
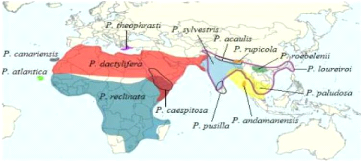
Figure n° 05 : Carte de répartition
géographique du genre Phoenix dans le monde (Munriel
Gros-Balthazard. 2013 ).
II. En Algérie
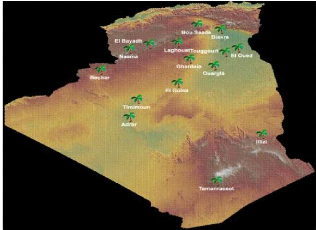
Comme montre la figure I.1, Le palmier dattier est cultivé
dans les régions sahariennes du pays : Ziban (Biskra), Le Souf
(El-Oued), Oued-Righ (M'Ghaïr, Touggourt...), Ouargla, M'Zab
(Ghardaïa), Touat (Adrar), Gourrara (Timimoun), Tidikelt (In-Salah),
Saoura (Béchar), Hoggar-Tassili (Tamanrasset, Djanet). On trouve
également de petites palmeraies dans le sud des Wilayas steppiques
(Tébessa, Khenchella, Batna, Djelfa, Laghouat, M'Sila, Naâma,
El-Bayedh) (Belguedj, 2010).
|
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Figure n°06 : Répartition de la
superficie de la palmeraie algérienne (Omar El
Barnaoui,2010).
Sillon 165.400 ha de Ministère de l'Agriculture, du
Développement Rural 2014. La diversité génétique
est importante. L'inventaire variétal établi par
(Hannachi et al. 1998) sur l'ensemble des oasis
algériennes fait état de 946 cultivars.
II.3-Composition biochimique des dattes
La datte est constituée d'une partie charnue, (chair ou
pulpe) et d'un noyau. C'est un fruit essentiellement énergétique,
(cinq grammes de datte apportent une quantité de calories 4 à 5
fois plus importante que la majorité d'autres fruits. (Munier,
1973).
Tableau 05:Composition moyenne pour 100g net de
dattes communes (Pierre, 1990; Booij et al, 1992)
Composants Quantité (g/100g de dattes
communes)
Glucides 69.0
Protides 2.5
Lipides 0.1
Fibres alimentaires 7.1
Les minéraux et oligoéléments
1.5 à 1.8
70 à 80 dans la datte fraiche et 10 à 40 dans
Eau
la datte sèche
Apports énergétiques 287.0 K
Calories/1200 K Joules
Vitamines ( mg )
Vitamine C 2
Provitamine A 0.03
B1 0.06
B2 0.10
B3 1.7
B5 0.8
B6 0.15
B9 0.028
Page 16
Page 17
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.4-Stades d'évolution
La datte passe par différents stades de
développement avant maturation. Plusieurs auteurs rapportant que durant
les 200 jours après la pollinisation la datte passe par cinq
différents stades d'évolution. Chacun d'eux porte un nom
spécifique qui n'a pas d'équivalent en
français.(Dowson et Aten, 1963 ; Munier, 1973 ; Barreveld,
1993). La terminologie irakienne est celle qui est utilisée en
raison de son adoption en anglais (Nahili, 2006).
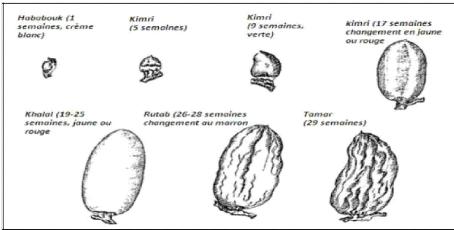
Figure n°07: Stades d'évolution de
la datte (Sawaya et al., 1983).
Page 18
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
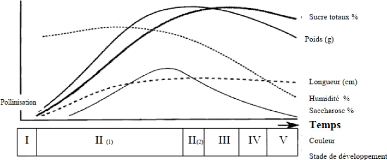
Figure n°08 : Les importants changements
pendant le développement des dattes (Barreveled,
1993).
II.5. Production des dattes dans le monde et en
Algérie II.5.1. Production des dattes dans le monde
La production mondiale des dattes est d'environ 7 millions de
tonnes par année et a plus que doublé depuis les années
1980. Cela place la datte au 5 ème rang des fruits les plus produits
dans les régions arides et semi-arides. D'après
la F.A.O, la production mondiale de dattes est estimée à 7.62
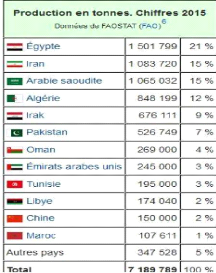
millions de tonnes en 2015. Les principaux pays producteurs de dattes les plus
importants sont : l'Egypte, l'Iran, l'Arabie Saoudite, les Emirats arabes,
l'Irak, le Pakistan et l'Algérie et le Soudan. Selon les données
de la FAO, l'Algérie serait le quatrième producteur mondial de
dattes. Du point de vue quantitatif, la production algérienne
représente 12% de la production mondiale, mais du point de vue
qualitatif, elle occupe le premier rang à la variété
Deglet- Nour, la plus appréciée mondialement (FAO.,
2015).
Tableau 06 : Production mondiale de dattes
(FAO, 2015).
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
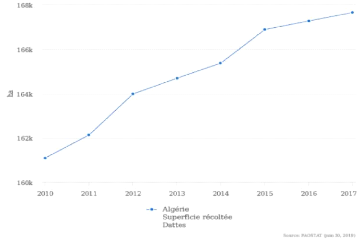
II.4.2. Production de la datte en Algérie
Le graphe suivant représente l'accroissement de la
superficie destinée a la production des dattes entre 2010 et 2017
Figure n°09 : Production de la datte en
Algérie (FAO.STAT 2019). II.4.Principales
variétés cultivées
Page 19
Page 20
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Il existe environ 200 de dattes cultivées en
Algérie qui se différencient par leur qualité
organoleptique et leur appréciation sur le marché
(qualité marchande) (Mehaoua, 2006).
Page 21
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Tableau 07 : Principales cultivar de dattes
algériennes et leur aire de culture (Dubost, 1991).
|
Variétés
|
Consistance
|
Air de culture
|
Utilisation
|
|
Deglet-Nour
|
Demi-molle (T)
|
Bas zabSahara ,M
|
Export tout usage
|
|
Demi Molle (P)
|
Ghars IIdem
|
En pate (patiserie)
|
|
Degla-Beida
|
Sèche (T)
|
Oud righ
|
Farine
|
|
Mech degla
|
Sèche (T)
|
Ziban
|
Farine
|
|
Tante boucht
|
Molle (P)
|
Ourgla ,Mzab
|
En pate
|
|
Tatezuine
|
Demi Molle(P)
|
Ourgla , Mzab
|
Fruit frais
|
|
Bent Keballah
|
Molle(P)
|
Ourgla , Mzab
|
Congelée
|
|
Tadala
|
Molle (N)
|
Mzab , Laghout
|
Fruit frais
|
|
Timjouhert
|
Demi molle (N)
|
Mzab , Gourara
|
Fruit frais
|
|
Hmira
|
Demi molle(N)
|
Touat , Saoura
|
Conservation
|
|
Tegaza
|
Demi molle(N)
|
Tidikelt
|
Vent / Sahel
|
|
Tazerzait
|
Demi molle(N)
|
Sud ouest
|
Vent
|
|
Ouarglia
|
Demi molle(N)
|
Sud ouest
|
Fruit frais
|
|
Tim-nacer
|
Sèche(N)
|
Sud ouest
|
Vent / Sahel
|
|
Taker-boucht
|
Demi molle(T)
|
Touat , Gourara
|
Vent locale
|
|
Ghars
|
Sèche(T)
|
Tout
|
Conservation
|
« P : Précoce (Période de récolte en
fin Août), N : Normale (Période de récolte en Septembre), T
: Tardive (Période de récolte en Novembre) »
II.5-Classification
La consistance ou la texture des dattes varie selon les
cultivars. Selon cette caractéristique, les dattes sont réparties
en trois catégories (Espiard, 2002).
II.5.1/ Dattes molles
L'humidité supérieure ou égale à 30%.
Elles renferment des sucres réducteurs (fructose, glucose) (Ghars,
Hamraia, Litima...etc.).
Page 22
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.5.2. Dattes demi-molles
De 20 à 30% d'humidité, Elles occupent une position
(Deglet-Nour), c'est une datte à base de saccharose par excellence
(Cook et Furr, 1952).
II.5.3. Dattes sèches
Dures, avec moins de 20% d'humidité, riche en saccharose.
Elles ont une texture farineuse (Mech-Degla, Degla Beida...etc.).
Estanove (1990) a classé les dattes selon leur
importance économique(Fig.11).

Figure n°10 : Classification de dattes
selon leurs consistances (Absi, 2010).
Page 23
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
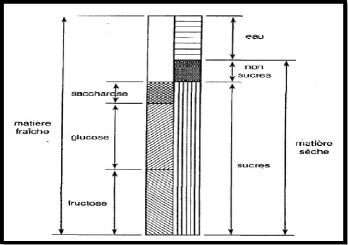
Figure n°11 : Composition de la datte
(Estanove, 1990). On classé les dattes selon leur
importance économique à 3 catégories
- Dattes nobles : destinées à
l'exportation et à la commercialisation à l'échelle
nationale. - Dattes communes: destinées à la
consommation locale ou a l'alimentation du bétail.
- Dattes non consommées:
représentent les cultivars de faible valeur marchante destinés
à l'alimentation animale ou perdues.
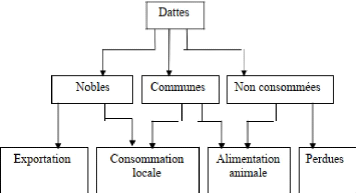
Figure n°11 : Classification des dattes
(Estanove, 1990).
Page 24
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.6. Technologie des dattes et sa
valorisation
La technologie de la datte recouvre toutes les
opérations qui, de la récolte à la commercialisation, ont
pour objet de préserver toutes les qualités des fruits et de
transformer ceux qui ne sont pas consommés, ou consommables, en
l'état, en divers produits, bruts ou finis, destinés à la
consommation humaine ou animale et à l'industrie (Estanove,
1990).
II.7. Transformation des dattes
La datte constitue un substrat de choix pour la production de
nombreux autres produits tels que le jus de dattes (Siboukeur,
1997), l'alcool (Ould El Hadj et al, 2001)...etc.
(Fig.13)
II.7.1. Pâte de datte
Les dattes molles ou ramollies par humidification donnent lieu
à la production de pâte de datte. La fabrication est faite
mécaniquement. Lorsque le produit est trop humide il est possible
d'ajouter la pulpe de noix de coco ou la farine d'amande douce. La pâte
de datte est utilisée en biscuiterie et en pâtisserie
(Espiard, 2002).
II.7.2. Farine de datte
Elle est préparée à partir de dattes
sèches ou susceptibles de le devenir après dessiccation. Riche en
sucre, cette farine est utilisée en biscuiterie, pâtisserie,
aliments pour enfants (Kendri , 1999; Aït-Ameur, 2001) et
dans la fabrication du yaourt (Benamara et al. , 2004; Amellal,
2008).
II.7.3. Sirop de datte
Il est fabriqué à base de dattes saines car il
est important d'éviter tout arrière goût de fermentation.
C'est un produit stable d'une couleur plus ou moins brune qui peut être
utilisé comme un édulcorant (Mimouni, 2015).
Page 25
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.7.4. Sucre de datte
Ce produit est obtenu par concentration et déshydratation
des sirops de dattes pour l'obtention d'un composé solide. Il est de
couleurs plus au moins brune et possède un pouvoir édulcorant
supérieur à celui du glucose (Chelghoum,
2012).
II.7.5 .Alcool
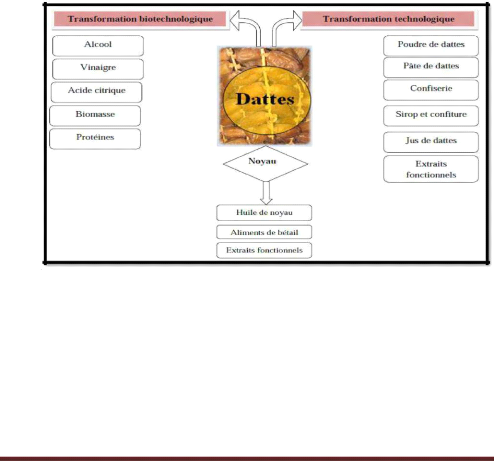
Figure n°13 : Technologies des dattes
(Boukhiar Et Al., 2009).
Selon Ould EL hadj et al (2001) les dattes
constituent un substrat de choix pour la production de l'alcool
éthylique. La fermentation permet d'obtenir de 30 à 34 litres
d'alcool pur pour 100kg de dattes (Espiard, 2002).
Page 26
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.8. Valorisation des rebuts de dattes
Les dattes de faible valeur marchante (attaquées par
les oiseaux, ratatinées...etc.) peuvent être utilisées en
raison de leur forte teneur en sucres pour la production de biomasse
Kendri (1999), ou comme aliments de bétail...etc.)
(Gualtieri et Rappaccini, 1994)
II.9. Vinaigre traditionnel des dattes
Les dattes peuvent être utilisées pour
l'élaboration du vinaigre. Ce dernier a été produit par
culture de la levure Saccharomyces uvarum sur un extrait de datte
(Boughnou, 1988 ; Ould EL hadj et al. 2001; Benamara
et al. , 2007).
De tout temps les populations sahariennes ont eu à
fabriquer localement leur propre vinaigre. Cette production est une tradition
ancestrale qui utilise un matériel artisanal et confère au
vinaigre élaboré des avantages que l'on ne retrouve pas chez le
vinaigre industriel. Le vinaigre est obtenu par la mise en fermentation d'une
mesure de dattes pour deux mesures d'eau, auxquelles sont additionnées,
selon les techniques du savoir-faire traditionnel certaines substances :
blé, orge, Harmel, coriandre, piment, sel de table, clou en fer, charbon
et huile de table. La durée de fermentation est de 40 à 50 jours
(Ould El- hadj et al., 2001).
Après parage, triage et lavage des dattes, à une
mesure de datte est ajoutée deux mesures d'eau du robinet. Au
mélange ainsi obtenu, est additionné selon les habitudes
traditionnelles des zones de production divers produits en faible proportion,
parmi lesquels : grain de blé (7 grains), grains d'orge (7 grains),
Harmel (7 grains), coriandre (7 grains), quelques pincées de piment,
quelques pincées de sel de table, un ou deux clous en fer en fonction de
la quantité du produit.... Le mélange est mis en fermentation
durant quarante à cinquante jours à la température
ambiante, dans une gargoulette ou jarre bouchée avec du gypse ou avec du
lif de palmier, laissant un microtrou d'aération. Ce temps
écoulé, la jarre ou le récipient est
débouché. Il est procédé au tamisage. Le produit
ainsi obtenu est le vinaigre traditionnel (Ould El-hadj et al. 2001;
Benchelah et Maka.2008).
Page 27
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
II.9.1. Cultivars utilisés pour la production du
vinaigre traditionnel
En vinaigrerie traditionnelle, le choix des
variétés de dattes, est orienté par leur
disponibilité, leur abondance et leur appréciation pour la
fabrication de vinaigre traditionnel. Bien que répartie entre les trois
classes de dattes, les variétés sont classées comme sous
produits du palmier dattier à cause de leur valeur marchande. Elles sont
destinées essentiellement à l'alimentation du bétail et
comme appoint alimentaire pendant les périodes de disette. Les
variétés de dattes ci-dessous sont les plus couramment
utilisées, toutefois, Deglet-Nour et Ghars, sont très
appréciées, et sont aussi largement utilisées en
vinaigrerie traditionnelle (Ould El-hadj et al. 2001 ;Benchelah et
Maka.2008).
? Harchaya : Appelée aussi `Dkel Akerded'.
? Assabri : Cette datte sèche de petite taille, est de
couleur brune.
? Hamraya : C'est une variété molle de couleur
rouge foncée connue aussi sous le nom de,`Tazagart'.
? El Horra : C'est une variété sèche de
forme ovoïde, Elle présente une couleur ombrée, avec une
légère nuance blanchâtre.
II.9.2. Fabrication du vinaigre traditionnel par
proposition d'amélioration (Technique de double fermentation
spontané)
La qualité du vinaigre de dattes obtenue par voie
traditionnelle (double fermentation simultanée et spontanée :
alcoolique/acétique) est adoptée dans certaines régions du
sud algérien cela donne des produits avec une acidité totale de
(2.48 #177; 0.02%) les normes préconisées par la
réglementation en vigueur est de (5%). La teneur en alcool est, quant
à elle excessive (4.83 #177; 0.07 % v/v) alors que la norme recommande
un seuil maximum de 0,5%. Les expériences au laboratoire ont
démontré qu'il est illusoire d'obtenir un vinaigre de dattes
réglementaire par un tel procédé. Ce qui a amené
à proposer quelques mesures d'amélioration, tenant compte des
risques encourus par la consommation d'un tel vinaigre développement des
moisissures particulièrement (Boukhiar, 2009).
La réalisation d'une double fermentation
spontanée (alcoolique et acétique simultanément) (Fig.14)
s'avère entachée de plusieurs risques parmi lequel le
développement des moisissures

Page 28
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
constitue un danger potentiel qui peuvent nuire à la
santé du consommateur (Boukhiar, 2009).
Figure n° 14 : Conception d'un
schéma de production traditionnelle du vinaigre.
(Boukhiar,
2009).
L'arrêt de sortie des bulles de gaz (CO2) peut
être considéré comme un indicateur de la fin de la
fermentation alcoolique. Au terme de cette première étape, le
moût est transvasé dans un autre récipient
présentant un rapport largeur/Hauteur élevé est
recommandé. L'usage de la mère du vinaigre des fermentations
antérieures accélère le processus. Une proposition de
l'installation apte à assurer une fermentation alcoolique
spontanée à 30°C tout en évitant le
développement de la flore aérobie à été
faits par (Boukhiar, 2009).
Page 29
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
III. vinaigre du raisin
Le vinaigre est un liquide naturel produit par la fermentation
de sources de glucides telles que raisins, mélasses, dattes, maïs,
pommes, poires, raisins, baies, pastèques, noix de coco, miel, orge,
érable, pommes de terre, betteraves et lactosérum.
Le vinaigre est obtenu en faisant fermenter le sucre contenu
dans une levure naturelle et converti en alcool. L'alcool est ensuite converti
en composé d'acide acétique par la bactérie responsable de
ce processus, la bactérie acide acétique. Il existe deux
méthodes principales de production de vinaigre: la méthode
naturelle et la méthode commerciale; La première nécessite
une période de fabrication allant de quelques semaines à
plusieurs mois, et la méthode commerciale est utilisée dans de
courtes périodes et au cours desquelles plusieurs étapes de la
fabrication du vinaigre naturel traditionnel sont dépassées. Le
produit au vinaigre, qui est responsable du goût piquant et acide et de
la forte odeur caractéristique du vinaigre, a été
distingué, mais l'acide acétique essentiel ne peut pas être
remplacé par l'acide acétique formé dans le vinaigre,
l'acide acétique dilué ne peut pas être
considéré comme du vinaigre et ne peut pas être
utilisé et ajouté aux produits alimentaires. Administration
américaine des aliments et drogues (FAO). En plus de l'acide
acétique, le vinaigre contient de nombreuses vitamines, sels
minéraux, acides aminés et poly phénols, tels que l'acide
gallique, la caté chine, l'acide caféine et l'acide
féerique (Caryoline rigondet, 2019).
III. 1. La vigne
La vigne (Vitis vinifera L.) est une plante grimpante
pérenne à croissance indéterminée, capable de se
multiplier par voie sexuée, par bouturage ou par greffage (This
et al., 2006). La Vigne est cultivée pour ses fruits charnus :
les baies de raisin. Ces dernières permettent la préparation du
jus de raisin, l'élaboration du vins, la distillation de liqueurs
(armagnac, cognac, porto) ou peuvent être consommées comme fruit
frais ou secs. La constitution d'un vignoble nécessite du temps : il
faut attendre 3 ans pour obtenir les premiers fruits, 10 à 12 ans pour
avoir un rendement significatif, et 25 ans pour arriver à la pleine
production. La qualité organoleptique augmente avec l'âge du
cep.
Page 30
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
III.2. Histoire et caractérisation du raisin
Le raisin est l'un des fruits les plus vieux que l'on
connaisse. Des traces fossilisées remontant à l'ère
tertiaire attestent de son existence à cette époque, en
Europe. Toute porte à croire que la vigne,
dont il est le fruit, était également présente en
Asie mineure (This et al., 2006).
III.3. Systématique
La vigne appartient à la famille des
ampélidacées (vitacées). Les vitacées sont, en
général, des arbrisseaux souvent sarmenteux, grimpant comme des
lianes, s'attachant à des supports variés grâce à
des vrilles oppositifoliées, simples ou le plus souvent
ramifiées. Cette famille comprend dix-neuf genres (Galet,
2000) un seul de ceux-ci nous intéresse: le genre Vitis
lui-même divisé en trois groupes de vigne, classée en
fonction de leur origine géographique (Huglin et Schneiderc,
1998).
III.4. Importance de la viticulture
III.4.1. Dans le monde
La vigne est l'une des espèces fruitières les
plus cultivées dans le monde en terme de surface et de valeur
économique. En 2007, la FAO a
estimé le vignoble mondial à 7.792 millions d'Ha et la production
mondiale de raisin à 665 millions de quentaux
En 2010, le vignoble présente une large
répartition, sur les cinq continents avec une superficie d'environ 8
millions d'ha. La majorité des surfaces viticoles mondiales sont
situées en Europe (57.9%), le reste étant réparti entre
l'Asie (21.3%), l'Amérique (13,0%), l'Afrique (5.2%) et l'Océanie
(2.7%) (OIV, 2010).La production mondiale des raisins en 2010 (consommation
directe, séchage) est estimée approximativement à 12
millions de tonnes. Environ 18% (2.2 millions de tonnes) sont acheminés
vers les marchés extérieurs. Les exportations sont
caractérisées par une forte concentration géographique.
Les plus grands pays producteurs sont l'Italie, la Chine et les USA. Ce dernier
est en même temps un grand importateur après l'Allemagne et le
Royaume Uni, qui importent surtout des raisins secs (Aigrin, 2003; OIV,
2010).
Page 31
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Les pays méditerranéens viennent en tête
dans l'importance des surfaces viticoles avec prés de 6 millions d'ha.
En 2012, la surface du vignoble est passée à 7.528 millions d'ha
(OIV, 2012).
III.4.2. En Algérie
La culture de la vigne a été
développée en Algérie par la colonisation
française. À l'indépendance, en 1962, le vignoble
algérien, à destination vinicole, couvrait plus de 350 000 ha
dont l'essentiel de la production était écoulé en France.
Sur le territoire de la future wilaya de Mostaganem (2269 km2),
49030 ha étaient alors couverts de vignes, en particulier sur le plateau
de Mostaganem. La perte du marché français à la fin des
années 1960 a provoqué une réduction très forte du
vignoble. Ce déclin n'a fait que s'aggraver jusqu'aux mesures
adoptées en 2000 pour soutenir l'agriculture. Afin d'analyser
l'évolution des superficies plantées en vigne, une étude
diachronique a été menée à partir de cartes
topographique (1958 et 1983) et d'images satellitaires Google Earth Pro (2017).
Les résultats mettent en évidence un effondrement des superficies
entre 1958 et 1983. Le vignoble s'est encore rétracté entre 1983
et 2017, date à laquelle il ne couvre que 6190 ha. Mais l'examen des
parcelles présentes en 1983 qui ont disparu en 2017, confirme que le
déclin du vignoble a été maximal à la fin des
années 2000. L'évolution du vignoble s'est également
traduite par une profonde mutation spatiale. Les communes du plateau de
Mostaganem et plus encore des plaines des Bordjias ont subi des pertes
relatives considérables. Au contraire, les vignes ont mieux
résisté dans les communes littorales du nord et les superficies
ont même augmenté entre 1983 et 2017 dans certains secteurs des
monts du Dahra. Malgré le regain récent, l'avenir du vignoble
reste incertain dans un pays où la religion interdit la consommation de
vin et juge sévèrement sa production.(Caïd et al
.,2019)
Compte tenu du climat, du terroir disponible et de
l'expérience agricole acquise par la profession, la viticulture a sa
place en Algérie. Dans beaucoup de zones et notamment au centre et
à l'ouest du pays, la viticulture représente une utilisation
optimale du sol. Mais les rendements réalisés sont relativement
faibles, si bien que le coût de production par unité de volume est
relativement élevé. Ceci est probablement dû à la
pluviométrie irrégulière au cours de l'année, aux
cépages utilisés, à la vieillesse des plantations, aux
itinéraires techniques appliqués inadéquats
(Basler, 2000).
Page 32
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
La plus importante production est réalisée dans
la région centre (75%), environ 25% à l'Ouest et elle est
très faible à l'Est du pays. Les vignobles en production sont
relativement âgés. La conduite se fait généralement
de manière extensive (Toumi, 2006).
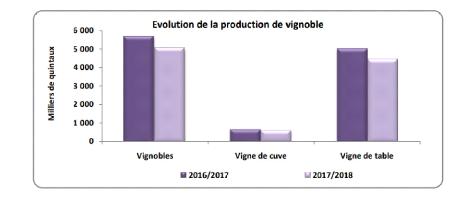
En termes de production de vignoble, la quantité totale
produite au cours de la campagne agricole 2017/2018 est évaluée
à 5,03 millions de quintaux, enregistrant ainsi une baisse de 11% par
rapport à la saison agricole de 2017. Cette régression est
essentiellement due à la diminution de la production de raisins de table
(-12%) qui constitue près de 88% de la production totale. De même
pour la production de raisin de cuve, qui a vu sa production reculer de 7% par
rapport à l'année écoulée. Quant à la vigne
de séchage, la production demeure nulle successivement pour 2017 et 2018
(MADR, 2018).
Figure n °15 : Evolution de la production
de vignoble MADR, 2018 III.5. Petite analyse de la situation de la
viticulture en Algérie Commençant par un aperçu
sur le bilan mondial selon l'OIV,(2019).
- La superficie viticole mondiale: 7,4 millions d'hectares.
- La production mondiale de raisin: 78 millions de tonnes.
- -Raisin de table: 27,3 millions de tonnes.
- Raisin sec: 1,3 millions de tonnes.
- Vin: 292 millions d'hectolitres.
- Situation de la filière viticulture en Algérie
(MADRP, 2018)
Page 33
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
III.5.1. Avantages de la viticulture
- Elle s'adapte parfaitement aux différentes conditions
agro climatiques des différents ones de reliefs et plaines).
- Elle constitue la meilleure espèce qui valorise les
zones difficiles terroirs
- Elle contribue à la création d'emploi (230
à 260 j/ha/ an de travail)
- Elle peut générer une gamme de produits
très variée (raisins frais, secs, vin, jus,
vinaigre, sucre, ou produits, coproduits ).
- Elle présente la possibilité de
développer des marchés a l'exportation des raisins frais en
effet, il est à retenir une chose importante: La maturité et la
récolte des raisins de table en Algérie peut se faire deux a
trois semaines avant l'Italie et l'Espagne, et durant cette période les
marchés européens et autres marchés, sont demandeurs de
raisins.
III .5. 2. Superficie viticole totale
67% de la superficie occupée par la vigne de table, et
33% par la vigne de transformation, les statistiques enregistrent une
superficie très réduite des champs de pieds mère (CPM) ne
dépasse pas 73 ha, et absence totale de la vigne à raisin
secs.
III .5. 3. La production totale de raisin
88% de la production représente le raisin de table et
seulement 12% pour les raisins de transformation.
La production en raisin de table permet en moyenne, une
consommation de 11,3 kg par habitant et par an de raisins
frais.
Page 34
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
III .5. 4. Total de variétés
homologuées :
Il existe 96 variétés dont: 55
Variétés de table, 31 Variétés de transformation,
05 Variétés viticole de séchage et 10
Variétés de portes greffes.
III.6.Perspectives de la viticulture en Algérie
III.6.1. Orientations pour le développement de la
vigne à raisins de table
Le développement de la vigne de table est lié
à l'étalement de la production et au choix des
variétés en fonction des zones. Les nouvelles plantation doivent
être orientées vers les variétés précoces et
tardives pour permettre l'étalement de la période de
récolte et de la disponibilité sur le marché.
III.6.2. Orientations pour le développement de la
vigne à raisins secs
Le développement de la vigne a raisins secs
nécessite:
Le choix adéquat des variétés en fonction de
la zone,
- l'étalement de la gamme variétale existante.
-le développement des techniques de séchage.
-l'appui technique à la production et à la
commercialisation (Office Nationale des Statistiques,
2018).
III.6.3.Orientations pour le développement de la
vigne de transformation
Possibilité de développement des produits
dérivés du raisin autre que le vin, en particulier:
· Le jus de raisin
· Le sucre de raisin
· Le vinaigre de raisin
· -Les co-produits (ou produits connexes, comme rob, halwat
laaneb, )
|
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Les sous produits: fertilisants, compost, substrat, aliments de
bétail. (Office Nationale des Statistiques, 2018).
III.7. Vinaigre traditionnelle de raisin
La fabrication du vinaigre repose sur une double fermentation .La
première dite alcoolique : les sucre fermente sible initiaux
présent dans la matière première sont transformés
en alcool par les levures à la température ambiante pendants
quelque jours.
Ces sucre proviennent de différentes sources agricoles
(pommes, raisin, betteraves, pomme de
terre (Komia, 1996).
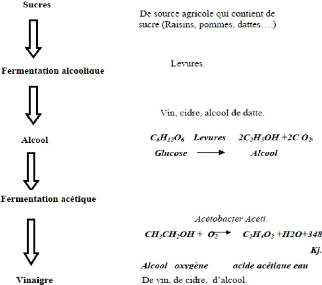
Page 35
Figure n° 16: Protocole
expérimentale de fabrication de vinaigre (Brewdusud
,2004)
|
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
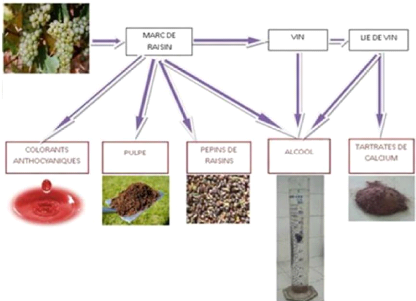
Figure n°17: Les coproduits issus du marc
de raisin (Bustament et al., 2007)
Page 36
Chapitre 1 : Le vinaigre biologique
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Pulpes
Pépins
Pellicules
Rafles
Nutraceutiques
Cosméseutiques
Alimentaire (vins, boisson à
différents
D° d'alcool, jus de
raisin
Cosmétique (application :
produit de soins,
vinothérapie,
oenothérapie)
Pharmacie (application :
collyre à base jus de
raisin)
Energie
Vins
Sécrétions (utilisation de larme de vignes comme
collyre)
Récolte de raisin
Grappe
entière
(grain)
Coproduits
Autre produits : raisin frait, sec et jus de raisin
Sarments
(pour
barbecue)
Bois
(fabrication
de cannes)
Racines (extrait de racine pour traitement du psoriasis ;
Viridian)
Coproduits
Viniculture
Page 37
Anthocyan
es
Alimentaire
Huile
Autres
Cosmétique
Agriculture
Pharmaceutique
Poly phénols
Valorisation directe
Acide tartrique
Page 38
[PARTIE I : REVUE BIBLIOGRAPHIQUE]]
|
Chapitre 1 : Le vinaigre biologique
|
|
|
Figure n°18 : Schéma qui
représente les différents types des valorisations et des
transformations du raisin (Boussetta, 2010 et Anonyme 1).
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 38
II.1.Historique de la microbiologie des bactéries
acétiques
Au début du XVIII siècle, Georg Ernst
Stahl Identifie la fermentation acétique de l'éthanol,
puis Herman Boerhaave met en évidence la
différence entre cette dernière et la fermentation alcoolique. En
1822, Christiaan Hendrik Persoon attribue
l'acescence à un biofilm cellulosique qu'il dénomme Mycoderma
aceti (littéralement: peau de champignon du vinaigre): « la
mère de vinaigre ».
Louis Pasteur, alors au service des
vinaigriers français, met en évidence les processus de
fermentation alcoolique et de fermentation acétique, En
1864. Il identifie l'une des espèces de
bactéries acétiques à l'origine de cette dernière:
Acetobacter aceti .Après Pasteur, d'autres
chercheurs (Hansen, Duclaux. Henneberg...) identifient
d'autres espèces de bactéries acétiques (Jean
Marc, 2015).
II.2.Généralité
Ce sont des bacilles Gram - parfois allongés ;
asporulés ; généralement mobiles. Ils sont oxydase - ;
aérobie et ont un métabolisme de type oxydatif. Ce sont les
agents de la « fermentation» acétique qui est en fait une
oxydation incomplète de l'éthanol. Leur caractéristique
principale est la production d'acide acétique à partir
d'éthanol. Les caractères du groupe peuvent être mis en
évidence par les testes suivants : coloration de gram ;
métabolisme respiratoire sur gélose VF semi solide ; teste
oxydase ; production d'acide à partir d'éthanol.Les
bactéries acétiques sont des contaminants fréquents des
produits alcoolisés qu'elles acidifient. Dans l'industrie ; elles sont
utilisées pour la fabrication du vinaigre. Les variétés
les plus utilisées sont celles de l'espèce A. aceti
(vinaigre par procédé d'Orléans en cuve
plate) et A. pasteurianus (vinaigrerie en cuve profonde agitées
et aérée). Elles sont également utilisées dans
l'industrie pour la production d'acide gluconique (Guiraud,
2012).
II.3.Ecologie :
Les bactéries acétiques sont très
répandues dans la nature elles sont présentées à la
surface des plantes (fleurs et fruits) (Galzy et Guiraud, 1980)
; c'est leur habitat naturel (Hamidi et Slimani
,2008).
Les bactéries acétiques jouent un rôle
positif et important dans certains aliments et boissons tels que le vinaigre et
le cacao. Cependant, pour d'autres produits et boissons, leur présence
n'est pas recherchée car la qualité des produits est fortement
diminuée lorsque les conditions d'élaboration et de conservation
des produits ne sont pas maîtrisées. Les bactéries
acétique sont répandus dans la nature et un grand nombre de
souches ont été isolées à partir de sources
très variées (Sengun et Karabiyikli, 2011).
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 39
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
En 1982 Michael et Pleczar, dit que les
bactéries acétiques sont très répandues dans la
nature sur les fruits et les légumes. C'est leur habitat naturel
(Tekkouk, 1997). Les bactéries acétiques sont
isolées de végétaux en fermentation alcoolique
(Prevot, 1961), dans les jus de vinaigre et les boissons
alcoolique (Michal et Pleczar, 1982).

Figure n°19 : Micrographie
électronique à balayage d'Acetobacter aceti
(Jean Marc, 2015).
II.4. Structure du génome
Il y a 3340429 paires de bases d'ADN qui composent le
génome d'Acetobacter aceti contient 3122 gène au total.
3050, soit quatre - vingt - dix - sept pour cent des gènes codent tous
pour les protéines, ce qui signifie qu'une grande partie
d'Acetobacter aceti doit produire des protéines (Jean
Marc, 2015)).
II.5. Classification
Les microbiologistes sont confrontés à la
tâche intimidante de comprendre la diversité de formes de vie
qu'on ne peut pas voir à l'oeil nu, mais qui peuvent apparemment se
trouver n'importe où sur la Terre. Un des premiers outils
nécessaire pour étudier un tel niveau de diversité est une
disposition se système de classification fiable. La taxinomie (du grec
taxi, ou ordre et nomos, loi ou nemein, distribuer ou gouverner) définit
comme la science de la classification biologique. Au sens large, elle est faite
de trois parties séparées, mais reliées entre elles : la
classification, la nomenclature et l'identification. Dès qu'un
schéma de classification est choisi, on l'utilise pour répartir
les organismes en groupes appelés taxons, sur la base de leur
similarité mutuelle. La nomenclature est la branche de la taxinomie qui
donne des noms aux groupes taxinomiques, selon des règles
publiées. Les biologistes uti lisent le système binomial
décrit dans la section. L'identification est le coté pratique de
la
Page 40
taxinomie, elle consiste a déterminer qu'un isolas
particulier appartient a un taxon connu , et si c'est le cas , lequel . Le
terme systématique est souvent utilisé pour taxonomie.
En pratique, la détermination du genre et de
l'espèce d'un pro caryote nouvellement découvert est basée
sur la taxinomie poly phasique. Cette approche inclut les caractères
phénotypiques, phylogénétiques et génotypiques.
Pour comprendre comment toutes ces données sont incorporées dans
un profil cohérent de critères taxinomiques, nous devons d'abord
considérer les composants individuels (Jacques at al.,
2013).
II.5.1. Classification d'Acetobacter aceti
Ce que caractérisent les bactéries
acétiques, c'est leur remarquable capacité d'oxyder
l'éthanol en acide acétique à des pH acide
(Bourgeois et Larpent, 1996).
Les premiers essais de classification sont dus à
Hansen (1894) ; Vissert (1925), fut le premier à
proposer une classification basée sur des critères
biochimiques.
Frateur (1950) fut le mérite de
réduire beaucoup le nombre d'espèces en utilisant cinq
critères : catalase, suroxydation de l'acide acétique (CH3COOH en
CO2 et H2O), oxydation du lactate en CO2 et H2O, oxydation du glycérol
en dihydroxyacétone, production d'acide gluconique à partir du
glucose. Certains caractères culturaux (température optimale,
formation de pigment, de voile utilisable possible de sels ammoniacaux comme
seul source d'azote.....). Selon Bergy (1957), les genres
Gluconobacter, et Acétobacter entrent dans la famille des Pseudomenaceae
et dans la tribu des Pseudomenadeae. Les bactéries acétiques sont
classées en quarts groupes biochimiques :
? Groupe peroxydant : représente par
Acétobacter peroxydant.
? Groupe oxydans : représente par
Acétobacter pasteruianum.
? Groupe suboxydans : représente par Gluconobacter
suboxydans (Belkacem, 1987).
? Groupe mesoxydans : représente par
Acétobacter aceti.
Puis Leifson (1954), distingua dans les
bactéries acétiques celles qui ont des flagelles
péritriches, et oxydent l'acétate, le genre Acétobacter de
celles qui ont des flagelle polaires, le genre Acetomonas. Carr et
Shimwell (1968), Asai (1968), proposèrent de remplacer
Acetomonas par Gluconobacter. les expériences d'hybridation de
Gillis et DeLey (1980) , ont bien montré qu'en
réalité, les deux genres devaient être regroupés
dans la même famille des Acétobacteriaceae. La 9éme
édition du manuel Bergy (1957) a retenu cette
proposition.Généralement la classification
d'Acétobacter est basée sur les caractères
culturaux, morphologiques, structuraux, biochimiques, et physiologiques.
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 41
II.5.2- Taxonomie Domaine : Bacteria.
Phylum : Proteobacteria.
Classe :
á-Proteobacteria.
Ordre : Rhodospirillales.
Famille : Acetobacteraceae.
Genre : Acetobacter.
Espèce: Acetobacter aceti
(Jacques et al., 2013).
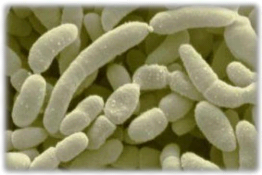
Figure n° : La micrographie
électronique à balayage d'Acetobacter aceti (
Jean Marc,
2015).
II.6. Facteur de croissances des bactéries
acétiques II.6.1. L'acide acétique
L'acide acétique était activateur de la croissance
des acétobacter jusqu'à la valeur de 2° (Bourgeois
et Larpent, 1996).
II.6.2-Oxygène
La fermentation acétique était réalisable
avec une bonne performance en milieu liquide bien aéré. La
formation d'un gramme d'acide acétique nécessite tout
l'oxygène contenu dans deux litres d'air et l'arrêt
d'oxygénation entraine la destruction des cellules. Cependant à
des
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
teneurs élevées l'oxygène entraine une
oxydation de l'acide acétique (Poxixoo, 2003 ; Belkacem,
1987).
II.6.3-Température et pH
La température optimale de croissance des
bactéries acétique se situe aux environs de 30°C, elle
augment la rapidité de l'acétification avec laquelle se
déroule la réaction (Kersters et al., 2006 ; Poxixoo,
2003). De grands systèmes de refroidissement sont
utilisés dans les bio-fermenteurs pour maintenir les températures
optimales de vie des bactéries acétiques dans la fabrication de
vinaigre (Mounir et al ., 2016). Et leur pli optimum de
croissance est situé entre 5,4 et 6,3 (Kersters et al .,
2006).
II.6.4-Concentration d'éthanol
La concentration d'éthanol est entre 10 et 13%, lorsque
la concentration est supérieures à 14%(v/v) l'éthanol est
oxydé difficilement et incomplètement et lorsque la concentration
d'éthanol est inferieur à 7%(v/v) l'acide acétique
formé est oxydé en CO2 et H2O (Belkacem, 1987; Follman,
1983; Boughnou, 1988).
II.6.5- Lumières
La lumière diffuse ne permet qu'une fermentation
acétique très lente, elle est la plus active à
l'obscurité. Les rayons ultra-violets sont nocifs (Duculot,
1932).
II.7.Caractères généraux des
bactéries acétiques II.7.1-Caractères
culturaux
Les colonies d'acétobacter sont blanches, jaunes,
irrégulières sur le milieu solide de Frateur (Ouled El
Hadj, 2001), certaines espèces sont pigmentées et
produisent parfois de la cellulose et des polysaccharides (Bourgeois et
Larpent, 1996).
Page 42
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 43
II.7.2-Caractères morphologiques et structuraux
Les bactéries acétiques se présentent au
microscope sous forme de petits bâtonnets, souvent groupées et
parfois en chainettes. Leur taille varie de 0,5 à 1 um de large et 2
à 3um de long. Les formes d'involution sont fréquentes
(Bourgeois et Larpent, 1990). Elles ont des formes
bacillaires, quelquefois ellipsoïdales, il existe des espèces
immobiles, et d'autres mobiles avec un cil polaire. Elles croissent bien en
général sur autolysat ou extrait de levure additionné
d'éthanol et d'autres substances oxydables (Prevot,
1961) (Fig.21 ).
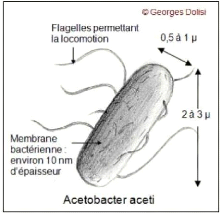
Figure n°21 : Morphologie
d'Acétobacter aceti (http : www.vulgaris
medical.com/uplood/visuelAcetobacter).
II.8.Caractères biochimiques
II.8.1. Transformation de l'alcool en acide
acétique
Tous les espèces de la tribu d'Acetobacter,
oxydent l'alcool en acide acétique, mais les espèses A.
peroxydans, A. oxydans et A. mesoxdans sont capables d'oxyder
l'acide acétique produit et de le transformer en gaz carbonique et eau
(Girad et Rougieux, 1958).
II.8.2. Réaction de la catalase
La présence de la catalase dans le microorganisme
permet la décomposition de l'eau oxygénée produit à
la fin de la chaine oxydoréduction. Seules les espèces du groupe
peroxydans sont catalase négatives, ces espèces comptent parmi
les seules aérobies catalase négatives (Girad et
Rougieux, 1958).
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
II.8.3-Pouvoir cétogène
Ce pouvoir se caractérise par la
propriété de transformer la fonction alcool secondaire en
fonction cétone, du fait de cette propriété les
acétobacters sont utilisés industriellement pour produire des
acides cétoniques comme l'acide ascorbique (vitamine C) (Girad
et Rougieux, 1958). Le pouvoir cétogène se rencontre
chez les espèces des groupes mesoxydans et suboxydans. C'est à
partir de glycérol qu'il y a production de dihydroxyacétone par
Acétobacter xylinum, Acétobacter suboxydans
suivant la réaction (Girad et Rougieux, 1958).

(Simon et Meunier, 1970)
La production d'acide 5-cétogluconique aux dépens
de glucose, par Acetobacter suboxydans.
(Simon et Meunier, 1970).
II.8.4-Transformation du glucose en acide gluconique
Cette propriété appartient à toutes les
espèces d'Acetobacter, sauf à celles du groupe peroxydans et
Acétobacter ascendens du groupe oxydans (Girad et
Rougieux, 1958), selon l'équation suivante :

Page 44
(Simon et Meunier, 1970)
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 45
Tableau 08 : Les caractères biochimiques
de quelques groupes d'acétobacters (Girad et Rougieux,
1958).
|
Groupes
|
Catalase
|
Oxydation
de l'acide
lactique
|
Oxydation du lactate de Ca formation de
CaCO3
|
Formation
d'acide
gluconique
|
Pouvoir
cétogène
|
|
Peroxydans
|
-
|
+
|
+
|
-
|
-
|
|
Oxydans
|
+
|
+
|
+
|
#177;
|
-
|
|
Mesoxydans
|
+
|
#177;
|
+
|
+
|
+
|
|
Suboxydans
|
+
|
-
|
-
|
+
|
+
|
II.8.5. Production de cellulose
Certaines souches d'Acétobacter forment des
microfibrilles, extracellulaires de cellulose qui entoure la masse des
bactéries en division (Perry, 2002).
Des cellules non proliférantes des bactéries
peuvent en quelques heures synthétiser la cellulose en
anaérobiose à partir de mannitol de fructose et de glucose
(Lambin et German, 1969).
Les cellules sont alors enrobées dans un grand masse de
fibrilles de cellulose .la cellulose est formée de manière
interne et secrétée à travers des pores situés dans
l'enveloppe externe lipopolysaccharidique. Dans les cultures non
agitées, les cellules synthétisant la cellulose sont
favorisées, et dans les cultures agitées, les mutant
dépourvus de cellulose prédominent (Perry,
2002).
Certaines espèces comme Acétobacter xylinum
élaborent une paroi constituée de cellulose (Lambin
et German ,1969).
II.9. Caractère physiologique
L'Acétobacter est dit sur-oxydateur, car il peut oxyder
l'acide acétique jusqu'au dioxyde de carbone par son cycle complet des
acides tricarboxylique (Gerom et al., 2002).
Certaines souches d'acétobacters forment des
micro-fibrilles extracellulaires de cellulose qui entoure la masse des
bactéries en division. La cellulose est formée de manière
interne et
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 46
sécrétée à travers des pores
située dans l'enveloppe externe lipopolysaccharidique (Gerom et
al., 2002).
Des cellules non proliférant des bactéries
peuvent synthétiser la cellulose en anaérobiose à partir
de mannitol de fructose et de glucose (Lambin et German,
1969).
La résistance des bactéries à l'acide
acétique et leur acidiphilie, reste encore inexpliquée. On peut
penser que la membrane de ces bactéries riche en acide gras
saturés reste relativement imperméable à cet acide qui se
trouve sous forme non dissociée dans les conditions industrielles
(Bourgeois et Larpent, 1990).
La protection des bactéries contre l'acide
acétique du milieu est vrai semblablement due à un système
membranaire énergétique, couplé au métabolisme de
l'éthanol, car l'arrêt de l'oxygénation et l'absence
d'éthanol, entraine la mort des cellules (Bourgeois et Larpent,
1996).
II.10.Besoins nutritionnels
La majorité des souches d'acétobacter sont
auxotrophes pour quelques vitamines, notamment l'acide
para-amino-benzoïque, la thiamine et l'acide pantothéique, leur
croissance nécessite l'extrait de levures. Les besoins nutritionnel des
bactéries acétiques dépendent étroitement de la
source de carbone, elles peuvent utiliser l'ammonium comme source d'azote,
l'acide á-cétoglutarique et l'acide aspartique paraissent
particulièrement efficaces. Les bactéries réalisant la
fermentation acétique des vinaigres d'alcools sont susceptibles de se
développer sur un milieu minéral à deux sources de
carbone, le glucose et l'éthanol mais sur les substrats utilisées
dans l'industrie (Bourgeois et Larpent, 1996).
Dans tous les cas, les concentrations cellulaires restent faibles
(Divies, 1970).
II.11.Métabolisme
La particularité des bactéries acétiques
est d'oxyder une grande variété de substrats et accumuler quasi
intégralement les produits dans le milieu, les bactéries
acétiques possèdent des déshydrogénases très
actives situées sur leurs systèmes membranaires et intimement
couplées à la chaine cytochromique (Mastsushita et al.,
1985; Bourgeois et Larpent, 1996). A cote des enzymes membranaires,
les bactéries acétiques possèdent des éthanols et
acétaldéhydes déshydrogénases solubles liées
au NAD et au NADP (Kersters et al, 2006 ; Bourgoi et Larpent,
1996).
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
De nombreux sucres peuvent être oxydés
directement. Le glucose est oxydé en acide gluconique, il peut aussi
après phosphorylation être entièrement oxydé en CO2
et H2O (Huge et al., 1955). La capacité cétogene
à partir du glucose est très différente selon les souches
(Stadler-Szoke et Coll, 1980). On peut retrouver à
coté de l'acide gluconique l'acide 2-céto-gluconique, l'acide
5-céto-gluconique et l'acide 2-5-céto-gluconique (Bourgoi
et Larpent, 1996).
Les bactéries du genre Acétobacter
(Divies, 1972) oxydent l'éthanol en acide
acétique et ensuite oxydent l'acétate lorsque l'éthanol a
disparu du milieu de culture. L'éthanol inhibe et réprime les
enzymes d'oxydation de l'acétate, l'acide acétique inhibe sa
propre oxydation pour des concentrations supérieures à 08°
et inférieure à 3° (Bourgeois et Larpent,
1990).
II.12.Mécanisme biochimique de formation d'acide
acétique
Le mécanisme est de type oxydatif ou la présence
d'oxygène est obligatoire, l'oxydation de l'éthanol fait
intervenir trois enzymes il s'agit de l'alcool cytochrome 533 réductases
(E1) ; de la coenzyme indépendant déhydrogénase(E2) et de
la NADP dépendant déshydrogénase (E3) (Chose et
Bhadra, 1985 cites in Bougnou, 1988) (Fig. n°22)
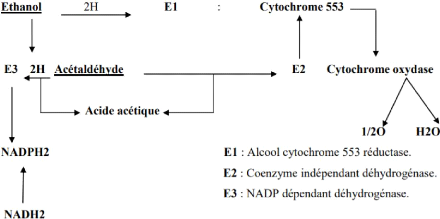
Figure n°22: L'oxydation de
l'éthanol par les bactéries acétiques (Bougnou,
1988).
Page 47
PARTIE I : REVUE BIBLIOGRAPHIQUE]]
Chapitre 2 : Acetobacter aceti
Page 48
II.13.Interactions microbiennes :
Dans le moût de raisin: Gilliland et Lacey
(1964), puis Grossman et Becker (1984) et Joyeux et al. (1984)
ont démontré que certaines souches de Acetobacter sont
capables d'inhiber Saccharomyces cerevisiae et certaines levures
indigènes. Drysdale et Fleet (1989) ont
démontré que les bactéries acétiques n'inhibent pas
fortement la croissance des levures, mais qu'elles affectent la capacité
des levures à fermenter le moût de raisin. Cette inhibition de S.
cerevisiae est principalement corrélée à la production
d'acide acétique par les Acetobacter hansenii et A.
pasteurianus inhibant le plus les levures. L'acide acétique est un
inhibiteur de développement des levures (Du Toit et Lambrechts,
2002), cependant, d'autres composés pourraient être
impliqués dans cet effet tel que l'éthanol, les résidus de
pesticides ou le SO2.
Très peu de travaux ont été
réalisés sur l'effet des bactéries acétiques sur le
développement des bactéries lactiques. Gilliland et Lacey
(1964) ont démontré que des souches du genre
Acetobacter pouvaient inhiber le développement d'espèces
bactériennes du genre Lactobacillus, alors que Joyeux et al.
(1984) ont mis en évidence que les BA stimulaient la
fermentation malolactique.
II.14.Pathologie
Acetobacter aceti n'a pas encore été
signalé en tant que microbe pathogène chez l'homme ou l'animal.
Acetobacter aceti produit pas de toxines, d'enzymes ni de virus
pouvant nuire l'homme ou aux animaux. Etant donné qu'Acetobacter
aceti est omniprésent dans la nature et que cette bactérie
est fréquemment en contact avec tous les animaux Acetobacter aceti
ne fait pas partie de la flore bactérienne normale de la peau
humains La seule pathologie potentielle qu'il pourrait présenter est que
si elle était présentée en quantités massives, une
réponse allergique ou immunitaire pourrait se produire. Acetobacter
aceti produit des alcools, ce qui signifie que s'ils sont consommés
en grande quantité, ces alcools pourraient affecter le système
nerveux central, provoquent une intoxication par l'alcool, un sous-produit
d'Acetobacter aceti bien que alcoolisme ou intoxication ne soit pas
dû à a bactérie. Acetobacter aceti est connu pour
provoquer une décoloration en pourriture et brunissement des fruits tels
que les pommes, les poires et les agrumes. Acetobacter aceti est connu
pour provoqué une maladie rose chez l'ananas, qui est le visage de
l'ananas rose en raison du métabolisme de l'ananas par Acetobacter
aceti et de la production de ses déchets (Jean Marc,
2015).
Page 50
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
I.1.Objectifs de l'étude
L'objectif de notre étude est isolements et
identifications d'Acetobacter aceti .Durant ce
travail, nous avons réalisé
? La préparation de vinaigre biologique.
? Faire les analyses physico-chimiques et déterminé
la qualité microbiologiques de
vinaigre préparé.
? Réaliser isolement d'Actetobacter aceti.
I.2. Lieu de l'étude
L'intégralité de ce travail est
préparation de vinaigre et isolement et identification d'Acetobacter
aceti a été réalisée au niveau du laboratoire
de microbiologie de département de biologie, université
Mustapha Stambouli Mascara durant la période allant du
09-05-2021 au 20-06-2021 Pour ce fait nous avons utilisé des
méthodes microbiologiques et physicochimiques standardisées.
I.3. Matériel et méthodes
I.3.1 Matériel végétale (date et
raisin)
Le choix des variétés des dattes et raisins est
orienté par leur disponibilité, leur abondance et leur
appréciation pour la fabrication de vinaigre traditionnel (Ould
el hadj et al., 2001). La proposition est d'utiliser des dattes de
faible valeur marchande, destinées le plus souvent à
l'alimentation humaine. Le cultivar utilisé est Algérie .Il est
répandu dans les palmeraies du Sud algérien. Les dattes de ce
cultivar sont semi- molles.
Tableau 09: Présentation du de la
matière végétale (datte).
Matériel biologique Variété
Espèce
|
Dattes
|
Hamira / Hmira Hamraya
|
Phaenix dactylifera
|
Tableau 10: Présentation du la
matière végétale (raisin).
Matériel biologique Variété Non
commun Espèce
|
Raisin Novocherkassk Rouge autochtone
|
Vitis vinifera ssp vinifera
|
Page 51
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
I.3.2. Méthodes
I.3.2.1. Analyse morphologiques et organoleptique des
dates
La couleur a été appréciée
visuellement. Par contre la consistance déterminée au
touché.
En ce qui concerne la longueur de datte, la longueur du noyau, le
poids de la datte, le poids de
la pulpe et le poids du noyau.
L'un des critères de qualité des dattes est un
rapport masse du noyau /datte a été calculé en
(1)
utilisant la formule (1) (Benhmed Djilali
Adiba,2007):
Noyau/Datte = Mase d'un noyau
Masse ??e la ??atte ×100
I.3.2.2. Analyse physicochimique de la datte
L'évaluer la qualité physique et biochimique des
dattes, on été réalisées en tenant compte des
normes fixées par le Ministère de l'Agriculture dans
l'arrêté interministériel du 17 Novembre 1992 pour les
variétés communes ainsi que les normes de la qualité
appliquée, à l'échelle internationale rapportées
par Melgi et Sourial (1982).
Ainsi ; une datte est dite de qualité physique et
biochimique acceptable quand elle présente
· Aucune anomalie et non endommagée.
· Masse de la datte supérieure ou égale
à 6 g.
· Masse de la pulpe supérieure ou égale
à 3.5g.
· Une longueur supérieure ou égale
à3.5 cm.
· Un diamètre supérieure ou égale
à1.5 cm.
· Une humidité compris entre 10-30 %.
· Un teneure en sucres supérieure ou égale
à 60% du poids sec.
I.3.2.2.1.Détermination du pH
? Principe
La détermination du pH est essentielle pour le
contrôle d'une fermentation microbienne. Sa variation nous renseigne sur
l'activité métabolique de la microflore.
? Mode opératoire
Dans une fiole de 200 ml, 4 g de dattes ou de raisin
dénoyautées / épépiner et broyées sont
dispersées dans de l'eau chaude. Après refroidissement, la fiole
est complétée jusqu'au trait de jauge avec de l'eau
distillée (Dowson et al., 1963).
Page 52
Chapitre I : Matériels et méthodes
Partie 2 : Etude expérimentale
|
|
|
|
La mesure du pH s'effectue par une lecture directe à
l'aide d'un pH-mètre préalablement étalonné de type
"PHS-25CWMICROCESSOR pH/mV MESTER.
I.3.2.2.2.Détermination de la teneur en
eau(TE) (AOAC N° 920.151) [AOAC N°920151 ; 1990 et Acourene et Tama
,1997 ;Chibane et al .,2007 ;Elleuch et al.,2008).]
-* Principe
La teneur en eau des dattes et des raisins fraiches matures
dépend de la fréquence et du volume d'irrigation au stade de la
récolte et de celle du lieu d'entreposage.
De nombreux auteurs insistent sur l'importance de
l'humidité relative sur la stabilité d'un produit. En effet, la
teneur en eau d'un produit est en relation directe avec l'humidité de
l'air. -* Mode opératoire
La teneur en eau a été déterminée
par un séchage d'une partie aliquote de 2 g de broyat,
étalée dans une capsule en inox tarée puis
séché dans une étuve à vide à une
température de 70°C pendant 48 heures. Ces conditions permettent
d'éviter la caramélisation des sucres et les réactions qui
en résultent (réaction de Maillard)
Les résultats sont exprimés en teneur en
matière sèche (% matière totale).
I.3.2.2.3. Détermination de la teneur en
cendres (NF V 03-922) [NF V 03-922-ISO 749 ; 1977]
-* Principe
Evaporation à sec d'une quantité connue du
produit, puis incinération à 525 °C+- 25 °C. -*
Mode opératoire
Peser à 1 mg près environ 25 g de
l'échantillon homogène et les introduire dans une capsule
préalablement tarée à 0.1 mg prés. A prés
passage au four à moufle à 525 °C+- 25 °C et
refroidissement dans le dessiccateur.
· Séchage : Evaporer à sec
la prise d'essai
· Pré incinération :
Chauffer lentement de façon à bruler la majeure partie du
résidu sec.
· Incinération : Placer alors la
capsule dans le four de moufle réglé à 525+- 25 °C et
l'y maintenir 1 heure. Sortir la capsule du four, la laisser refroidir à
l'air, humidifier les cendre- avec un peu d'eau distillées,
évaporer à sec et remettre dans le four.
· Répéter plusieurs fois
l'opération jusqu'à l'obtention du résidu blanc ou
grisâtre, exempt de particules de charbon.
Page 53
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
? Sortir la capsule et la laisser refroidir jusqu'à
température ambiante dans le
dessiccateur, puis peser à 1 mg près.
? Effectuer deux déterminations sur le même
échantillon pour essai.
? Expression des résultats
Le pourcentage en cendres est exprimé selon la formule
(2)
|
Teneur- en- cendre= (M2 - M0)
(M1 - M2)
|
×100 (2)
|
Avec :
M0: Masse de la capsule vide (g).
M1: Masse (capsule plus
échantillon) avant incinération (g).
M2, Masse (capsule plus cendres) après
incinération (g).
I.3.2.2.4. Détermination de la matière
organique selon (NFV05-113 -1972).
La matière organique est déterminée selon la
formule (3)
MO(%) = 100% - cendre % .(3)
I.3.2.2.5. Détermination de la conductivité
électrique et la salinité
Le principe est consiste à introduire dans un
bécher de 50 ml des jus des raisins et dattes, l'électrode d'un
conductimètre à lire directement la valeur de la
conductivité électrique. Elle nous renseigne sur la teneur en
sels solubles du produits, elle est mesurée par un
conductivimètre.les résultats sont exprimés en mohm/cm.
(Formule 4)
Elle nous renseigne aussi sur la teneur en sels solubles du
produit (salinité).elle est mesurée par un conductivimètre
de type(HANNA).les résultats sont exprimés en mS (milli siemens)
dans le cas de la conductivité électrique, et en g/l dans le cas
de la salinité (Dawson et Aten, 1963).
3.2
CE°20 C= Cet-(T-20) ×100 × CEt (4)
CEt : La lecture en milli siemens
(20°C).
T : Température que mentionne le
conductimètre divisé sur mille.
CE = CE°20 C *0.8273 (5)
K :
Coefficient = 0.8273.
La concentration en sel soluble est donnée par la relation
(6)
Page 54
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
Sels -Solubles (%)= (640*CE)
1000 (6)
I.3.2.2.5.Détermination de la teneur
d'oxygène
Le principe est consiste à introduire dans un
bécher de 50 ml des jus de la matière premières (D, R),
l'électrode d'un appareil multi paramètre à lire
directement la valeur d'oxygène. (Dawson et Aten,
1963).
I.3.2.2.6. Détermination du taux de solides
solubles « TSS ou Brix » (NF V 05-109 ,1970) Le Brix (%)
exprime le pourcentage de la concentration des solides contenus dans un
échantillon (solution aqueuse). Le contenu des solides solubles
représente le total de touts les solides dissous dans l'eau , incluant
les sucres , alcools , les sels , protéines , acides , etc , et la
mesure lue est leur somme totale . Fondamentalement, le Brix (%) est
calibré en fonction du nombre de grammes de sucres de cannes contenus
dans une solution de 100 gramme. Donc, lors de la mesure d'une solution de
sucre, le Brix (%) devrait parfaitement correspondre à la concentration
réelle. Dans le cas de solutions contenant d'autres composants, en
particulier lorsqu'il s'agit de connaitre la concentration exacte, une table de
conversion est nécessaire.
Mesure à la température de 20°C, de
l'indice de réfraction de l'échantillon préparé, et
conversion de cet indice en résidus sec soluble.
I.3.3.1. Analyse morphologiques et organoleptique des
raisins
La couleur a été appréciée
visuellement. Par contre la consistance déterminée au
touché.
En ce qui concerne la longueur de datte, la longueur du noyau,
le poids de la datte, le poids de la pulpe et le poids du noyau.
L'un des critères de qualité des raisins est un
rapport masse du noyau /raisin a été calculé en utilisant
la formule (1) dans la page51 de Matériels et méthodes.
I.3.3.2. Analyse physicochimiques du jus de raisins
On filtre ou on centrifuge l'échantillon de jus puis On
détermine la valeur du résidu sec soluble par
réfractomètre (lecture directe de la valeur du Brix)
I.3.3.2.1.Analyse des sucres (selon la méthode
Duboid, 1956)
? Mode opératoire
? Préparation du jus de
l'échantillon
V' -Peser 5 g d'échantillons puis mélanger le avec
25 ml eau distillée et broyage.
V' -Centrifuger les mélanges obtenus à 900 r
pendants 20 min.
V' Prendre un volume à partir du surnageant obtenues.
V' Préparation de l'échantillon
Page 55
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
y' On mélange 2ml de l'échantillon avec 50 ml
d'eau distillée et 01 g de CaCO3 (bicarbonate de calcium).
y' Puis le mélange subit un chauffage à
ébullition pendant 30 minutes. Après le refroidissement du
mélange, on complète le volume jusqu'à 100 ml, puis on
ajoute une quantité d'acétate de plomb (10%).
y' On fait une 1ere filtration pour éliminer les
protéines précipitées par l'acétate du plomb.
Après cette opération, on ajoute une quantité d'oxalate de
potassium qui se combine avec l'excès d'acétate de plomb et on
fait une 2ème filtration
y' La concentration en sucres totaux a été
déterminée en se référant à la courbe
d'étalonnage préparé.
Figure 1: Courbe d'étalonnage de dosage
de ST (Zribi Hatima; 2019).
Le taux de sucre est calculé selon la formule (7)
ST=A' × V ×
D/? ?×100 (7)
ST: Taux de sucres totaux(%).
X: Quantité de sucres calculée
à partir de la courbe d'étalonnage (mg/ml).
D: Facteur de dilution.
V : Volume de la solution analysée
(ml).
P:Poids de la prise d'essai (g).
Page 56
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
I.3.3.2. Dosage d'acidité titrable
? Principe
Au cours de la fermentation acétique,
l'évolution de l'acide acétique est le facteur essentiel à
contrôler, c'est le produit fini recherché.
L'acide acétique est dosé par titrimétrie
selon la méthode directe par Follaman (Follaman
,1983).
Produits utilisés
- Phénolphtaléine (1%).
- Hydroxyde de sodium 0.1N.
? Mode opératoire
? On a fait dilution des jus des dattes et raisins
(dilué à 10%)(10ml de jus de datte et raisins +90ml eau
distillée)
? Prélever VA=10ml de jus de raisin et jus des dattes
dilué à l'aide d'une pipette, on ajoute 3 gouttes de
Phénolphtaléine, remplir la burette de solution d'hydroxyde de
sodium de concentration molaire CB=0.1mol/L, ajuster le niveau du liquide au
niveau zéro de la burette, placer alors l'Arleen Meyer sous la burette,
agiter afin d'homogénéiser le mélange ( jus de D et R
+phénolphtaléine), verser à la burette, goutte à
goutte de l'hydroxyde de sodium dans L'Erlen Meyer jusqu' au virage au rose
persistant.
? On indiquer la valeur du volume d'hydroxyde sodium
correspondant à la zone de virage au rose persistant.
A l'équivalence CAXVA=CBXVB (8)
- CA est la concentration de la solution A.
-VA le volume de la solution A.
-CB est la concentration de la solution B.
-VA le volume de la solution B.
* on a A°=a. acétique + a. lactique (la
matière première «Datte, Raisin» contient la flore
lactique).
Le degré d'acidité D°(A°)
de vinaigre s'exprime par la masse.
La concentration en acide acétique est exprimée en
g/l par la formule (9) (Clavet, 1992).
(9)
C (g/l) = F.V X 60
V : Volume de la soude versé en ml.
F : Facteur correspondant à la
normalité de soude 0,1N.
Page 57
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
60 : La masse molaire de l'acide
acétique.
Le degré d'acidité de vinaigre est mesuré
par la formule suivante : D° = Macide Msolution
1 × 100 (ONEFD)
M acide : concentration de l'acide
acétique.
M solution : la masse d'un litre de solution.
I.3.4.Analyses microbiologiques de la matière
première (jus de dates et de raisins)(NF.
ISO 7954)
Dans les conditions très favorables, une cellule
microbienne présente à l'origine au niveau
d'une suspension mère se multiple en quelque heures
(bactéries, levures) ou en quelques jours
(moisissures).
La démarche de l'analyse microbiologique est
représentée par le schéma suivant
Incubation
Ensemencement dans le milieu de culture
Dilution décimales (1 ml dans 9 ml d'eau
physiologique )
Suspension mère
Prise d'essai (25 g)
Homogénéisation dans le diluant (225 g
d'eau stérile)
Comptage des colonies
Figure 2: Diagramme du protocole
expérimental (Guiraud, 2013) *Pour chaque dilution
trois répétitions sont effectuées; la moyenne est
retenue.
I.3.4.1.Dénombrement des germes totaux (TGEA) et
FMAT(GN) (NF.ISO 4833)
Le milieu de culture utilisé est le
tryptone-glucose-extrait de viande Agar (TGEA) et GN. L'incubation a
été réalisée à 30 °C pour TGEA et 37
°C pour GN pendant 24 à 48 heures. Le dénombrement est
effectué à l'aide d'un compteur de colonies. On ne tient compte
que des boites contenant un nombre convenable 30 à 300 colonies par
boite.
On calcule pour chaque dilution ayant donné ce
résultat, le nombre moyen de colonies en effectuant les moyennes des
nombres trouvé pour chaque boite de la même dilution. On
Page 58
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
arrondi de manière à n'avoir que 2 chiffres
significatifs et on multiplie par l'inverse du taux de dilution.
I.3.4.1.Dénombrement des levures et moisissures
(NF.ISO 4833)
Le milieu utilisé pour la recherche des levures et les
moisissures est l'oxytetracycline-glucose-Agar (OGA) ou Sabouraud. 0,1 ml de
chaque dilution est ensemencé puis étalé avec un
râteau stérile. L'incubation est effectuée à 25
°C pendant 5 jours.
I.3.4.1. Isolement des bactéries acétiques
(NF.ISO 4833)
Les dattes et les raisins et leur extrait constituent un milieu
très favorable à la prolifération des bactéries
acétiques selon Hamdoub (1994). Le milieu
sélectif est le milieu de Frateur. La présence des
bactéries acétiques est conditionnée par trois facteurs
:
? L'acidité (pH 2 à 5).
? Présence de l'alcool.
? Présence de glucose.
Elles appartiennent au genre acétobacter et transforment
l'alcool en acide acétique. L'oxydation de l'éthanol se traduit
par la dissolution du carbonate de calcium et l'éclaircissement autour
des colonies par acidification (Guiraud, 2013)
I.3.4.2.Dénombrement des bactéries
lactiques(NF.ISO4833)
Le milieu sélectif utilisé pour le
dénombrement des bactéries lactiques est MRS.
L'incubation a été réalisée à
30 °C pendants 5 jours.
I.2.5.Fabrication du vinaigre de dattes et des raisins
La fabrication du vinaigre traditionnel consiste en une double
fermentation combinée et spontanée (alcoolique et
acétique). Cette bioconversion utilise des levures et des
bactéries acétiques présence naturellement dans la datte
.Celles -ci entrainent une production d'éthanol qui est
transformé en acide acétique. C'est un procédé ou
les deux réactions biotechnologiques se déroulent au même
moment, bien que les exigences des organismes unicellulaires mis enjeu
différent en matière d'oxygène (Ejemni.M
et.al ;
2007).
|
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|

Figure °n23: Protocole de fabrication du
vinaigre par une double fermentation (Boukhiar Aissa,2009).

Figure °n24: Protocole expérimentale
de la double fermentation (Brewdusud ,2004).
Page 59
Page 60
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|


Matière première (Dattes
entière)
Traitement primaire des dattes (triage et
lavage)
1 /3dattes + 2/3 eau de robinet +autres
additifs
Fermentation (40-45 jours)
Séparation (filtration)
Vinaigre traditionnelle

Figure 5: Diagramme de fabrication
traditionnelle du vinaigre
? Technique d'élaboration
La méthode de préparation du vinaigre de dattes
se déroule en plusieurs étapes. Elle débute par le triage
et se termine par la filtration. La fermentation s'effectue dans un local
à la température ambiante.
Après triage, et lavage des dattes, on prend une mesure
de celle-ci, on ajoute deux mesures d'eau de minérale, puis on ensemence
avec Saccharomyces cereviceae (1g/l) ; le tout est mis dans un
récipient en plastique non entièrement remplis. Le
récipient est hermétiquement fermé (obscurités),
puis laissé pendant 15 jours à la température ambiante ;
on enlève le couvercle puis laissé pendant 25 jours à la
température ambiante. Finalement en filtre le vinaigre obtenue.
I.2.6. Evaluation la qualité microbiologique des
deux vinaigres
Se fait selon le même protocole démontré
pour la qualité microbiologique du jus de date et raisin (page57-58)
I.2.7. Evaluation de la qualité physico-chimique
des deux vinaigres (dates, raisins) I.2.7.1. Détermination du pH
(NFV05-108,1970)
A voir la page 51 matériel et méthodes
I.2.7.2.Détermination de la teneur en cendres
(NF V 03-922) [NF V 03-922-ISO 749 ; 1977]
A voir la page (52-53) matériel et méthodes
Page 61
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
I.2.7.3.Détermination de la teneur
d'oxygène A voir la page 45 matériel et
méthodes
I.2.7.2.Détermination du taux de solides solubles
«TSS ou Brix» (NF V 05-109 ,1970)
A voir la page 45 matériel et méthodes
I.2.7.3.Dosage des sucres totaux (méthode de Dubois,
1956)
A voir la page 45 matériel et méthodes
I.2.7.4.Dosage d'acidité titrable
A voir la page (56-57) matériel et méthodes
I.2.7.5.Détermination de la densité
(Siboukeur, 2008)
Elle nous renseigne sue l'état des produits par la mise en
oeuvre du taux de matière solide et
de la viscosité. Elle donc d'une importance
considérable dans la mesure où elle nous
renseigne sur l'aptitude des micros- organismes vis à vis
de l'état physique du milieu. Elle est
mesurée par lecture direct à l'aide d'un
densimètre ou pynctomètre.
La détermination de la densité est
réalisée par pynctomètre en verre vide. Le calcule se
fait
selon les formule (11) (12)
ñv = M1 - M0 (11)
Avec:
I.2.7.6.Détermination de la viscosité par la
loi de Stokes (Stokes,1981)
Principe
La viscosité est mesurée a l'aide du
viscosimètre a chute de bile (HAAKE).en Pascal par seconde (Pa/s) selon
la formule suivante :
(13)
r2+ (P2-P1 )+g
ç=
9V
D'où :
ç : viscosité.
P2 : la densité de la taille égale
: m/v ; m : masse de la bille et v
:4/3*ð*r3.
P1 : la densité du produit.
g:la gravité.
r : rayon de la bille utilisée.
v : la vitesse de la bille égale L/t ;
L : mesurer la distance entre les deux marques de tubes
Page 62
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
t : le temps en secondes de chute de la
taille a travers le produit a analyser.
? Mode opératoire
Le vinaigre est placé dans le tube du
viscosimètre puis on mesuré a l'aide d'un chronomètre
le temps « t »(en secondes) de passage de la billes
en distance « h »qui sépare les deux repères
A et B du viscosimètre et on a calculé la
viscosité du produit par la formule précédente.
I.2.7.7. Dosage de l'alcool (Audigité et al.,
1984).
Le dosage de l'alcool au cours de la fermentation est
effectué avec un alcoomètre
(gradué 0° à 100°). La méthode
consiste à mesurer le degré alcoolique, à la
température
Ambiante20°C, et lecture directe sur le gradient.
Le suivi de la production de l'alcool au cours de la
fermentation est d'une importance
considérable. Il renseigne sur l'évolution de
l'activité métabolique des micro-organismes.
? Matériels et méthodes
Le dosage de l'alcool est réalisé par la
distillation du vinaigre, l'oxydation et le titrage
? Principe
L'éthanol est oxydé par une quantité
connue et en excès de bichromate de potassium, en
milieu acide, l'excès de bichromate est dosé par
todométrie. Après dilution du milieu, on
ajoute un excès d'iodure, de manière à
réduire le bichromate du milieu et l'iode formé est dose
par le thiosulfate.
Le degré alcoolique peut se mesurer au moyen d'un
ébulliomètre on d'un alcoomètre indice de
0 à 10 et de 10 à 20. Il peut aussi être
détermine théoriquement : 1.7 g de sucre (saccharose)
fomente forme I ml ou 1 d'alcool pur.
1°Alcoolique = g d'alcool pure dans 100 ml de
solution.
? Mode opératoire
? Distillation de l'alcool
Dans un bécher mélanger:
-30 ml du vinaigre.
-200 ml d'eau distillée.
? Ajuster le pH du mélange par une solution de soude
à 0,1 N jusqu'à PH=8.
? Dans un ballon de distillation, verser le mélange
obtenu après l'ajustement.
? Introduire 5 billes en verre.
? Distiller doucement en évitant tout entrainement,
recueillir environ 8ml de distillat
dans 10 ml d'eau distillée.
? Le distillat récupéré est mis dans une
fiole jaugée de 100 ml.
Page 63
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
? Compléter le volume avec de l'eau distillée
jusqu'au trait de jauge.
2-Méthode de dosage de l'alcool
V' Dans une fiole d'Erlen Meyer de 150 ml, introduire
:
V' 20 ml de distillat.
V' 20 ml de solution de nitro-chromique à 0,05 N.
Boucher et attendre 30 min (pour que
l'oxydation de l'alcool soit complète).
V' Ajoute 10 ml de solution de lugole concentré
à100 g/1 après avoir préalablement
dilué le milieu par 40 ml environ d'eau
distillée.
V' Attendre 1 minute, puis doser l'iode forme par une
solution thiosulfate à 0.05 N de
titre connu.
> Témoin
Opérer comme pour l'essai, en remplaçant les 20 ml
de distillat par 20ml d'eau distillée.
> Expression des résultats
Cette expression a été démontrée en
se basant sur la méthode décrit par Audigité
et
collaborateurs (1984)
E1
Taux d'alcool (g/l) =TS2O3-2
(V2×E2 - ????)) ×
(46/4) × (1/E») × (E'/E) (14)
Ou :
V1 : Volume de thiosulfate utilisé pour
doser l'échantillon.
V2 : Volume de thiosulfate utilisé pour
l'essai à blanc. E : Volume de l'échantillon.
E1 : Volume de nitro- chromique pour l'essai.
E2 : Volume de nitro- chromique pour le
témoin.
E' : Volume de la solution dilué de
l'échantillon
E» : 20 ml de distillat que l'on soumit
à l'oxydation par nitrochromique.
Etude statistiques :
Nous avons faires des études statistiques (calcule la
moyenne et l'écartype) pour tous nos
résultats trouvable et nous avons utilisés teste
ANOVA pour les analyses statistiques de
densité optique (DO) dosage de sucres (Annexes 04).
1.2.8. Analyses microbiologiques
1.2.8.1. Technique d'isolements des bactéries
acétiques
La technique d'isolement consiste à prélever 0.1 ml
de solution mère et 0.1 ml des dilutions
(10-1 à 10-3) à l'aide d'une
pipette Pasteur stérile pour l'étalement.
Page 64
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
Le milieu de culture de base pour les bactéries
acétique est un milieu liquide glucosé contient des CaCO3
(bouillon pour bactérie acétique) ou le même milieu
gélosé (gélose pour bactérie acétique) .Pour
un isolement sélectif, il est préférable d'utiliser milieu
à l'éthanol du type de ceux décrits pour
différencier les Acetobacter des Gluconobacter et qui
permettent à la fois un isolement et une différenciation: milieu
gélose de Carr ou milieu gélose de Frateur. Ce milieu peut
être additionné éventuellement d'actidione si le produit
étudié contient beaucoup de levures. Le milieu DSM permet
également d'isoler et de différencier les bactéries
acétiques : il contient du sorbitol et du mannitol, du
désoxycholate et de la cycloheximide comme agent sélectif et du
lactate comme agent de différentiateur (avec BCP). Les Acetobacter
font au pourpre (lactate+) contrairement aux Gluconobacter qui
restent jaune (lactate -) (Guiraud, 1998).
? Prélèvement de colonies
isolées
On prélevant les colonies apparaissant
morphologiquement différentes. Sur le milieu d'isolement (milieu
Frateur), et par étalement régulier, les
prélèvements s'effectuent, prenant tous les colonies
isolées, et les colonies apparaissant morphologiquement
différents sur les autres. Il nécessaire de prélever au
hasard plusieurs colonies d'un même type pour vérifier
l'homogénéité (Guiraud, 2012 et NF.ISO
7218).
? Purification des souches (repiquages
successifs)
La méthode courante utilise des tubes de milieu solide
inclinés ou en culot .Une fois ensemencés, les tubes sont
placés à étuve pour que la croissance débute puis,
avant qu'elle ne soit trop abondante, les tubes sont placés dans une
armoire réfrigérée à 4°C. La vitalité
de la souche se maintient pendant des durées variables, selon la
température et l'espèce microbienne. Au bout de ce délai,
un nouveau repiquage est réalisé.
Les bactéries demandent un repiquage plus
fréquent. Il conseillé de conserver dans ce cas (souches
sélectionnées ou marquées génétiquement) les
repiquages antérieurs et d'effectuer le nouvel ensemencement à
partir du tubes le plus ancien (Guiraud, 2012).
? Conservation
Plusieurs méthodes sont utilisables en fonction de la
souche et du but recherché. La technique courante de conservation des
souches est celle des repiquages successifs, mais elle est limitée dans
le temps. En effet, certaines souches accumulent des déches toxiques ou
modifient le pH : il est nécessaire de les repiquer très vite
après la fin de la croissance. Pour augmenter la durée de
conserver des cultures importantes, il est nécessaire de recourir
à la dessiccation, à la congélation ou à la
lyophilisation (Bougnou, 1988).
? Congélation
Page 65
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
Elle permet la conservation d'une quantité importante
de germes. Les cultures sont centrifugées stérilement et mises en
suspension dans un milieu à 10 % de glycérol .Elles sont
conservées à -25°C ou mieux à -80°C, la survie
peut attendre plusieurs années (Vicent, 1970).
1.2.8.2. Identification des bactéries
acétiques
L'identification phénotypique utilise un faible nombre
de caractères considérés comme importants tels que la
morphologie, la mise en évidence d'un caractère biochimique
(enzymes), sérologique (anticorps) ect. Les identifications
bactériennes par les caractères biochimiques et
sérologiques sont les plus utilisés en routine (Aboulal,
2008)
> Étude macroscopique (l'aspect) des
colonies
La première étape du diagnostic bactérien
et du biotypage d'une souche est la description macroscopique des colonies
isolées, parfois cette seule étude permet de connaître le
germe qu'on a en présence car les colonies sont typiques....
(Tekkouk, 1977 et Bourgeois et Leveau ,1980).
> Etude microscopique
L'observation microscopique permet de faire une étude
morphologique des cellules d'une espèce bactérienne. Elle
comprend :
> L'état frais
Cet examen permet d'apprécier la forme et parfois la
mobilité des germes étudiés (Annexes 01).
> Coloration simple
Coloration au bleu de méthylène (Annexes 01).
> Coloration de Gram
C'est une coloration qui permet de mettre en évidence les
propriétés de la paroi
bactérienne, et d'utiliser ces propriétés
pour les distinguer et les classifier en deux grands
groupes: Gram + et Gram - (Bourgeois et Leveau ,1980)
(Annexes 01).
> Identification biochimique
Les bactéries acétiques sont
représentées par les genres Acetobacter qui peut oxyder
l'acide acétique et l'acide lactique en CO2 et H2O (pouvoir sur oxydant)
et Gluconobacter qui ne le peut pas.
Une classification des souches fréquemment
utilisées est ancienne classification de Frateur. Cet auteur classe les
souches des bactéries acétiques en quatre groupes:
o Le groupe suboxydans qui correspond au genre Gluconobacter
(ou Acetomonas)
contenant selon Frateur l'espèce G. oxydans avec
quatre variétés.
Page 66
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
o Le groupe mesoxydans qui correspond à la
majorité des espèces d'Acetobacter
(considérées par Frateur comme des sous-espèces
d'A. acetie).
o Les groupes oxydant et peroxydans qui correspond à
l'espèce A. pasteurianus (et selon Frateur, respectivement
à A. pasteurianus avec cinq sous-espèce et A.
peroxydans) (Guiraud ; 2012).
La classification des souches en groupes, espèce et
variétés est basée sur les testes suivant: ?
Pouvoir suroxydant
Le pouvoir suroxydant est mise en évidence sur le
milieu Carr : virage au jaune du vert de bromocrésol pour Gluconobacter
et virage puis réversion au bleu pour Acétobacter .Il doit
être vérifié par culture sur le milieu gélosé
au lactate de calcium. Ce milieu est prépare en boite pétri et
ensemencé par touches. La production de CO2 et donc pouvoir suroxydant
se traduisent par une précipitation de carbonate de calcium autour des
colonies après 48 heures d'incubation à 28-30°C (zone claire
pour Gluconobacter et zone claire et précipitation marginale pour
Acétobacter) (Guiraud ; 1998).
? Catalase :
Le test est réalisé à partir une culture sur
milieu gélosé (Karen Reiner, 2010).
Principe : En présence
d'oxygène moléculaire, certaines réactions
métaboliques conduisent à la formation d'eau
oxygénée. La catalase est une enzyme qui dégrade l'eau
oxygénée en eau et oxygène.
? Pouvoir cétogène
Certaines bactéries acétiques peuvent
transformer le glycérol en dihydroxy acétone, qui peut être
mise en évidence par la liqueur de Fehling. Un milieu gélose au
glycérol est coulé en boite de pétri et ensemencé
par touches. Après 48 h d'incubation à 28-30 °C, la surface
du milieu est recouverte de liqueur de Fehling. Un halo d'oxyde de cuivre rouge
se développe autour des colonies à pouvoir
cétogène. Ce pouvoir peut être testé sur d'autre
alcool en remplaçant le glycérol par les produits à tester
(Guiraud ; 1998).
? Culture en présence d'ammonium comme seule
source d'azote et de 3% d'éthanol.
La culture est réalisée en utilisant le milieu
liquide de Hoyer-Frateur. L'inoculation est réalisée avec une
faible quantité de bactéries (une a trois gouttes de suspension
dans l'eau physiologique, réalisée a partir d'une culture sur
milieu solide). Le milieu est incubé à une température
comprise entre 28 et 30 °C pendant une période de 2à 14j. Le
développement est comparé à celui d'un milieu
témoin sans ammonium (Guiraud ; 2003).
? Présence d'un pigment
Page 67
Chapitre I : Matériels et méthodes
|
Partie 2 : Etude expérimentale
|
|
|
Sur le milieu d'isolement certaines souches de
bactéries acétiques possèdent un pigment rose ou brun
(Guiraud ; 2012 et Mariama. c et. al ; 2021).
? Formation d'acide gluconique à partir du
glucose.
Elle est mise en évidence sur le milieu de culture de
base pour bactéries acétiques (gélose pour
bactéries acétiques). Ce milieu coulé en boite de
pétri contient du glucose et du carbonate de calcium. La production
d'acide se traduit après 48 heures d'incubation à une
température comprise entre 28 et 30°C par clarification du milieu
autour des colonies (Guiraud ; 2012).
? Formation d'acide cétogluconique
La formation d'acide cétogluconique à partir de
gluconate est réalisée en utilisant le milieu de Haynes que l'on
incube à une température de 30°C pendant 48h .La
révélation se fait à l'aide du réactif
Bénédict avec 10 min de chauffage au bain marie à
100°C :il apparait un précipité rouge orangé. La
technique utilisée pour mettre en évidence le pouvoir
cétogène est utilisable en remplaçant le glycérol
par du gluconate. La formation d'acide cétogluconique peut aussi
être recherchée à partir d'un milieu glucosé
(Guiraud ; 2003).
? Production de cellulose
Elle est mise en évidence sur le bouillon pour
bactéries acétiques. La pellicule formée à la
surface du milieu prélevée et placée dans une capsule ou
sur une lame et recouverte de réactif (lugol) puis d'acide sulfurique
à 60%.Le développement d'une couleur bleue traduit la production
de cellulose (Mariama . C et. al ; 2021). Le
développement des fibres d'une couleur bleue signifier une production de
cellulose (Gibbs et Shapton ,1968)
? Etude de la tolérance des bactéries
acétiques aux températures élève
La thermo- tolérance des souches isolées a
été réalisé dans des milieux liquides de Frateur
(50 ml), ensemencé et incubé aux différentes
températures ; 30°C, 35°C, 40°C, 45°C, 50°C,
55°C, 60°C. Toutes les cultures sont comparées avec une
culture blanc (50 ml). Les flacons ont été inoculés avec
des colonies jeunes de 48 h d'incubation à 30°C puis incubé
simultanément séparément à des températures
différentes. La qualité totale de biomasse produit a
été déterminée en mesurant l'absorbance de la
culture sur un spectrophotomètre à 600 nm (DO mesuré par
spectrophotomètre) pour tous les échantillons (Mounir et
al. 2016).
? Etude la mobilité et l'utilisation de
mannitol (essai propre lui) :
Ensemencer avec pipette Pasteur, par piqure centrale, jusqu'au
fond du tube de gélose. Incuber à 30°C pendants 48 h ; la
fermentation du mannitol virage de la couleur au jaune du milieu .Les
bactéries mobiles envahissent tout le milieu à partir de la
piqure centrale.
Page 68
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
II.2. Résultats et discussions
Etude statistique :les résultats #177;
écartypes.
II.2.1. Matériels biologiques
(végétales)
II. 2.1.1Caractère morphologiques des dattes et des
raisins (#177; écartype)
Les caractéristiques des fruits
utilisées dans la fabrication du vinaigre sans regroupées dans
le
tableau (11)
Tableau 11 : Résultats des
caractéristiques morphologiques des dattes et raisins
|
Caractéristiques
morphologiques des
dattes
|
Valeurs
|
Caractéristiques morphologiques
des
raisins
|
Valeurs
|
|
(Masse totale|Masse de noyau) *10(%)
|
12.82#177;3.8
|
(Masse totale|Masse de noyau) *
10(%)
|
6.83#177;2.84
|
|
La masse totale (g)
|
6.5#177;0.4
|
La masse totale (g)
|
9.33#177;0.44
|
|
La masse de la pulpe (g)
|
5.7#177;0.06
|
La masse de la pulpe (g)
|
7.5#177;1.00
|
|
La masse du noyau (g)
|
1.02#177;0.5
|
La masse du noyau (g)
|
1.5#177;0.33
|
|
Longueur des dattes (cm)
|
3.7#177;0.3
|
Longueur des raisins (cm)
|
2.86#177;0.04
|
|
Largeur des dattes (cm)
|
1.5#177;0.05
|
Largeur des raisins (cm)
|
2.73#177;0.15
|
|
|
|
A partir du tableau nous remarquons une variation
Pour les dattes qui ont une variation de masse de la pulpe c'est
0.06 et d'un noyau est 0.5 et leur longueur est égale 0.3 et leur
largeur entre 0.05. Concernons les raisins on observe une variation de masse de
la pulpe c'est 1.00 et d'un noyau est 0.33 et leur longueur est égale
0.04 et leur largeur entre 0.15.
Cette variation due à la morphologie de chaque fruit.
Page 69
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
II.2.1.2-Analyses physicochimiques des dattes et raisins et
des deux vinaigres
? pH
La valeur de pH des matières premières (des
dattes et raisins) et les deux vinaigres sont présentés dans la
figure (1)
|
pH à 25°C
|
7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D R VD VR
Figure (1): Résultats du pH à 25
°C des échantillons (D : jus de datte, R :
jus de raisin, VD :
vinaigre de datte, VR:vinaigre de raisin).
Le control de PH est très importante pour la
détermination d'activité enzymatique de microflores
d'échantillons analysés. On observe que pour chaque
échantillon à un pH spécifique due à leur
composition. La variation du pH est due à la nature du substrat et de sa
composition, ces valeurs de pH ont un rôle dans la présence et la
multiplication des microorganismes spécifiques.
Le potentiel d'hydrogène est influencé par le taux
des différents acides contenant dans le produit alimentaire. Le pH joue
un rôle déterminant au cours des réactions chimiques et
biochimiques et influé sur la cinétique enzymatique par
conséquent sur les microorganismes. La figure (1) montre que pour le jus
de dattes le pH est d'une valeur maximale égale à 5.68 ce
résultat se rapproche de celui de Girard (1965) et qui
est égale à 5.61.
Concernant le jus de raisin le pH est d'une valeur maximale
égale à 4.65 ce qui est dans la gamme acide, cela est due
à sa composition naturelle
Page 70
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
Pour le vinaigre de datte le pH est acide avec une valeur
maximale de 3.80 ce qui favorise la croissance des bactéries
acétiques et qui donne une odeur particulière au vinaigre, notre
résultat est identique à celui de Ould El Hadj et
collaborateurs (2001)
? La teneur en eau (humidité)
Les valeurs d'humidité des dattes et raisins sont
présenté dans le tableau (12)
Tableau 12: Teneur en eau des dattes et raisin
:
Le fruit Teneur en eau(%)
Dattes 30.77
Raisin 31.02

A
B
Figure n°25: Résultats de la
mesure de l'humidité des l'échantillon étudiés A :
raisin, B : datte
L'étude de paramètre de l'humidité est
très importante pour la conservation d'échantillon. Le taux
d'humidités obtenues pour nos deux échantillons est presque
similaire. Et pour la datte « Hamira » la teneur en H2O est entre une
valeur minimum de 28.6% et un maximum de 52.37% ce qui correspond aux
résultats obtenues par Girard (1965), notre
résultat montre une qualité acceptable selon les normes de la
qualité diététique des dattes demi - molle
? Teneur en cendre et matière organique
(matière sèche)
Les valeurs de teneurs en cendres et matière
sèches des dattes et raisins et leurs vinaigres sont
présentées dans la figure (26).
Page 71
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|

98.58 99.92 99.52
98
D R VD VR
cd (%) MS (%)
Figure n°26: les résultats de cd :
cendre(%) et MS : matière sèche(%) des
échantillons (D
: jus de datte, R : jus de raisin, VD : vinaigre de datte,
VR:vinaigre de
raisin).

A B
Figure n°27 Résultats des MS des
échantillons A:Datte (D), B: Raisin (R) après
incinération.
On remarque que tous les résultats de la matière
sèche (MS) sont similaires cela signifie qu'il y'a une disparition
totale de l'eau et le reste de l'échantillon est une matière
organique. Les valeurs (MS) des deux vinaigres sont élevées est
sont rapprochées par rapport à leurs matières
premières et par contre pour les valeurs de cendre (cd) es
résultats sont négligeables cela est dues à l'absence
totale de l'eau et la présence de la matière organique.
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
Cette matière sèche est
représentée par la fraction organique et minérale des nos
échantillons (D : Datte, R : Raisin, VD : Vinaigre de datte, VR:Vinaigre
de raisin). Cette matière sèche est représentée par
la fraction organique et minérale des nos échantillons (D :
Datte, R : Raisin, VD : Vinaigre de datte, VR:Vinaigre de raisin). « Elle
est obtenue après évaporation de l'eau ».
Pour les résultats des dattes on a une valeur des
cendres égales à un maximale de 2%, le même résultat
est obtenues par Girard(1965). Et aussi proche de
résultats qui à obtenue par Slimani Abdelkader et Harma
Mohammed (2018) 2.5%.
Et notre résultat de datte est inférieure de
résultats de Ould EL Hadj et al. (2001) qui est
égale : pour le cendre qui est égale 8.00 et pour la
matière sèche égale 11.26.
? Conductivité et salinité
D R VD VR
Axis Title
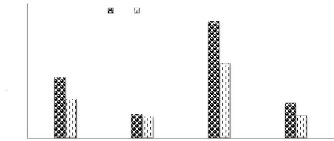
Axis Title
4
0
6
5
3
2
1
2.73
5.22
CE T° des sels
3.34
1.59
1.01
1.74
1.083
0.96
Figure n°27: Conductivité (CE) et
T° des sels des échantillons (D : Datte,
R : Raisin, VD :
Vinaigre de datte, VR:Vinaigre de raisin).
Page 72
On remarque que la conductivité et le taux des sels
sont très élevés dans vinaigre de datte par rapport les
autres, puis dattes, VR, finalement raisin.
La présence de conductivité et le taux de sel
signifies que (D : jus de datte, R : jus de raisin, VD : vinaigre de datte,
VR:vinaigre de raisin), contient des ions.
Page 73
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
Pour les deux matières premières en a
présence des macros et des micro-éléments naturellement
(les deux sont riches). Pour les deux vinaigre dues à la
dégradation des substances par des micro-organismes (bactéries et
champignons) et sont détectés par les analyses microbiologiques
(dénombrements :FMAT , GT, bactérie acétique, levure et
moisissure).
Et notre résultats de datte inférieure que la
résultats de Ould EL Hadj et al.(2001) qui est
égale 6.29.
? Le taux d'oxygène
Les différents résultats du taux d'O2 des
échantillons (D : jus de datte, R jus de raisin, VD : vinaigre de datte
et VR : vinaigre de raisin) sont présentés dans la figure
(29).
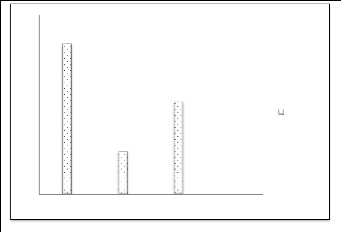
2.5
2
1.5
O2 mg/l
1
0.5
0
D R VD VR
Figure n°29: Les résultats du taux
d'O2 dans les échantillons (D :
Datte, R : Raisin, VD : Vinaigre de
datte, VR:Vinaigre de raisin).
Les résultats montrent que l'échantillon de
datte contient un taux élevé d'O2 par rapport aux autres
échantillons. Le vinaigre de raisin ne contient pas d'O2 ;
Page 74
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
? Dosages des sucres
Les résultats de la figure (6) représente les
résultats d'indice de réfraction des notre échantillon (D
: Jus de datte, R : Jus de raisin, VD : Vinaigre de datte, VR : Vinaigre de
raisin).
V' TSS (degré Brix)
La méthode du degré Brix permet de
déterminer le taux de saccharose. La figure (30) représente les
résultats obtenus pour les différents échantillons.
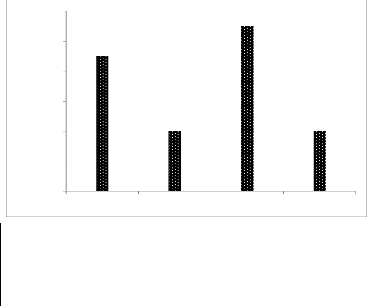
1.342
1.34
Indice de réfraction (IR)
1.338
1.336
1.334
1.332
1.33
VD VR D R
Figure n°30 : Les résultats
d'indice de réfraction (IR) des échantillons (D : Jus de datte, R
: Jus de raisin, VD : Vinaigre de datte, VR : Vinaigre de raisin).
On observe que TSS : taux des sucres soluble des dattes est le
plus élevé avec une valeur de 1.341 alors que pour le vinaigre de
datte (VD) il est de 1.339, le vinaigre de raisin et le jus de raisin ont une
valeur similaire égale à 1.334 et notre résultat de jus de
datte supérieure que résultats de Ould El Hadj et
al(2001) qui est égale 7.00.
V' Courbes d'étalonnage :
Tableau 13 : Les résultats des
dilutions de mesure des sucres totaux des échantillons (D : Jus de
datte, R : Jus de raisin, VD : Vinaigre de datte, VR : Vinaigre de raisin),
puis l'extrapolation sur la courbe d'étalonnage
référencier.
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
|
Dattes
|
Raisin
|
Vinaigre
dattes
|
Vinaigre.
raisins
|
|
T0
|
3.36#177;1.1
|
1.46#177;1.22
|
1.05#177;0.73
|
0.66#177;1.15
|
|
T1
|
1.39#177;0.93
|
0.16#177;0.16
|
0.04#177;0.04
|
1.42#177;2.2
|
|
T2
|
1.30#177;1.11
|
0.17#177;0.07
|
0.01#177;0.01
|
0.59#177;0.9
|
|
T3
|
1.01#177;0.96
|
0.12#177;0.08
|
0.04#177;0.04
|
0.06#177;0.02
|
|
T4
|
0.85#177;0.73
|
0.06#177;0.08
|
0.07#177;0.09
|
0.04#177;0.3
|
|
T5
|
0.35#177;0.56
|
0.05#177;0.07
|
0.06#177;0.09
|
0.08#177;0.01
|
|
On prend T4 pour les calculs des ST : sucre
totaux(%).
|
|
|
|
Dattes
|
Raisins
|
Vinaigre
de dattes
|
Vinaigre
de raisins
|
|
ST(%)
|
98
|
54
|
31
|
15
|
On observe que le sucres totaux%(ST %) de dattes est plus
élevé que les autres échantillons car la
variété des dattes « Hamraya, locale » donc cette
variété constitue un excellent aliment de grande valeur nutritive
et énergétique, notre résultat qui est de 98% est plus
élevé que celui de Girard (1965) qui est de
56.78% et aussi plus élevé que Ould EL Hadj et
al(2001) qui est de 9.58%, et aussi
élevée que Belguedj(1996) qui est 66%.
? L'acidité tétrable
Les résultats du tableau (14) résume les
résultats de concentrations d'acide acétique et acide lactique
des échantillons (D : Jus de datte, R : Jus de raisin, VD : Vinaigre de
datte, VR : Vinaigre de raisin) en fonction de cette équation :
Acidité =acide acétique +acide lactique
Tableau 14: Les résultats de
concentrations d'acide acétique et acide lactique des
échantillons (D : Jus de datte, R : Jus de raisin, VD : Vinaigre de
datte, VR : Vinaigre de raisin).
Dattes Raisins Vinaigre Vinaigre
de. dattes de. raisins
Acide acétique 0.30#177;0.08 0.016#177;0
0.18#177;0.02 0.17#177;0.02
Page 75
Page 76
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
(mol/l)
|
Acide lactique
(mol/l)
|
0.2#177;0.05 0.01#177;0 0.110#177;0.01 0.113#177;0.01
|
Les résultats montrent que la matière
première des dattes et le vinaigre de datte (VD) contiennent des
concentrations élevés en acide acétique avec des valeurs
moyenne égale 0.30 mol/l et 0.18 mol/l successif et acide lactique aussi
avec des valeurs moyenne égale0.2 mol/l et 0.113 mol/l par rapport au
jus de raisin et vinaigre de raisin qui à des valeurs moyenne
égale :Pour l'acide acétique à égale (0.016 mol/l
et 0.17 mol/l) successif et l'acide lactique (0.01 mol/l et 0.113 mol/l)
successif.
L'acidité titrable est un indice quantitatif qui permet
de juger la fraîcheur de nos échantillons (D : Datte, R : Raisin,
VD : Vinaigre de datte, VR:Vinaigre de raisin). ; Elle est également
étroitement liée aux acides organiques de produit sous l'action
des microorganismes sur les sucres réducteurs qui sont présent
avec abondance dans nos produits.
Et notre résultat d'acidité de datte est
inférieur aux résultats de Belguedj(1996) et Slimmani
Abdelkader et Harma Mohamed(2018) qui est égale
3.
? Densité
Les résultats de la densité des deux vinaigres
obtenus sont présentés dans la figure 31.
D
Densité
23.2
23
22.8
22.6
22.4
22.2
22
VD VR
Figure n°31: Résultats de la
densité de vinaigre des dattes (VD) et vinaigre de raisins (VR).
Page 77
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
On observe que la densité de vinaigre de raisin est plus
élevée que vinaigre de dattes.
Et en parallèle notre résultats de VD est plus
élevé que le résultat de Ould El Hadj et
al, (1.15).
? La viscosité
Les résultats de la viscosité des deux vinaigres
sont résumés dans le tableau 15 Tableau 15:
Résultats de la viscosité des deux vinaigres :
Echantillons Viscosité
Vinaigre de raisins 6.02#177;0.2
Vinaigre de dattes 3.7#177;0.2
Les résultats montrent que la viscosité du
vinaigre de raisin et plus élevé que celle du vinaigre des
dattes, car le taux de la force de friction est plus élevé dans
le vinaigre de raisin.
Page 78
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
? Dosage d'alcool
Les résultats du dosage d'alcool par deux méthodes
sont résumés sur le tableau 5
Tableau 16: résultats du dosage
d'alcool par deux méthodes des deux échantillons raisins et
dattes
Page 79
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
|
Echantillons
|
Mesure directe par l'alcoomètre
|
Indirecte (g/l)
(dosage d'alcool)
|
|
Vinaigre de dattes
|
|
Non détectable
(trace)
|
|
1.517
|
|
|
|
|
|
|
Vinaigre de raisins
|
|
Non détectable
(trace)
|
|
1.518
|
|
|
|
Page 80
|
Partie 02 : ETUDE EXPERIMENTALLE]
|
Chapitre II : Résultats et discussions
|
|
Le tableau 5 révèle que le taux d'alcool est de
1.517 g/l pour le vinaigre de dattes et 1.518 g/l pour le vinaigre de raisins.
Nos résultats sont inférieur à ceux de de Boukhiar
Aissa (2019) dans la région M'Zab trouvé où la
valeur était de (3.82#177;0.05).
Il convient de rappeler que le taux d'alcool résiduel
dans un vinaigre ne devant pas dépasser 0.5% (Codex Alimentarus), donc
nos résultats dépassent le seuil. On devrai procéder
à l'évaporation de l'alcool pour qu'il soit consommable.
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
II.2.1.3. Résultats des analyses microbiologiques
des matières premières (dattes et raisins) et leurs
vinaigres
Le tableau 17, nous indique le résultat du nombre de
colonies (UFC) par gramme de dattes et de raisins.
Tableau 17: Résultats des analyses
microbiologiques de la matière première jus de dattes et raisins
et leurs vinaigres
|
Produit
analysé
|
FMAT
(UFC/gr)
|
GT
(UFC/gr)
|
BA
(UFC/gr)
|
BL
(UFC/gr)
|
Levures et
moisissures
(UFC/gr)
|
|
Jus de dattes
|
6.5#177;0.2
|
6.4#177;0.2
|
Ind
|
Ind
|
6.1#177;0.3
|
|
Jus de raisins
|
6.3#177;0.1
|
6.2#177;0.1
|
6.3#177;0.05
|
Ind
|
4.7#177;0.7
|
|
Vinaigre de
dattes
|
6.2#177;0.6
|
6.3#177;0.2
|
+
|
6.4#177;0.4
|
5.4#177;0.7
|
|
Vinaigre de
raisins
|
Abs
|
6.5#177;0.08
|
+
|
5.1#177;0.8
|
Moins de 30
colonies
|
FMAT: Flore mésophile totale, GT : Germes totaux, BA :
Bactéries acétiques, BL: Bactéries lactiques
+ : bactérie recherchée ; S : stérile ;
Ind : indénombrable, Abs : absence.
Les résultats du tableau (6) montrent que pour le jus
de datte les FMAT ont une valeur moyenne de 6,5 (UFC/gr) tandis que pour le jus
de raisin la valeur est inferieur et elle est égale à 6.3
(UFC/gr)
Concernant la qualité microbiologique des deux
vinaigres deux répétitions ont été
réalisées pour le dénombrement des FMAT et germes totaux.
Le tableau (6) indique que le vinaigre de datte comprend un nombre égale
à 6.2 (UFC/gr) en FMAT une absence de cette flore est notée dans
le vinaigre de raisin.
Pour les germes totaux on a la valeur moyenne concernons le
jus de datte égale 6.4 qui est supérieure au jus de raisin. Et
pour leur vinaigre le vinaigre de datte est inférieur que le vinaigre de
raisin.
Page 81
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 82
Concernant les bactéries acétiques est
indénombrable dans les analyses de jus de datte et supérieure que
jus de raisin car on a obtenu une valeur moyenne égale à 6.3 (car
les bactéries acétique se trouve à la surface des
fruits).Et pour les deux vinaigre obtenue s'est notre but principale de cette
expérience.
Les résultats montrent que pour les bactéries
lactiques pour les deux échantillons (datte et raisin) on a nombre
indénombrable. Concernons le vinaigre on a obtenu une valeur moyenne
égale à 6.4 pour vinaigre de datte et supérieure à
vinaigre de raisin 5.1.
Les levures et moisissures sont présentes dans le
vinaigre de raisin (=5 colonies) car les conditions sont défavorables.
Les conditions dans le vinaigre de raisins sont favorables pour la
multiplication de certain type des champignons spécifiques.
La qualité microbiologique des deux vinaigres ne sont
pas acceptable (insatisfaisant) selon les normes du Journal Officiel de la
République (JORA N°39., p31.2017 /1438). Car notre
résultat est supérieur par rapport au seuil (102).
Les résultats de Ould El Hadj et al (2001)
pour datte cultiva Hamraya indique que Concernons les germes totaux
(GT) il trouvé (13.8 et 2.30), donc la valeur moyenne de nos
résultats (6.4) est entre 13.8 et 2.30.
Pour bactéries acétique il trouvé 13.8,
est nous en a nombre indénombrable, donc supérieure que 13.8.
Et en fin pour les champignons il trouvé 2.30
inférieure que nos résultats 6.1.
II.2.2. Essai préliminaire de la formulation du
vinaigre biologique à partir d'une méthode traditionnelle:
Application aux dattes variété « Hmira » et raisin
(rouge autochtone)
Nous avons effectué deux essai de formulation du
vinaigre biologiques tout en gardant les mêmes recettes
préconisée par la pratiques traditionnelle dans la région
de Mascara / Ghriss. Les conditions opératoires choisies sont
décrites dans le tableau 18
Tableau 18: Condition opératoires de
la préparation du vinaigre de datte et de raisin par la méthode
traditionnelle. (Ould el hadj et al ., 2001).

Chapitre II: Résultats et discussions
PARTIE02 :ETUDE EXPERIMENTALLE
Page 83
Natures végétales Les conditions
opératoires
|
Dattes et raisins
|
-Bouteille en plastiques.
-Rapport massique Dattes et
raisins / eau
(1/ 2).
-T=25°C et 30°C.
-A prés 15 j
on lève le couvercle.
- A prés 40 j on filtrés le
vinaigre obtenues.
|
Le tableau (18) représente les principales conditions
opératoires de la préparation du vinaigre de datte et de raisin
par la méthode traditionnelle, en doits le respectée cette quatre
conditions pour avoir un vinaigre.
Nous utilisons bouteille en plastique opaque pour ne laisse
pas la lumière passe aux vinaigre (pour éliminer les effets et
l'interaction avec notre solution).
Pour le rapport elle est déjà citée dans
le protocole opératoire de préparation de vinaigre (voire page 59
dans partie méthode).
Concernons le temps :
A prés 15 j on lève le couvercle car cette
première durée de temps (15 j premier) c'est le temps de
fermentation alcoolique se faits aux conditions hermétique fermée
et après en doits l'ouvert le couvercle pour le déclenchement de
fermentation acétique. Et finalement en filtrait le vinaigre obtenue.
La technique d'élaboration du vinaigre traditionnelle
est basée sur une double fermentation combinée: anaérobie
et aérobie successif (voire processus de fermentation)
.Cette bioconversion utilise des levures et des bactéries
acétiques présentes naturellement dans la datte. (Ould el
hadj et al ., 2001).

Processus de fermentation Fermentions
alcoolique
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 84
La fermentation alcoolique se déroule en milieu
anaérobie. Elle est assurée par des levures du genre
Saccharomyces qui sont présentes naturellement sur la datte (surface des
fruits). Elle est principalement basée sur la transformation des sucres,
essentiellement glucose et fructose, qui pénètrent dans la
cellule de la levure par diffusion facilitée et subissent une
phosphorylation aboutissant à la fin de la fermentation à
l'alcool éthylique, mais aussi sur la production de différents
composé qui accompagnent cette production alcoolique, et jouant un
rôle organoleptique majeur sur la qualité du produit
(Bouorgeois et Larpent, 1990). La réaction se
déroule selon l'équation suivante :
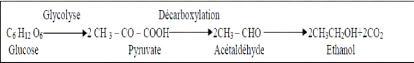
Fermentation acétique
La fermentation acétique assurée par les
Acétobacters qui oxydent l'éthanol en acide acétique en
présence d'oxygène. Les bactéries acétiques
n'interviennent que si la teneur en alcool est faible (Guiraud, 1998 ;
Tesfaye et al., 2002).
Elle met en jeu des déshydrogénases membranaires
liées à des cytochromes (Bourgois et al, 1990),
selon la réaction suivante:
II.2.1. Caractères organoleptique
Les caractéristiques organoleptiques des deux vinaigres
(datte et raisin) sont résumées dans le tableau 19
Tableau 19: caractéristiques
organoleptiques des deux vinaigres (datte et raisin)
|
Echantillons/ conditions
|
Gout
|
Odeur
|
Couleur et aspect
|
|
Vinaigre de
|
Avant
filtration
|
/
|
Désagréable
|
Brun foncé avec précipité
marron.
|
|
dattes
|
Après
filtration
|
/
|
Désagréable
|
Brun
|
|
Vinaigre de
|
Avant
filtration
|
/
|
Agréable
|
Rose avec précipitaté.
|
|
raisin
|
Après
filtration
|
/
|
Agréable
|
Rose.
|
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 85
On remarque que dans les deux vinaigres présence une
précipitation.
Le vinaigre des dattes est brun due a la couleur des dattes,
précipitation (sédimentation) avant filtration car les composant
et tous les éléments sont précipiter en bas.
Pour le vinaigre des raisins il est rose due a la couleur des
raisins, précipitation (sédimentation) avant filtration car les
composant et tous les éléments sont précipiter en bas.
2.3. Isolement et identification d'Acetobacter aceti à
partir des deux vinaigres
2.3.1. Etude macroscopique (Caractère
culturaux)
L'isolement a été réalisé sur milieu
Frateur et Bactérie acétique les résultats sont
démontrés dans le tableau 20
Tableau 20 : les caractères culturaux des
neufs (09) isolats.
|
Isolats
|
Taille
|
Forme
|
Surface
|
Opacité
|
consistance
|
Pigmentation
|
|
A1
|
Moyenne 2 mm
|
Circulaire
et bombée
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Beige
|
|
A2
|
Petite
1 mm
|
Irrégulière
et convexe
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Beige
|
|
A3
|
Petite
1 mm
|
Irrégulière
et convexe
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Beige
|
|
A4
|
Moyenne
2 mm
|
Circulaire
et convexe
|
Brillante
|
Opaque
|
visqueuse
et crémeuse
|
Beige
|
|
A5
|
Petite
1mm
|
Punctiforme et convexe
|
Brillante
|
Opaque
|
visqueuse
et crémeuse
|
Beige
|
|
A6
|
Grosse
5 mm
|
Circulaire
et bombée
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Beige
|

Chapitre II: Résultats et discussions
PARTIE02 :ETUDE EXPERIMENTALLE
Page 86
|
A7
|
Grosse
5 mm
|
Irrégulière
et convexe
|
Brillante
|
Opaque
|
Visqueuse et crémeuse
|
Beige
|
|
A8
|
Grosse
5 mm
|
Circulaire
et convexe
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Beige
|
|
A9
|
Petite
1mm
|
Punctiforme
et convexe
|
Brillante
|
Opaque
|
Visqueuse
et crémeuse
|
Crème
|

Figure n°32: Aspect macroscopique de
l'isolat A1 sur milieu
milieu Frateur.
À l'issu des résultats de culture des
échantillons de vinaigre de datte cultivar Hamraya et vinaigre de raisin
variété rouge autochtone sur le milieu sélectif Frateur,
des colonies avec différents critères culturaux sont obtenues,
ces critères ont varié pour les colonies d'un même
échantillon et pour celles provenant des deux types
d'échantillons.
Les colonies cultivées sur milieu solides
présentent en différent types de formes et de taille, lesquelles
:
-Les isolats A1 et A5 ont taille moyenne (2 mm) et forme
circulaire et sont beige par rapport les isolats A6, A7, A8 ont de taille
grosse (5mm) et forme circulaire irrégulière et circulaire,
convexe et son aussi beige. Concernons les isolats A2, A3, A5, A9 sont de
taille petite (1mm)
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
et forme les isolats A2, A3de forme irrégulière et
A5, A9 de forme punctiforme et son aussi beige.
Et d'après nos résultats en remarque que les neufs
(09) isolats ont le même surface, opacité, consistance,
pigmentation malgrais sont issue de deux échantillons.
Ces caractères culturaux sont différents est
spécifiques pour chaque isolats due à la présence des
gènes spécifiques.
Donc, d'après nos résultats des isolements des
bactéries acétiques sur milieu naturel(Frateur), Les
caractères morphologiques et culturaux des colonies présentes des
profils caractéristiques correspondent probablement aux bactéries
acétiques (Ould Elhadj et al., 2001).
II.2.3.2. Etudes microscopiques
Le tableau 21 suivant résume les observations
microscopiques de coloration de Gram correspondant aux colonies décrites
précédemment
Page 87
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 88
Tableau 21: Résultats obtenus d'observations de
coloration de Gram àG100x :
|
Milieu
|
Type de
colonies
|
Formes et
association
|
Types de Gram
|
Photo
|
|
A1
|
Opaque et bombée
|
*Forme variable (bacille transformé en
coccobacille.
*Mode de groupements : Isolés, diplobacille et en amas.
|
négative
|
|
|
A2
|
Opaque, brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
|
A3
|
Opaque brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
|
A4
|
Opaque brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 89
|
A5
|
Opaque brillante et convexe
|
*Forme de coccobacille.
* Mode de groupements : Isolé, diplobacille et en
chainette.
|
négative
|
|
|
A6
|
Opaque brillante et bombée
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
|
A7
|
Opaque brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
|
A8
|
Opaque brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
|
A9
|
Opaque brillante et convexe
|
*Forme de coque.
*Mode de groupements : Isolés, diplocoques, en amas et en
chainette.
|
négative
|
|
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
L'examen microscopique de ces souches après coloration
de Gram, les bactéries apparaissent sous forme de coque et coccobacille
de taille variable, de couleur rose, donc ces bactéries sont de Gram
négative et elles sont regroupent en forme isolées ou en
chaînette.
Pour Soheir (2012), l'examen microscopique
des colonies bactérienne acétique isole dans le thé de
Kombicha en Egypte donne la même forme et Gram avec nos
résultats.
Et aussi, pour Aboulala ( 2008), cité
par Khelif ( 2016), l'examen microscopique des colonies
isolées dans le vinaigre de Daglet-Nour et Hchef Daglet-Nour de
différentes régions Ouargla, Ghardaïa et Touggourt, et
Khelif ( 2016), l'examen microscopique des colonies
isolées à partir des échantillons du vinaigre traditionnel
de datte (Hamraya et Déchet Daglet-Nour) du Sahara Septentrional Est
Algérien, donne les mêmes formes, regroupements et Gram avec nos
résultats.
Pour Bachi Hanane et Bensayah Sara(2017),
l'examen microscopique des colonies isolées à partir des
échantillons du vinaigre traditionnel du vinaigre traditionnel des
dattes cultiva Hamraya donne la même forme et Gram avec nos
résultats.
Pour Frouhat Aicha et Drib Amina (2017),
l'examen microscopique des colonies isolées à partir des
échantillons du vinaigre traditionnel des dattes cultiva Deglt-Nour
donne la même forme et Gram avec nos résultats.
2.3.3. Etude physiologique et biochimique
Les résultats obtenus suite aux différents tests
physiologiques et biochimiques sur les colonies isolées et
purifiées sont illustrés dans le tableau 22
Page 90
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Tableau 22: Identification Biochimiques de
différentes souches isolées sur différents milieux
Pouvoi
|
Catalase HF
|
r.sor
|
Pigmentation Cellulose Acide gluconique Pouvoir
cétogène Haynes
|
Expérience
A1 + + + - + - + -
A2 + - - - + + + +
A3 + + + - - + + +
A4 + - + - + + + +
A5 + - + - - + + +
A6 + - + - - + + +
A7 + - + - + + + +
A8 + - + - - + + +
A9 + - + + - + + +
Page 91
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 92
Page 93
Page 94
Page 95
Page 96
*La recherche de la catalase est un test fondamental pour
l'identification des souches, après la réalisation du test
catalase, nos souches d'Acétobacter sont de catalase positive
(production d'O2 et l'apparition de bulles).
caua ??a??e
O2
D'après nos résultats on observe que tous les 09
isolats sont catalase positifs selon la photo dans le tableau 9.
H2O2 H2O +1
2
L'enzyme catalase permet la décomposition de l'eau
oxygénée (l2O2) produit en fin de la chaine
d'oxydoréduction en O2 et l2O (Guiraud, 2012).
Pour Khelif (2016), les isolats
d'Acétobacter issues du vinaigre traditionnel de dattes (Hamraya et
Déchet Daglet-Nour) d'Ouargla, présentent un catalase positive
comme nos résultats. Pour (Arifuzzaman et al., 2014)
tous les isolats d'Acétobacter issues de la canne à
sucre et des fruits pourris présentent un catalase positive comme nos
résultats. L'enzyme catalase permet la décomposition de l'eau
oxygénée (l2O2) produit en fin de la chaine
d'oxydoréduction en O2 et l2O (Guiraud, 2012).
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé trois souches des bactéries acétique sont
catalase positif qui était isolait à partir du vinaigre
traditionnel des dattes cultivas Hamraya comme nos résultats.
Beheshti-Mall et Shafiee (2012), toutes les
souches d'acétobacter isole a partir de pêche iranienne sont de
catalase positive comme nos résultats.
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour qui ont une catalase positif comme
nos résultats.
* Pour la culture sur milieu de loyer pendant 72h à
30°C, test de l'utilisation des sels ammoniacaux comme seule source
d'azote les résultats montre que les deux isolats A1 et A3 sont de
Hoyer+, Donc ces isolats peuvent se développer en présence
d'ammonium comme seul source d'azote et de 3% d'éthanol (loyer positif)
(Photo dans le tableau 22).
Pour Kader et al., (2008), trouvent que les
bactéries acétiques isolée a partir de noix de coco sont
de Hoyer + donc il ya le développement des souches qui sont utilises des
sels ammoniacaux comme source d'azote est la résultat se traduit par
l'apparition de turbidité de milieu, ce résultat est proche
à nos résultat.
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique qui
sont isolées à partir du vinaigre traditionnel des dattes
cultivas Hamraya ont teste Hoyer+.
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour qui ont une Hoyer + comme nos
résultats.
Ce sont les résultats obtenus par Khelif
(2016), pour les souches d'Acétobacter, isolées du
vinaigre traditionnel de dattes (Hamraya et Déchet Deglet-Nour) de
Ouargla trouvé comme nos résultats.
Et pour les autres isolats :
Résultats négatifs d'A4 (présence de
trouble dans le milieu HF#177; ammonium) cet isolat n'utilise pas des sels
ammoniacaux comme seule source d'azote ; il utilise le et d'autres comme source
d'azote. Et les isolats A2, A5, A6, A7, A8, A9 n'utilisent pas l'ammonium comme
source d'azote « absence de trouble le milieu HF#177; ammonium ».
* Après la réalisation du première test
du pouvoir suroxydant, réalisé sur milieu de Carr et permet de
mettre en évidence la différence entre les bactéries du
genre Acétobacter et celles du genre Gluconobacter, le résultat
obtenu est comme la suite :
Le virage de l'indicateur coloré du bleu-vert au jaune
sous l'effet de la production d'acide acétique, puis la réversion
au bleu-vert, ceci indique que ces bactéries sont du genre
Acétobacter car ce genre à la capacité d'oxyder l'acide
acétique en CO2 et H2O. Alors que et le virage de l'indicateur
coloré au jaune du vert de bromocrésol est spécifique aux
bactéries du genre Gluconobacter, puisque se genre à la
capacité de produire de l'acide acétique (Guiraud, 1998
et Girard et Rougieux, 1958).
Pour les isolats 01, 03, 04, 05, 06, 07,08 et 09 on remarque
le virage de couleur au bleu après 48h qui ont pouvoir suroxydant
positif, par à contre l'isolat 02 à négative (pas de
changements de couleur) selon la photo dans le tableau (22).
Alors que les résultats de Aboulala (2008),
des colonies isolées dans les vinaigres des dattes Daglet-Nour
et Hchef Daglet-Nour de Ouargla, Ghardaïa et Touggourt, et les
résultats de Khelif (2016), pour les vinaigres des
cultivars Hamraya et Déchet Daglet Nour de Ouargla, sont relativement
proche de nos résultats obtenu où ils ont trouvés un seul
genre Acétobacter. Les résultats de l'isolement des
bactéries acétiques issues de la canne à sucre et des
fruits pourris, laissent remarquer un virage de vert au jaune puis une
réversion au bleu sur milieu de Carr, ce qui confirme que sont des
genres d'Acétobacter (Arifuzzaman et al., 2014). La
capacité des souches à convertir la couleur vert de Carr au jaune
après 48 heures ont suggéré qu'elles étaient
liées à Gluconobacter ou Acétobacter
spp, mais la couleur revenait du milieu Carr du jaune au bleu après
96 heures d'incubation à 30 ° C a montré que la
bactérie isolée
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
était une souche suroxydant et a confirmé celle
relative à Acétobacter spp (Beheshti Maal et
Shafiee, 2012) proche de nos résultats.
Beheshti-Maal et Shafiee (2012), les
bactéries acétique isolé à partir de pêche
iranienne sont de pouvoir suroxydant positif proche de nos résultats.
Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique qui
ont isolées à partir du vinaigre traditionnel des dattes cultivas
Hamraya ont une pouvoir suroxydant positif proche de nos résultats.
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour ont une pouvoir suroxydant positif
proche de nos résultats.
* Le résultat de test de pigmentation, montre que les
isolas A1, A2, A3, A4, A5, A6, A7, A8, n'ont pas de pigment sur milieu glucose
carbonate solide après 48h d'incubation à 30°C (Photo dans
le tableau 22).
Kader et al. (2008), trouvent que les
bactéries acétiques isolée a partir de noix de coco ne
peuvent pas produit de pigment proche de nos résultats.
Selon Aboulala (2008), le test de
pigmentation sur milieu glucose carbonate solide, montre que la
sous-espèce de l'espèce Acétobacter aceti issues du
vinaigre traditionnel des dattes Deglet-Nour et Hchef Deglet-Nour de Ouargla,
Ghardaïa et Touggourt présente un résultat négatif
proche de nos résultats.
Pour (Kadere et al., 2008), tous les isolats
d'Acétobacter issues du vin de noix de coco de zones de Mtwapa et
Kikambala de la région côtière du Kenya, les
résultats de test de formation de pigment brun sur milieu GYP (Glucose,
Extrait de levure et peptone) étaient négatifs proche de nos
résultats.
Les bactéries acétiques issues de la canne
à sucre et des fruits pourris, isolés par Arifuzzaman et
al. (2014), présente un résultat négatif de
pigmentions brune sur milieu GYP proche de nos résultats.
Et pour l'isolat A9, elle est pigmentée en brun sur
milieu glucose carbonate solide après 48h d'incubation à
30°C.
Concernant la production de cellulose chez notre isolats (A1,
A2, A4, A7), on a observé le développement d'une pellicule
blanche, après l'addition de lugol puis l'acide sulfurique, on a obtenue
des fibres de couleur bleu donc il y a de production de cellulose (Photo dans
le tableau 22).
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Et pour les restes isolats (A3, A5, A6, A8, A9), on n'a pas
remarqué développement d'une pellicule blanche à la
surface du tube.
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique qui
sont isolées à partir du vinaigre traditionnel des dattes
cultivas Hamraya : n'ont pas la capacité de produire la cellulose proche
de nos résultats des isolats (A3, A5, A6, A8, A9).
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour : ne peuvent pas produisent la
cellulose proche de nos résultats des isolats (A3, A5, A6, A8, A9. Le
test de production de cellulose présente un résultat
négatif pour certains isolats d'Acétobacter issues des vinaigres
des dattes Daglet-Nour et Hchef Daglet-Nour de Ouargla, Ghardaïa et
Touggourt (Aboulala, 2008) et des dattes Hamraya et
Déchet Daglet-Nour de Ouargla (Khelif, 2016) proche de
nos résultats des isolats (A3, A5, A6, A8, A9).
Romero-Cortes et al., (2012) trouvent dans
les études d'isolement et caractérisation des bactéries
acétique dans la fermentation des souches bactérienne
acétique ne prouvent pas produit la cellulose.
* Pour la formation d'acide gluconique à partir de
glucose. Après 48 h d'incubation des isolats A2, A3, A4, A5, A6, A7, A8,
A9 qui ont ensemencées sur milieu glucosé carbonaté
solide, apparaissent des zones claires autour des colonies, donc les deux
souches produit l'acide gluconique (Photo dans le tableau 22).
Pour Hamidi et Slimani, (2008), ont
isolée des bactéries acétiques issues du vinaigre
traditionnel de dattes de la région de M'Zab, qui forment l'acide
gluconique à partir de glucose proche de nos résultats des
isolats (A2, A3, A4, A5, A6, A7, A8, A9).
Et pour l'isolat A1, elle ne peut pas produit l'acide
gluconique « absence une zone claire autour des colonies.
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique qui
sont isolées à partir du vinaigre traditionnel des dattes
cultivas Hamraya : ne prouvent pas produit l'acide gluconique proche de nos
résultats d'isolat A1.
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour : ne prouvent pas produit l'acide
gluconique proche de nos résultats d'isolat A1.
Pour certains isolats d'Acétobacter du vinaigre
traditionnel de dattes (Hamraya et Déchet Daglet-Nour) d'Ouargla, le
test de formation d'acide gluconique à partir du glucose sur milieu
gélose carbonate de calcium donne un résultat négatif
(Khelif, 2016) proche de nos résultats d'isolat A1.
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
L'incubation des souches pendant 48 heures à 30°C
sur milieu gélosé au glycérol puis l'addition de liqueur
de Fehling, laisse apparaitre une halo rouge autour de colonies
résultant de la précipitation de l'oxyde de cuivre et cela avec
toutes les 09 isolats. Donc toutes ces souches ont un pouvoir
cétogène (Photo dans le tableau 22)
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour qui ont une pouvoir
cétogène proche de nos résultats.
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique sont
pouvoir cétogène qui était isolées à partir
du vinaigre traditionnel des dattes cultivas Hamraya proche de nos
résultats.
Les isolats d'Acétobacter issues du vinaigre
traditionnel de dattes (Hamraya et Déchet Daglet-Nour) d'Ouargla, ont un
pouvoir cétogène (Khelif, 2016). D'après
Aboulala (2008), si le teste de catalase est positif, et le
teste du pouvoir cétogène est positif, ça permet de
pré-identifier l'espèce Acétobacter aceti proche
de nos résultats.
L'isolat A1 elle est ensemencée sur milieu Haynes
liquide. Après 48 heures d'incubation à 30°C, une
révélation est poursuivre à l'aide de réactif de
Bénédict avec 10 minutes de chauffage au bain-marie à
100°C. On n'observe pas une apparition d'un précipité rouge
orange (Photo dans le tableau 22). Donc il n'y a pas de formation d'acide
cétogluconique. Pour Khelif (2016), certains isolats
d'Acétobacter issues du vinaigre traditionnel de dattes (Hamraya et
Déchet Daglet-Nour) d'Ouargla ne sont pas capables de produire l'acide
cétogluconique proche de nos résultats d'isolat A1.
Les travaux de Li et al. (2011), de
l'isolement et l'identification des bactéries acétiques issues
des dépôts abricot, montre la présence des bactéries
acétiques qui ne peuvent pas former l'acide cégluconique proche
de nos résultats d'isolat A1.
Pour Bachi Hanane et Bensayah Sara(2017),
trouvé deux souches des bactéries acétique qui
sont isolées à partir du vinaigre traditionnel des dattes
cultivas Hamraya : n'ont pas la capacité de produire cet acide proche de
nos résultats d'isolat A1.
Frouhat Aicha et Drib Amina (2017),
trouvé trois souches des bactéries acétique qui
ont isolées à partir des échantillons du vinaigre
traditionnel des dattes cultiva Deglt-Nour : n'ont pas la capacité de
produire cet acide proche de nos résultats d'isolat A1.
Et pour les isolats A2, A3, A4, A5, A6, A7, A8, A9, elles sont
la capacité de produire cet acid
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
2.3.1. Etudes de la tolérance des bactéries
acétiques à différentes températures :
Le tableau 23 et 24 résume les résultats de la
tolérance des neufs (09) isolats aux températures 25°C
30°C 37°C et 45°C
Tableau 23: Tolérance des bactéries
acétiques à différentes températures (les
résultats sont exprimé en UFC/g « nombres des colonies
»)
|
Isolats
|
|
UFC/g X (105)
|
|
|
25°C
|
30°C
|
37°C
|
45°C
|
|
A1
|
63
|
147
|
26
|
510
|
|
A2
|
75
|
22
|
54
|
590
|
|
A3
|
78
|
59
|
82
|
20
|
|
A4
|
34
|
10
|
92
|
52
|
|
A5
|
39
|
1
|
22
|
340
|
|
A6
|
81
|
920
|
53
|
48
|
|
A7
|
36
|
106
|
92
|
118
|
|
A8
|
10
|
190
|
540
|
480
|
|
A9
|
98
|
12
|
109
|
1
|
Tableau 24: Tolérance des bactéries
acétiques à différentes températures (les
résultats sont exprimé en DO « turbidité
»)
|
Isolats
|
|
|
DO
|
|
|
25°C
|
30°C
|
37°C
|
45°C
|
|
A1
|
0.63
|
1.47
|
0.26
|
0.051
|
|
A2
|
0.75
|
0.22
|
0.54
|
0.059
|
Page 97
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
|
A3
|
0.78
|
0.59
|
0.82
|
0.20
|
|
A4
|
0.34
|
1.00
|
0.92
|
0.52
|
|
A5
|
0.39
|
0.10
|
0.22
|
0.034
|
|
A6
|
0.81
|
0.092
|
0.53
|
0.48
|
|
A7
|
0.36
|
1.06
|
0.92
|
1.18
|
|
A8
|
0.10
|
0.019
|
0.054
|
0.048
|
|
A9
|
0.98
|
1.20
|
1.09
|
0.10
|
Les 09 isolats des bactéries acétiques qui sont
isolés à partir des deux vinaigres traditionnels
présentent des taux de croissances variables (mesuré par DO
à 600nm à prés 48h) dans différentes
températures de 25°C à 45°C), sur milieu Frateur
liquide avec DO0= 0.01
=
105UFC/g.
Tous d'abords nous commence par l'isolat A1 : à un taux
de croissance entre 0.051à T°C=45°C, 1.47 à T°C
=30°C, cette dernier présente une meilleure croissance à
leur T°C idéale des bactéries acétiques. Donc,
l'isolat A1elle toléré la croissance à T°C=30°.
Concernant l'isolat A2 : à un taux de croissance variée entre
0.059 à T°C = 45°C et 0.75 à T°C=25°C et
cette dernier représente une croissance maximale. Donc, l'isolat A2 elle
a une croissance maximale à 25°C.
Pour l'isolat A3 : à un taux de croissance minimum
à 45°C (DO=0.020) et maximum à 37°C (DO=0.82). Donc,
l'isolat A3 elle préféré de croitre à 37°C.
Pour l'isolat A3 : à un intervalle de taux de
croissance entre 0.82 à T°C =37°C, 0.22 à T°C
=45°C. Donc cette T°C qui favorise plus la croissance cette
isolat.
Pour l'isolat A4 : à un taux de croissance changer entre
0.34 à T°C =25°C ,1.00 à T°C=30°C. Donc, la
T°C= 30°C c'est la T°C favorable pour obtenir une croissance
maximum. Concernant l'isolat A5 : à un intervalle de taux de croissance
entre 0.034 à T°C =45°C, 0.39 à T°C=25°C
.Donc, l'isolat A5 elle a une croissance maximale à 25°C.
Pour l'isolat A6 : à un taux de croissance minimum
à 30°C (DO=0.092) et maximum à 25°C (DO=0.81). Donc,
l'isolat A6 elle préféré de croitre à 25°C.
Concernant l'isolat A7 : à un taux de croissance
variée entre 1.18 à T°C = 45°C et 0.36 à
T°C=25°C. Donc, l'isolat A7 elle a une croissance maximale à
45°C.
Page 98
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 99
Concernant l'isolat A8 : à un intervalle de taux de
croissance entre 0.019 à T°C =30°C, 0.10 à
T°C=25°C et cette dernier représente une croissance maximale
.Donc, l'isolat A8elle a une croissance maximale à 25°C.
Finalement pour l'isolat A9 : à un taux de croissance
minimum à 45°C (DO=0.10) et maximum à 30°C (DO=1.20).
Donc, l'isolat A9 elle préféré de croitre à
30°C.
D'après notre résultats en conclure que :
l'isolat A9 à une meilleure croissance (DO=0.89) à 25°C et
l'isolat A1 à un taux de croissance très élevée par
rapport les autres isolats à 30°C (DO=1.47) et A9 à un taux
de croissance maximum aux T°C=37°C par rapport les autres isolats
(DO=1.09).En fin, l'isolat A7 à un taux de croissance
élevée et bonne adaptation et termotolérance à
45°C(DO=1.18).
Une étude de la tolérance des bactéries
acétiques aux températures élevées sera
effectuée, pour la sélection des souches thermotolérantes
identifiées à caractère industriel .Donc
l'isolat A7 à ce caractère par rapport les autres isolats.
Concernant la tolérance des bactéries
acétiques aux hautes températures des autres études qui on
des résultats proche de nos résultats :
On a les souches qui ont isolé par Frouhat
Aicha et Drib Amina (2017) elles tolèrent des
températures de 30°C jusqu'à 45°C, et 40°C,
45°C, 50°C et 55°C sont les meilleures
températures de croissance préféré
par rapport les trois souches issue du vinaigre
traditionnel de dattes. Ces
hautes températures de 35°C jusqu'à 60°C sont celles
enregistrés dans la cuvette de Ouargla, vue les conditions climatiques
durant la période estivale dans cette zone aride (Le Hourou,
1990).
Ces observations ont montré que les souches
d'Acétobacters isolées à partir des échantillons du
vinaigre traditionnel de dattes de cultivar Daglet-Nour et Hechef Daglet-Nour
peuvent s'adapter rapidement à l'extrême des conditions telles que
des températures élevées de 35°C à 60 °C.
Par contre, la plupart des espèces des bactéries acétiques
peuvent pousser à 37 ° C mais pas à 45 ° C
(Matsushita et al., 2016). Les souches des bactéries
acétiques isolées à partir des dattes Iranien
détériorés tolèrent des températures de 36
à 38°C (Bheshti-Maal, 2014).
Alors que les résultats de Mounir et al. (2016) pour
l'isolement des bactéries acétiques issues de vinaigres
traditionnels (de datte et de pomme), vins, jus de fruits et les miels et les
fruits, ont montré que toutes les souches d'Acétobacter sauf les
souches de
vinaigre traditionnel de dattes et de pomme ont
considérablement poussées à 35° C et 41° C. Pour
Beheshti Maal et Shafiee. (2012), les examens de
tolérance de la souche Acetobacter isolée de la
pêche iranienne à des températures élevées
telles que 34°C, 36°C, 38°C et 40°C,
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 100
ont montré que la croissance de la souche Acetobacter
isolée pourrait augmenter sur les modifications de milieu de Carr avec
des concentrations d'éthanol de 2,5% et 5% au 34 °C, 36 °C, 38
°C et 40 ° C après 24-96 heures d'incubation.
Les isolats d'Acetobacter et de Gluconobacter issues des
vinaigres domestiques dans les villes de l'Iran (Téhéran, Qazvin,
Abhar, Takestan) de Moghadami et al. (2013), peuvent
poussée à 40 ° C.
Pour Mounir et al. (2016), les taux
d'inactivation thermique de l'ADH (Alcool déshydrogénase) et de
l'ALDH (Aldéhyde déshydrogénase) étaient
supérieurs à 38°C pour toutes les souches
d'Acétobacters, et l'ADH était plus Thermosensible que l'ALDH.
Ainsi, l'ADH était moins thermostable que l'ALDH.
Pour Perumpuli et al. (2014),
l'activité ADH et ALDH dans les fractions membranaires des
souches d'Acetobacters cultivés à 37°C pendant 24 heur avec
et sans éthanol et ont été comparés avec A.
pasteuranus mésophile. Les résultats a
révélé que les activités ADH et ALDH des souches
thermotolérance étaient plus fortes que celles de la souche
mésophile lorsque les cellules ont été cultivées
à 37°C.
Les travaux de Matsutani et al, (2016), ont
élucidés la séquence complète du génome de
la bactérie thermotolérance, A.pasteurianus SKU1108, et
l'ont comparée à celle d'autres souches A. pasteurianus
thermotolaires et mésophiles. En utilisant une analyse
génomique comparée des souches étroitement liées,
ils ont révélé plusieurs gènes candidats qui
sous-tendent le phénotype de la thermotolérance. D'autres
recherches de ces souches étroitement liées peuvent fournir de
nouvelles connaissances sur les causes génétiques de leurs
phénotypes spécifiques.
De plus, ils ont affirmé que la température
constitué un des paramètres majore influence le
développement des bactéries au sein des aliments (vinaigre) et de
l'enivrement (Prescot et al. ,2002). La plupart des
espèces bactéries acétiques peuvent pousser à
37°C mais pas à 45°C (Matsushita et al., 1985
). Les souches des bactéries acétiques isolées
à partir des dattes Iraniennes détériorées
tolèrent des températures de 36 à 38°C
(Bheshti-Maal et Shafiee, 2012).
En 1980, Ohmori et collaborateurs ont obtenus
une souche A. acéti subsp acéti, isolée à
partir du mout du vinaigre, des sols des usines du vinaigre et des fruits, qui
présente une meilleure activité à 35°C, mais cette
activité a totalement disparu à 38°C.
La croissance des souches de Bachi Hanane et Bensayah
Sara(2017) à la température 35°C jusqu'un 60°C
peut s'expliquer par une possible tolérance aux températures
acquis par la souche de leur nature ou zone transférées
(Legrand Sow, 2004). Car ces hautes températures
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
de 35°C jusqu'à 60°C sont celles
enregistrés dans la cuvette de Ouargla, vue les conditions climatiques
durant la période estivale dans cette zone aride (Boudjellal,
2009).
On conclure que les bactéries acétiques peut
adaptés à la condition défavorable (T°C
élevés). Cette variation de concentration de trouble due à
la variation génétique et spécifique pour les
bactéries acétiques.
Test Mannitol Mobilité :
Tableau 25 : Les résultats de mannitol
-mobilité des neufs (09) isolats
A1 A2 A3 A4 AS A6 A7 A8 A9
|
Mannitol
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Mobilité
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
On remarque que les neufs(09) isolats des bactéries
acétiques utilisent le mannitol comme source de carbone car contient des
enzymes qui fermenter le sucre mannitol. Donc ces neufs(09) bactéries
acétique ont les mêmes types de métabolisme
d'énergétique.
Et sont aussi mobile car la cellule de bactéries
acétique contient des péritriches pour la mobilité.
Page 101

Tableau 26: Résultat de l'identification des
espèces et sous espèces (Guiraud, 2012).
A3 A2/A4 A8/A9 A1 A5/A6 A7
Espèces et sous espèces
|
Pouvoir sur oxydant
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Catalase
|
+
|
+
|
+
|
+
|
+
|
+
|
|
Culture sur Hoyer
|
+
|
-
|
-
|
+
|
-
|
-
|
|
Pouvoir cétogène**
|
+
|
+
|
+
|
-
|
+
|
+
|
|
Acide gluconique***
|
+
|
+
|
+
|
+
|
+
|
+
|
|
A.5cétogluconique***
|
+
|
+
|
+
|
-
|
-
|
+
|
|
Pigment
|
-
|
-
|
+
|
-
|
-
|
-
|
|
Cellulose
|
-
|
+
|
-
|
+
|
-
|
+
|
** Sur glycérol, ***A partir de glucose.
D'après notre résultats, on a l'isolat A3c'est
A.aceti subsp.aceti aceti selon l'auteur Guiraud(2012)
qui à de caractère biochimique (pouvoir sur oxydant et
catalase et culture sur Hoyer et un pouvoir cétogène et acide
gluconique et aussi A.5cétogluconique sont positifs et non
pigmenté et ne produise pas la cellulose).
Notre résultat d'isolats A3 et similaire et plus proche
de résultats de Bachi et Bensayah
(2017).
Les isolats A2 et A4 ont des mêmes caractères
biochimiques donc selon Guiraud (2012) sont : A.aceti
subsp. Xylinum qui ont un pouvoir sur oxydant, catalase, un pouvoir
cétogène,
Page 102
us
ns
A.hansensii
A.xylinum
A.aceti
A.pasteuran
A.liquefacie
aceti aceti
A.aceti subsp. Orleanensis
A . a ceti subsp.
A.aceti subsp. Xylinum
A.aceti subsp.
Xylinum
A.aceti
subsp.
Liquuefanciencs
A.pasteurianus
subsp.estunensis
PARTIE02 :ETUDE EXPERIMENTALLE
Chapitre II: Résultats et discussions
PARTIE02 :ETUDE EXPERIMENTALLE

Chapitre II: Résultats et discussions
Page 103
acide gluconique, cellulose et aussi A.5cétogluconique
sont positifs et non pigmenté et culture sur Houer négative.
Concernons les isolats A8 et A9 qui ont des caractères
biochimiques identiques, donc selon la clé déclitomique de
Guiraud(2012) sont A.aceti subsp. Liquuefanciencs qui
ont des résultats positifs des ces testes (pouvoir sur oxydant et
catalase, un pouvoir cétogène acide gluconique et
A.5cétogluconique et aussi pigmentation) et négative sur ces deux
testes (cellulose et culture sur Hoyer).
Pour l'isolat A1qui à un : pouvoir sur oxydant et
catalase, un acide gluconique et aussi cellulose et culture sur Hoyer positifs,
et les teste de pigmentation et pouvoir et aussi A.5cétogluconique
cétogène sont négatifs. Donc selon Guiraud
(2012) c'est A.pasteurianus subsp.estunensis .
Et pour les isolats A5 et A6 qui ont des caractères
biochimiques identiques, donc selon la clé déclitomique de
Guiraud(2012) sont A.aceti subsp. Orleanensis qui ont
des résultats positifs des ces teste (pouvoir sur oxydant et catalase,
un pouvoir cétogène acide gluconique) et négative sur ces
testes (cellulose et culture sur Hoyer et A.5cétogluconique et aussi
pigmentation).
Et en fin pour l'isolat A7 selon Guiraud (2012)
c'est A.aceti subsp. Xylinum par ce qu'il a c'est
caractères biochimiques (pouvoir sur oxydant et catalase, un pouvoir
cétogène, cellulose, acide gluconique et aussi
A.5cétogluconique sont positifs et culture sur Hoyer négatif, non
pigmenté).
[CONCLUSION GENERALE]
Conclusion générale
Page 104
La valorisation des dattes et des raisins par des
procédés biotechnologiques, et leur transformation en vinaigre,
en l'occurrence, peut contribuer à sauvegarder la
biodiversité.
Le vinaigre traditionnel de dattes est connu depuis longtemps
chez les populations sahariennes.
Les résultats d'analyses de la recherche et
d'identification de quelques souches des bactéries acétiques
issues des deux vinaigres biologiques de datte cultiva de Hmira et de raisin
variété Rouge autochtone.
Révèle la présence sur milieu de cultures
sélectives Frateur la présence des bactéries
acétiques dans les deux vinaigres à différents aspects
macroscopique et microscopique.
En appliquant les tests de pouvoir suroxydant sur milieu de
Carr aux cellules issues des colonies qui ont présences dan le milieu
Frateur, les résultats ont permis de mettre en évidence
l'appartenance des bactéries issues de deux colonies au genre
Acetobacter. Alors, que l'isolat A2 est négatif et les autres sont
positif (coloration bleu dans la boite de milieu Carr). En complétant
les tests sus cités par des tests biochimiques aux bactéries
appartenant au genre Acetobacter, ce qui a conduit à la mise en
évidence que ces bactéries appartenaient à la sous
espèce : Acétobacter. aceti subsp aceti. Cette
bactérie est but principale et elle est présenté dans
l'échantillon de vinaigre biologique cultivar Hamraya(Hmira) et ces
espèces A.aceti subsp. Xylinum, A.pasteurianus subsp.estunensis
qui ont productrice de cellulose est se sont des souches très utile
et important pour notre pratique, A.aceti subsp. orleanensis ,
Acétobacter. aceti subsp aceti, et A.aceti subsp. liquuefanciencs
qui ne produisent pas de cellulose.
Concernant la tolérance de ces bactéries
acétiques aux températures élevées : on observe que
la croissance de ces isolats elles sont différents.
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 105
A
-ABDELMOUNAIM KHADIR,
https://elearnunv-oran1.dz
(Article).
-ABOULALA. S, (2008). Recherche et
identification de quelques souches de bactéries acétiques issues
de vinaigre traditionnel de datte, et l'étude d'une
propriété technologique : pouvoir acidifiant. Mémoire de
la fin d'étude pour l'obtention diplôme d'ingénieur
d'état en biotechnologie. Université d'Oran;(in BACHI
HANANE et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
- ABSI. R, (2010). Analyse de la
diversité variétale du palmier Dattier (Phoenix dactylifera
L). Mémoire de Magister en science agronomiques. Université
Mohamed Khider Biskra .
-ACOURENE, S., TAMA, M., (1997),
Caractérisation physico-chimique des principaux cultivars de dattes de
la région des Zibans. Recherche agronomique, Vol.1 ; (in ZERIBI
HATIM, Phoeniculture et technique de valorisation des dattes ;
(Biskra, Mastère) ; Contribution à l'amélioration des
techniques de production du vinaigre des dattes ; 2019/2020).
-Anonyme01, 2004 France
sidplayer.fr : valorisation de
raisin.
-AIGRIN P., 2003. Note de conjoncture
mondiale. Bull. OIV ;( in Mme AGOUAZI Ounissa épouse MEHRI
;( Magister ; Tizi-Ouzou) .Contribution à la
caractérisation physico-chimique de cépages de Vitis vinifera
ssp vinifera autochtones d'Algérie. Sciences de la vigne et
préservation des ressources phylogénétiques ;
2012/2013).
- Aka, A. H., Kibangou, N. S. A., Koua, B. K., &
Toure, S. (2021). Effet de la fermentation sur la cinétique de
séchage solaire des fèves de cacao. Sciences des Structures
et de la matière, 3.
-ALINE. L F, VINCENT. R ET PIRRE. S, (2010).
Microbiologie du vin, bases fondamentales et applications .Ed. TEC et
DOC. Paris ;(in BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 106
-AOAC N° 920.151 (1990), Official
Methods of Analysis Association of Official Analytical Chemists 15 th. Ed
Washington D.C USA ; (in Melle BENAHMED DJILALI ADIBA,
Ingénière d'état en Technologie Alimentaire (Boumerdes,
Magistère) ; Etude et optimisation d'un processus de fabrication
traditionnelle du vinaigre a partir de deux variétés de dattes
communes cultivées dans le sud Algérien ; 2007).
-ARNAUD J.,"Vinaigre". Site:
www.vinajol.com. ; (in
ZERIBI HATIM, Phoeniculture et technique de valorisation des
dattes ; (Biskra, Mastère) ; Contribution à l'amélioration
des techniques de production du vinaigre des dattes ; 2019/2020).
-ARIFUZZAMAN M.D., ZAHID HASAN M.D., BADIER RAHMAN
S.M., KAMRUZZAMAN PRAMANIK MD. (2014): Isolation and characterization
of Acetobacter and Gluconobacter spp from sugarcane and rotten fruits.
Trade Science Research & Reviews in BioSciences .Vol. 8(9)
-AUDIGIE CL., FIGARELLA J., ZONSZAIN F., (1984),
"Manipulations d'analyse biochimique". 1" Edition. 4 èmme
tirages Doin Paris ; (in Melle BENAHMED DJILALI ADIBA,
Ingénière d'état en Technologie Alimentaire (Boumerdes,
Magistère) ; Etude et optimisation d'un processus de fabrication
traditionnelle du vinaigre a partir de deux variétés de dattes
communes cultivées dans le sud Algérien ; 2007).
B
-BASLER A., 2000. L'environnement
international pour le développement de l'arboriculture et de la
viticulture en Algérie ;( in Mme AGOUAZI Ounissa épouse
MEHRI ;( Magister ; Tizi-Ouzou) .Contribution à la
caractérisation physico-chimique de cépages de Vitis vinifera
ssp vinifera autochtones d'Algérie. Sciences de la vigne et
préservation des ressources phytogénétiques ;
2012/2013).
-BEHESHTI MAAL. K ET SHAFIEE. R, (2012).
Characterization of an Acetobacter strain isolated from Iranian peach
that tolerates. International journal of biological and life sciences 8:4.
-BELKACEM. M, (1987). Contribution à
la production d'acide acétique à partir du lactosérum.
Thèse Ing INA, El Harrach;(in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 107
issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-BENAMARA S., CHIBANE H, BOUKHLIFA M., (2004),
Essai de formulation d'un yaourt naturel aux dattes. Revue Industrie
Agricole et Alimentaire. Actualités technique et scientifiques,
N°1/2 mensuel ; (in ZERIBI HATIM, Phoeniculture et
technique de valorisation des dattes ; (Biskra, Mastère) ; Contribution
à l'amélioration des techniques de production du vinaigre des
dattes ; 2019/2020).
-BENAMARA S.; GOUGAM H.; AMELLAL H.; DJOUAB A.;
BENAHMED A.ET NOUI Y. (2007), Some Technologic Proprieties of Commun
date (Phoenix dactylifera L.) Fruits. American Journal of Food
Technologies, volume 8 ; (in ZERIBI HATIM, Phoeniculture et
technique de valorisation des dattes ; (Biskra, Mastère) ; Contribution
à l'amélioration des techniques de production du vinaigre des
dattes ; 2019/2020).
-BELGUED.M(1996), caractéristique de
cultivas de dattiers du nord-est du Sahara Algérien.
-BOUDJELAL A., NACIB N., (2001), " Production
d'acide lactique par Lactobacilles Rhamnosus sur milieu à base
de jus de dattes", Rev. Energ. Ren. Production et valorisation. Biomasse (in
Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerdes, Magistère) ; Etude
et optimisation d'un processus de fabrication traditionnelle du vinaigre a
partir de deux variétés de dattes communes cultivées dans
le sud Algérien ; 2007).
-BOUDJELLAL. L, (2009). Rôle de l'oasis
dans la création de l'îlot de fraicheur dans les zones chaudes et
arides « cas de l'oasis de Chetma -Biskra -Algérie ».
Mémoire pour l'obtention du diplôme de magister option:
architecture bioclimatique. Université Mentouri Constantine.
-BOUGNOU. N, (1988). Essai de production du
vinaigre à partir des déchets se dattes. Thèse
Magister INA. El-Harrach;(in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques issues
du vinaigre traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-BOURGEOIS C.M., LARPENT T.P., (1996),
Microbiologie alimentaire ; (in ZERIBI HATIM,
Phoeniculture et technique de valorisation des dattes ; (Biskra,
Mastère) ;
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 108
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Contribution à l'amélioration des techniques de
production du vinaigre des dattes ; 2019/2020).
-BOURGEOIS. C M ET LEVEAU. J Y,
(1980).Technique d'analyse et de contrôle microbiologique.
Volume III. Ed. Technique et documentation. Paris;(in BACHI HANANE
et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-BREWDUSUD,(2004),"Le vinaigre". Article
36.Version 2. Site :
File://Brewdusud.nuxit.Net/ xoops ; (in Melle
BENAHMED DJILALI ADIBA, Ingénière d'état en
Technologie Alimentaire (Boumerdes, Magistère) ; Etude et optimisation
d'un processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-BUCHANAN R.E., GIBBNS N.E. (1984) : Family
VI. Acetobacteraceae. In: Bergey'ss Manual of Systematic Bacteriology. The
Williams and Wilkins Co.. Baltimore.Vol. 1.
-BOUGUERA A., DOUMMA A., EVINA H.E., HAMDOUNI N.,
MUSUMBU J.,2003.Valorisation de savoirs et savoir-faire: Perspectives
d'implication des acteurs, dontla femme, dans la conservation in-situ de la
biodiversité du palmier dattier dans les oasisdu Djérid
(Tunisie).Ed .Tunisie .
C
-CARYOLINE RIGONDET (
https://jardindegrandmere.com)
; 20/10/2019( Article)-CECILE LAURENT JEREMY
LABROSSE, JULIEN BAJARD, REMI VINCENT;2014 Organisme commanditaire :
Distillerie CAVALE et Distillerie d'ARZENS. Etude préalable à
l'amélioration de la valorisation des pépins et des pulpes
produits par la distillerie de la coopérative La Cavale .Projet
d'élèves ingénieurs n° 12.
-CARR J.G., SHIMWELL J.L. (1968): Pigment
souches productrices d'Acetobacter aceti. Nature.
-CAÏD, N., CHACHOUA, M., & BERRICHI, F.
(2019). Analyse spatiale diachronique de l'occupation du vignoble
algérien depuis 60 ans: cas de la wilaya de Mostaganem.
Physio-Géo. Géographie physique et environnement,
(Volume 13), 53-74.
Page 109
-CHELGHOU M. (2012). Essai de production de
biomasse "Saccharomyces cerevisiae" à partir des dattes
"Ghars". Mémoire d'Ingénieur. Département d'agronomie.
Batna ; (in ZERIBI HATIM, Phoeniculture et technique de
valorisation des dattes ; (Biskra, Mastère) ; Contribution à
l'amélioration des techniques de production du vinaigre des dattes ;
2019/2020).
-CHIBANE
,H.,BENAMARA,S.,NOUI,Y.,DJOUAB,A.,2007.Somephysicochimicaland
morphological caractérisation of three varieties of Algerien commun
dates , Europian journal of scientific resarch ,vol.18°1;(in Mr
BOUKHIAR AISSA, Analyse du processus traditionnel d'obtention du
vinaigre de dattes tel qu'appliqué au sud algérien : essai
optimisation, (Boumerdès, Magistère) ; 2008/2009.
-CLAVET. (1992), Alcool méthylique.
Vinaigre. Ed, Béranger, Paris et liège ; (in ZERIBI
HATIM, Phoeniculture et technique de valorisation des dattes ;
(Biskra, Mastère) ; Contribution à l'amélioration des
techniques de production du vinaigre des dattes ; 2019/2020).
-CODEX ALIMENTAIRE. (1987) : Norme codex pour
le vinaigre. Norme régionale africaine. Codex. STAN.
-COOMBE B.G. AND MCCARTHY, M.G., 2000.
Dynamics of grape berry growth and physiology of ripening. Australian Journal
of grape and wine research 6 ;( in Mme AGOUAZI Ounissa épouse
MEHRI ;( Magister ; Tizi-Ouzou) .Contribution à la
caractérisation physico-chimique de cépages de Vitis vinifera
ssp vinifera autochtones d'Algérie. Sciences de la vigne et
préservation des ressources phytogénétiques ;
2012/2013).
D
-DIVIES C, (1970). Le vinaigre, microbiologie
alimentaire, Les fermentations alimentaires. Ed. Tec et Doc. Paris;(in
BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-DIVIES. C, (1989). Le vinaigre Microbiologie
alimentaire. Les fermentations alimentaires.
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 110
Ed. Tec et doc. Lavoisier .vol 2;(in BACHI HANANE
et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée,2016 /2017).
-DOWSON W H., ATEN, (1963), "Récolte
et conditionnement des dattes." Ed FAO ; (in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerdes, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-DUBOST D. (1991). Ecologie,
aménagement et développement agricole des oasis
algériennes. Thèse de doctorat, université de Tours,
France ; (in ZERIBI HATIM, Phoeniculture et technique de
valorisation des dattes ; (Biskra, Mastère) ; Contribution à
l'amélioration des techniques de production du vinaigre des dattes ;
2019/2020).
-DUCULOT. H, (1932). C, H, B Beall 175
Acetobactereaacea (orto-epia de eliot johen et du bartas-Goulat Gallica, etudes
en philogy, XIII, 1946;(in BACHI HANANE et BENSAYAH
SARA (Mastère, Ouargla) ; Recherche et identification de
quelques souches de bactéries acétiques issues du vinaigre
traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-DU TOI, W.J., ET LAMBRECHTS, M.G(2002).The
enumeration and identification of acetic acid bacteria from South African red
wine fermentation.Int.J.Food Microbiol, ( in Hervé Alexandre »HAL
» thèse de doctorats, développement de méthodes
permettant la détection et la quantification de microorganismes
d'altération du vin ; Etude de facteurs de développement (univ de
Bourgogne-Franche Comté) science alimentaire, microbiologie. 2016).
- DJERBI M., 1994. Précis de
phoéniciculture. FAO.
-DRYSDALE, G.S., ET FLEET, G.H(1985).Acetic
acid bacteria in some Australian wines . Food Technol. Aust, ( in Hervé
Alexandre »HAL » thèse de doctorats, développement de
méthodes permettant la détection et la quantification de
microorganismes d'altération du vin ; Etude de facteurs de
développement (univ de Bourgogne-Franche Comté) science
alimentaire, microbiologie. 2016).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 111
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
E
-ELLEUCH ,M., BESBES ,S., ROISEUX ,O., BELCKER
,C.,DEROANNE ,DRIRA,N. E.,HAMADI,A.,2008. Date flesh : Chimical
composition and characteristics of the dietary fibre .Journal of Food
Chemistry, Vol 111;(in Mr BOUKHIAR AISSA, Analyse du processus
traditionnel d'obtention du vinaigre de dattes tel qu'appliqué au sud
algérien : essai optimisation, (Boumerdès, Magistère) ;
2008/2009.
-EL-HADRAMI L. (1998), "Biotechnologies
végétales et amélioration du palmier dattier pivot de
l'agriculture oasienne Marocaine". Cahiers Agricultures. Vol 17. N° 6 ; (
in Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerdes, Magistère) ; Etude
et optimisation d'un processus de fabrication traditionnelle du vinaigre a
partir de deux variétés de dattes communes cultivées dans
le sud Algérien ; 2007).
- ESPIARD E. (2002), Introduction à la
transformation industrielle des fruits. Ed. Lavoisier ;( in ZERIBI
HATIM, Phoeniculture et technique de valorisation des dattes ;
(Biskra, Mastère) ; Contribution à l'amélioration des
techniques de production du vinaigre des dattes ; 2019/2020).
-ESTANOVE P. (1990), Note technique:
Valorisation de la datte. In Options méditerranéennes,
série A, N° 11. Systèmes agricole oasiens. Ed. CIHEAM ; (in
ZERIBI HATIM, Phoeniculture et technique de valorisation des
dattes ; (Biskra, Mastère) ; Contribution à l'amélioration
des techniques de production du vinaigre des dattes ; 2019/2020),( in
Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerdes, Magistère) ; Etude
et optimisation d'un processus de fabrication traditionnelle du vinaigre a
partir de deux variétés de dattes communes cultivées dans
le sud Algérien ;2007 ) .
-ESTEE GRIMAUD ; 2004 (Article).
F
-FAO. (2007).Organisation Des Notions Unies
Pour L'alimentation et L'agriculture File://Brewdusud.nuxit.Net/ xoops ; (in
ZERIBI HATIM, Phoeniculture et technique de valorisation des
dattes ; (Biskra, Mastère) ; Contribution à l'amélioration
des techniques de production du vinaigre des dattes ; 2019/2020).
Page 112
-FELDMAN, M. 1976. Taxonomie classification
and names of wild, cul andmoderne cultivated wheats.Evolution of plants.
Longman, London,
-FOLLMAN H., (1983), "Acetic-acid".Vol 5.
Chap3 ;( in Melle BENAHMED DJILALI ADIBA,
Ingénière d'état en Technologie Alimentaire (Boumerdes,
Magistère) ; Etude et optimisation d'un processus de fabrication
traditionnelle du vinaigre a partir de deux variétés de dattes
communes cultivées dans le sud Algérien ; 2007).
I
-ISO72118 ; sélection et isolements
des souches (in Ejemni .M ;Merji.S.,2006 ;valorisations des
écats des déchés des dattes cas d'application de
production de vinaigre ).
-ISO4833 : dénombrements ( in
Mélissa et al.,P ;2018 ; transformation un viande de
bovine selon un procédé de type Biltong).
G
-GALET. (1993). précis de viticulture.
(in Mr. KARIM Abdelkarim Elmaghili ;(master ; Mostaganem),
Etude des différentes tailles viticole sur les paramètres
physiologiques de la variété Sultanine dans des conditions arides
(Coopérative agricole : Tamanrasset) ; 14/09/2017).
-GALET. (2000). Précis de viticulture.
Saint Jean de Vedas,: JFimpression,( in MR. KARIM ABDELKARIM
ELMAGHILI ;(master ; Mostaganem), Etude des différentes tailles
viticole sur les paramètres physiologiques de la variété
Sultanine dans des conditions arides (Coopérative agricole :
Tamanrasset) ; 14/09/2017).
-GLAZY. P ET GUIRAN. D J, (1980). L'analyse
microbiologique dans les industries alimentaire. Ed. L'usine nouvelle.
Paris.
-GEROME. J, JAMES. T ET STEPHEN. L, (2002).
Microbiologie. Cours et questions de divisions. Ed. Dunod. Paris;(in
BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 113
-GIBBS. B M ET SHPTON. D A, (1968).
Identification methode for microbiologists. Ed. Academic press
london;(in BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-GILLILAND, R.B., ET LACEY, J.P(1964). Lethal
action bay an Acetobacter on years .Nature 202, ( in Hervé Alexandre
»HAL » thèse de doctorats, développement de
méthodes permettant la détection et la quantification de
microorganismes d'altération du vin ; Etude de facteurs de
développement (univ de Bourgogne-Franche Comté) science
alimentaire, microbiologie. 2016).
-GIRARD ET ROUGIEUX, (1958). Technique de
microbiologies agricole. Ed. Dunod. Paris;(in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques issues
du vinaigre traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-GLAZY. P ET GUIRAN. D J, (1980). L'analyse
microbiologique dans les industries alimentaire. Ed. L'usine nouvelle.
Paris;(in BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-GROSSMAN, M.K., ET BECKER, R(1984).
Investingations on bacterial inhibition of wine fermentation.
Kellerwirtschaf, ( in Hervé Alexandre »HAL » thèse de
doctorats, développement de méthodes permettant la
détection et la quantification de microorganismes d'altération du
vin ; Etude de facteurs de développement (univ de Bourgogne-Franche
Comté) science alimentaire, microbiologie. 2016).
-GUALTIERI ET RAPPACCINI (1994), Date stones
in broiler's feeding. In Technologie de la datte. Ed. GRIDAO ; (in
ZERIBI HATIM, Phoeniculture et technique de valorisation des
dattes ; (Biskra, Mastère) ; Contribution à l'amélioration
des techniques de production du vinaigre des dattes ; 2019/2020).
-GUIRAUD J., GALZY P. (1998), Microbiologie
alimentaire. Ed. Dunod. Paris. 615 P. 49. JORA. (1998). Arrêté sur
le vinaigre, Journal officiel de la république algérienne. Vol 18
N°
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 114
17 ; (in ZERIBI HATIM, Phoeniculture et
technique de valorisation des dattes ; (Biskra, Mastère) ; Contribution
à l'amélioration des techniques de production du vinaigre des
dattes ; 2019/2020).
-GUIRAUD J.P., (2003)," Microbiologie
alimentaire". Ed RIA. Dunod ;( in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerdes, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-GUIRAUD -JOSEPH-PIERRE. Microbiologie
Alimentaire ; Paris, 2012.
H
-HAMDOUD I., (1994), "Essai de production de
levure boulangères (Saccharomyces cerevisiae) sur le mout de 3
variétés de dattes (Assabri, Degla-Beida, Tacherwit)
"Mémoire D'Ingemeur. INFS/AS ; (in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerdes, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-HAMIDI A., SLIMANI A. (2008) :
Identification des souches d'acétobacter isolées à partir
du vinaigre traditionnel de datte de la région de M'Zab. DESS,
Université d'Ouargla.
-HAUGE. J G, KING. T E. ET CHELDELIN. V H,
(1955). Oxydation de dihydroxyacetone via le cycle pentose dans
suboxydans Acetobacter. J. Biol. Chem. 214;(in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques issues
du vinaigre traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-HUGLIN P. ET SCHEIDER T., 1998. Biologie et
écologie de la vigne. Ed. Payot. Lausanne. (In
Mme AGOUAZI Ounissa épouse MEHRI ;( Magister ;
Tizi-Ouzou) .Contribution à la caractérisation physico-chimique
de cépages de Vitis vinifera ssp vinifera autochtones
d'Algérie. Sciences de la vigne et préservation des ressources
phytogénétiques ; 2012/2013).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 115
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
-HYPERLINK., (2005), Site:
http://Fr.ekopedia.org/vinaigre
; (in Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerès, Magistère) ;
Etude et optimisation d'un processus de fabrication traditionnelle du vinaigre
a partir de deux variétés de dattes communes cultivées
dans le sud Algérien ; 2007).
J
-J.COYATTE ET M. MERGEAY, Microbiologie, 4
èmme édition, Bruxelles ; 2013. -JEAN MARC ; 2015.
https://www.jean-marc-gil-toutsurlabotanique.com
(Article).
-JOURNAL OFFICIEL DE LA REPUBLIQUE ALGERIEN N°
39, 8 choual 1438 / 2 juillet 2017.
-JOYEUX, A., LAFON-LAFOURCADE, S., ET RIBEREAU-GAYON,
P(1984).Evolution of acetic acid bacteria during fermentation and
storage of wine. Appl. Environ.Microbiol.KKKKKKKK
K
-KADERE T. T., MIYAMOTO T., ONIANG R. K., KUTIMA P.
M., NJOROGE S. M. (2008) : Isolation and identification of the genera
Acetobacter and Gluconobacter in coconut toddy (mnazi). African Journal of
Biotechnology. Vol. 7 (16) :2963-2971.
-KAREN REINER (2010), Catalase test
protocol(Article).
-KENDRI S. (1999). Caractéristiques
biochimiques de la biomasse « Saccharomyces cerevisiae»
produite à partir des dattes Variété Ghars »
Mémoire d'ingénieur agronome. Département d'agronomie
Batna ; (in ZERIBI HATIM, Phoeniculture et technique de
valorisation des dattes ; (Biskra, Mastère) ; Contribution à
l'amélioration des techniques de production du vinaigre des dattes ;
2019/2020).
-KERSTERS. K, LISDIYANTI. P, KOMAGATA. K ET SWINGS. J,
(2006). The family Acetobacteraceae : The Genera Acetobacter,
Acidomonas, Asaia, Gluconacetobacter, Gluconobacter, and Kozakia. Journal of
Prokaryotes 5.
-KHLIF. F, (2016). Recherche et
identification de quelques souches des bactéries acétiques issues
du vinaigre traditionnel des dattes Sahara Septentrional Est Algérien :
Etude du pouvoir
Page 116
acidifiant. Mémoire pour l'obtention du diplôme
de masters académiques. Université d'Ouargla.
-KOMIA M., (1996). "Produire du vinaigre avec
des fruits tropicaux : c'est simple et peu coûteux". Bulletin du
réseau TPA. N° 19 ; (in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerdès, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-KONATE M., ESSOH AKPA E., BAN KOFFI L, SEVERIN KRA
K.A., MEGNANOU R.M., NIAMKE S. (2014): Isolation of thermotolerant and
high acetic acid-producing Acetobacter pasteurianus from Ivorian palm
wine. Emir. J. Food Agric.Vol. 26 (9)
L
-LAMBIN. J P ET GERMAN. A, (1969).
Précis de microbiologie. Tome 1. Ed. Masson et cie. Paris.
-LARPENT. J P, (1991). Microbiologie
alimentaire : technique de laboratoire. Ed. TEC et DOC.
-LI. F, FUXIAN. Z ET BIN. Z, (2012).
Isolation and Identification of Acetic Acid Bacteria. Department of
Biology, Hanshan Normal University, Chaozhou 521041.
-LEGRAND-SOW. N, (2004). Sélection et
caractérisation de bactéries lactiques d'origine africaine en vue
d'une utilisation comme probiotiques. Ph. D. dissertation. Faculté
universitaire des sciences agronomiques de Gembloux. Belgium.
M
-MARIAMA CIRE KOUROUMA, MALICK MBENGUE, KHADY SARR and
COUMBA TOURE KANE ; (IJAR) ;
ww.journalijar.com ;
Isolement, Identification et caractérisation de souches de
bactéries acétique a partir d'un alcool de mangue fermente
(Article).
-MATSUSHITA. K, TOYAMA. H ET ADACHI. O,
(1985).Chaînes et bioénergétique des
bactéries acétiques respiratoires. Adv. Microb. Physiol;(in
BACHI HANANE et
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 117
BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-MATSUTANI M., HIRAKAWA H., HIRAOKA E., THEERAGOOL G.,
YAKUSHI T., MATSUSHITA K. (2016): Complete Genome Sequencing and
Comparative Genomic Analysis of the Thermotolerant Acetic Acid Bacterium,
Acetobacter pasteurianus SKU1108, Provide a New Insight into Thermotolerance.
Microbes Environ. Vol. 00: 0, 000-000.
-MEHAOUA, (2006 Etude de niveau d'infestation
par la cochenille blanche Parlatoria Blanchardi Targ. 1868 (Homoptera,
Diaspididae) sur une variété de palmier dans une palmeraie
à Biskra. Thèse Magistère en sciences agronomiques. I.N.A.
El Harrach. Alger.
-MELIGI M.A., SOURIAL G.F., (1982). "Fruit
quality and général évaluation of some Iraqui date palm
cultivars grown under-conditions of barrage région". Ed First symposium
on the date palm, Saudi-Araia. Vol 23-25 ; (in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerès, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
-MICHAEL. J ET PELCZAR. J R, (1982).
Eléments de microbiologie. Ed. H RW;(in BACHI HANANE
et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-MIMOUNI. Y. (2015). Développement de
produits diététiques hypoglycémiants à base de
dattes molles variété «Ghars», la plus répandue
dans la cuvette de Ouargla, thèse doctorat en biologie univ-Ouargla ;
(in ZERIBI HATIM, Phoeniculture et technique de valorisation
des dattes ; (Biskra, Mastère) ; Contribution à
l'amélioration des techniques de production du vinaigre des dattes ;
2019/2020).
-MOGHADAMI F., SOUDI M.R., SEPEHR S.H., REZVANIANZADE
M.R. (2013) : Evaluation of Thermotolerance of Native Strains of
Acetic acid Bacteria in Iran. International Research Journal of Applied and
Basic Sciences. Vol 4 (9).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 118
-MOUNIR. M, SHAFIEI. R, ZARMEHRKHORSHID. R, HAMOUDA.
A, ISMAILI ALAOUI. M ET THONART. P, (2016). Simultaneous production of
acetic and gluconic acids by a thermo-tolerant Acetobacter strain during
acetous fermentation in a bioreactor. Journal of Biosciences and
Bioengineering.VOL. 121 No. 2, 166-171. P 01;(in BACHI HANANE
et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-MUNIER. P, (1973). La datte. In: " Le
palmier-dattier". Paris (France) : Maisonneuve et Larose;(in BACHI
HANANE et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
N
-NAHILI N. (2006). Valorisation de quelques
variétés de dattes. Mémoire d'ingéniorat
d'état en agronomie spécialité sciences alimentaires,
université Saad Dahlab-Blida ; (in ZERIBI HATIM,
Phoeniculture et technique de valorisation des dattes ; (Biskra,
Mastère) ; Contribution à l'amélioration des techniques de
production du vinaigre des dattes ; 2019/2020).
-NF V 03-922- ISO 749-(1977),
"Détermination des cendres totaux". Vol 49. N° 4;( in
Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerès, Magistère) ;
Etude et optimisation d'un processus de fabrication traditionnelle du vinaigre
a partir de deux variétés de dattes communes cultivées
dans le sud Algérien ; 2007).
-NF V-05-109 DECEMBRE (1970), "Produits de
l'agriculture. Produits dérivés des fruits et
des légumes. Détermination conventionnelle du
résidu sec soluble". Méthode
réfractométrique ;
(in Melle BENAHMED DJILALI ADIBA, Ingénière
d'état en Technologie Alimentaire (Boumerdès, Magistère) ;
Etude et optimisation d'un processus de fabrication traditionnelle du vinaigre
a partir de deux variétés de dattes communes cultivées
dans le sud Algérien ; 2007).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 119
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
-NFV05-113 -1972. Détermination de MO
;(in Mr BOUKHIAR AISSA, Analyse du processus traditionnel
d'obtention du vinaigre de dattes tel qu'appliqué au sud algérien
: essai optimisation, (Boumerdès, Magistère) ; 2008/2009).
O
-OHMORI. S, MASAI. H, ARIMA. K ET TERUHIKO B, (1980).
Isolation and Identification of acetic acid bacteria for submerged
acetic acid fermentation at high temperature. Online Journal home page. Agric.
BioI. Chem., 44 (12).
-OMAR EL BARNAUI (C. R. S. T. R. A) ;
https://rs.umc.educ.dz
: Quelques variétés des dattes
algérienne ; atout économique ; social et nutritionnel
(Article).
-OULD EL-HADJ M.D., SEBIHI A.H. SIBOUKEUR O. (2001),
Qualité hygiénique et caractéristique
physico-chimique du vinaigre traditionnel de quelques variétés de
dattes d'Ouargla. Revue Energie Renouvelable: Production et
valorisation-Biomasse(Article).
P
-PREVOT. A R, (1961). Traité de
systématique bactérienne.Tomel. Ed. Dunod. Paris;(in
BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-PERUMPULI P.A.B.N., WATANABE T., TOYAMA H.
(2014) : Identification and characterization of thermotolerant acetic
acid bacteria strains isolated from coconut water vinegar in Sri Lanka.
Bioscience, Biotechnology, and Biochemistry. Vol.78(3).
-POXIXOO. F, (2003). Vinaigre
élément de base. Site : Fille:// : vinaigre 20/0 à 20/2
imprimé.
-PEYRON G., 2000. Cultiver le palmier dattier.
Ed. Cirad. Vol. 19.
R
Page 120
-REYNES M., BOUABIDI H., PIOMBO G., RISTERUCCI A.M.,
(1994), "Caractérisation des principales variétés
de dattes cultivées dans la région du Djérid en Tunisie".
Rev. Fruits. Vol ; (in Melle BENAHMED DJILALI ADIBA,
Ingénière d'état en Technologie Alimentaire (Boumerdes,
Magistère) ; Etude et optimisation d'un processus de fabrication
traditionnelle du vinaigre a partir de deux variétés de dattes
communes cultivées dans le sud Algérien ; 2007).
-REYNIER A., 2003. Manuel de viticulture. 9e
édition. J.L Bailliere. Paris ;( in Mme AGOUAZI Ounissa
épouse MEHRI ;(Magister ; Tizi-Ouzou) .Contribution à la
caractérisation physico-chimique de cépages de Vitis vinifera
ssp vinifera autochtones d'Algérie. Sciences de la vigne et
préservation des ressources phytogénétiques ;
2012/2013).
-RHOUMA A.M., (1994)," Le palmier dattier en
Tunisie". Ed Arabesques Pris ;( in Melle BENAHMED DJILALI
ADIBA, Ingénière d'état en Technologie
Alimentaire (Boumerès, Magistère) ; Etude et optimisation d'un
processus de fabrication traditionnelle du vinaigre a partir de deux
variétés de dattes communes cultuvees dans le sud Algérien
; 2007).
-RICHARD D (1984)," Guide pratique d'analyse
sur l'industrie des céréales. Ed APRIA. Paris ;( in Melle
BENAHMED DJILALI ADIBA, Ingénière d'état en
Technologie Alimentaire (Boumerès, Magistère) ; Etude et
optimisation d'un processus de fabrication traditionnelle du vinaigre a partir
de deux variétés de dattes communes cultivées dans le sud
Algérien ; 2007).
S
-SAWAYA W.N., KHALIL J.K., SAFI W.M., AL SHALAT A.
(1983), Physical and Chemical Caracterisation of Three Saudi Date
Cultivars at. Various Stages of developement. Can. Ins. Food Sci. Technol. J.
16, 2 ; (in ZERIBI HATIM, Phoeniculture et technique de
valorisation des dattes ; (Biskra, Mastère) ; Contribution à
l'amélioration des techniques de production du vinaigre des dattes ;
2019/2020).
- SEBIHI A. (1996) : Contribution à
l'étude de quelques paramètres de la qualité
hygiénique et biochimique du vinaigre traditionnel de quelques
variétés de dattes de la cuvette d'Ouargla. INFA/AS. Peu
coûteux". Bulletin du réseau TPA. N° 19.
--SLIMANI ABDELKADER ET HARMA MOHAMED(2018),
(mémoire mastère, Adrar) ; Valorisation des
différents produits secondaires des dattes cas de Wilaya d'ADRAR.
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 121
-SIMON. P ET MEUNIER. R, (1970).
Microbiologie industrielle et génie biochimique. Ed. Masson et
Cle ED. Paris;(in BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-STADLER-SZOKE. A, NYESTE. L ET HALLO. J, (1980).
Les études sur les facteurs affectant gluconiques et 5 acides
cétogluconique formation par Acetobacter. Acta Aliment;(in BACHI
HANANE et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre traditionnel des dattes du cultivar
Hamraya: Etude de la thermo-tolérance. Microbiologie fondamental et
appliquée, 2016 /2017).
-SOHEIR. S A, (2012). 16S rRNA Gene Sequence
Detection of Acetic Acid Bacteria Isolated from Tea Kombucha. New York Science
Journal, 5(3).
T
-TEKKOUK. F, (1997). Contribution à
l'étude de quelques paramètres de la qualité
hygiénique et biochimique du vinaigre traditionnel de quelques
variétés de dattes de cuvette d'Ouargla. Thèse Ing,
I.N.F.A.S. Ouargla;(in BACHI HANANE et BENSAYAH SARA
(Mastère, Ouargla) ; Recherche et identification de quelques
souches de bactéries acétiques issues du vinaigre traditionnel
des dattes du cultivar Hamraya: Etude de la thermo-tolérance.
Microbiologie fondamental et appliquée, 2016 /2017).
-TEKKOUK. F, (1997). Recherche, isolement et
caractérisation de souches d'Acétobacter D'origine locale.
Thèse ING.INFS/AS. Ouargla;(in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques issues
du vinaigre traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-TESFAY. W, MORALES. M L, GARCIA. P, TRANCOSO. A M,
(2002).Wine vinegar : technology, authenticity and quality evaluation,
Jornal of trends in food .Sience et technology. Vol 13;(in BACHI HANANE
et BENSAYAH SARA (Mastère, Ouargla) ;
Recherche et identification de quelques souches de bactéries
acétiques issues du vinaigre
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 122
traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
-THIS P., DETTWEILER E., 2003. EU-
project-genrs CT96 No81: European vitis data base and results regarding the use
of a common set of microsatellite markers. Acta. Hortic. 603 ;( in MME
AGOUAZI OUNISSA EPOUSE MEHRI ;( Magister ; Tizi-Ouzou) .Contribution
à la caractérisation physico-chimique de cépages de
Vitis vinifera ssp vinifera autochtones d'Algérie. Sciences de
la vigne et préservation des ressources phytogénétiques ;
2012/2013).
-TOUMI M., 2006. Evaluation de l'état
nutritionnel du vignoble de table. Thèse de doctorat d'Etat en sciences
agronomiques. Institut National Agronomique El Harrach ;( in MME
AGOUAZI OUNISSA EPOUSE MEHRI ;( Magister ; Tizi-Ouzou) .Contribution
à la caractérisation physico-chimique de cépages de
Vitis vinifera ssp vinifera autochtones d'Algérie. Sciences de
la vigne et préservation des ressources phytogénétiques ;
2012/2013).
-TOUTAIN G. (1996). Rapport de
synthèse de l'atelier "Techniques culturales du palmier dattier". In :
Options méditerranéennes, série, N° 28. Le palmier
dattier dans l'agriculture d'oasis des pays méditerranéens. Ed.
IAM, Zaragoza, Spain.
V
-VINCENT. J M, (1970). A manual for the
practical study of the root-nodule bacteria.IBP handbook N°15. Blackwell
Scientific Publishers, Oxford, (in BACHI HANANE et
BENSAYAH SARA (Mastère, Ouargla) ; Recherche et
identification de quelques souches de bactéries acétiques issues
du vinaigre traditionnel des dattes du cultivar Hamraya: Etude de la
thermo-tolérance. Microbiologie fondamental et appliquée, 2016
/2017).
Z
-ZAMORA.F ; 2009. Biochimiste of Alcoholic
Fermentation (chapitre 1) .Jornal of
Wine;Chemistry and Biochemistry. (in BOUKHIAR AISSA
;(Magister ;
Boumerdès).analyse du processus traditionnel
d'obtention de vinaigre de dattes t'el qu'appliqué au sud
algérien : essai d'optimisation ; 01-07-2009).
[REFERENCE BIBLIOGRAPHIQUE]
Références bibliographiques
Page 123
Références de classification :
Référence ITIS: Acétobacter
Beijerinck, 1898 (fr) (+ version anglaise (en)) (consulté le 30
BackboneTaxonomy.doi: 10,15468 / 39omei Consulté via
http://www.gbif.org/species/3221528
sur 16/05/2016.
Sites d'internet :
-
https://www.researchgate.net
: Qualité diététique de datte demi -
molle (Article). -
https://www.humeau.com
: Milieu MANNITOL - MOBILITE (Article).
-
https://fr.agrolib.rs,
Bétail et jardinage ; Que peut-on dire de la forme du raisin ;
2019/07/19 (Article).
-http//
agriculturemono.net.
Viticulture-en-algerie.
[ANNEXES 01]
Annexes
[ANNEXES 01]
Annexes
Annexes 01 : Les méthodes des travailles
classiques
1- Étude macroscopique (l'aspect) des colonies
:
La première étape du diagnostic bactérien et
du bio typage d'une souche est la description macroscopique des colonies
isolées ; parfois cette seule étude permet de connaître le
germe qu'on a en présence car les colonies sont typiques....
Cette description doit mentionner :
· La taille : diamètre des
colonies. Vous pouvez mesurer cette taille à l'aide d'une règle
graduée. On distingue :
? Colonies punctiformes : Colonies à
peine visibles, dont la taille est inférieure au millimètre
? Petites colonies: Colonies dont le
diamètre est compris entre 1 et 2 mm ? Colonies moyennes
: Colonies dont le diamètre est compris entre 1 et 2 mm
? Colonies moyennes: Colonies dont le diamètre est
compris entre 3 et 5 mm ? Grosses colonies : Colonies dont le
diamètre est supérieur à 5 mm
La vue de profil (élévation) (bombée,
plane, ombiliquée, a bords surélevés ou en oeuf au plat)
et avec vue de dessus (bords ou contours) (bords : dentèles, en
étoile, ovoïde, régulière, ondulée,
lobée).
· L'aspect de la surface (lisse, rugueuse,
brillante).
· L'opacité. Les colonies opaques
ne laissent pas passer la lumière contrairement aux translucides.
Certaines sont très transparentes, car ils laissent passer la
lumière.
· La consistance. Elle se juge au moment
du prélèvement. On distingue les colonies crémeuses des
sèches et des muqueuses (gluantes).
· La couleur ou pigmentation. La plupart
des colonies isolées sur gélose ordinaire sont couleur
crème (sans pigment) mais certaines sont blanc porcelaine, jaune,
vert,... (Tekkouk, 1977 et Bourgeois et Leveau ,1980).

Figure N° 33 : aspect macroscopique des
colonies bactériennes (Khadir Abdelmounaim). 2-
L'étude microscopique :
L'observation microscopique permet de faire une étude
morphologique des cellules d'une espèce bactérienne
(Aboulala, 2008). Elle comprend :
? L'état frais :
Cet examen permet d'apprécier la forme et parfois la
mobilité des germes étudiés. Technique :
1. À partir d'une culture en milieu liquide :
Déposer sur une lame propre soit le contenu d'une «
anse de platine » soit « une petite goutte» à l'aide
d'une pipette Pasteur. Recouvrir la goutte d'une lamelle, éviter les
bulles d'air. Et recommencer au besoin.
2. À partir d'une culture sur milieu solide :
Déposer une gouttelette de liquide (milieu liquide ou eau)
sur la lame. Prélever une trace de culture à l'anse de platine et
l'émulsionner dans le liquide.
? Après coloration :
1) Préparation du frottis :
2) Étalement : l'étalement doit
se faire en couche mince, sur une lame dégraissée.
3)
[ANNEXES 01]
Annexes
Séchage : laisser sécher
à l'air.
4) Fixation : passer trois fois rapidement
dans la flamme du bec Bunsen la face de la lame opposée à
l'étalement. Ne pas trop insister sous peine de carboniser le
prélèvement. On peut également fixer en laissant
évaporer quelques gouttes d'alcool éthylique versées
directement sur le prélèvement.
5) A ce stade les germes ne sont plus
considérés comme contaminants. Liquide (Guiraud
.2003).
2.1-Coloration simple :
Coloration au bleu de méthylène
Sur le frottis fixé et refroidi :
- Faire couler la solution de bleu de méthylène
phéniqué jusqu'à ce que toute la lame soit recouverte.
- Laisser agir 1 minute.
- Rincer abondamment la lame avec le jet d'une pissette d'eau
distillée, ou à l'eau du robinet jusqu'à
élimination des colorants en excès.
- Sécher à l'air ou sur une platine chauffante,
ou encore sécher délicatement entre deux feuilles de papier
filtre fin (ou buvard), sans frotter.
- Examiner au microscope, objectif à immersion.
Résultats : les bactéries sont colorées en bleu sombre.
Cette coloration est intéressante pour l'observation rapide des frottis,
mais elle permet seulement l'étude de la morphologie des
bactéries.
Il est donc souvent nécessaire de la compléter
par une coloration de Gram (Guiraud .1998).
2.2-Coloration différentielle : Coloration de Gram
:
C'est une coloration qui permet de mettre en évidence
les propriétés de la paroi bactérienne, et d'utiliser ces
propriétés pour les distinguer et les classifier en deux grands
groupes:
[ANNEXES 01]
Annexes
? Gram+ : qui ont une paroi de peptidoglycanes
épaisse (ex : Bacillus cereus).
? Gram- : qui ont une paroi de
peptidoglycanes fine, mais ont en plus une membrane externe (Khadir
Abdelmounaim).
Protocole :
1. Coloration par le violet de Gentiane ou cristal violet :
laisser agir de 30 secondes à 1 minute. Rincer à l'eau
déminéralisée.
2. Mordançage au Lugol (solution d'iode
iodo-iodurée): étaler le lugol et laisser agir 30 secondes ;
Rincer à l'eau déminéralisée. On peut
réaliser une deuxième fois l'opération identiquement pour
plus de sécurité.
3. Décoloration (rapide) à l'alcool
(+acétone): verser goutte à goutte l'alcool ou un mélange
alcool-acétone sur la lame inclinée obliquement, et surveiller la
décoloration (5 à 10 secondes). Le filet doit être clair
à la fin de la décoloration. Rincer sous un filet d'eau
déminéralisée ;
4. Recoloration à la Safranine ou à la Fuchsine
: laisser agir de 30 secondes à 1 minute. Laver doucement à l'eau
déminéralisée.
5. Sécher la lame sur une platine chauffante à
40°C, 10 à 15 minutes ou à l'air libre.
6. Examen. Observer avec une goutte d'huile à
immersion objectif 100 (X1000) (Guiraud 2012 et Bourgeois et Leveau
,1980).

Figure N° 34: les différentes formes
de cellules bactériennes (Khadir Abdelmounaim).
Test catalase :
Le test est réalisé à partir une culture sur
milieu gélosé (Guiraud ; 2012).
* Principe :
En présence d'oxygène moléculaire,
certaines réactions métaboliques conduisent à la formation
d'eau oxygénée. La catalase est une enzyme qui dégrade
l'eau oxygénée en eau et oxygène.
2 112O2 2112O+ O2
Technique : déposer sur une lame de verre
une ou deux gouttes d'eau oxygénée à 10 volumes.
Prélever à l'aide de l'effilure d'une pipette
pasteur un fragment de colonie et dissocier la culture dans l'eau
oxygénée.
Lecture : la présence d'une catalase se
traduit, en quelques secondes, par la formation de bulles d'oxygène (une
effervescence (dû à un dégagement de dioxygène)
signe la présence
[ANNEXES 01]
Annexes
d'une catalase). Si rien n'est observable, la bactérie
ne possède pas l'enzyme (Guiraud, 1998 et Karen
Reiner,2010).
Figure n° : Résultats positive de
teste catalase.
[ANNEXES 02]
Annexes
Annexe 02 : Matériels
I. Matériels biologiques :
I. Les dattes :
Caractères spécifiques pour dattes Hmira
:
Nom vernaculaire : Hamraya ou Hamraye selon les
localités ; origine de nom ; sa couleur rouge de sa maturation.
Couleur au stade maturité totale : Noire
avec reflets rouge vifs importance et abondance : fréquent dans toutes
les palmeraies du sud - est et plus abondant dans le bassin du souf (bas
Sahara).
Dattes de maturation : fin de septembre
à fin octobre selon terroir.
Mode de consommation : fraiche en l'état
à un stade de pré maturation ; concassée et tassée
dans des sacs en cuir, en tissu.
Appréciation : appréciée
surtout en tant que primeur.
Conservation : fort aptitude de conservation
notamment sous vide pour une longue période de 6 à 12 mois.
Degré de commercialisation : peu
demandée, elle surtout consommée localement car peu connue.
Taille moyenne de la datte : 4/1.6 (cm).
Poids moyenne de la datte : 8 g.
Datte charnue convient à la fabrication de la
patte de datte (Omar El Barnaoui(C.R.S.T.R.A).
II. Les raisins ;
Critère de classification des raisins selon
Bétail et Jardinage : Forme de baies-variété
anniversaire Novotcherkassk
Souvent, plusieurs autres conteurs sont ajoutés
à cette classification :
[ANNEXES 02]
Annexes
À coté convexes ; cylindrique ; mamelon ; pointu ;
émoussé ; la forme correcte ; faucille ; à sens
unique.
II. Matériels du labo
II.1. Verrerie
Béchers-Entonnoirs-Eprouvette graduée-Erlen
Meyer-Fioles-Mortiers-Papier filtre-Pipettes Pasteur -Spatules-Tubes à
éssai -Mortie.
II.2.

Appareillage

Figure n°35 : Balance électrique
(DENVER INSTRUMENT / S-403).
Figure n°36 : Réfractomètre
(ADJUTEMNT) .

Figure n°37 : Appareille multi
paramètres « mesure O2 »(CONSORT).
Figure n°38 : Appareille
Conductimètres (HANNA INSTRUMENT).

Figure n°39 : PH mètre
(PHS-25CWMICROCESSOR pH/mV MESTER).

[ANNEXES 02]
Annexes
Figure n°40 :
Rota-vapeur(Stuart).
Figure n°41 : Pynctomètre.

[ANNEXES 02]
Annexes
Figure n°42 : Four à
moufle(Heraeus).

Figure n°43 : Centrifugeuse
(Minifuge RF).

Figure n°44 : Alcoomètre.

[ANNEXES 02]
Annexes
Figure n°46 : Four Pasteur
(FALC-INSTRULENT).
Figure n°45 : Viscosimètre
(Thermo).
Figure n°47 : Incubateur
(memmert).

[ANNEXES 02]
Annexes
Figure n°49 : Spectrophotomètre
(UV mini-1240).
Figure n°48 : Autoclave
(Systec).

[ANNEXES 02]
Annexes
Figure n°50 : Microscope optique bi
oculaire (OPTIKA / B-150/ITALY).

Figure n°51 : Déssiccateure.
[ANNEXES 03]
Annexes
Milieux des cultures
1-Milieux d'isolements Milieu Frateur
|
Carbonate de Calcium
|
20 g
|
|
Extrait de levure
|
30 g
|
|
Agar
|
20 g
|
|
Eau distillée
|
1000 ml
|
-Après stérilisation (autoclavage) à
110°C pendant 10 min le milieu est lassai refroidir jusqu'à
45°C, puis on ajoute 100 ml d'alcool éthyliques à 15%.
2-Milieux des identifications Milieu de Carr
|
Extrait de levure
|
30 g
|
|
Agar
|
20 g
|
|
Vert de bromocrésol
|
1 ml
|
|
L'eau distillée
|
1000 ml
|
-Après stérilisation (autoclavage) à
110°C pendant 10 min le milieu est lassai refroidir jusqu'à
45°C, puis on ajoute 100 ml d'alcool éthyliques à 20%.
Milieu gélosé au glycérol : test de
pouvoir cétogène
|
Extrait de levure
|
30 g
|
|
Glycérol
|
30 g
|
|
Agar
|
20 g
|
|
L'eau distillée
|
1000 ml
|
-Autoclavage pendant 15°C durant 10 min le milieu lassai
refroidir jusqu'à45°C. le milieu ainsi refroidis, on ajoute 100 ml
d'alcool éthyliques à15%.
Milieux de test de Hoyer
Milieu Hoyer-Frateur avec ammonium
|
Sulfate d'ammonium
|
1 g
|
|
Phosphate di potassique
|
0.1 g
|
|
Phosphate mono potassique
|
0.9 g
|
|
Sulfate de magnésium
|
0.025 g
|
|
Perchlorure de fer
|
0.02 mg
|
|
L'eau distillée
|
1000 ml
|
[ANNEXES 03]
Annexes
[ANNEXES 03]
Annexes
-Repartir ce milieu en tubes a essai (09ml) puis en autoclave 15
min a 120C°.
-Avant l'emploi, ajouter dans chaque tube de milieu 1 ml d'une
solution stérilisée par filtration d'éthanol a 30%.
Milieu Hoyer-Frateur sans ammonium
|
Phosphate di potassique
|
0.1 g
|
|
Phosphate mono potassique
|
0.9 g
|
|
Sulfate de magnésium
|
0.025 g
|
|
Perchlorure de fer
|
0.02 mg
|
|
L'eau distillée
|
1000 ml
|
-Repartir ce milieu en tubes a essai (09ml) puis en autoclave 15
min a 120C°.
-Avant l'emploi, ajouter dans chaque tube de milieu 1 ml d'une
solution stérilisée par filtration d'éthanol a 30%.
Milieu test de pigmentation
|
Extrait de levure
|
30 g
|
|
Carbonate de calcium
|
20 g
|
|
Glucose
|
20 g
|
|
Agar
|
20 g
|
|
L'eau distillée
|
1000 ml
|
-Avant l'emploi autoclave a 120C° pendant 15 min.
Milieu gélosé carbonaté solide
« bactérie acétique » (milieu de test d'acide
gluconique)
|
Extrait de levure
|
10 g
|
|
Carbonate de calcium
|
20 g
|
|
Glucose
|
100 g
|
|
Agar
|
25 g
|
|
L'eau distillée
|
1000 ml
|
-Après stérilisation (autoclavage) à
110°C pendant 10 min le milieu est lassai refroidir jusqu'à
45°C, puis on ajoute 100 ml d'alcool éthyliques à 15%.
Bouillon Haynes (milieu test de formation d'acide
cétogluconique)
|
Extrait de levure
|
1 g
|
|
Peptone
|
1.5 g
|
|
Phosphate di potassique
|
1 g
|
|
Glucose
|
40 g
|
|
L'eau distillée
|
1000 ml
|
-Stérilisation à l'autoclave a 120C° pendant
15 min.
Bouillon pour les bactéries (milieu teste de
production de cellulose)
|
Extrait de levure
|
10 g
|
|
Carbonate de calcium
|
20 g
|
|
Glucose
|
100 g
|
|
L'eau distillée
|
1000 ml
|
-Répartir en tubes à essais 09 à 10 ml de ce
milieu.
- Stérilisation à l'autoclave a 120C° pendant
15 min.
Milieu Mannitol-mobilité (dégradation de
mannitol et observation de la mobilité)
|
Peptone
|
20 g
|
|
Nitrate de potassium
|
1 g
|
|
Mannitol
|
2 g
|
|
Rouge de phénol
|
40 mg
|
|
Gélose
|
4 g
|
|
L'eau distillée
|
1000 ml
|
|
PH
|
7.6
|
[ANNEXES 03]
Annexes
-Répartir en tubes à essais (8 à 10
ml).
-Autoclave 15 min à120 °C. Solidifier en culot.
3-Milieux pour dénombrements
Milieu gélose nutritive ordinaire « milieu
GNO » « nutrient agar »
|
Peptone
|
10 g
|
|
Extrait de viande
|
5 g
|
|
Chlorure de sodium
|
5 g
|
|
Agar
|
15 g
|
|
L'eau distillée
|
1000 ml
|
|
PH
|
7.2
|
-Autoclaver 20 minutes à 120 °C. Milieu
MRS
|
Peptone
|
10 g
|
|
Extrait de viande
|
10 g
|
|
Extrait de levure
|
5 g
|
|
Glucose
|
20 g
|
|
Tween 80 « polysorbate 80 »
|
1 ml
|
|
Phosphate di potassique
|
2 g
|
|
Acétate de sodium
|
5 g
|
|
Citrate triammonique
|
2 g
|
|
Sulfate de magnésium
|
200 mg
|
|
Sulfate de manganèse
|
50 mg
|
|
Peptone
|
10 g
|
|
Agar
|
20 g
|
|
L'eau distillée
|
1000 ml
|
|
PH
|
6.5
|
[ANNEXES 03]
Annexes
-Répartir en tubes à essais (7 à 10 ml).
-Autoclaver 15 minutes à 120°C. Milieu
Sabouraud
|
Peptone de viande
|
5 g
|
|
Peptone de caséine
|
5 g
|
|
Glucose
|
20 g
|
|
Agar
|
15 g
|
|
L'eau distillée
|
1000 ml
|
|
PH
|
6.3
|
-Autoclaver 20 minutes à 120°C. Milieu
TGEA
|
Tryptone
|
5 g
|
|
Extrait de levure
|
2.5 g
|
|
Glucose
|
9 à 18 g
|
|
Agar
|
20 g
|
|
L'eau distillée
|
1000 ml
|
-Autoclaver 20 minutes à 120°C.
Conservateur
Bouillon nutritif « BN » « Nutrient broth
»
|
Peptone
|
10 g
|
|
Extrait de viande
|
5 g
|
|
Chlorure de sodium (facultatif selon la
formule)
|
5 g
|
|
L'eau distillée
|
1000 ml
|
|
PH
|
7.2
|
[ANNEXES 03]
Annexes
-Autoclaver 20 minutes à 120°C.
Diluant
Eau physiologique « sérum physiologique
»
|
Chlorure de sodium
|
8.5 g
|
|
L'eau distillée
|
1000 ml
|
- Stérilisation à l'autoclave a 120C° pendant
15 min.
Solution chimique
NaOH 0.1 N
|
NaOH
|
4 g
|
|
L'eau distillée
|
100 ml
|
Liqueur de Fehling
Mélanger avants emploi volume à volume des deux
solutions suivantes :
*Solution 1 :
|
Sulfate de cuivre
|
70 g
|
|
Soude caustique
|
100 g
|
|
Eau distillée
|
100 ml
|
*Solution 2 :
|
Tartrate double de sodium et potassium
|
350 g
|
|
Eau distillée
|
1000 ml
|
HCL 0.1N
|
HCL
|
3.65 g
|
|
Eau distillée
|
1000 ml
|
[ANNEXES 03]
Annexes
[ANNEXES 03]
Annexes
Réactif de Bénédict
*Solution 1 :
|
Eau distillé chaud
|
60 ml
|
|
Citrate sodique
|
17.3 g
|
|
Carbonate sodique anhydre Na2CO3
|
9 g
|
-Filtrer et amener à 85 ml avec l'eau distillée.
*Solution 2 :
|
Eau distillé
|
150 ml
|
|
CuSO4
|
17.3 g
|
-Mélanger la solution (1) et 15 ml de la solution (2)
lentement en agitant le mélange. Bleu de méthylène
(réactif de coloration simple)
|
Bleu de méthylène
|
1.5 g
|
|
Acide phénique
|
1 g
|
|
Alcool absolu
|
10 ml
|
|
Eau distillée
|
100 ml
|
-Broyer dans un mortier le colorant dans l'alcool .Ajouter peu
à peu l'eau phéniquée préparée à
part, en continuant à broyer (la solution doit être
filtrée).
Phénolphtaléine
|
Phénolphtaléine
|
1 g
|
|
Alcool éthylique à 95°
|
100 ml
|
Réactif nitrochromique à ??
??e mol. L-??
|
Dichromate de potassium
|
4 g
|
|
Acide nitrique
|
2 ml
|
|
Eau distillée
|
1000 ml
|
[ANNEXES 04]
Annexes
Analyse statistique de la densité optique (DO)
de dosage de ST des échantillons (datte, raisin, V. de datte, V. de
raisin) :
|
VD
|
VR
|
D
|
R
|
|
T0
|
0,2
|
2
|
2,08
|
0,452
|
|
T0
|
1,48
|
0,002
|
4
|
2,83
|
|
T0
|
1,48
|
0,004
|
4
|
1,1
|
|
T1
|
0,09
|
4
|
1,87
|
0,339
|
|
T1
|
0,049
|
0,14
|
2
|
0,13
|
|
T1
|
0,005
|
0,12
|
0,312
|
0,012
|
|
T2
|
0,008
|
1,63
|
0,022
|
0,26
|
|
T2
|
0,034
|
0,096
|
1,9
|
0,123
|
|
T2
|
0,004
|
0,046
|
2
|
0,15
|
|
T3
|
0,0038
|
0,09
|
0,055
|
0,211
|
|
T3
|
0,1
|
0,08
|
1,015
|
0,125
|
|
T3
|
0,035
|
0,037
|
1,98
|
0,047
|
|
T4
|
0,005
|
0,008
|
0,054
|
0,155
|
|
T4
|
0,18
|
0,079
|
1
|
0,018
|
|
T4
|
0,031
|
0,053
|
1,5
|
0,011
|
|
T5
|
0,004
|
0,092
|
0,01
|
0,137
|
|
T5
|
0,172
|
0,074
|
0,05
|
0,01
|
|
T5
|
0,02
|
0,1
|
1
|
0,012
|
|
Moyenne
|
0,21671111
|
0,48061111
|
1,38044444
|
0,34011111
|
|
Ecart type
|
0,46411464
|
1,04581542
|
1,24709098
|
0,67231277
|
|
Moyenne T0
|
1,05333333
|
0,66866667
|
3,36
|
1,46066667
|
|
Ecartype T0
|
0,73900834
|
1,15296892
|
1,10851252
|
1,22934183
|
|
Moyenne T1
|
0,048
|
1,42
|
1,394
|
0,16033333
|
|
[ANNEXES 04]
|
|
|
|
Annexes
|
|
Ecartype T1
|
0,04250882
|
2,23436792
|
0,93929122
|
0,1655969
|
|
MoyenneT2
|
0,01533333
|
0,59066667
|
1,30733333
|
0,17766667
|
|
Ecartype T2
|
0,01628906
|
0,90043619
|
1,11425371
|
0,07256951
|
|
Moyenne T3
|
0,04626667
|
0,069
|
1,01666667
|
0,12766667
|
|
Ecartype T3
|
0,04907966
|
0,02816026
|
0,96250108
|
0,08203251
|
|
Moyenne T4
|
0,072
|
0,04666667
|
0,85133333
|
0,06133333
|
|
EcartypeT4
|
0,09442987
|
0,03592121
|
0,73437411
|
0,08119319
|
|
Moyenne T5
|
0,06533333
|
0,08866667
|
0,35333333
|
0,053
|
|
Ecartype T5
|
0,09272181
|
0,01331666
|
0,56038677
|
0,07275301
|
Analyse de variance: deux facteurs avec
répétition d'expérience
|
RAPPORT DÉTAILLÉ
T0
|
VD
|
VR
|
D
|
R
|
Total
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
3,16
|
2,006
|
10,08
|
4,382
|
19,628
|
|
Moyenne
|
1,05333333
|
0,66866667
|
3,36
|
1,46066667
|
1,63566667
|
|
Variance
|
0,54613333
|
1,32933733
|
1,2288
|
1,51128133
|
2,00595988
|
|
T1
|
|
|
|
|
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
0,144
|
4,26
|
4,182
|
0,481
|
9,067
|
|
Moyenne
|
0,048
|
1,42
|
1,394
|
0,16033333
|
0,75558333
|
|
Variance
|
0,001807
|
4,9924
|
0,882268
|
0,02742233
|
1,53816917
|
|
T2
|
|
|
|
|
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
0,046
|
1,772
|
3,922
|
0,533
|
6,273
|
|
[ANNEXES 04]
|
|
|
Annexes
|
|
|
|
Moyenne
|
0,01533333
|
0,59066667
|
1,30733333
|
0,17766667
|
0,52275
|
|
Variance
|
0,00026533
|
0,81078533
|
1,24156133
|
0,00526633
|
0,6459973
|
|
T3
|
|
|
|
|
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
0,1388
|
0,207
|
3,05
|
0,383
|
3,7788
|
|
Moyenne
|
0,04626667
|
0,069
|
1,01666667
|
0,12766667
|
0,3149
|
|
Variance
|
0,00240881
|
0,000793
|
0,92640833
|
0,00672933
|
0,35028812
|
|
T4
|
|
|
|
|
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
0,216
|
0,14
|
2,554
|
0,184
|
3,094
|
|
Moyenne
|
0,072
|
0,04666667
|
0,85133333
|
0,06133333
|
0,25783333
|
|
Variance
|
0,008917
|
0,00129033
|
0,53930533
|
0,00659233
|
0,22928633
|
|
T5
|
|
|
|
|
|
|
Nombre d'échantillons 3
|
3
|
3
|
3
|
12
|
|
Somme
|
0,196
|
0,266
|
1,06
|
0,159
|
1,681
|
|
Moyenne
|
0,06533333
|
0,08866667
|
0,35333333
|
0,053
|
0,14008333
|
|
Variance
|
0,00859733
|
0,00017733
|
0,31403333
|
0,005293
|
0,07637027
|
|
Total
|
|
|
|
|
|
|
Nombre d'échantillons
|
18
|
18
|
18
|
18
|
|
|
Somme
|
3,9008
|
8,651
|
24,848
|
6,122
|
|
|
Moyenne
|
0,21671111
|
0,48061111
|
1,38044444
|
0,34011111
|
|
|
Variance
|
0,2154024
|
1,0937299
|
1,55523591
|
0,45200446
|
|
|
ANALYSE DE VARIANCE :
|
|
|
|
|
|
Source des variations
|
Somme des carrés
|
Degré de liberté Moyenne des
carrés
|
F
|
Probabilité
|
|
Échantillon
|
18,1505124
|
5 3,63010249
|
6,05106454
|
0,00020263
|
|
[ANNEXES 04]
|
Annexes
|
|
Colonnes 15,0789589 3 5,02631965 8,37843689
0,00013926
Interaction 9,43207651 15 0,6288051
1,04816331 0,42649141
A l'intérieur du
groupe 28,7957463 48 0,59991138
Total 71,4572942 71
Df Sum Sq Mean Sq F value Pr(>F)
Dose 5 18,1505124 3,63010249 6,05106454
0,00020263
Traitement 3 15,0789589 5,02631965 8,37843689
0,00013926
Dose:Traitement 15 9,43207651 0,6288051
1,04816331 0,42649141
Residuals 48 28,7957463 0,59991138 NA NA
Post hoc test: Honesty Signicance Difference de Tukey
(HSDT): Multiple Comparisons: Tukey
Valeur groups
T0 1,6357 a
T1 0,7556 ab
T2 0,5228 b
T3 0,3149 b
T4 0,2578 b
T5 0,1401 b
Valeur groups
D 1,3804 a
VR 0,4806 b
R 0,3401 b
VD 0,2167 b
Valeur groups
[ANNEXES 04]
Annexes
T0:D 3,3600 a
T0:R 1,4607 ab
T1:VR 1,4200 ab
T1:D 1,3940 ab
T2:D 1,3073 ab
T0:VD 1,0533 ab
T3:D 1,0167 ab
T4:D 0,8513 b
T0:VR 0,6687 b
T2:VR 0,5907 b
T5:D 0,3533 b
T2:R 0,1777 b
T1:R 0,1603 b
T3:R 0,1277 b
T5:VR 0,0887 b
T4:VD 0,0720 b
T3:VR 0,0690 b
T5:VD 0,0653 b
T4:R 0,0613 b
T5:R 0,0530 b
T1:VD 0,0480 b
T4:VR 0,0467 b
T3:VD 0,0463 b
T2:VD 0,0153 b

Isolement et identification d'Acetobacter aceti à
partir d'un vinaigre biologique.

Mots clés: vinaigre biologique, dattes, raisin,
bactéries acétiques, Acétobacter,
thermotolérances.
Résumé :
Les dattes et les raisins possèdent une grande
importance dans la fabrication alimentaire, parmi lesquels l'élaboration
du vinaigre traditionnel et ou biologique. Ce vinaigre est obtenu par une
double fermentation simultanée, alcoolique et acétique. Les
résultats de notre étude dont l'objectif est la fa la recherche
et identification des bactéries acétiques issues du vinaigre
biologique de dattes du cultivas Hmira et de raisin variété rouge
autochtone, ont permet déterminer la qualité microbiologique et
physico-chimique des dattes et raisin et leurs deux vinaigre obtenues .et
éssentiellemt d'isolement et identification d'espèce
Acétobacter aceti et de la sous -espèces :
Acétobacter subsp aceti aceti et les autres espèces de
même genre Acetobacter, et l'étude de la
thermotolérance des souches obtenues, montre leur croissance à
des températures aux alentours de 25°C à 45°C, dont
elles tolèrent.
Isolation and identification of Acetobacter aceti from
organic vinegar.
Abstract:
Dates and grapes haves a great importance in food
manufacturing, among which the elaboration of traditional and or organic
vinegar. This vinegar is obtained bay simultaneous double fermentation,
alcoholic and acetic. The results of our study, the objective of which is
research and identification of acetic bacteria resulting from the organic
vinegar of dates of the Hmira and of the indigenous and variety grape, have
made it possible to determine the microbiological and physiochemical quality of
dates and grapes and their two, vinegar obtained and essentially isolation and
identification of Acetobacter aceti species and of the subspecies:
Acétobacter subsp aceti aceti and other species of the same
genus Acetobacter, and the study of the thermotolerance of the
obtained strains, shows their growth at temperatures around 25°C to
45°C, which they tolerate.
Keywords : organic vinegar, dates, grapes, acetic bacteria,
Acetobacter, thermotolerances.
. 
ñìÖÚäÇ
ãÎäÇ åã
Acetobacter aceti ,.,.,_; s Ji=
ÞóÒØ åÚ
ãÎäÇ ÇÐøå ðåÚ
áìÕÍäÇ ãÊó
|
. ñìÖÚäÇ
ãÎäÇ æÇ æ
ñÐõåÞÊäÇ
ãÎäÇ ÊÚÈìÕ
ÈåìõÈ åã
ÊóÐÛáÇ
ÊÚÈìÕ ò
ÉÒõÈß ÊõãåÇ
Èãåä ÈìÚäÇæ
ÒãÊäÇ
|
ãÎäÇ åÚ
ÊÌÊÈìäÇ
ßõåÎäÇ
ÈóÒõÊßÈ ðåÚ
ÒÚÊäÇ æ
ËÍÈäÇ ðäÇ ÐåÊ
òÊäÇ
ÈìÊÓÇÑÏ
ÌÆÈÊæ äÇ
|
. òåÎäÇ æ
òäìÍßäÇ Ó
åãÇÔÊãäÇ
ÌæÏÔãäÇ
ÒõãÎÊäÇ
|
|
|
ãÎäÇæ ÈÚã
ÈìÚäÇæ
ÒãÊåä
ÊõÆÈõãßìóÔõäÇæ
ÊõÌìäìõÈæÒßõãäÇ
ÉÏìÌäÇ ÐóÐÍÊ
æ ° òåÍãäÇ
ÈìÚäÇ æ
ÉÒõãÍ ìÕ
ÒãÊäÇ åã
ÊÚììÕãäÇ
|
. ßóìÖÚäÇ
|
|
åã íÒÎÇ
ÚÇìæÇ æ Acetobacter subsp aceti
acetiÊõÚÒäÇ
ËáÇáÇÓäÇæ Acetobacter
aceti
|
ÐóÐÍÊæ
áÔÚæ åõåÚ
áìÕÍäÇ ãÊ
òÊäÇ
|
|
ÊÌÑÏ
|
45 ðäÇ ÊóìÆã
ÊÌÑÏ
|
25 åõÈ
ÉÑÇÒÍäÇ
ËÈÌÑÏ ò
Èåìãæ ÍÖìó
òÊäÇ ÈåõåÚ
ãÕÍÊãäÇ
ËáÇáÇÓåä
ñÑÇÒÍäÇ
ããÍÊäÇ
ÊÓÇÑÏæ
ÓìÌäÇ Óæ
|
|
. ÉÑÇÒÍåä
ÊåãÍÊã Acetobacter
|
.ÈåæìåãÍÊó
òÊäÇæ ÊóìÆã
ßõåÎäÇ
ÖãÍ ÈóÒõÊßÈ
ÈìÚ ÒãÊ
ñìÖÚ ãÎ
:ÊõÍÈÊã
ËÈãåß
|



