II.6.1.2. Recrutement des patients
Les participants été recrutés à
l'HLD de Juin 2021 à Aout 2021. Le recrutement s'est
déroulé en respectant les règles d'éthique
liées à la recherche sur l'Homme en vigueur au Cameroun.
A cet effet, pour le recrutement des patients souffrant du
paludisme, fièvre typhoïde et co-infections paludisme-fièvre
typhoïde s'est fait dans le laboratoire central ainsi que dans les
services de pédiatrie. Quant aux témoins, le recrutement s'est
fait dans les services des vaccinations de l'HLD. Un entretien de 10 à
15 minutes nous a permis d'informer les parents des enfants de l'objectif, la
méthodologie et les contraintes liés à l'étude
avant la prise du sang de leur enfant.
25
Rédigé et présenté par
: Axel MASRA
II.6.1.3. Collecte des données
Avant le prélèvement sanguin, les données
anthropométriques (poids, âge, taille), hygiéniques
(fréquence de lavage de mains, condition de vie) et cliniques
(symptômes, sous médication ou non) ont été
collectées à partir de la fiche
d'enquête.
II.6.2. PHASE PRE-ANALYTIQUE
II.6.2.1. Prélèvement sanguin
Avant le prélèvement les tubes ont
été préalablement étiquetés. Les
informations portées sur l'étiquette ont concerné le
numéro d'identification du patient et la date du jour de
prélèvement. Trois millilitres de sang ont été
prélevés par ponction veineuse dans des tubes secs pour l'examen
de Widal-Felix, dans des tubes EDTA pour la NFS et les flacons stériles
ont été remis aux parents des patients pour les selles pour la
coproculture.
Après prélèvement, les tubes ont
été retournés délicatement de façon à
éviter l'hémolyse et la formation des bulles d'air. Tous les
prélèvements ont été réalisés dans
les conditions d'asepsie.
II.6.2.2. Transport et conservation des
échantillons
Les tubes prélevés ont ensuite été
transportés au laboratoire à l'aide d'un bac
réservé à cet effet. Ils ont par la suite subit une
centrifugation à l'aide d'une centrifugeuse de marque VanGuard V6000
(Annexe VI).
II.6.3. PHASE ANALYTIQUE
II.6.3.1 Etude de la prévalence des
co-infections Plasmodium-Salmonelles
1. Prévalence des infections à Plasmodium
? Examen de TDR
Il est utilisé pour une détection qualitative
rapide de la HRP2 (protéine riche en histidine 2) du Plasmodium
falciparum dans le sang humain en tant qu'aide au diagnostic d'infection
du paludisme.
Principe : Le TDR utilisé est le
CareStartTM Malaria Pf (HRP2) Ag RDT qui
contient une membrane pré-revêtue d'un anticorps monoclonal en
ligne complète tout au long de la
bande de test. L'anticorps monoclonal est spécifique
à l'HRP2 du P. falciparum. Le tampon conjugué est
distribué avec des anticorps adsorbés dans des particules
d'or.
26
Rédigé et présenté par
: Axel MASRA
Procédure : Nettoyer la zone du doigt
avec un tampon d'alcool avant de piquer. A l'aide d'une lancette, percer la
zone du doigt nettoyée, essuyer la première goutte de sang avec
du coton et recueillir l'échantillon de sang (5ul) en utilisant un
dispositif de transfert */fourni dans le kit. Ajouter les 5ul sang
prélevés dans le puits « S », ensuite ajouter 2 gouttes
(60ul) de solution tampon dans le puits « A ». Attendre 20 minutes et
lire les résultats.
? Examen de la goutte épaisse
La goutte épaisse a été choisie comme
technique de référence pour la recherche de Plasmodium.
On utilise à cet effet la coloration de Giemsa qui est utilisée
entre autres, pour la coloration de protozoaires. Elle fait partie avec le
frottis sanguin des techniques de références pour diagnostiquer
le paludisme, c'est-à-dire mettre en évidence le Plasmodium
responsable du paludisme.
Principe : Lors de l'addition d'eau, les sels
(l'éosinate de méthylène et l'azur de
méthylène) se précipitent et se fixent
sélectivement sur les constituants cellulaires. Les noyaux étant
colorés de bleu à violet-noir et les hématies en
beige-rose.
Procédure : Après avoir
étiqueté une lame porte objet, une goutte de sang sera
déposée et étalée sur une lame préalablement
étiquetée. Puis la goutte de sang sera étalée
à l'aide d'un bouchon d'aiguille pour seringue par un mouvement en
spirale ou rotatoire. La lame sera enfin séchée à l'abri
de la poussière, des mouches et de la chaleur, puis recouverte de Giemsa
diluée au 1/10ème et examinée au microscope à
l'objectif 100X après 15 minutes (POIMT., 2008).
2. Prévalence des infections à
Salmonelle
? Sérodiagnostic Widal-Felix
Le sérodiagnostic de WIDAL et FELIX permet de
détecter la présence dans le sang d'anticorps dirigés
contre les constituants de Salmonella: Les anticorps anti-O
apparaissent vers le 7-8e jour, atteignent leur maximum vers le 14e jour,
restent ensuite en plateau jusqu'à la 4e semaine puis disparaissent
rapidement. Les anticorps anti-H apparaissent vers le 10e jour, montent
rapidement pour atteindre un maximum de 1/800e à 1/1600e vers le 14e
jour, restent en plateau jusqu'à la 4e semaine et diminuent ensuite.
Mais à l'inverse des anticorps
27
Rédigé et présenté par
: Axel MASRA
anti O, ils ne disparaissent pas complètement. Ils
persistent toute la vie à un taux de l'ordre de 1/200e.
II.6.3.2 Evaluation de l'effet des co-infections
Plasmodium-Salmonelles sur
les paramètres
hématologiques
? Numération de Formule Sanguine
Cet examen de sang permet de renseigner les personnes sur leur
état de santé. Les renseignements obtenus concernent les volumes
de cellules érythrocytes et des lymphocytes.
? Valeurs normales de l'hémogramme chez les
enfants Tableau I : Numération réalisée sur
l'automate Pentra XRL
|
Paramètres
|
Valeurs
|
|
Globules rouges
|
3,50 - 5,50
|
|
Hémoglobines
|
12,00 - 14,00
|
|
Hématocrite
|
36 - 44
|
|
Volume Globulaire Moyen
|
73 - 89
|
|
Teneur Globulaire Moyenne en Hémoglobine
|
24 - 30
|
|
Concentration Corpusculaire Moyenneen Hémoglobine
|
32 - 36
|
|
Plaquettes sanguines
|
200 - 400
|
|
Globules blancs
|
4,50 - 13,50
|
|
Neutrophiles
|
1,80 - 8,00
|
|
Lymphocytes
|
1,50 - 6,50
|
|
Monocytes
|
0,00 - 0,80
|
|
Eosinophile
|
0,00 - 0,65
|
|
Basophile
|
0,00 - 0,20
|
? Procédure
Le comptage et l'analyse des échantillons sanguins sont
effectués rapidement après la collecte à l'aide de
l'hématimètre Pentra XRL (Annexe VIII).
Après avoir enregistré les données du
28
patient, secouez doucement le tube EDTA pour bien
homogénéisé l'échantillon de sang, puis
présentez le tube d'échantillon à la sonde (gardez la
sonde au fond du tube). Appuyez sur la touche Run. Les résultats seront
disponibles après l'analyse. Les résultats des tests et les
histogrammes de WBC, de RBC et de PLT seront affichés à l'analyse
des cellules sanguines après comptage et analyse.
? Analyses statistiques
Les résultats issus des fiches d'enquêtes et
analyses de laboratoire ont été saisis dans le logiciel Excel
2016 et traités avec le logiciel SPSS version 22. Pour évaluer
l'effet des co-infections Plasmodium-Salmonelles sur les
paramètres hématologiques, nous avons
procédé à l'analyse des variances (ANOVA). Les
différences entre les moyennes des différents paramètres
hématologiques dans les quatre groupes de la population d'étude
ont été calculées et nous les avons comparés
à l'aide du test de Pearson Square (test de chi 2) au seuil de
signification 0,05.
Rédigé et présenté par
: Axel MASRA
29
CHAPITRE III : RESULTATS ET DISCUSSION
30
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
I. RESULTATS
I.1 Caractéristiques de la population
d'étude
Cette étude a porté sur une population
constituée de 101 patients volontaires des deux sexes. Cette population
a été subdivisée en quatre groupes : patients
infectés au Plasmodium, les patients infectés de
Salmonelles, les patients co-infectés de Plasmodium et
Salmonelles et les patients témoins.
I.1.1 Répartition de la population d'étude
en fonction des caractéristiques sociodémographiques
L'analyse des données montre une fréquence de
(50,5%) chez les enfants de sexe feminin contre (49,5%) chez les enfants de
sexe masculin.De plus on observe une forte fréquence de (62,4%) chez les
enfants vivant dans les zones urbaines que les enfants vivant dans les zones
rurales (37,6%).
Tableau II: Distribution de la population
d'étude selon les caractéristiques sociodémographiques
|
Variables
|
Groupes
|
Fréquence
|
Pourcentage
|
|
Féminin
|
51
|
50,5%
|
|
Sexe
|
|
|
|
|
Masculin
|
50
|
49,5%
|
|
Rurale
|
38
|
37,6%
|
|
Zone
|
|
|
|
|
Urbaine
|
63
|
62,4%
|
Feminin Masculin Rurale Urbaine
Caractères sociodémographiques
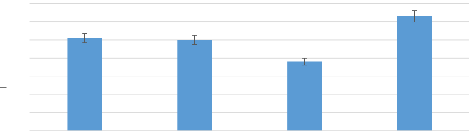
70
60
50
Frequence
40
30
20
10
0
63
50
38
51
Figure 9 : Répartition de la population
en fonction des caractéristiques sociodémographiques
31
I.1..3 Fréquence des co-infectés par
rapport aux patients reçus
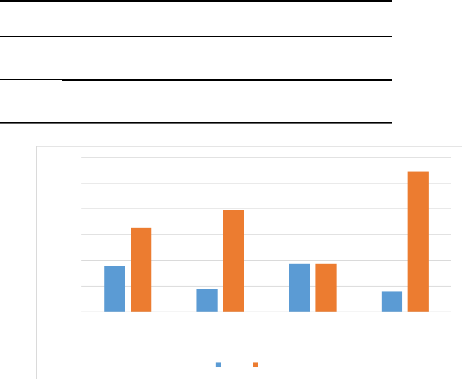
Nous remarquons dans le tableau III que le sexe le plus
touché est le sexe féminin avec 18 patients soit une
prévalence de 17,82% alors que chez le sexe masculin nous avons un
effectif de 9 patients avec une prévalence de 8,91%. L'effectif total de
patients sains est de 77 soit 76,23% reparti comme suit, 33 (32,67%) chez les
filles et 40 (39,60%) chez les garçons. La zone la plus touchée
est la rurale avec 19 soit une prévalence de 18,81 contre 8 patients
soit une prévalence de 7,92% dans la zone urbaine. La prévalence
des co-infections à Plasmodium et Salmonelles dans
notre population d'étude est de 26,73%. Les deux groupes étaient
statistiquement comparables (p-value < 0,05).
Tableau III : Fréquence des patients
souffrant des co-infections à Plasmodium et Salmonelles
par rapport aux patients reçus
|
Variable
|
|
Positif (%)
|
Négatif (%)
|
X2
|
P Valeur
|
|
Féminin
|
18(17,82%)
|
33(32,67%)
|
|
|
|
Sexe
|
|
|
|
3,633
|
0,0567
|
|
Masculin
|
9(8,91%)
|
40(39,60%)
|
|
|
|
Rurale
|
19(18,81%)
|
19(18,81%)
|
|
|
|
Zone
|
|
|
|
16.84
|
< 0.0001***
|
|
Urbaine
|
8(7,92%)
|
55(54,45%)
|
|
|
Feminin Masculin Rurale Urbaine
Groupes
Positif Negatif
60
50
40
Fréquence(%)
30
20
10
0
18,81
18,81
7,92
54,45
17,82
32,67
39,6
8,91
Figure 10 : Fréquence des patients
co-infectés à Plasmodium et Salmonelles par
rapport aux
patients reçus
32
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
I.2. Influence des statuts infectieux sur les
paramètres hématologiques
I.2.1 Influence des infections à Plasmodium
sur le profil hématologique
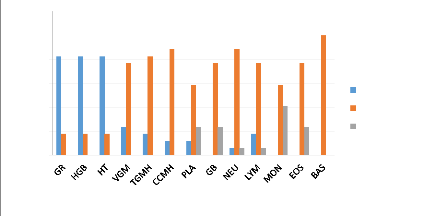
Nous remarquons dans cette partie que le taux de globules rouges,
d'hémoglobines et d'hématocrites ont considérablement
diminuée avec une prévalence de 82,35%
Tableau IV: Influence de l'infection à
Plasmodium sur le profil hématologique
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
14 (82,35%)
|
3(17,64%)
|
0(0%)
|
|
HGB
|
14(82,35%)
|
3(17,64%)
|
0(0%)
|
|
HT
|
14(82,35%)
|
3(17,64%)
|
0(0%)
|
|
VGM
|
4(23,52%)
|
13(76,47%)
|
0(0%)
|
|
TGMH
|
3(17,64%)
|
14(82,35%)
|
0(0%)
|
|
CCMH
|
2(11,76%)
|
15(88,23%)
|
0(0%)
|
|
PLA
|
2(11,76%)
|
10(58,82%)
|
4(23,52%)
|
|
GB
|
0(0%)
|
13(76,47%)
|
4(23,52%)
|
|
NEU
|
1(5,88%)
|
15(88,23%)
|
1(5,88%)
|
|
LYM
|
3(17,64%)
|
13(76,47%)
|
1(5,88%)
|
|
MON
|
0(0%)
|
10(58,82%)
|
7(41,17%)
|
|
EOS
|
0(0%)
|
13(76,47%)
|
4(23,52%)
|
|
BAS
|
0(0%)
|
17(100%)
|
0(0%)
|
33
Frequence(%)
120
100
40
80
60
20
0
Paramètres hématologiques
Inf. Normale Normale
Sup. Normale
Figure 11: Influence de l'infection à
Plasmodium sur le profil hématologique
I.2.2.
Influence des infections à Salmonelles le profil
hematologique
Nous remarquons dans cette partie une diminution du taux de
globules rouges (61,90%), d'hémoglobines (66,66%) et
d'hématocrites (71,42%).
Tableau V: Influence de l'infection à
Salmonelles sur le profil hématologique
Rédigé et présenté par
: Axel MASRA
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
13(61,90%)
|
7(33,33%)
|
1(4,76%)
|
|
HGB
|
14(66,66%)
|
7(33,33%)
|
0(0%)
|
|
HT
|
15(71,42%)
|
6(28,57%)
|
0(0%)
|
|
VGM
|
5(23,80%)
|
11(52,38%)
|
5(23,80%)
|
|
TGMH
|
4(19,04%)
|
14(66,66%)
|
3(14,28%)
|
|
CCMH
|
7(33,33%)
|
14(66,66%)
|
0(0%)
|
|
PLA
|
3(14,28%)
|
15(71,42%)
|
3(14,28%)
|
|
GB
|
0(0%)
|
13(61,90%)
|
8(38,09%)
|
|
NEU
|
0(0%)
|
14(66,66%)
|
7(33,33%)
|
|
LYM
|
1(4,76%)
|
16(76,19%)
|
4(19,04%)
|
|
MON
|
0(0%)
|
11(52,38%)
|
10(47,61%)
|
|
EOS
|
0(0%)
|
20(95,23%)
|
1(4,76%)
|
|
BAS
|
0(0%)
|
20(95,23%)
|
1(4,76%)
|
34
|
100 90 80 70 60 50 40 30 20 10
0
|
|
|
|
|
Frequence(%)
|
|
Inf. Normale Normale
Sup. Normale
|
Paramètres hématologiques
Rédigé et présenté par
: Axel MASRA
Figure 12 : Influence de l'infection à
Salmonelles sur le profil hématologique
I.2.3. Influence des co-infections à
Plasmodium et Salmonelles sur le profil
hématologique
Nous remarquons dans cette partie une diminution du taux de
globules rouges (85,18%), d'hémoglobines (74,07%) et
d'hématocrites (70,37%), de plaquettes sanguines (55,55%). Ainsi qu'une
augmentation du taux de monocytes (59,25%).
Tableau VI: Influence des co-infections à
Plasmodium et Salmonellessur le profil
hématologique
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
23(85,18%)
|
4(14,81%)
|
0(0%)
|
|
HGB
|
20(74,07%)
|
7(25,92%)
|
0(0%)
|
|
HT
|
19(70,37%)
|
8(29,62%)
|
0(0%)
|
|
VGM
|
5(18,51%)
|
19(70,37%)
|
3(11,11%)
|
|
TGMH
|
5(18,51%)
|
18(66,66%)
|
4(14,81%)
|
|
CCMH
|
5(18,51%)
|
22(81,48%)
|
0(0%)
|
|
PLA
|
15(55,55%)
|
7(25,92%)
|
5(18,51%)
|
|
GB
|
7(25,92%)
|
7(25,92%)
|
13(48,14%)
|
|
NEU
|
8(29,62%)
|
17(62,96%)
|
2(7,40%)
|
|
LYM
|
13(48,14%)
|
7(25,92%)
|
7(25,92%)
|
|
MON
|
0(0%)
|
11(40,74%)
|
16(59,25%)
|
|
EOS
|
0(0%)
|
24(88,88%)
|
3(11,11%)
|
|
BAS
|
0(0%)
|
23(85,18%)
|
4(14,81%)
|
35
|
100,00 90,00 80,00 70,00 60,00 50,00 40,00 30,00 20,00 10,00
0,00
|
|
|
|
|
Frequence(%)
|
|
Inf. Normal Normal
Sup. Normal
|
|
|
|
|
Paramètres hématologiques
Figure 13: Influence des co-infections à
Plasmodium et Salmonelles sur le profil
hématologique,
Rédigé et présenté par
: Axel MASRA
36
Rédigé et présenté par
: Axel MASRA
|
|



