Chapitre II : Matériel & Méthodes
Pour son utilisation in vivo dans un modèle de
colite induite par le DSS, l'extrait soluble de la ML est préparé
après broyage mécanique dans un tampon PBS stérile (pH :
7.4) contenant des anti-protéases.
Afin d'éliminer toute contamination pouvant
interférer avec l'effet de la ML nous avons procédé
à la décontamination des extraits brut et soluble par un kit
d'élimination d'endotoxines, Endotoxin Removal kit (Life technologies).
Cela a été réalisé selon les instructions du
fabricant.
2. Induction d'une colite aigue par le Dextran Sulfate
Sodium (DSS) chez des souris BALB/c :
La colite expérimentale est induite après
administration de 3% de DSS ad libitum dans l'eau de boisson à
des souris BALB/c pendant 5 jours. Les souris ont été
randomisé en 3 groupes de 4souris chacun (Figure 7).
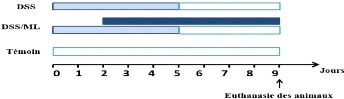
Figure 7: Schéma
expérimental.
La solution de DSS à 3% est préparée
fraichement chaque jour, les souris sont pesées chaque jour et les
paramètres cliniques de la colite le poids, saignements rectaux,
consistance des selles ont été contrôlés
quotidiennement chez toutes les souris, durant la période
expérimentale afin d'évaluer la sévérité de
l'inflammation tout au long de l'expérimentation. Chacun de ces
paramètres est évalué sur une échelle de 0 à
4 afin de calculer le «Disease Activity Index» (DAI), le DAI est
établis tous les jours comme suit (Cooper et al, 1993) :
Tableau V : Paramètres de calcule du
DAI.
|
Paramètres
Scores
|
selles
|
sang
|
Perte de poids
|
|
0
|
normales
|
Pas de sang
|
Pas de perte de poids
|
|
1
|
Normales/molles
|
Pas de sang
|
1 à 3% de perte de poids
|
|
2
|
molles
|
Visible dans les selles
|
3 à 6% de perte de poids
|
|
3
|
Diarrhée liquide
|
selles et intérieur de l'anus
|
6 à 9% de perte de poids
|
|
4
|
Liquide et queue marron
|
Sang au niveau de l'anus et la queue
|
> 9% de perte de poids
|
25
Chapitre II : Matériel & Méthodes
3. Prélèvements sanguins :
Après avoir sacrifié les souris le sang a
été récupéré par ponction cardiaque dans des
Eppendorf contenant de l'EDTA à 2.6%. Il a été ensuite
centrifugé pendant 10min à 3000 rpm, et les plasma ont
été récupérés et conservés à
-20°C pour un dosage ultérieur du NO.
4. Préparation des macrophages
péritonéaux : 4.1 Récupération des macrophages
:
Pour récupérer les macrophages
péritonéaux il est nécessaire d'effectuer un lavage
péritonéal, pour ce faire un volume de 5ml de PBS stérile
est injecté dans la cavité péritonéale de la
souris. Celle-ci est secouée quelque secondes afin de
récupérer un maximum de cellules. Le liquide
péritonéal prélevé est ensuite centrifugé a
2800 rpm pendant 10min. le culot obtenu est remis en suspension dans un volume
déterminé de DMEM après deux lavages avec du PBS
stérile.
4.2 Test de viabilité :
Un test de viabilité et un comptage des macrophages
sont d'abord effectués sur une cellule Malassez. La viabilité
cellulaire est évaluée en utilisant un colorant vital (Bleu de
trypan) ce dernier nous permettra de différencier entre les cellules
vivantes qui apparaissent réfringentes des cellules mortes de couleur
bleu.
La densité cellulaire (4.105 cellules/ml) est
déterminée par la formule suivante :
Le nombre de cellules= M x d x 105 x V
M : moyenne des macrophages vivants observés dans 3 champs
de la lame de Malassez.
D : facteur de dilution
105 : volume pris par la rigole de la lame de
Malassez.
V : volume de la suspension cellulaire.
| 


