UNIVERSITE CATHOLIQUE
DE L'AFRIQUE DE L'OUEST
(UCAO)
Unité Universitaire à
Bobo-Dioulasso (UUB)
------------------------------------
UNITE DE FORMATION ET
DE RECHERCHE EN SCIENCES
ET TECHNIQUES(UFR/ST)
RAPPORT DE FIN DE CYCLE
Présenté en vue de l'obtention du
Diplôme de Licence
Domaine : Sciences et Techniques
Mention : Sciences Biologiques Appliquées
THEME :
Diagnostic précoce du VIH-1 chez les enfants
nés des mères séropositives par RT/PCR au laboratoire
de virologie du Centre MURAZ
0Spécialité : Analyses
Biologiques
Présenté et soutenu publiquement par :
YANGALBE JIANSERBE
Jean-Jacques Prince
Directeur de rapport et Maître de stage :Dr
Dramane KANIA
Président du Jury : Dr Jacques
KABORE
Membres du Jury : Dr Isidore
HOUAGA
Dr Dramane KANIA
Année académique 2019-2020
DEDICACE
Je dédie ce travail
A l'Eternel mon Dieu
A mon père YANGALBE PASSIRI (In
memoriam) : tu es parti si tôt. Merci
pour tout l'amour et le courage que tu as su nous donner. J'aurais tant
aimé que tu sois là mais Dieu en a décidé autrement
qu'il t'accueille dans son
paradis. Je suis sûre que de là ou tu es, tes prières ont contribué à l'élaboration de ce
travail. Puisse ton âme reposer en paix
papa. Tu me manques beaucoup !
A ma mère KALSOBE martine :
Chère mère exemplaire, les mots m'ont toujours manqué pour
exprimer toute l'admiration que j'ai pour toi. Femme joyeuse, dynamique,
généreuse et sociale. Tes prières, tes conseils m'ont
été d'un grand soutien au cours de ce long parcours. Ce travail
est la consécration de tous les efforts que tu as déployés
pour tes enfants. Puisse Le Tout Puissant te donne la santé, le bonheur
et une longue vie afin qu'on puisse te combler à notre tour.
Amen !
A ma grande soeur YANGALBE KALNONE Elise :
Entomologiste de formation, c'est grâce à toi et ton
brillant parcours que j'ai pris le goût de la Biologie. Je rends
grâce à Dieu de t'avoir comme grande soeur. Tu m'apportes beaucoup
d'encouragement et un soutien très fort. Je t'en suis reconnaissant.
Trouve en ce travail un élément de satisfaction.
A mon grand frère YANGALBE KAGONBE
Yves : Je rends grâce à Dieu de t'avoir comme grand
frère. Tu m'apportes beaucoup d'encouragement et un soutien très
fort. Je t'en suis reconnaissant. Trouve en ce travail un élément
de satisfaction.
A tous mes frères et soeurs : Que
l'entente et l'affection soient toujours présentes dans nos relations et
n'oublions jamais les efforts fournis par nos parents pour parfaire notre
éducation et que l'unité familiale soit notre but.
A tous les enfants de moins de 18 mois nés des mères infectées par le VIH,
Puisse ce travail contribuer à l'amélioration de votre prise en charge.
REMERCIEMENTS
Ce travail est l'aboutissement de la contribution de plusieurs
personnes auxquelles nous tenons à exprimer notre profonde gratitude. Il
sied de remercier particulièrement :
ü Le révérend père
Édouard ADE, président de l'Université Catholique
de l'Afrique de l'Ouest/ Unité Universitaire à Bobo-Dioulasso
(UCAO/UUB) ;
ü Dr Dramane KANIA, PharmD, MSc, PhD,
Directeur scientifique et Technique du Centre MURAZ, mon professeur de
virologie au semestre 3, merci de m'avoir donné le goût de la
virologie et d'avoir accepté de diriger mon travail malgré vos
multiples occupations. Surtout mes sincères remerciements,
J'espère avoir été à la hauteur de vos attentes et
soyez assurés de ma profonde reconnaissance ;
ü Aux membres du jury, pour l'effort
consenti à apporter leur contribution à notre travail en le
jugeant ;
ü Dr Amariane OUATTARA, responsable du
laboratoire de Biologie clinique du Centre MURAZ, nous vous remercions de nous
avoir permis de réaliser notre stage auprès de vous ;
ü A tous le corps professoral et administratif
de l'UCAO/UUB pour la qualité de l'enseignement reçu
;
ü A Mlle Viviane NIKIEMA, KADEBA
Franck Edgar,YOUSSOUF adam cherifpour leur disponibilité et
pour le temps qu'ils m'ont consacré tout au long de mon stage. J'ai
beaucoup appris d'eux ;
ü Aux Dr Thérèse
KAGONE,Moumouni NOCTARApour les conseils et le
soutient que j'ai reçu d'eux au fil des jours de mon stage ;
ü Tous nos promotionnaires de la licence
2019-2020. Ce fut un plaisir et une chance de vous avoir à nos
côtés tout le long du parcours. Grand merci à vous pour
cette attache familière et la marque de sympathie, pour vos conseils
ainsi que vos encouragements.
Table des matières
DEDICACE
I
REMERCIEMENTS
II
LISTE DES ILLUSTRATIONS
V
LISTE DES ABREVIATIONS ET SIGLES
VI
PREAMBULE
VII
RESUME
VIII
ABSTRACT
IX
INTRODUCTION
1
PREMIERE PARTIE : GENERALITES
4
I.GENERALITES SUR LE VIRUS DE
L'IMMUNODEFICIENCE HUMAINE
5
I.1. Le virus de l'immunodéficience
humaine
5
I.1.1 Historique
5
I.1.2. Données
épidémiologiques
5
I.1.3. Mode de contamination
6
I.1.4. Taxonomie et diversités
génétiques du VIH
7
I.1.5. Structure et organisation génomique du
VIH
8
I.1.6. Les marqueurs du VIH et leurs
évolutions
10
I.1.7. Histoire naturelle du VIH.
11
I.1.8. Physiopathologie des infections du VIH
12
I.1.9. Prévention
14
I.1.10. Traitement
14
I.2.Diagnostic biologique
17
I.2.1. Diagnostic sérologique (indirect)
17
I.2.2. Diagnostic moléculaire (direct)
18
II. Diagnostic du VIH-1 chez les
enfants
19
II.1. Diagnostic de l'infection à VIH-1 chez
le nouveau-né
19
II.2. Diagnostic de l'infection à VIH-1
au-delà de l'âge de 18 mois
20
DEUXIEME PARTIE : ETUDE
EXPERIMENTALE
22
I.METHODOLOGIE
23
I.1.Cadre d'étude
23
I.2.Types et périodes d'étude
23
I.3. Population d'étude
23
I.3.1. Critères d'inclusion
24
I.3.2. Critères de non inclusion
24
I.4.Echantillonnage
24
I.5. Recueil des données
24
I.6.Traitement et analyse des données
24
I.7.Définitions opérationnelles
25
I.8. Matériel de laboratoire
utilisé
25
I.8.1. Réactifs
25
I.8.2. Appareillage
27
I.8.3. Autres matériel
28
I.8.4. Consommables/accessoires
28
I.9. Analyses au laboratoire
28
I.9.1. Prélèvement
28
I.9.2. Préparation des
échantillons
29
I.9.3. Technique d'extraction et d'amplification de
l'ADN-VIH
29
II. RESULTATS
30
II.1. Caractéristiques
sociodémographiques des enfants
30
II.1.1. L'âge des enfants de
l'étude
30
II.1.2. Répartition selon le sexe
31
II.2. Répartition selon la prophylaxie ARV
des enfants
31
II.3. Répartition des enfants selon le type
d'allaitement
31
II.4. Traitement ARV de la mère pendant
la grossesse
32
II.5. Prophylaxie ARV de la mère au moment de
l'accouchement
32
II.6. Résultats des analyses au
laboratoire
33
II.6.1. Résultats PCR en fonction de
l'âge des enfants exposés au VIH
33
II.6.2. Résultats PCR en fonction de la
prophylaxie ARV de l'enfant
33
II.6.3. Résultats PCR en fonction du type
d'allaitement
34
II.6.4. Résultats PCR de l'enfant en fonction
du traitement de la mère
35
II.6.5. Résultats PCR de l'enfant en fonction
de la prophylaxie de la mère
35
III. DISCUSSION
36
CONCLUSION
38
RECOMMANDATIONS
38
REFERENCES BIBLIOGRAPHIQUES
39
ANNEXES
i
LISTE DES ILLUSTRATIONS
Liste des figures
Figure 1: Structure du
VIH (Huraux et al.,2003)
2
Figure 2 : Organisation
génomique du VIH(Mesbah et al., 2013)
10
Figure 3 : Les
marqueurs du VIH et leurs évolutions
11
Figure 4 : Histoire
naturelle de l'infection par le VIH
12
Figure 5: Cycle de
réplication du VIH (Furelaud et Pavie,2002).
13
Figure 6: Algorithme pour le
diagnostic du VIH (CNLS-IST,2018).
21
Figure 7 : Kit d'extraction
COBAS Ampliprep/COBAS TaqMan.
27
Figure 8 : Instrument Cobas
AmpliPrep/Cobas Taqman 48 (Centre MURAZ)
27
Figure 9: Agitateur
thermostaté (thermomixer compact. Eppendorf)
28
Figure 10 : Exemple
d'échantillon valide de DBS
28
Figure 11 :
Découpage des DBS avec PUNCHER (Centre
MURAZ).
29
Figure 12:
Répartition des enfants exposés au VIH-1 en
fonction de l'âge
30
Figure 13:
Répartition des enfants en fonction du sexe
31
Figure 14:Répartition
des mères en fonction du traitement ARV pendant la grossesse
32
Figure 15: Prophylaxie de la
mère au moment de l'accouchement
32
Liste des tableaux
Tableau I : Principaux ARV
par classe thérapeutique (CNLS-IST,2018)
2
Tableau II : Prophylaxie
post partum améliorée (CNLST-IST,2018)
17
Tableau
III :Répartition des enfants selon le type
d'allaitement
31
Tableau IV: Résultats
PCR en fonction de l'âge des enfants exposés au VIH
33
Tableau V: Résultats
PCR en fonction de la prophylaxie de l'enfant
34
Tableau VI: Résultats
PCR en fonction du type d'allaitement
34
Tableau VII:
Résultats PCR de l'enfant en fonction du traitement de la
mère
35
Tableau VIII:
Résultats PCR de l'enfant en fonction de la prophylaxie de la
mère
35
LISTE DES ABREVIATIONS ET
SIGLES
ADN : Acide désoxyribonucléique
ARN: Acide ribonucléique
AN:Acide nucléique
AZT:Zidovudine
CAP /CTM: COBAS AmpliPrep/COBAS TaqMan
CD4: Cluster of Differenciation 4
CM : Centre MURAZ
CNLS/IST Conseil National de Lutte Contre le
SIDA et les Infections Sexuellement Transmissibles
CRF: Circulating Recombinant Form
DBS: «Dried Blood Spot»
(Tache de sang séchée)
ELISA:Enzyme-Linked Immunosorbent Assay
GAM: « Global AIDS Monitoring »
HTLV: Human T Lymphotropic Virus
LAV: Lymphadenopathy Associated Virus
NVP : Névirapine
OMS : Organisation Mondiale de la
Santé
ONU/SIDA : Programme commun des Nations Unies
sur le SIDA
PCR : « Polymerase Chain Reaction »
(Réaction en Chaine par Polymérase)
PTME : Prévention de la Transmission
Mère-Enfant
RT/PCR :« Reverse
Transcriptase/Polymerase Chain Reaction » (Réaction en chaîne
de transcriptase inverse / polymérase)
SIDA : Syndrome d'immunodéficience
Acquise
VIH-1 : Virus de l'immunodéficience
Humaine 1
VIH-2 : Virus de l'immunodéficience
Humaine 2
WB : Western Blot
PREAMBULE
L'Unité Universitaire à Bobo-Dioulasso (UUB) de
la chaîne de la grande Université Catholique de l'Afrique de
l'Ouest (UCAO) a ouvert officiellement ses portes le 15 février 2006.
Cette unité a pour option de base l'agro-alimentaire et a adopté
le système « Licence Master Doctorat » (LMD) comme
système pédagogique dès son ouverture. Compétente
dans la formation et la recherche en Biologie, Génie Civil,
Marketing/Management, Économie du Développement, Finance
comptabilité, Sciences Juridiques et Politiques, Sciences Humaines.
Cette unité universitaire est scindée en huit (08)
filières réparties entre quatre (4) Unités de Formation et
de Recherche (UFR) à savoir :
ü Sciences Économiques et de Gestion (SEG) ;
ü Sciences Juridiques et Politiques (SJP) ;
ü Lettres et Sciences Humaines (LSH) ;
ü Sciences Techniques (ST) ;
A travers ses quatre (4) UFR, l'unité universitaire
à Bobo-Dioulasso s'est donnée pour
Objectifs de :
v Participer au développement durable à travers
la promotion du secteur agro-alimentaire ;
v Contribuer à la professionnalisation des acteurs
dudit secteur ;
v Aider en l'enracinement de la foi et de la culture dans les
politiques et actions de développement ;
v Renforcer la culture de l'intégration des peuples et
des nations.
Elle a pour devise : Foi-Science-Action.
L'UCAO/UUB forme des étudiants de diverses
nationalités (béninoise, burkinabè, ivoirienne,
nigérienne, tchadienne, togolaise...).
La valeur fondamentale qui constitue le point de départ
de l'UCAO/UUB est la culture de l'excellence et cette valeur reçoit
toute l'abnégation de l'administration universitaire, qui ne cesse de
fournir toute l'énergie possible pour la faire accepter par tous.
RESUME
Au Burkina Faso, le VIH-SIDA reste toujours un problème
de santé publique. Pour les enfants de moins de 18 mois, le
dépistage fait appel à des techniques de biologie
moléculaire comme la Réaction en chaîne de transcriptase
inverse / polymérase-Acide Nucléique.
Notre étude a eu pour objectif de déterminer le
statut VIH des enfants nés des mères séropositives au
VIH-1 à l'aide de la technique RT/PCR au Centre MURAZ.
Ce travail a été effectué au Centre
MURAZ. Il s'agit d'une étude transversale de
Juillet à Septembre 2020. Nous avons utiliséla
technique Cobas AmpliPrep/Cobas TaqMan (CAP/CTM), l'extracteur automatique
Cobas AmpliPrep avec le Kit Cobaspour l'extraction de l'ADN virale.
L'amplification a été faite par l'appareilCobas TaqMan. Les
résultats sont automatiquement rendus sur la station de travail.
La technique de RT/PCR nous a permis de détecter 6
enfants positifs au VIH-1 sur un total de 125 avec un taux de transmissionde
4,8% au VIH-1. La moyenne d'âge était de 3,32 #177; 3,86 mois
avec un sex ratio (H/F)de1,15.
La grande majorité des enfants étaient
âgé de moins de 3 mois avec un allaitement
sécurisé.
Le taux de transmissiondu VIH-1 chez les enfants nés
des mères séropositives reste toujours élevé
malgré les efforts déployés par le ministère de la
santé. Il est donc nécessaire d'établir un diagnostic
précoce pour une meilleure prise en charge des enfants
exposés.
Mots clés : VIH,
RT/PCR, CAP/CTM, Centre MURAZ, Burkina Faso, enfants nés.
ABSTRACT
In Burkina Faso, HIV-AIDS still remains a public health
problem. For children under 18 months of age, screening involves molecular
biology techniques such as Reverse Transcriptase/Polymerase Chain
Reaction-Nucleic Acid.
The goal of our study was to determine the HIV status of
children born to HIV-1 positive mothers using the RT / PCR technique at the
MURAZ Center.
This work was carried out at the MURAZ Center.It was a
cross-sectional study from Julyto September 2020. We used the Cobas AmpliPrep /
Cobas TaqMan (CAP / CTM) technique, the Cobas AmpliPrep automatic extractor
with the Cobas Kit for viral DNA extraction. Amplification was done by the
Cobas TaqMan apparatus.
The results are automatically displayed on the workstation
screens. The RT / PCR technique allowed us to detect 6 HIV-1 positive children
out of a total of 125 with a transmission rate of 4.8% to HIV-1. The average
age was 3.32 #177; 3.86 months with a sex ratio (M / F) of 1.5.
The vast majority of children were under 3 months of age with
safe breastfeeding.
The rate of transmission of HIV-1 among children born to
HIV-positive mothers remains high despite the efforts of the Ministry of
Health. It is therefore necessary to establish anearly diagnosis for a better
care of the exposed children.
Key words: HIV, RT / PCR, CAP / CTM,
MURAZ Center, Burkina Faso, children born.
INTRODUCTION
L'infection par le Virus de l'Immunodéficience Humaine/
Syndrome de l'Immunodéficience Acquise (VIH/SIDA) est observée
partout dans le monde. En 2018 on estimait à 37,9 millions le nombre de
personnes vivants avec le VIH ; les adultes représentant 36,2 millions
et les enfants de moins de 15 ans 1,7 millions (ONUSIDA,
2018).
Depuis 2010, le nombre annuel des nouvelles infections
à VIH ont diminué d'environ 16%, passant de 2,1 millions à
1,7 millions en 2018.Chez les enfants, les nouvelles infections à VIH
ont diminué de 41%, passant de 280 000 en 2010 à
160 000 en 2018.
L'Afrique subsaharienne est la région du monde la plus
touchée par cette épidémie avec environ 22,9millions de
personnes vivant avec le VIH, soit 68% du total mondial et reste la
première cause de décès des adultes (ONUSIDA/OMS,
2017).
Au Burkina Faso, l'évolution de la prévalence du
VIH en population générale au cours des dix dernières
années présente une tendance à la baisse. En effet, selon
les estimations de Global AIDS Monitoring, le nombre de personnes,
adultes et enfants, vivant avec le VIH/SIDA est passé de 110.000 en 2009
à 94 000 en 2019 dont 9 400 enfants de moins de 15 ans. La
prévalence du VIH chez les adultes est estimée à 0,80% en
2019 et La prévalence du VIH parmi les jeunes femmes enceintes (15 -
24ans) est de 0,51% en 2018(GAM, 2019).
Le VIH se transmet essentiellement par voie sexuelle, par voie
sanguine et par voie verticale de la mère à l'enfant. La
transmission verticale est à l'origine de la majorité des
infections à VIH chez les enfants de moins de 10 ans (OMS,
2002). Il existe trois (03) étapes possibles de transmission
mère-enfant : elle peut se faire, en absence de prévention, in
utero pendant la grossesse (5 à 10% des cas), pendant l'accouchement (10
à 20% de cas) ; ou au moment de l'allaitement (5 à 20%)
(OMS, 2002 ; 2005).
Le Burkina Faso à l'instar d'autres pays africains a
élaboré une stratégie nationale multisectorielle de lutte
contre le VIH/SIDA et les IST (CNLS-IST, 2018). La
stratégie inclue un programme national dePrévention de la
Transmission Mère-Enfant du VIH par chimioprophylaxie : chez la
mère une trithérapie à base de Tenofovir(TDF) +
Emtricitabine(FTC) + Efavirenz(EFV) ou Lopinavir /ritonavir(LVP/r) ; chez
le nouveau-né allaité ou non, une thérapie à base
de la Névirapine(NVP) + Zidovudine (AZT) de la naissance jusqu'à
l'âge de 12 semaines.
Ce programme devait contribuer à réduire la
propagation du VIH au sein de la population, plus spécifiquement en
réduisant celle de la transmission du VIH de la mère à
l'enfant.
Le risque lié à l'allaitement maternel peut
être réduit à moins de 2% en cas de traitement
antirétroviral préventif administré à la
mère et dans les premières semaines de vie du Nouveau-né
(OMS, 2007). Bien qu'il n'y ait pas de différence
significative entre le taux de mortalité parmi les enfants nourris au
lait maternel (1,9%) et parmi les enfants nourris artificiellement (2,1%)
(Simpore et al., 2006).
Il est toujours important de noter qu'en dehors d'une PTME
jusqu'à 20% des nourrissons nés de mères infectées
par le VIH peuvent contracter l'infection par le lait maternel (OMS,
2002). Pour une meilleure prise en charge effective, un diagnostic
précoce du VIH-1 chez les enfants nés des mères
séropositives s'avère alors nécessaire. Chez ces enfants,
les anticorps d'origine maternelle sont décelables jusqu'à
l'âge de 15-18 mois, empêchant toute démarche diagnostique
sérologique car pouvant donner des résultats faussement positifs.
L'utilisation d'une méthode de diagnostic moléculaire est
indiquée à cet effet (Coutlee et al., 1994 ;
Tarnagda et al., 2003).
Malgré les programmes de PTME du VIH-1, il existe des
risques de transmission résiduels du VIH-1 chez l'enfant né de
mère séropositive.
Notre étude nous permettra de déterminer le taux
de transmission résiduel malgré les méthodes de
prévention de la transmission du VIH-1 de la mère à
l'enfant au Burkina Faso.
Pour cela, nous avons fixé les objectifs suivants :
Objectif général :
Diagnostiquer précocement,
l'infection à VIH-1 chez les enfants nés des mères
séropositives, par RT/PCR.
Objectifs
spécifiques :
- Réaliser le diagnostic précoce du VIH-1 par
RT/PCR au laboratoire de Virologie du Centre MURAZ ;
- Décrire les caractères
sociodémographiques des enfants exposés au VIH-1 ;
- Déterminer le taux de transmissionrésiduel du
VIH-1 chez les enfants nés de mères séropositives.
Afin de rendre notre travail plus explicite, le présent
rapport a été scindé en deux (02) parties : la
première partie concerne les généralités sur le VIH
et la seconde partie est consacrée à notre étude faisant
un point sur la méthodologie utilisée, les résultats qui
seront commentés et discutés, suivi d'une conclusion et des
recommandations.
PREMIERE PARTIE :
GENERALITES
I.GENERALITES SUR LE VIRUS
DE L'IMMUNODEFICIENCE HUMAINE
I.1.Le virus de
l'immunodéficience humaine
I.1.1 Historique
Le SIDA a été décrit en 1981 par le
Centre pour le contrôle et la prévention des maladies, devant un
tableau clinique inhabituel qui était observé chez des jeunes
homosexuels américains.Il était caractérisé par une
atteinte du système lymphatique avec une survenue d'infections
opportunistes associées à une immunodéficience
sévère. La description d'autres cas dans la communauté
homosexuelle et parmi les utilisateurs de drogues par voie injectable aboutit
à individualiser ce nouveau syndrome : le SIDA.
L'agent étiologique fut isolé pour la
première fois en 1983 à l'institut Pasteur et appelé LAV
pour Lymphadenopathy Associated Virus (Choisy et
al.,2004) ; dans la même année aux Etats-Unis,
l'équipe du professeur Gallo, isolait le même virus et le
dénommait HTLV-III (Human T- Lymphotropic Virus type III) (Gallo
et al.,1983). En 1985, des réactions
sérologiques atypiques étaient mises en évidence avec des
sérums de travailleuses du sexe du Sénégal (Clavel
et al.,1986). Ces observations démontraient
l'existence d'un autre virus humain plus proche d'un Rétrovirus simien.
Ce virus a été isolé en 1986 et désigné
LAV-2. En 1986, une révision taxonomique harmonisa les
différentes dénominations et définit les VIH ou HIV (Human
Immunodeficiency Virus) de type 1 et de type 2 comme agents responsables du
SIDA (Clavel et al.,1986).
I.1.2. Données
épidémiologiques
v Situation épidémiologique
mondiale.
En 2018, ONUSIDA estimait à 37,9 millions le nombre de
personnes vivants avec le VIH ; les adultes représentant 36,2 millions
et les enfants de moins de 15 ans 1,7 millions (ONUSIDA, 2018).
On estimait à 1,7 millions des personnes nouvellement
infectées par le VIH et 770 000 personnes sont
décédés de maladies liées au SIDA.
Ainsi, en Europe de l'Est et centrale et en Amérique la
prévalence est de 88% et 78% en Asie et Pacifique.
L'Afrique subsaharienne est la région du monde la plus
touchée par cette épidémie avec environ 22,9millions de
personnes vivant avec le VIH, soit 68% du total mondial (ONUSIDA/OMS,
2011).
Dans les régions d'Afrique de l'Est et Centrale, la
prévalence des infections est de 64%.
v Situation épidémiologique au Burkina
Faso.
Au Burkina Faso, La prévalence du VIH chez les adultes
est estimée à 0,80% en 2019 et La prévalence du VIH parmi
les jeunes femmes enceintes (15 - 24ans) est de 0,51% en 2018(GAM,
2019). La région du Sud-Ouest du Burkina Faso présente
une très forte prévalence d'infection au VIH avec 2,6%
d'infections (CNLS-IST, 2019).
I.1.3. Mode de
contamination
Depuis le début de la pandémie Trois (3)
principales voies de transmissions ont été
observés :
v Transmissions par voie sexuelle
A l'échelon mondiale, la grande majorité de
infections par le VIH ont été acquises à l'occasion de
rapports sexuels non protégés. La transmission sexuelle de
l'infection à VIH se fait par l'intermédiaire des muqueuses
génitales ou rectales, lorsqu'elles sont en contact avec des
secrétions sexuelles ou du sang infecté (Huraux et
al.,2003).
v Transmission par voie sanguine
Elle concerne principalement trois (3) groupes de
population : les usagers de drogue par voie injectable, les
hémophiles, les transfusés et plus rarement les professionnels de
santé dans des lieux de soins et laboratoires, victimes d'accident
exposant au sang (Huraux et al.,2003).
v Transmission verticale
(mère-enfants)
La transmission du virus de la mère à l'enfant
peut survenir à différentes étapes de la grossesse en
absence de mesures de prévention :
· In utero : dans les semaines
précédant l'accouchement dans un tiers des cas ;
· In intra partum : au moment de l'accouchement dans
deux tiers des cas ;
· In post partum : la période de
l'allaitement présente également un risque d'infection pour
l'enfant, estimé entre 5-7% (Huraux et
al.,2003).
I.1.4. Taxonomie et
diversités génétiques du VIH
Le VIH fait partie de la famille de Retroviridae,
sous-famille des Orthoretrovirinae et du genre
lentivirus(Sontier,2010). Il existe deux types de
VIH, le plus fréquent dans le monde entier est le VIH-1 tandis que le
VIH-2 n'est présent qu'en Afrique de l'Ouest.
Le VIH-1 est divisé en trois (3) groupes :
Ø Groupe M (pour Major group), responsable de la
pandémie actuelle ;
Ø Groupe O (pour Outier group), présent en
Afrique Centrale ;
Ø Groupe N (pour non-M, non-O group), présent au
Cameroun.
En 2009, un nouveau variant du VIH-1 a été
identifié chez une patiente camerounaise vivant en France. Il a
été classé comme un 4ème groupe et
appelé « P » par les auteurs(Kwimatoua,2010).
Le groupe M est actuellement subdivisé en 9 sous-types
(A, B, C, D, F, G, H, J, K) et près de 100 formes recombinantes (CRF ou
URF)(Moisan,2019). Le sous-type A est subdivisé en
sous-sous-types A1, A2 et plus récemment A3 et A4. Le sous-type F est
lui-même subdivisé en sous-sous-type F1 et F2. Le sous-type B est
le plus répandu en Occident. On le retrouve majoritairement chez les
homosexuels et les toxicomanes (Roquebert et
al.,2009).
A cela s'ajoute plusieurs formes recombinantes (en anglais
Circulating Recombinant Form ou CRF), qui ont pour origine la multiple
injection d'une cellule par des sous-types différents, ce qui entraine
des phénomènes de recombinaison au sein des génomes
viraux. On compte de nos jours, prèsde 100 CRFs et plusieurs centaines
d'UFRs, leurs nombres ne cesse d'augmenter(Moisan,2019). Les
CRFs les plus fréquemment retrouvés sont le CRF01-AE
(recombinaison entre les virus de sous-type A et les virus de sous-types E) en
Asie, le CRF02-AG (recombinaison entre les virus de sous-type A et les virus de
sous-type G) et le complexe CRF06 cpx en Afrique de l'Ouest. De très
nombreuses formes recombinantes ne correspondant pas aux critères de
classification sont appelés UFR (unique recombinant forms). Ces formes
recombinantes proviennent d'évènement de recombinaison intervenue
lors de la rétro-transcription de leur ARN dans une cellule
co-infectée par différents sous-types (Roquebert et
al.,2009).
Pour le VIH-2, 8 groupes ont été décrits
(d'A à H), seuls les groupes A (Cap-Vert, Guinée-Bissau,
Guinée, Sénégal) et B (Côte-d'Ivoire, Mali et
Burkina-Faso) ont une diffusion épidémique (Roquebert et
al.,2009).
I.1.5. Structure et
organisation génomique du VIH

Il se présente sous la forme d'une particule
sphérique de 90 à 120 nm de diamètre (Hoen et
al.,2007) et se compose d'un matériel
génétique(ARN) accompagné de quelques protéines, le
tout contenu dans deux «coques» protéiques (les capsides),
elles-mêmes entourées d'une membrane, portant des protéines
spécifiques (ils forment l'enveloppe du virus) (Furelaud Et
Pavie,2002).
Figure 1: Structure
du VIH (Huraux et al.,2003)
Le génome du VIH-1 se compose d'un ARN simple brin
d'environ 9 181 nucléotides. Il comporte trois gènes principaux
(Gag, Pol, et Env.), ainsi que quelques gènes de régulation
(Soubéiga, 2012). Les gènes des
rétrovirus ne s'expriment qu'après avoir été
transformés en ADN « proviral » (Koné,
2010).
Les principaux gènes sont (Mesbah et
al., 2013) :
Ø Les trois gènes classiques des
rétrovirus :
· Le gène gag qui code pour les protéines
de structure interne, les protéines de structure ;
· Le gène Pol qui code pour la transcriptase
inverse, la protéase et l'intégrase ;
· Le gène env qui code pour les protéines
qui après glycosylation secondaire, donneront une partie de l'enveloppe
du virus les glycoprotéines d'enveloppe (gp120 et gp41).
Ø Les gènes propres au VIH :
Le gène tat est un gène
indispensable à la rétro transcription, capable d'agir à
distance d'où le terme de trans. Il joue un rôle de
synchronisation de la production virale et augmente l'expression par activation
de la séquence tat des LTR (long terminal repeat).
Le gène rev exerce une fonction de
régulation différentielle. Il code pour la protéine rev
grâce à deux séquences nucléotidiques
éloignées chacune ayant un rôle distinct : l'une
inhibitrice et l'autre levant cette inhibition.
Le gène nef est responsable de la
régulation négative de l'expression du virus donc de latence. Sa
destruction augmente la pathogénicité du virus.
Le gène vif intervient dans la
réplication virale. Il est responsable du pouvoir infectieux du virus.

Figure 2 :
Organisation génomiquedu VIH(Mesbah et al.,
2013)
I.1.6. Les marqueurs du VIH
et leurs évolutions
On retrouve 4 marqueurs virologiques dans le sérum ou
le plasma :
ü L'ARN du VIH(ARN-VIH) : le premier marqueur
à apparaitre entre le 7e et le 14e jour,
témoigne d'une réplication active du virus ;
ü L'antigène p24(Ag p24) : détectable
entre le 10e et 26e jour (14e jour en
moyenne) ; elle se négative en 3 à 4 semaines. Sa
réapparition, souvent des années après la primo-infection,
est le témoin d'une réplication virale intense ;
ü Les anticorps(Ac) anti-VIH : détectable entre le
15e et 45e jour et persistent à des concentrations
élevées tout au long de l'infection ;
ü L'ADN proviral ou ADN total cellulaire est le marqueur
le plus utilisé dans les essais cliniques.Détectable entre le
15e et 45e jour et persistenttout au long de
l'infection.


Figure 3 :Les
marqueurs du VIH et leurs évolutions
I.1.7. Histoire naturelle du
VIH.
Selon l'évolution de la charge virale et du nombre de
lymphocytes de l'organisme, on distingue trois phases à l'infection par
le VIH :
Ø La primo infection, juste après la
contamination, le nombre de virus augmente fortement, puis diminue, du fait de
la réponse immunitaire de défense de l'organisme. Certaines
personnes ressentent un syndrome pseudo grippal, une inflammation des
ganglions, et des courbatures ;
Ø La phase de latence clinique (ou portage
asymptomatique), il s'agit d'une période de durée très
variable selon les individus, pendant laquelle l'infection est
indécelable cliniquement parlant. La charge virale augmente lentement,
et le virus attaque insidieusement le système de défense de
l'organisme. Le risque de contamination à ce stade est aussi
élevé qu'au stade SIDA ;
Ø La phase d'immunodépression mineure ou majeure
(ou SIDA), c'est le moment où les cellules du système immunitaire
encore compétentes ne sont plus assez nombreuses pour canaliser la
multiplication du virus. Elles sont débordées, le nombre de virus
augmente fortement, et les premiers signes cliniques apparaissent avec des
maladies dites opportunistes caractéristiques. On retrouve
fréquemment : une pneumonie, la tuberculose, des troubles digestifs, des
mycoses buccales (muguet) etc.

Figure
4 :Histoire naturelle de l'infection par le VIH
I.1.8. Physiopathologie des
infections du VIH
I.1.8.1. Cellules cibles du virus
Les cellules cibles de l'infection à VIH sont
principalement celles qui expriment à leurs surfaces le récepteur
CD4+ et l'un des corécepteurs CCR5 et/ou CXCR4
(Pantaleo et Al.,1993).
I.1.8.2. Cycle de réplication du VIH dans la
cellule hôte
Le virus du Sida présent dans le sang est capable de se
fixer à des cellules particulières du système immunitaire
: les lymphocytes T CD4+. Ces lymphocytes sont ainsi nommés,
car porteurs de la protéine transmembranaire CD4+. La
fixation du virus à ces cellules fait intervenir CD4+
(reconnu par la protéine gp120 du virus), ainsi que d'autres
protéines membranaires (les co-récepteurs). À partir de
cette fixation, le matériel génétique du VIH peut
pénétrer dans le lymphocyte(Furelaud et
Pavie,2002).
Il est à noter que le VIH peut en fait infecter de
nombreux types cellulaires différents. Nous nous limiterons ici à
l'exemple des lymphocytes T CD4+.
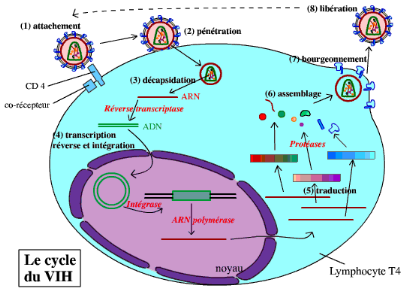
Figure 5:Cycle de
réplication du VIH (Furelaud et Pavie,2002).
(1) Attachement : Le virus se fixe sur le
lymphocyte T CD4+, par reconnaissance entre la protéine
virale gp120 et la protéine CD4+ du lymphocyte (ainsi qu'un
co-récepteur).
(2) Pénétration : Les deux
membranes (du virus et du lymphocyte) fusionnent, ce qui permet la
pénétration de la nucléocapside (les deux capsides + le
matériel génétique, etc.) du virus dans le cytoplasme.
(3) Décapsidation : La capside se
dissocie, libérant l'ARN viral dans le Cytoplasme.
(4) Transcription inverse et
intégration : Grâce à la transcriptase inverse
virale, l'ARN viral est rétrotranscrit en ADN double brin. Cet ADN
pénètre dans le noyau, où il s'intègre au
génome du lymphocyte. Il est ensuite transcrit en ARN.
(5) Traduction : Après avoir
été transcrits par l'ARN polymérase de la cellule, les ARN
messagers viraux sont traduits en trois précurseurs protéiques.
Ces précurseurs sont clivés par des protéases, pour donner
les différentes protéines du virus.
(6) Assemblage : Les protéines virales
et l'ARN viral (transcrit par ailleurs) sont associés pour reformer des
virus (sans la membrane). Les protéines virales membranaires sont
intégrées à la membrane du lymphocyte.
(7) Bourgeonnement : Le virus bourgeonne,
emportant un fragment de la membrane plasmique du lymphocyte (qui contient
uniquement les protéines membranaires virales).
(8) Libération : Les nouveaux virus
sont libérés dans le milieu intérieur. Ils peuvent
infecter de nouveaux lymphocytes T CD4+.
I.1.9. Prévention
La prévention du VIH/SIDA est primordiale, les moyens
de prévention les plus efficaces et connues pour le moment
sont :
Ø Le dépistage de l'infection à
VIH ;
Ø L'utilisation régulière des
préservatifs masculin ou féminin lors des rapports
sexuels ;
Ø L'abstinence ;
Ø La fidélité à un seul
partenaire ;
Ø Le port d'équipement de protection
individuel(EPI) ;
Ø La prévention de la transmission
mère-enfants(PTME) ;
Ø La prophylaxie pré-exposition par voie orale
(PrEP) ;
Ø La prophylaxie post-exposition(PPE) ;
Ø Le traitement antirétroviral précoce
pour la prévention du VIH(TasP).
I.1.10. Traitement
Les antirétroviraux sont des molécules
virostatiques qui inhibent essentiellement l'activité d'enzymes
indispensables à la réplication du VIH (la transcriptase inverse,
l'intégrase et la protéase) sans le détruire
(CNLS-IST,2018).
· Les inhibiteurs de la transcriptase
inverse sont subdivisés en trois sous classes :
Ø les inhibiteurs nucléosidiques de la
transcriptase inverse (INTI ou IN) qui bloquent la transcriptase inverse par
compétition avec les nucléosides naturels ;
Ø les inhibiteurs nucléotidiques de la
transcriptase inverse (INtTI ou INt) qui bloquent la transcriptase inverse par
compétition avec les nucléotides naturels ;
Ø les inhibiteurs non nucléosidiques de la
transcriptase inverse (INNTI ou INN) qui agissent directement par fixation sur
le site catalytique de la transcriptase inverse du VIH-1. Ils sont inactifs sur
le VIH-2.
· Les inhibiteurs de la
protéase :
Les inhibiteurs de la protéase (IP) empêchent
l'assemblage des protéines virales nouvellement
synthétisées par fixation sur le site catalytique de la
Protéase, bloquant ainsi son activité protéolytique. Cela
conduit à la production de virions immatures non infectieux et donc
à l'interruption du cycle viral par inhibition de la phase
post-traductionnelle de la réplication. Ils sont actifs sur les cellules
infectées de façon chronique, contrairement aux inhibiteurs de la
transcriptase inverse.
· Les inhibiteurs de
l'intégrase :
Les inhibiteurs de l'intégrase (II) empêchent
l'insertion covalente, ou intégration du génome du VIH dans le
génome de la cellule hôte par inhibition de l'activité
catalytique de l'intégrase.
· Les inhibiteurs de fusion :
Les inhibiteurs de la fusion (IF) bloquent la fusion entrela
membrane virale et la membrane de la cellule cible empêchant ainsi l'ARN
viral d'entrer dans la cellule cible par inhibition du réarrangement
structural de la gp-41 du VIH-1.

Tableau I:Principaux ARV
par classe thérapeutique(CNLS-IST,2018)
*Les molécules en astérisque
sont celle qui ne sont pas disponible au Burkina Faso
Il existe des formes combinées (deux ou trois
molécules combinées) telles que :
· Zidovudine (300 mg) + Lamivudine (150 mg)
· Lopinavir (200 mg) + Ritonavir (50 mg)
· Ténofovir (300 mg) + Emtricitabine (200 mg)
+ Efavirenz (600 mg)
· etc.
Pour ce qui concerne le nourrisson né de mère
infectée par le VIH, les dernières recommandations de l'OMS
2015-2016 indiquent la prophylaxie post partum améliorée.
Tableau II:Prophylaxie post
partum améliorée(CNLST-IST,2018)
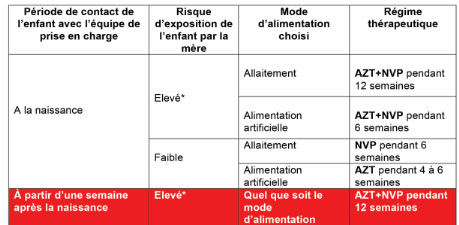
*La mère doit alors
débutée le traitement antirétroviral (TAR)
I.2.Diagnostic biologique
Le diagnostic des infections à VIH chez l'adulte et les
enfants de plus de 18 mois repose sur le diagnostic indirect par la
détection des anticorps.
Seul le diagnostic précoce dans les premiers mois de
vie chez l'enfant né de mère séropositive nécessite
la mise en évidence du virus, de ses composants ou de son
génome.
I.2.1. Diagnostic
sérologique(indirect)
Le dépistage des anticorps anti-VIH s'effectue le plus
souvent par des tests ELISA (Enzyme Linked ImmunoSorbent Assay) en utilisant un
spectrophotomètre lecteur de microplaques ou par des tests rapides
à lecture de bandes visuelles. Ces tests sont capables de
dépister à partir d'un sérum ou d'un plasma humain, les
anticorps anti-VIH-1 et anti-VIH-2 (Maiga and al.,
1992).
I.2.1.1. Tests de dépistage
Deux types de tests sont utilisés pour le
dépistage :
Ø Tests ELISA
Les méthodes immuno-enzymatiques de type ELISA sont
actuellement
les méthodes de référence pour mettre en
évidence les anticorps sériques du sujet infecté par le
VIH (OMS, 2004).
Ø Tests rapides
Ce sont généralement des tests de
dépistage. Ces tests font appel à une agglutination ou à
une absorption du complexe antigène-anticorps (Ag-Ac) sur une membrane,
suivie d'une coloration visible à l'oeil nu. Ils peuvent être
faits en moins de 30 minutes, sans appareillage sophistiqué, et sont
capables de dépister les anticorps anti-VIH-1 et anti-VIH-2.
I.2.1.2. Tests de confirmation
Le Western Blot (WB) est une méthode utilisée
comme test de confirmation de référence (Plantier and
Simon, 2002 ; Klimkait, 2008).
Le WB est une technique, pour laquelle les protéines
virales sont séparées par électrophorèse avant
d'être transférées sur une membrane de nitrocellulose.
I.2.2. Diagnostic
moléculaire(direct)
Le diagnostic direct est la mise en évidence entier du
VIH ou de ses composantes.
I.2.2.1. Détection de l'antigène p24
Les antigènes viraux circulants correspondent aux
particules virales et aux protéines virales libres. Les méthodes
ELISA commercialisées détectent essentiellement la
protéine p24 du VIH-1 (Coulibaly, 2006).
I.2.2.2. Isolement du VIH en culture cellulaire
L'isolement viral se fait à partir des cellules
mononuclées sanguines ou du plasma du sujet infecté grâce
à l'adjonction de cellule mononuclées de donneurs sain qui
servent de support pour la multiplication virale.
I.2.2.3. Détection des acides nucléiques
viraux
L'amplification génique (la « Polymerase Chain
Reaction » PCR ou l'amplification multienzymatique de type NASBA) permet
de détecter l'ARN génomique contenu dans les particules virales
(Lazurl, 1993). Une technique d'hybridation amplifiée
sans amplification génique, fondée sur l'utilisation de sondes
ramifiées « ADN branché » permet aussi la
détection de l'ARN VIH-1. Dans ses derniers développements, cette
dernière a une sensibilité qui serait proche de celle de
l'amplification génique.
II. Diagnostic du VIH-1 chez
les enfants
Le risque de transmission du virus de la mère à
l'enfant est lié au taux de virus maternel et au risque de transmission
virale par micro-transfusions en fin de grossesse ou par contamination de
l'enfant lors du passage dans la filière génitale.
En l'absence de traitement le risque de transmission du virus
à l'enfant est de l'ordre de 20%, il est réduit à moins de
1% en cas de traitement antirétroviral préventif
administré à la mère et dans les premières semaines
de vie du nouveau-né. Le diagnostic de l'infection à VIH chez un
enfant né de mère séropositive se fait différemment
selon l'âge auquel sont effectués les prélèvements
sanguins (Wainberg et Brun, 2003).
II.1. Diagnostic de l'infection
à VIH-1 chez le nouveau-né
Le diagnostic précoce est très important pour la
prise en charge médicale des enfants nés de mères
infectées par le VIH. À cause du transfert passif des
immunoglobulines maternelles, la détection d'anticorps dirigés
contre le VIH ne peut pas être utilisée comme outil diagnostique
avant l'âge de 18 mois. Pour surmonter ce problème, une
stratégie de diagnostic moléculaire basée sur la
détection des particules virales présentes dans le plasma
(RT-PCR) et/ou la rechercher de l'ADN proviral du virus présent dans les
cellules circulantes infectées (PCR-ADN) est utilisée.
La recherche de virus par culture reste intéressante en
cas de virus atypique ou variant non reconnu par les techniques
moléculaires. Il s'agit le plus souvent d'infections survenant chez des
femmes d'origine africaine ; pour faciliter le diagnostic chez le
nouveau-né, il est parfois nécessaire d'adresser un
prélèvement maternel en cours de grossesse au laboratoire de
virologie qui réalisera le diagnostic, afin qu'il puisse
sélectionner les techniques adaptées au virus maternel avant de
les appliquer aux échantillons de l'enfant (exemple : infection par un
virus VIH-1 du groupe O). En l'absence de traitement de l'enfant, les
sensibilités des deux techniques de PCR-ADN et ARN-VIH plasmatique sont
équivalentes. Pour poser le diagnostic d'infection, il est
nécessaire d'avoir deux prélèvements positifs, cela quelle
que soit la technique utilisée. Inversement pour poser un diagnostic de
non-infection, il faut deux prélèvements négatifs. En cas
de traitement préventif de la transmission virale, le diagnostic est peu
fiable tant que l'enfant est sous traitement antirétroviral. Il faut
donc deux prélèvements négatifs hors période de
traitement pour considérer un enfant comme non infecté. Les
prélèvements précoces, naissance et premières
semaines de vie, peuvent être informatifs en cas de résultat
positif, ils permettent notamment d'affirmer une infection in utero en cas de
positivité dès la naissance (Wainberg et Brun,
2003).
En cas d'allaitement maternel, il est nécessaire de
rechercher l'infection dans les trois mois qui suivent l'arrêt
définitif de l'allaitement. Cette situation peut se rencontrer chez des
nourrissons d'origine africaine. En cas d'infection à VIH-2, seules les
techniques de PCR-ADN utilisant des amorces spécifiques de VIH-2 sont
à privilégier, du fait que la technique de mesure de l'ARN-VIH-2
plasmatique n'a pas été évaluée dans le contexte du
diagnostic de l'enfant. Les mêmes règles de prescription que
celles décrites pour VIH-1, en soulignant la nécessité des
deux prélèvements négatifs pour affirmer une non infection
et celle de deux prélèvements positifs pour un diagnostic
d'infection (Wainberg et Brun, 2003).
II.2. Diagnostic de l'infection
à VIH-1 au-delà de l'âge de 18 mois
Les techniques sérologiques permettent de
détecter la réponse anticorps de l'enfant, elles peuvent
être utilisées selon le même algorithme que celui
utilisé pour le diagnostic de l'infection de l'adulte.

Figure 6:Algorithme
pour le diagnostic du VIH (CNLS-IST,2018).
DEUXIEME PARTIE : ETUDE EXPERIMENTALE
I.METHODOLOGIE
I.1.Cadre d'étude
L'étude a été réalisée dans
la Région des Hauts Bassins, ville de Bobo-Dioulasso, Province du Houet.
Le Centre Muraz a servi de structure d'accueil où nous avons
effectué notre stage.
Ø Présentation du Centre
Muraz
Le Centre MURAZ est une institution de recherche du
Ministère de la Santé. Il est basé à Bobo-Dioulasso
dans la partie sud-ouest du Burkina Faso. Ce centre a été
créé dans le cadre de la lutte contre la trypanosomiase humaine
en 1939. Puis ces missions ont évolué pour s'intéresser
aux grandes endémies tropicales de l'époque, pour aboutir
à la création de l'Organisation de Coopération et de
Coordination pour la lutte contre les Grandes Endémies (OCCGE) en 1960.
Le centre MURAZ est l'un des trois centres qui ont fusionné pour former
l'Institut Nationale de Santé Publique (INSP) du Burkina Faso. Les
activités du centre sont orientées par un Conseil Scientifique
International. Sa mission est de contribuer, essentiellement au Burkina Faso,
à la prévention, au diagnostic et au contrôle des maladies
transmissibles et non transmissibles par la promotion et la réalisation
de la recherche en santé, la formation et l'expertise en biologie
médicale, en sciences humaines et en santé publique.
Ce centre participedepuis 2009 au diagnostic précoce
chez les enfants exposés au VIH dans le cadre du programme national de
PTME. Il constitue un centre de référence pour le diagnostic
pédiatrique dans les régions de l'Ouest où il
reçoit en moyenne plus de 500 échantillons d'enfants chaque
année.
I.2.Types et périodes
d'étude
Il s'est agi d'une étude de type transversale dont la
collecte des données a été effectuée sur une
période de 3 mois, de JuilletàSeptembre 2020.
I.3. Population
d'étude
Notre étude a porté sur les 125 enfants
nés d'une mère séropositive au VIH-1.
Ces enfants sont prélevés dans les
différents centres de santé dans le cadre de la PTME. Les
prélèvementssont envoyés au laboratoire du CM. Chaque
prélèvement est accompagné d'une fiche individuelle de
prélèvement où sont mentionnées les informations
sociodémographiques ainsi que les informations relatives aux
interventions de la PTME concernant la mère et l'enfant.
I.3.1. Critères
d'inclusion
Ø Mères incluses dans le programme de
PTME ;
Ø Enfants dont les mères sont infectées
par le VIH-1 ou ont une coinfection de VIH-1/VIH-2.
I.3.2. Critères de
non inclusion
Ø Les enfants dont les mères sont
infectées uniquement par le VIH-2 ;
Ø Les enfants âgés de plus de 18 mois.
I.4.Echantillonnage
L'échantillonnage était exhaustif des patients
répondant aux critères d'inclusion.
Les variables de l'étude choisies sont :
Âge, sexe, type de l'allaitement, prophylaxie,
traitement et le résultat du RT/PCR de l'enfant.
I.5. Recueil des
données
Les données ont étérecueillies à
partir des informations mentionnées dans le registre de laboratoire et
sur le bulletin de demande d'examen. La collecte concerne les variables
suivantes : l'âge, le sexe, type de l'allaitement, prophylaxie,
traitement et le résultat du RT/PCR de l'enfant.
I.6.Traitement et analyse des
données
Les données ont été consignées
d'abord sur la fiche de demande PCR (annexe 1) puis saisies
à l'ordinateur dans un fichier du logiciel Microsoft Excel version 2016.
Ce logiciel nous a permis de traiter les données et de calculer les
pourcentages et élaborer les tableaux et figures.
I.7.Définitions
opérationnelles
Ø Allaitement sécurisé :
c'est un allaitement au cours duquel l'enfant est nourri exclusivement au lait
maternel et l'enfant est mis sous prophylaxie depuis la grossesse jusqu'aux 6
premières semaines d'allaitement ;
Ø Allaitement mixte :c'est un
allaitement au cours duquel l'enfant est nourri au sein maternel et au
biberon ;
Ø Allaitement maternel :c'est un
allaitement au cours duquel l'enfant est nourri uniquement au sein
maternel ;
Ø Substitut du lait : tout
aliment commercialisé ou présenté de toute autre
manière comme produit de remplacement partiel ou total du lait
maternel ;
Ø Prophylaxie de la mère :
c'est au moment de l'accouchement on administre des ARV pour réduire le
risque de transmission mère enfant ;
Ø Traitement de la mère : c'est
lorsque la mère est sous ARV depuis le début de la grossesse
jusqu'à l'accouchement ;
Ø Prophylaxie de l'enfant :
Après juste la naissance, on administre des ARV à
l'enfant pour prévenir l'infection.
I.8. Matériel de
laboratoire utilisé
Les réactifs, appareils et consommables/accessoires
suivant ont été utilisés au cours de notre étude :
I.8.1. Réactifs
Ø Kit d'extraction et d'amplification COBAS
Ampliprep/COBAS TaqMan
Les réactifs destinés au test sont :
· Quatre (04) cassettes pré remplies et
prêtes à l'usage :
· La cassette CS1 : c'est la cassette de réactifs
de particules de verres magnétiques et d'une solution d'isopropanol
à 93% ;
· La cassette CS2 : est celle du réactif de lyse.
Elle contient du dihydrate de citrate de sodium, du thiocyanate de guanidine
à 42,5%, du polydocanol à moins de 14% et dudithiothréitol
à 0,9% ;
· La cassette CS3 : est destinée aux multi
réactifs, contenant une solution de protéinase et un tampon
d'élution ;
· La cassette CS4 : contient les réactifs
spécifiques au test VIH-1 : le standard de quantification (QS) du VIH-1.
C'est un RNA non infectieux contenant des séquences de liaison aux
amorces VIH-1 et un site unique de liaison à la sonde ainsi que
del'acide de sodium ;
· Le master mix : c'est le mélange
réactionnel HIV-1. Le master-mix est constitué des
désoxyribonucléotides, les amorces sens et anti-sens pour les
régions gag et LTR du HIV-1, les sondes oligonucléotidiques
liées à un marqueur fluorescent et spécifiques du HIV-1,
QS, l'ADN polymérase, l'enzyme Ampérase (Uracile-N-glycosylase)
et de l'azide de sodium ;
· Une solution de sel de manganèse qui sert de
tampon. Les réactifs destinés au test sont conservés entre
2 et 8°C et restent stables jusqu'à la date de péremption
indiquée tant que le flacon n'est pas ouvert. Après ouverture du
flacon, ces réactifs restent stables pendant 28 jours 2-30°C.
Chaque kit contient des réactifs en quantité suffisante pour 48
tests, qui peuvent être effectués en lots de 12 à 24 tests
;
· Le réactif de lavage est constitué de
dihydrate de citrate de sodium et de Nméthylisothiazolone-HCl à
0,1%. Le réactif de lavage reste stable jusqu'à la date de
péremption indiquée. Après ouverture du flacon, il reste
stable pendant 28 jours à 2- 30° C ou jusqu'à la date de
péremption si celle-ci survient en premier ;
· Témoins : ils assurent un contrôle interne
lors du test, ils sont constitués d'ARN non infectieux et sont de 2
types :
- Le témoin négatif (NC) ;
- Le témoin positif (PC).
Les témoins sont conservés entre +2 et
+8°C, ils restent stables jusqu'à la date de péremption
indiquée. Une fois le flacon ouvert, les substances non utilisées
sont jetées. Les témoins ont des pinces à code-barres
spécifiques à chacun, celles-ci doivent être
conservées à 2-30 °C. Les réactifs et les
témoins ne doivent pas être congelés.

Figure 7 :Kit
d'extraction COBAS Ampliprep/COBAS TaqMan.
I.8.2. Appareillage
ü Cobas AmpliPrep/Cobas Taqman 48 (CAP/CTM) ;
ü Ordinateur (système informatique
connecté) ;
ü Agitateur thermostaté (thermomixer compact.
Eppendorf) : T°C comprise entre -15°C à 100 °C ;
ü Poste de sécurité microbiologique (PSM)
de type II.

Extracteur CAP
Thermocycleur CTM / Ordinateur

Figure 8: Instrument
Cobas AmpliPrep/Cobas Taqman 48(Centre MURAZ)

Figure 9:Agitateur
thermostaté (thermomixer compact. Eppendorf)
I.8.3. Autres
matériel
Mélangeur à vortex, puncher, portoir de S-tubes,
micro-pipettes1000ulcalibrées avec graduation.
I.8.4.
Consommables/accessoires
Gants stérile sans talc, papier absorbant, embouts
stériles avec filtre de1000ul, S-tube de 2 ml, Eau de Javel à 10
%, Alcool à 70 % ; eau distillée ; conteneur de
déchets à couvercle, cahier ou registre de résultats.
I.9.Analyses au laboratoire
I.9.1.
Prélèvement
Les échantillons de sang étaient
prélevés dans les différents centres de santé et
envoyés au Centre MURAZ. Ces échantillons étaient
reçus au Centre MURAZ sous forme de gouttes de sang total
séché sur papier filtre appelé Dried Blood Spot
(DBS), en anglais.

Figure 10:Exemple
d'échantillon valide de DBS
I.9.2. Préparation
des échantillons
Recueil des spots de sang à partir des DBS :
- A l'aide d'une perforeuse(PUNCHER) qui est nettoyée
après chaque échantillon avec du papier essuie tout imbibé
de désinfectant, découper un spot complet de la carte de papier
filtre pour chaque échantillon. Si le cercle est perforé,
utilisé une pince pour détacher la goutte de sang
séché ;
- Chaque spot est placé dans un S-tube en ajoutant 1100
ul de réactif de pré-extraction d'échantillons (SPEX)
- Les S-tubes sont placées dans un thermomixer pendant
10 minutes à 56°C
Figure
11 :Découpage des DBS avec PUNCHER (Centre
MURAZ).
I.9.3. Technique
d'extraction et d'amplification de l'ADN-VIH
v Principe du test
Le test qualitatif Cobas AmpliPrep/Cobas TaqMan HIV-1, v2.0
est un test de diagnostic in vitro, d'amplification de l'acide
nucléique(AN) total destiné à la détection
qualitative de l'ADN et de l'ARN du HIV-1 dans les taches de sang
séché. Il est utilisé en association avec le
réactif de pré-extraction d'échantillons (SPEX) Cobas
AmpliPrep/Cobas TaqMan. Le test qualitatif Cobas AmpliPrep/Cobas TaqMan HIV-1,
v2.0 s'appuie sur trois opérations principales :
Ø La préparation des échantillons dans le
but d'isoler les acides nucléiques du HIV-1 ;
Ø La transcription inverse de l'ARN cible pour produire
l'ADN complémentaire (ADNc) ; et
Ø L'amplification par PCR de l'ADN et de l'ADNc cible
en même temps que la détection des sondes de détection
d'oligonucléotides clivés, doublement marqués,
spécifiques de la cible et du contrôle interne (CI).
Le mode opératoire est d'écrit dans
l'annexe 2.
II. RESULTATS
Au total, 125 enfants ont été inclus dans notre
étude entre juillet et septembre 2020.
II.1.
Caractéristiquessociodémographiques des enfants
II.1.1. L'âge des
enfants de l'étude
Dans notre étude, les enfants étaient
âgés de 0 à 18 mois avec un âge moyen de
3,32#177; 3,86mois.
La tranche d'âge la plus représentée
était de [0 ; 3] mois avec un pourcentage de 74,4% et celle de ]15 ; 18]
mois était la moins représentée avec un pourcentage de
1,6%.

Figure
12:Répartition des enfants exposés au VIH-1 en fonction
de l'âge
II.1.2. Répartition
selon le sexe
Dans notre étude, 58 (46,4%) enfants étaient de
sexe féminin avec un sex-ratio (H/F) de 1,15 (Figure13).
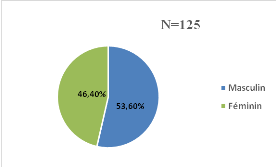
Figure 13:
Répartition des enfants en fonction du sexe
II.2. Répartition selon
la prophylaxie ARV des enfants
Parmi les enfants de l'étude, l'information sur la
prophylaxie ARV était disponible chez 98 enfants ; avec 82 (83,67%) qui
étaient sous la Nevirapine (NVP) et Zidovudine (AZT).
II.3. Répartition des
enfants selon le type d'allaitement
Parmi les enfants ayant des informations disponibles sur le
mode d'alimentation pratiquée par la mère (n=118), l'allaitement
sécurisé était majoritaire avec 94,92% (112/118) de cas
(Tableau III).
Tableau III :
Répartition des enfants selon le type d'allaitement
|
Type d'allaitement
|
N
|
(%)
|
|
Allaitement sécurisé
|
112
|
94,92
|
|
Allaitement maternel
|
3
|
2,54
|
|
Allaitement Mixte
|
1
|
0,84
|
|
Substitut au lait
|
2
|
1,70
|
|
TOTAL
|
118
|
100
|
II.4. Traitement ARV de la
mère pendant la grossesse
Parmi les enfants de l'étude, l'information sur le
traitement des mères était disponible pour 104 d'entre elles.
Quatre-vingt-dix-neuf virgules zéro trois pour cent (99,03%)
étaient sous traitement ARV pendant la grossesse (Figure 14).

Figure
14:Répartition des mères en fonction du traitement ARV
pendant la grossesse
II.5. Prophylaxie ARV de la
mère au moment de l'accouchement
Parmi les enfants de l'étude, l'information sur la
prophylaxie des mères était disponible pour60 d'entre elles.
Quarante-huit(48) mères étaient sous prophylaxie à
l'accouchement (Figure 15).

Figure
15:Prophylaxie de la mère au moment de l'accouchement
II.6. Résultats des
analyses au laboratoire
Sur un total de 125 enfants nés de mères
infectées par le VIH-1, le nombre de cas testés positifs
était de 6 enfants, soit un taux de transmission globale de l'infection
à VIH-1 de 4,80% chez les enfants de moins de 18 mois nés de
mères infectées.
II.6.1. Résultats PCR
en fonction de l'âge des enfants exposés au VIH
Les résultats PCR en fonction de l'âge sont
indiqués dans le tableauIV.
Tableau IV:
Résultats PCR en fonction de l'âge des enfants exposés au
VIH
|
Résultats
|
Positif
|
Négatif
|
Total
|
|
N
|
(%)
|
N
|
(%)
|
N
|
(%)
|
|
[0 ; 3]
|
5
|
4
|
88
|
70,4
|
93
|
74,4
|
|
] 3 ; 6]
|
0
|
0,00
|
14
|
11,2
|
14
|
11,2
|
|
] 6 ; 9]
|
1
|
0,8
|
5
|
4
|
6
|
4,8
|
|
] 9 ; 12]
|
0
|
0,00
|
7
|
5,6
|
7
|
5,6
|
|
] 12 ; 15]
|
0
|
0,00
|
3
|
2,4
|
3
|
2,4
|
|
] 15 ; 18]
|
0
|
0,00
|
2
|
1,6
|
2
|
1,6
|
|
Total
|
6
|
4,8
|
119
|
95,2
|
125
|
100
|
II.6.2. Résultats PCR
en fonction de la prophylaxie ARV de l'enfant
Parmi les 82 enfants qui avaient reçu la prophylaxie
ARV à la naissance, 3 avaient un
résultat positif à la PCR (TableauV).
Tableau V: Résultats
PCR en fonction de la prophylaxie de l'enfant
|
Prophylaxie ARV
|
Positifs
|
Négatifs
|
Total
|
|
N
|
(%)
|
N
|
(%)
|
N
|
(%)
|
|
Oui
|
3
|
2,4
|
79
|
63,2
|
82
|
65,6
|
|
Non
|
0
|
0,00
|
16
|
12,8
|
16
|
12,8
|
|
Inconnue
|
3
|
2,4
|
24
|
19,2
|
27
|
21,6
|
|
Total
|
6
|
4,8
|
119
|
95,2
|
125
|
100
|
II.6.3. Résultats PCR
en fonction du type d'allaitement
Parmi les 112 enfants sous allaitement sécurisé,
6 avaient unrésultat positif à la PCR (Tableau VI).
Tableau VI:
Résultats PCR en fonction du type d'allaitement
|
Type d'allaitement
|
Positif
|
Négatif
|
Total
|
|
N
|
(%)
|
N
|
(%)
|
N
|
(%)
|
|
Allaitement sécurisé
|
6
|
4,8
|
106
|
84,8
|
112
|
89,6
|
|
Allaitement maternel
|
0
|
0,00
|
3
|
2,4
|
3
|
2,4
|
|
Allaitement mixte
|
0
|
0,00
|
1
|
0,8
|
1
|
0,8
|
|
Substitut de lait
|
0
|
0,00
|
2
|
1,6
|
2
|
1,6
|
|
Inconnu
|
0
|
0,00
|
7
|
5,6
|
7
|
5,6
|
|
Total
|
6
|
4,8
|
119
|
95,2
|
125
|
100
|
II.6.4. Résultats PCR
de l'enfant en fonction du traitement de la mère
Parmi les 103 enfants dont les mères étaient
sous traitement ARV pendant la grossesse, 3 avaient unrésultat positif
à la PCR (Tableau VII).
Tableau VII:
Résultats PCR de l'enfant en fonction du traitement de la
mère
|
Positif
|
Négatif
|
Total
|
|
N
|
(%)
|
N
|
(%)
|
N
|
(%)
|
|
Traitement oui
|
4
|
3,2
|
99
|
79,2
|
103
|
82,4
|
|
Traitement non
|
0
|
0,00
|
1
|
0,8
|
1
|
0,8
|
|
Inconnue
|
2
|
1,6
|
19
|
15,2
|
21
|
16,8
|
|
Total
|
6
|
4,8
|
158
|
95,2
|
125
|
100
|
II.6.5. Résultats PCR
de l'enfant en fonction de la prophylaxie de la mère
Parmi les 48 enfants dont les mères avaient reçu
la prophylaxie ARV au moment de l'accouchement, 2 avaient unrésultat
positif à la PCR (Tableau VIII).
Tableau VIII:
Résultats PCR de l'enfant en fonction de la prophylaxie de la
mère
|
Positif
|
Négatif
|
Total
|
|
N
|
(%)
|
N
|
(%)
|
N
|
(%)
|
|
Prophylaxie oui
|
2
|
1,6
|
46
|
36,8
|
48
|
38,4
|
|
Prophylaxie non
|
0
|
0,00
|
12
|
9,6
|
12
|
9,6
|
|
Inconnue
|
4
|
3,2
|
61
|
48,8
|
65
|
52
|
|
Total
|
6
|
4,8
|
158
|
95,2
|
125
|
100
|
III. DISCUSSION
Notre population d'étude était constituée
à 53,6 % (67/125) de sexe masculin soit un sex-ratio (H/F) de
1,15.Le sexe masculin était supérieur au sexe féminin. Nos
résultats se rapprochent de ceux de Kwimatoua (2012) au
Burkina Faso qui avait obtenu un sex-ratio (H/F) de 1,2
(Kwimatoua, 2012).
La tranche d'âge la plus représentée
était celle de [0 ; 3] mois soit 74,4% avec des extrêmes de 0
à 18 mois. Cette prédominance de tranche d'âge pourrait
s'expliquer par le fait que l'OMS recommande que le diagnostic précoce
s'effectue à la sixième semaine de l'enfant. Nos résultats
se rapprochent à ceux rapportés par des études
antérieures menées par Sontier en 2010
àOuagadougou et Ugochukwu et alen 2010 au
Nigéria qui avaient trouvé que le diagnostic précoce
s'effectuait en majorité avant les 2 premiers mois (Sontier,
2010 ; Ugochukwu et al., 2010). Pour une meilleure prise en
charge des enfants exposés, il est donc nécessaire que le
prélèvement s'effectue le plus tôt possible pour un
diagnostic précoce.
Dans la répartition des enfants sous prophylaxie ARV,
83,67% étaient sous la Nevirapine (NVP) et Zidovudine (AZT). Cette
valeur pourrait s'expliquer par le fait que, les dernières
recommandations OMS 2015-2016 indiquent la prophylaxie post partum
améliorée pour des enfants nés de mères
infectées par le VIH.
Concernant le type d'allaitement, les enfants dont le type
d'alimentation était disponible, 94,92% étaient sous allaitement
sécurisé ; Cette valeur pourrait s'expliquer par le fait que
laPTME au Burkina Faso recommande un allaitement sécurisé des
enfants nés de mères infectéespar le VIH.
Le taux de transmission du VIH-1chez les enfants de moins de
18 mois a été de 4,8%. Ce fort taux pourrait s'expliquer par le
fait que pour des raisons économiques, sociales et éducatives les
femmes ne respectent pas les recommandations de la PTME. Ces résultats
sont comparables à ceux de Ghomaréalisé
en 2017 au Burkina Faso et au Congo qui avait obtenu 4,8% dans une étude
similaire (Ghoma, 2017). Ce taux de transmission reste assez
élevé au vu des objectifs du millénaire pour le
développement qui ambitionnait de réduire à 0% d'ici 2015
la transmission mère-enfants du VIH.
Le taux de transmission du VIH-1 chez les enfants nés
de mère sous traitement ARV était de 3,2%. Les enfants dont les
mères étaient sous prophylaxie ARV à l'accouchement, le
taux de transmissionétait de 1,6%. Nos résultats diffèrent
de ceux de Ghoma (2017) au Burkina Faso et au Congoqui avait
trouvé 0,0% (0/114) chez les enfants nés de mères sous
traitement ARV et 6,82%(18/264) chez les mères sous prophylaxie ARV
(Ghoma, 2017).Cette discordance laisse supposer un non-respect
du nouveau protocole de la PTME en ce qui concerne la trithérapie et la
triprophylaxie au Burkina Faso.
Comme toute autre étude, la nôtre a
également rencontré des limites. L'objectif de notre étude
était de diagnostiquer précocement, l'infection à VIH-1
chez les enfants nés des mères séropositives, par RT/PCR
au Centre MURAZ.
Nous avons été confrontés à des
difficultés,qui sont entre autres :
ü la quantité insuffisante de sang
déposé sur le spot et le nombre de spot (? 4) sur le papier
buvard ;
ü le manque de données, liée à un
mauvais remplissage de la fiche de demande d'examen PCR;
ü l'indisponibilité des réactifs.
CONCLUSION
Cette étude nous a permis d'analyser 125 enfants
nés des mères infectées au VIH-1, par la technique de la
RT/PCR en temps réel, 6 enfants étaient positifs au VIH-1 soit un
taux de transmission de 4,8%. Ce tauxde transmission reste toujours
élevé malgréles efforts déployés par le
ministère de la santé. Il est donc nécessaire de renforcer
les mesures de PTME chez les enfants exposés pour une meilleure prise en
charge de l'infection VIH-1.
RECOMMANDATIONS
En vue d'améliorer la qualité de la prise en
charge des enfants nés de mères séropositives, les
recommandations suivantes sont formulées aux acteurs sanitaires :
v Au Ministre de la Santé
Renforcer les mesures de PTME pour le diagnostic
précoce de tous les enfants exposés au VIH.
v Aux cliniciens :
Ø Remplir correctement la fiche de demande de
PCR ;
Ø Appliquer les nouvelles recommandations de la PTME
qui consiste à établir un Allaitement sécurisé et
la prophylaxie chez l'enfant et la mère ;
Ø Prélever à temps les enfants
exposés (dans 6 semaines).
v Aux techniciens et biologistes du
laboratoire
Réaliser le diagnostic des échantillons
d'enfants exposés au VIH dans un cours délais (inférieur
à 2 semaines).
v Aux mères des enfants exposés aux
VIH
Respecter les conseils du personnel de santé pour les
mesures de prévention de transmission du VIH.
REFERENCES
BIBLIOGRAPHIQUES
Choisy M., Woelk C.H., Guegan JF., Robertson D.,
2004. Comparative study of adaptative in different human
immunodeficiency virus groups and subtypes. Journal of
Virology.78(4):1962-1970.
Clavel F., Brun-Vezinet F. et al.,
1986.Isolation of a new human retrovirus from west African patients
with AIDS.Science.233(4761):343-600p.
CNLS-IST (Conseil National de Lutte contre le SIDA et
les IST), 2018.Normes et protocoles de prise en charge médicale
des personnes vivant avec le VIH au Burkina Faso.Programme sectoriel
Santé de lutte contre le Sida et les IST.5éme
édition.41-57p.
Coulibaly S. M.,2006. La tolérance
clinique et Biologique de la NEVIRAPINE chez les malades du SIDA sous
traitement à l'hôpital du national du point G. Thèse
pharmacie à l'université de Bamako.86 pages.
Coutlée F., 1994. Molecular diagnosis
of HIV-1 infection: potential roles and applications. Union Médicale du
Canada. 123 (6) : 348-358p.
Furelaud G., Pavie B., 2002.Le virus du
sida. Planet-vie.2p
Gallo R.C.,Sarin P.S., Gelmann E.P. et al.,
1983.Isolation of human T-cell leukemia virus in acquired immune
deficiency syndrome (AIDS). Sciences .220(4599) : 8-7p.
Ghoma Linguissi Laure Stella,2017.
Prévention de la transmission mère-enfant au Congo et au Burkina
Faso : processus, aspect moléculaire, défis et perspectives.
Thèse de Doctorat unique à Université de Ouagadougou.148
pages.
GLOBAL AIDS MONITORING (GAM), 2019. Rapport
d'activité sur la Riposte du sida au Burkina Faso. 8-15p.
Hoen B., Cooper D., Lampe F., Fiona C. et
al., 2007. Predicators of virological outcome and safety in
primary HIV-1 infected patients initiating quadruple antiretroviral therapy:
QUEST GW PROB3005.Clin infect Dis.45:381-90p.
Huraux J.M., Agut H., Nicolas J.C., Peigue-La Feuille
H., 2003. Traité de virologie Médicale. Paris : Ed
Estem.332-341p
Klimkait T., 2008. Test VIH. Forum
Médical Suisse. 8 (15) : 278-281p.
Koné J.W.,2010. Problématique
de la prévention de la transmission mère- enfant du VIH/sida chez
les gestantes en commune ii du district de BAMAKO. Thèse médecine
Université de BAMAKO. 101p.
Kwimatoua L. A. F.,2010. Comparaison des
trousses Géneric HIV charge virale Biocentric et NucliSENS Easyq HIV-1
V2.0 (Biomerieux) dans le diagnostic et le suivi de l'infection à VIH-1
sur DBS et plasma. DEA, à l'Université Polytechnique de
Bobo-Dioulasso. 82 pages.
Lazurl D.,1993. La PCR, un
procédé de réplication in vitro. ED Médicales
internationales. 387p.
Maiga M. A., Turcotte F., Doucoure A., Sanogo B.,
Sidibe D., Dicko I.S. Et Comite -Sida Du Mali, 1992.
Séroprévalence du Virus de l'Immunodéficience Humaine
(VIH) chez les femmes enceintes de Bamako et de Selingue (Mali).
Médecine d'Afrique. 39 (2) : 94-98p.
Mesbah S., Bouzeghoub S., Mohammedi et al.,
2013. Consensus national sur le diagnostic biologique de l'infection
à VIH/sida Algerie.34p.
OMS, 2002.La prévention de l'infection
au VIH chez les nourrissons et lesjeunes enfants. www.who.int/hiv/mtct/
PreventionInfantsReviewF.pdf.
OMS,2004. Le virus de
l'immunodéficience humaine et son diagnostic. Manuel de
référence à l'usage des personnels de laboratoire.60
pages.
OMS, 2005. La transmission du VIH par
l'allaitement au sein : Bilan des connaissances actuelles.
whqlibdoc.who.int/publications/2005/9242562718_fre.pdf.
OMS, 2007. Guide pour la mise à
l'échelle au plan mondial de la prévention de la transmission
mère-enfant duVIH. www.who.int/hiv.
ONUSIDA, 2018.Fiche
d'information-Dernières statistiques sur l'état
de l'épidémie de sida.7p.
ONUSIDA/OMS, 2011.Rapport : Le point sur
l'épidémie de sida. http://www.unaids.org.
ONUSIDA/OMS, 2017.Rapport : Le point sur
l'épidémie de sida. http://www.unaids.org.
Pantaleo G., Graziosi C., Vadim P., 1993.
Mechanisms of disease: the immunopathogenesis of immunodeficiency virus
infections.327-336p.
Plantier J.-C., Simon F., 2002. Diagnostic
sérologique des infections à VIH. Développement et
Santé. n°162.
Roquebert, F., F. Damond, D. Brun-Vezinet and
Deschamps, 2009. "Diversité génétique des VIH et
ses conséquences." Pathologie Biologie .57(2) :142-148p.
Simpore J., Pietra V., Savadogo A. et al.,
2006. Reduction of mother-to-child transmission of HIV at Saint
Camille Medical Centre in Burkina Faso. Journal of Medical Virology. 78 (2)
:148-152p.
Sontier Ba-Nephane Sonia, 2010.
Intérêt du « DRIED BLOOD SPOOT » ou DBS dans le
diagnostic par le VIH-1 chez les enfants de moins de 18 mois nés de
mère infectée. Comparaison des résultats de la PCR ARN
plasmatique et PCR ADN sur DBS. Thèse en Pharmacie, Université de
Ouagadougou.123 pages.
Tarnagda Z., Drabo K. M., Yaro S., Yougbaré I.
et al., 2003. Diagnostic des infections par les virus de
l'immunodéficience humaine à Bobo-Dioulasso, Burkina Faso.
Médecine d'Afrique Noire. 50 (7) : 331-335p.
Ugochukwu E. F. and Kanu S. O.,2010."Early
infant diagnosis of HIV infection in southeastern Nigeria: prevalence of HIV
infection among HIV-exposed babies." West Afr J Med 29(1): 3-7p.
Wainberg M., Brun Vezinet F.,2003. HIV : épidémiologie et diagnostique
Virologie.23(2) :335-369p.
ANNEXES
Annexe 1 :Fiche de demande
d'examen PCR
Région : ........................................
District sanitaire :..................... Formation Sanitaire
:.....................Demandeur (Nom/Prénoms):..................
Renseignements sur l'enfant :
Nom et prénom de l'enfant :
......................................................
Date de naissance : /_____/_____/_________ Age : .........Sexe
: M /__/ F /__/
Porte d'entrée : PTME/_ / CREN :/_ / CC :/_ /
HOSPITALISATION : /_ / AUTRES : /_ / (préciser)
..................................
Code de l'enfant : .............................. (si PTME,
code PTME suivi de BB) ProphylaxieARV :oui /__/ non /__/ Si oui NVP /__/
ou AZT /__/
Mode d'alimentation : Allaitement sécurisé /__ /
Substituts du lait /__ / Mixte /__/ Enfant sevré : Oui /__/ Non /__/
date : (.................................)
Renseignements sur la mère :
Vivante : oui /__/ non /__/ Age
:.....Gestité:.........Parité :...Contacts :..........
Mode d'accouchement : Voie Basse /__/ Césarienne
/__/
Code PTME de la mère : .............
Date de découverte de la séropositivité :
/_______/_______/_________
Type de VIH : VIH-1 /__ / VIH-2 /__ / VIH-1+VIH-2
/__/ Inconnu /__/ Traitement ARV : oui /__/ non /__/
Date de début du traitement/_____/____/_______
Protocole d'ARV : ...................................
Prophylaxie ARV : oui /__/ non /__/ Date de début du
traitement /__/___/___
Combinaison ARV :
Prélèvement : Date
/_______/_______/_________ Heure :............
Préleveur (Nom/Prénoms)
:..........................................Signature :
Réception au Labo PCR : Date
/____/____/_______ Nom .........................
Signature :
Annexe 2 :mode opératoire de
CAP/CTM
La procédure de travail est automatisée à
l'aide de l'appareil COBAS®AmpliPrep et de l'analyseur COBAS®
TaqMan® ou COBAS® TaqMan® 48. En suivant le protocole fournis
par le fabriquant, nous avons procéder comme suit :
v Démarrage de l'automate
· Allumer le CTM et le CAP ;
· Allumer l'ordinateur ;
· Ouvrir l'Amplilink (User ID : .......... Et Password :
............)
· Vérifier le niveau du réactif de lavage
et les indications de maintenance du CAP et du CTM ;
· Remplacer le réactif de lavage et
exécuter la maintenance si nécessaire.
v Chargement des réactifs
· Sortir les réactifs du
Réfrigérateur et les charger immédiatement ;
· Charger la Cassettes Réactifs CS1 dans un
portoir Réactif et insérer dans la position A ;
· Charger les Cassettes Réactifs CS2, CS3 et CS4
dans un autre portoir Réactif et insérer le dans une des
positions B à E.
v Traitement des échantillons pour le
diagnostic sur DBS :
· Introduire les cercles dans les S-tubes ouverts
préalablement déposés sur le thermomixer ;
· Refermer les S-tubes ;
· Ouvrir les S-tubes individuellement, introduire 1100
ul de diluent et refermer immédiatement ;
· Prendre 2 S-Tubes et introduire dans le 1er tube 1000
ul de témoin négatif et dans le 2ème 1000 ul de
témoin Positif (Vortexer 20 seconde les témoins avant
l'utilisation) ;
· Incuber les S-tubes contenant contrôles et
échantillons dans le thermomixer à 1000 rpm à une
température de 56°C pendant 10 min.
v Demande pour chaque échantillon et
contrôle
· Pour créer les demandes des échantillons
à analyser, cliquer sur l'icône de demande d'examens ensuite sur
Sample. Pour chaque échantillon cliquer New puis Order et entrer
l'identité du patient puis faire OK. Sélectionner la liste et
choisir le test. A la fin cliquer sur SAVE ;
· Pour saisir le Rack des échantillons du test
à réaliser, cliquer sur Sample rack puis New, noter le
numéro du portoir échantillon dans la case Sample rack ID et
identifier le RUN dans Bach ID ;
· Cliquer sur le test à faire au bas de la
feuille ;
· Cliquer dans la case S pour sélectionner le NC
;
· Déplacer le curseur sur les cases :
ü LPC et HPC, pour la charge virale plasmatique suivantes
et procéder de même pour le (pour les tests quantitatifs)
ü PC, pour le diagnostic moléculaire ;
· Pour les échantillons, sur la ligne en dessous
des contrôles, dans la case Sample ID faire double clique, une liste
apparait. Choisir l'identité du premier échantillon et faire OK ;
· Procéder de la même manière pour
les suivants. On peut sélectionner toute la liste et faire OK si les
identités sont dans l'ordre de la liste de paillasse ;
· Cliquer sur Save.
v Chargement des consommables et échantillons
· Insérer les SPU dans le portoir des SPU. Appuyer
de part et d'autre pour bien les insérer ;
· Charger le portoir SPU dans une des positions J, K ou
L ;
· Charger les K-Tips de M à P ;
· Charger le portoir Echantillon dans une des positions
F, G
ü Association K-Carrier au portoir K-carrier
· Placer le K-carrier sur le portoir ;
· Cliquer sur le System puis sur Sample ;
· Scanner le Barcode du portoir du K-carrier (une
fenêtre apparait) ;
· Scanner immédiatement le Barcode du K-Carrier
(délai 5 secondes) ;
· Cliquer sur OK (délai 5 secondes) ;
· Insérer le portoir K-carrier dans une des
positions de M à P.
NB : Créer toujours le Rack échantillon et le
charger avant d'associer un K-carrier
v Lancement du COBAS AmpliPrep
· Vérifier le chargement des cassettes,
échantillon et system ;
· Cliquer sur Start (sur l'ordinateur) ;
· Noter le temps auquel l'extraction prend fin ;
· A la fin sortir le K-carrier du CAP ;
· Décontaminer le CAP en cliquant faire service
all ;
· Ensuite faire light décontamination
(durée = 30 secondes) ;
· Eteindre le CAP ou faire la maintenance
journalière.
v Lancement du COBAS TaqMan
· Sélectionner TaqMan dans le system ;
· Cliquer Open ;
· A l'aide du K-carrier transporté déposer
le K-carrier dans le thermocycler et fermer le couvercle ;
· Cliquer sur Start pour démarrer l'amplification
et la détection ;
· A la fin visualiser les résultats ;
· Sortir le K-carrier pour valider les résultats.
NB : Pour réutiliser le K-carrier et Sample Rack venant
du Run précédant il faut obligatoirement valider les
résultats.
Matériel et consommables nécessaires
à l'Appareil CAP /CTM : Kit contenant code barre clip
pour les contrôles ; bidon de tampon de lavage ; Tubes SPU ;
K-tubes ; K-tips ; K -carrier + code barre ; Code Barre
clip pour échantillons ;portoir des S-tube et K-tube + Code
Barre ; portoir des tubes SPU ;portoir réactifs + Code Barre
;portoir k-carrier + Code Barre ;Porteur K-carrier ; Porteur
K-tube ; lecteur code barre.




