|
Université Marien NGOUABI
|
Ecole Normale
Supérieure
Brazzaville Fax 242 81 01
Chaire UNESCO en Sciences de l'Education pour l'Afrique
Centrale 41
|
Option : Didactique des Disciplines et
Evaluation
Titulaire : Professeur Louis MARMOZ
U EMoigi
Pour l'obtention du Diplôme d'Etudes Approfondies
(D.E.A
En Sciences de l'Education
Option : Didactique des Disciplines et
Evaluation
Spécialité : Didactique de
Sciences Physiques
Présenté et soutenu publiquement par :
Monsieur Pacôme BABELA KOUELA
Le 11
Juillet 2012

LA PLACE DE L'EXPERIMENTAL DANS
L'ENSEIGNEMENT
DE LA CHIMIE AU SECONDAIRE :
Cas du test
d'identification des ions en solution
En Classe de seconde C
Directeur de recherche : Pr. Aubin Nestor
LOUMOUAMOU
Jury
- Monsieur : Pr. Pascal Robin ONGOKA, Maître de
Conférences
- Monsieur : Pr. Simon Charles KOBAWILA, Maître de
Conférences
- Monsieur : Pr. Aubin Nestor LOUMOUAMOU, Maître de
Conférences
Année académique 2011-2012
Dédicace
A mon père et ma mère,
Je vous dédie ce travail en témoignage de la
profondeur de mes sentiments de reconnaissance que j'éprouve pour
vous.
A mes fr~res et soeurs,
qu'ils trouvent dans ce travail l'expression de mon
dévouement et mon attachement infini.
Remerciements
Je tiens à remercier monsieur le Pr. Pascal Robin
ONGOKA,
président du jury pour l'honneur qu'il me fait de
présider la soutenance
de mon mémoire, malgré ses
multiples obligations, ainsi que monsieur le
Pr. Simon Charles KOBAWILA,
pour l'honneur qu'il me fait
d'accepter la tâche d'examiner mon
travail.
Ma gratitude va également au Pr. Aubin Nestor
LOUMOUAMOU,
pour avoir bien voulu diriger ce mémoire, malgré
ses multiples
obligations. Foisonnant d'idées, ses rendez-vous ont
toujours été très
enrichissants et efficaces.
Je n'oublie pas de remercier l'ensemble des enseignants de
la Chaire
UNESCO de l'Ecole Normale Supérieure (université
Marien
NGOUABI) pour toutes les connaissances acquises auprès eux et
qui
ont beaucoup contribué pour la réalisation de ce
travail.
Je remercie les personnes qui m'ont aidé de pres ou
de loin pour leur
précieuse aide dans la prise en charge des
différentes analyses, ainsi
que toute la promotion en formation en
DEA.
Je remercie les membres du laboratoire de CHIMIE de ENS,
mes
collègues (enseignants ou non), les membres de ma famille et tous
ceux
qui dans mon environnement professionnel ont su m'apporter leur aide
et
leur soutien.
Table des matières
DEDICACE i
REMERCIEMENTS ii
TABLE DES MATIERES iii
INTRODUCTION 6
CHAPITRE 1: PROBLEMATIQUE ET CADRE THEORIQUE DE REFERENCE9
1) Problematique 10
2) Hypothèse de recherche 11
3) Cadre théorique de référence 12
3.1) L'enseignement de la chimie au secondaire 12
3.1.1) Quelques caractéristiques de la Chimie 12
3.1.2) Les difficultés de l'enseignement de la chimie
13
3.1.3) La notion des ions en classe de Seconde C 13
3.1.4) Les objectifs assignés à l'enseignement de
la chimie 14
3.1.5 Volume horaire assigné à l'enseignement de la
chimie au
secondaire 16
3.2) L?experience et la demarche experimentale en chimie 17
3.2.1) Définition de l'expérience 17
3.2.2) Définition de l'expérimentation. 17
3.3.3) Définition de la démarche
expérimentale. 17
3.3) Les activités expérimentales 18
3.3.1) Les modes didactiques des activités
expérimentales 18
3.3.2) Rôles des activités expérimentales
20
3.4) Quelques théories sur l'expérimentation
22
3.4.1) La théorie des situations, le milieu 22
3.4.2) La transposition didactique 22
3.4.3) Le socioconstructivisme 23
3.5) Évaluation 24
CHAPITRE 2 : METHODOLOGIE 28
1) Méthodologie générale 28
2) Champ d'investigation 28
3) La population 28
4) Échantillon 29
5) Les types d?activités expérimentales. 29
6) Instruments de collecte de données 30
CHAPITRE 3 : Résultats 32
3.1) Résultats de la classe témoin 33
3.1.1.Description du cours présenté 33
3.1.2. Evaluation diagnostique 34
3.1.3.Evaluation sommative. 37
3.1.4 Comparaison des réponses exactes entre
l?évaluation
diagnostique et sommative 42
3.2) Résultats dans les classes expérimentales
42
3.2.1.Description du cours avec activités
expérimentales 42
3.2.2.Evaluations diagnostiques 43
p
3.2.3.Evaluation sommative 52
1) Classe 1 52
2) Classe 2 55
3) Comparaison entre la classe 1 et la classe 2 58
3.3)
Comparaison des résultats entre la classe témoin et les
classes
expérimentales 59
3.4) Les activités réalisées 60
A) Présentation 60
B) Condition de réalisation 60
3.5) Analyse, interprétation et conclusion de tous les
résultats 64
1) Analyse et interprétation des résultats 64
2) Conclusion des résultats 66
CONCLUSION ET PERSPECTIVE 69
REFERENCES BIBLIOGRAPHIQUES 72
ANNEXES
INTRODUCTION
INTRODUCTION
L'appui sur la conduite d'expériences et la
manipulation de dispositifs par les élèves lors des travaux
pratiques est une nécessité affirmée depuis longtemps pour
l'enseignement des sciences physiques : « la physique et la chimie sont
des sciences expérimentales, elles doivent être enseignées
comme telles ». Cette référence à
l'expérimental, voire au travail du scientifique a été
également au coeur de l'introduction de l'ordinateur en France en tant
qu'outil de laboratoire : « des ordinateurs pour faire de la physique
d'abord » a été aussi un leitmotiv fédération
(RICHOUX, 2000).
Notre recherche s?inscrit dans le champ de la didactique de la
chimie. Elle se propose d?étudier les aspects portant l?enseignement
expérimental. En effet, l'enseignement expérimental constitue un
sujet d'actualité dans les recherches didactiques et la
prolifération des projets de recherche à travers notamment les
mémoires de DEA (MBOUKOU, 2011; etc.), des thèses (HRAIRI, 2004 ;
LOUMOUAMOU, 1998), et des activités présentées aux
colloques, à travers les publications (Revue d?Aster, Journées
Internationales de Chamonix) en témoignent.
Les travaux pratiques dans l'enseignement de sciences
physiques devraient occupés une place très importante dans la
formation car la physique et la chimie sont des sciences exactes et
expérimentales.
Par ailleurs, en plus de leur côté attractif pour
les élèves, les activités expérimentales
présentent des moments privilégiés permettant à
l?apprenant de s?exercer à la démarche expérimentale,
à la critique, à l'émission des hypothèses,
à la conception des expériences, à l'interprétation
des résultats (HRAIRI, 2004). Nous considérons que
l?expérimentation aide à une bonne compréhension des
notions en chimie ou engage une construction du savoir scolaire chez les
élèves.
Le profil de l'apprenant défini par le programme exige
que l'apprenant doit pouvoir procéder à des expériences
scientifiques simples
susceptibles de mettre en évidence certains faits et de
déceler les causes. L'apprenant doit donc manipuler, observer.
Cependant les premières observations montrent que dans
le système éducatif congolais, notamment dans l'enseignement
secondaire, l'enseignement de la chimie demeure théorique et
traditionnel.
Notre étude sur les problèmes de l?enseignement
expérimental en chimie s?appuie sur une thématique bien
précise qui est celle de l?identification des ions en solution. Cette
thématique est enseignée au collège comme au lycée,
mais nous avons choisi d?étudier le problème au niveau du
Lycée.
La présentation de notre étude est
structurée selon le plan ci après.
> Chapitre 1 : problématique et cadre théorique
de référence > Chapitre 2 : méthodologie
> Chapitre 3 : résultats

PROBLEMATIQUE ET CADRE
THEORIQUE DE REFERENCE
CHAPITRE 1 :
CHAPITRE I : PROBLEMATIQUE ET CADRE THEORIQUE DE
REFERENCE
1-) Problématique
L'enseignement des sciences physiques, comme l'indiquent les
principes généraux de l'enseignement de la physique et de la
chimie au collège et au lycée (INRAP ,2002) repose sur la
conduite d'expériences : « au travers de la démarche
expérimentale, il [l'enseignement de la chimie] doit former les esprits
à la rigueur, à la méthode scientifique, à la
critique, à l'honnêteté intellectuelle » et, ainsi,
« il doit montrer que cette représentation cohérente (de
l'univers) est enracinée dans l'expérience : les activités
expérimentales ont une place essentielle ».
Or, d'après les travaux menés par Ntsila,
Massamba, Kama-Niamayoua et Silou (2000), le rapport d'inspection
pédagogique et les conclusions des colloques, séminaires
nationaux sur l'enseignement des sciences physiques depuis quelques
années, au Congo, font état d'un enseignement "illustratif". Au
Lycée, la plupart des activités proposées sont, si elles
existent, des expériences de "monstration" ou de
"démonstrations".
Ceci serait dû à la pérennisation d'un
système éducatif traditionnel qui insiste plus sur l'acquisition
des connaissances théoriques que sur le travail expérimental,
développe plus la mémoire que les habiletés manipulatoires
et la capacité constructive de l'apprenant. Il faut ajouter à
cela la compétence des enseignants dans la construction des
stratégies pédagogiques et le déversement des contenus
pour le rendre le savoir compréhensible.
Les activités expérimentales dans l?enseignement
de la chimie sont considérées comme essentielles, tant par les
concepteurs de programmes que par les enseignants. Parmi les arguments
régulièrement réaffirmés, figure celui de la
référence à une science
expérimentale, renvoyant à une certaine
idée de la science, ou du moins de l?activité scientifique,
où se mêlent des points de vue épistémologiques et
des arguments relatifs aux méthodes et à l?instrumentation
(RICHOUX et BEAUFILS, 2005).
D'après les travaux menés par NGOUILOU (2006),
il ressort que les enseignements de SVT sont plus théoriques parce que
les enseignants accusent des faiblesses provenant de leur formation initiale.
Ce constat fait sur l?enseignement des SVT l?est aussi pour d?autres
disciplines. Nous avons donc cherché à étudier les
problèmes relatifs à l?enseignement expérimental en
chimie. Dans cette perspective, nous avons mené une étude sur la
place de l?expérimental dans l?enseignement de la chimie au secondaire.
Le problème que nous étudions ici concerne la réalisation
d'une activité expérimentale, voir sa place, son
intérêt dans l'enseignement/ apprentissage de la chimie. Nous
avons choisi notamment le test d'identification des ions en solution en classe
de seconde C.
Notre problématique est structurée autour de la
question principale suivante :
> Les activités expérimentales ont-elles un
impact réel dans la maitrise par les élèves des concepts
chimiques ?
2-) Hypothèse de recherche
Nous supposons que les activités expérimentales
(séances de TP) intégrées au cours peuvent aider
l?élève à découvrir et à observer les
phénomènes en jeu afin de construire les concepts et comprendre
les lois étudiées. Bon nombre de difficultés de
compréhension résulte du fait que les enseignants manipulent des
concepts, sans pour autant chercher à les concrétiser à
travers notamment des activités expérimentales. L?enseignement
est purement théorique et que
l?élève manque souvent d?un référent
empirique susceptible de l?aider à mieux conceptualiser les notions.
L?objectif du travail est donc de concevoir des
activités expérimentales dans un domaine précis de la
chimie et d?étudier leur impact sur l?apprentissage des notions y
relative par les élèves afin de :
> former les apprenants à la rigueur scientifique,
à l'esprit critique et à la démarche scientifique,
> susciter la curiosité chez l'apprenant, pour
l'amélioration des
apprentissages des contenus de cette discipline par les
élèves.
Par ces activités expérimentales il s?agit
également de contribuer à la réalisation d?une «
banque des activités expérimentales » au service de
l?enseignant pour l?accompagner dans son travail.
3) Cadre théorique de
référence
3.1) L'enseignement de la chimie au secondaire 3.1.1)
Quelques caractéristiques de la Chimie
Alors que les contenus de la physique au lycée
étaient finalement restés très stables dans leur structure
profonde de 1903 à 1979, la chimie avait beaucoup évolué
depuis la deuxième guerre mondiale, passant d'une science descriptive et
classificatoire à une science des structures et des modèles en
passant par une concentration sur quelques fonctions. D'autre part il faut
noter que près du quart des chimistes universitaires ont pu être
impliqués dans un réseau comme Recodic (Recherches
coopératives en didactique de la chimie) ; cependant, pour
l'enseignement secondaire, la chimie n'a pas bénéficié
comme la physique de l'appui des Recherche sur l'Enseignement des
Mathématiques (IREM), très intéressés par les
"relations mathématiques-physique" (Aster, 1998).
Des journées sur l'enseignement de la chimie se
tiennent régulièrement et les Olympiades ont apporté des
innovations importantes. Et l'activité de renouvellement de
l'enseignement de la chimie est permanente.
Pourtant, il n'est pas sûr que la recherche didactique
ait vraiment "décollé" : peu d'"épistémologie
appliquée", alors que le double caractère de science et
d'industrie (ou de "techno-science") de la chimie appellerait des
réflexions approfondies beaucoup plus nombreuses ; et une tendance,
qu'on retrouve dans beaucoup d'autres pays, à concevoir la recherche sur
l'enseignement de la chimie comme une coopération d'expertise chimique
et de sciences de l'éducation, qui fait l'impasse sur des
problématiques spécifiquement didactiques.
3.1.2) Les difficultés de l'enseignement de la
chimie
L'article de R. Viovy et J. Carretto, cité par
Dominique Rebaud dans les Aster(1994) montre que le concept n'est pas simple
à définir. Il renvoie au concept d'espèce chimique "pivot
central" de la réaction chimique. La reconnaissance s u r le plan
macroscopique d'une espèce chimique suppose de prendre en
considération u n grand nombre de paramètres qui font appel
à d'autres notions et entre autres à celle de changement
d'état et de mélange. Les auteurs soulignent qu'au niveau
microscopique, l'individualité des entités est délicate
à déterminer même pour le chimiste : quand on casse des
liaisons hydrogène, crée-ton une nouvelle entité ? Si la
dissolution du sucre dans l'eau se fait sans modification de structure, il n'en
est pas de même de celle du sulfate de cuivre anhydre qui peut être
envisagée comme une "véritable" réaction chimique.
3.1.3) La notion des ions en classe de Seconde C
L?enseignement de la chimie commence actuellement en seconde
par
une partie substantielle visant à introduire le concept
d'espèce chimique (EC) : mise en évidence, classement,
extraction, caractérisation, séparation, identification et
synthèse font partie des activités organisées pour
comprendre ce concept. Si la réaction chimique est définie comme
la disparition d'EC et/ou la possibilité de former de nouvelles EC, on
comprend bien l'intérêt d'introduire le concept d'EC avant
d'étudier la réaction chimique.
Par ailleurs l'étude menées par LE
Maréchal, (2004) a montré que l'EC sont introduites en ne faisant
appel ni aux symboles ni à leur structure microscopique. La vie de tous
les jours et l'approche expérimentale doivent être
privilégiées.
3.1.4) Les objectifs assignés à
l'enseignement de la chimie
Dans l'enseignement secondaire, les sciences physiques sont
constituées des sous disciplines d'enseignement qui sont la physique et
la chimie dans lesquelles on a précisé les objectifs
généraux et objectifs spécifiques. La chimie au secondaire
(de la 6ème en Terminale) est subdivisée en deux (2) domaines ou
modules qui sont :
'I la structure de la matière
'I la réaction chimique
Il faut noter à cela l'introduction en classe de
Première de la chimie organique. Ainsi, chaque domaine est
constitué par ces objectifs qui visent à installer en
élève : le savoir, le savoir-faire et le savoir-être. Ils
sont ainsi présentés de la manière suivante :
a-) Au niveau du collège d'enseignement
général
Il existe dans le programme, dix sept (17) objectifs
généraux et soixante seize (76) objectifs spécifiques
repartis dans tous les niveaux et domaines confondus. Comme notre
expérimentation (test de recherche d'ions en solution) est une
réaction chimique, alors l'ensemble de ces objectifs est
présenté dans le tableau I ci-après :
Tableau I : objectifs généraux et
spécifiques par niveau au C.E.G.
|
Niveau
|
Objectifs Généraux
|
Nombre d'OS
|
|
6ème
|
OG1 : Connaître les transformations chimiques de la
|
|
|
matière
|
05
|
|
OG2 : Connaître l'utilité des combustions et
leurs
|
|
|
dangers
|
03
|
|
5ème
|
OG1 : Traduire une réaction chimique en équation
|
|
|
chimique
|
05
|
|
OG2 : Développer les compétences techniques
|
|
|
acquises
|
04
|
|
4ème
|
OG1 : Caractériser les ions dans les solutions
|
|
|
aqueuses
|
04
|
|
OG2 : Acquérir des notions d?oxydoréduction
|
03
|
|
OG3 : Comprendre le phénomène
d'électrolyse
|
04
|
|
OG4 : Développer les compétences techniques
|
|
|
acquises
|
05
|
|
3ème
|
OG1 : Caractériser les composés organiques et
les
|
|
|
dérivés du pétrole
|
06
|
|
OG2 : connaître les structures, les
propriétés et les
|
|
|
différents modes d'obtention des métaux
|
07
|
|
OG3 : Réaliser l?étude des solutions aqueuses
acides
|
|
|
et basiques
|
05
|
|
OG4 : développer les compétences techniques
|
|
|
acquises
|
07
|
OG : objectif général OS : objectif
spécifique
Au total : douze (12) OG et cinquante huit (58)
OS pour ce qui est du domaine de la réaction chimique au
collège.
b-) Au niveau des lycées d'enseignement
général
Dans le programme destiné aux lycées, la Chimie
comporte seize (16) objectifs généraux et soixante douze (72)
objectifs spécifiques pour tous les domaines, les séries
scientifiques et niveaux confondus.
Pour des raisons expérimentales les objectifs du domaine
de la réaction chimique sont représentes dans le tableau
II suivant.
Tableau II : objectifs généraux et
spécifiques par niveau au lycée
|
Niveaux
|
Objectifs généraux
|
Nombres d'OS
|
|
Seconde <<C
|
OG1 : Réaction chimique
|
04
|
|
»
|
OG2 : Étudier les solutions aqueuses des acides, des bases
et des sels
|
07
|
|
OG3 : Interpréter des réactions
d?oxydoréduction
|
02
|
|
Première
|
OG1 : Réaliser l'étude des métaux
|
02
|
|
<< C,D »
|
OG2 : Comprendre les réactions
|
|
|
d?oxydoréduction
|
03
|
|
Terminale
|
OG1 : Comprendre l'étude cinétique d'une
|
|
|
<< C,D »
|
réaction
|
04
|
|
OG2 : Caractériser les équilibres chimiques
|
04
|
|
OG3 : Réaliser l'étude des solutions aqueuses
|
|
|
des acides et des bases
|
06
|
|
OG4 : caractériser les réactions
d?estérification,
de saponification et les produits obtenus
|
02
|
|
OG5 : Comprendre les réactions
|
|
|
d?oxydoréduction
|
06
|
|
OG6 : Acquérir les habiletés techniques
|
04
|
|
Total
|
Onze (11) objectifs généraux
|
44 O.S.
|
Au regard de ces deux tableaux, nous remarquons qu'au
collège la partie expérimentale (développer les
compétences techniques acquises TP) est prévue, mais
malheureusement elle est placée à la fin d'un domaine
d'étude (réaction chimique,...) ; nous constatons qu'au
lycée c'est juste en Terminale ou elle est prévue dans le
programme.
3.1.5 Volume horaire assigné à
l'enseignement de la chimie au secondaire
Le programme officiel ne prévoit pas un volume horaire
particulier ou spécial à l'enseignement de la chimie. La chimie
obéit au volume horaire hebdomadaire réservé aux sciences
physiques qui se présente comme suit :
- Au collège : deux (02) heures en sixième et
cinquième ; quatre (04) heures en quatrième et six (06) heures en
troisième
- Au lycée : six (06) heures en seconde "C" et
première "C, D" ; cinq
heures en terminale "C" ou "D".
3.2 L'expérience et la démarche
expérimentation en chimie
Les discours à propos de l?expérience et la
démarche expérimentale sont très variables et
reflètent un vrai problème de définitions des concepts
véhiculés par les orientations officielles dans le secondaire.
Nous passerons brièvement en revue, à la lumière des
théories récentes quelles-uns des concepts les plus importants
dans notre domaine : l?expérience, l?expérimentation et la
démarche expérimentale.
3.2.1) Définition de l'expérience
Dans le dictionnaire Grand Larousse (1961), expérience
en latin veut dire : expérientia, de expérire, ce qui signifie en
français éprouver. Il s'agit d'une "épreuve qui a pour
objet d'étudier un phénomène et d'en rechercher les lois :
l'expérience seule doit nous diriger ; elle est notre critérium
unique.
G. Fourez cité par Tatchou (2004, p.42) « Une
expérience est une occasion de tester ce qu'une théorie permet de
réaliser, elle donne un pouvoir-faire, elle ouvre à l'action.
C'est une sorte d'essai à la théorie ».
3.2.2) Définition de
l'expérimentation.
D?après Develay cité par Tatchou (2004, p.43) :
« L'expérimentation est un processus qui commence par
l'émission d'une hypothèse et qui finit par la réalisation
d'une expérience et l'analyse de ses résultats.
L'expérimentation ne représente qu'une partie de la
démarche expérimentale ».
3.3.3) Définition de la démarche
expérimentale.
Selon le dictionnaire Grand Larousse (1961), il s'agit de
«l?ensemble des moyens mis en oeuvre pour atteindre un but fondé
sur l'expérimentation scientifique ».
Les spécialistes distinguent de manière
générale deux types de démarches : la
démarche expérimentale du chercheur (ou savante) et
la démarche expérimentale scolaire. La
première d'entre elles (celle savante) qui sous-tend
l'élaboration des concepts physiques peut Être
résumée en six étapes (Tatchou, 2004) :
v' Formulation d'un problème de recherche ;
v' Formulation des hypothèses ;
v' Élaboration d'un protocole expérimental ;
v' Réalisation pratique et résultats des mesures
;
v' Analyse et interprétation des résultats ;
v' Conclusion
Notons que cette démarche n'est pas séquentielle et
linéaire.
3.3) Les activités expérimentales
Dans cette partie, nous passons en revue quelques points de
vue sur l'articulation des savoirs et de l'expérience sensible, plus
particulièrement en ce qu'ils influencent l'enseignement.
3.3.1) Les modes didactiques des activités
expérimentales
Nous nous référons ici aux travaux en didactique
des sciences expérimentales menés par Coquidé (1998). Elle
a analysé les textes officiels français, des guides d'enseignants
et a recueilli des opinions d'enseignants concernant l'intérêt et
la mise en cuvre d'une pratique expérimentale. Les pratiques
expérimentales, que ce soit dans l'enseignement de la biologie ou de la
physique-chimie, contribuent à la constitution d'un
référent empirique pour les élaborations conceptuelles ou
modélisantes, et à l'apprentissage de (Kane, 2011)
compétences à travers trois modes didactiques d'activités.
Nous en résumons les principales caractéristiques ci-dessous.
· Mode d'expérience-action ou
d'expérienciation
(familiarisation pratique)
Le mode d'expérience-action, ou
d'expérienciation, permet aux élèves d'explorer et d'agir,
à travers des situations variées et diversifiées, avec des
finalités de familiarisation pratique à des objets, à des
phénomènes, et à des instruments scientifiques et
techniques. Il permet d'inciter l'élève à un
questionnement et de constituer un référent empirique. Les
pratiques expérimentales peuvent lui faire acquérir des
savoir-faire préalables ou s'approprier des techniques d'investigation
(instruments, procédures). L'élève expérimente pour
«voir» ; il explore et contrôle peu à peu ses actions ;
il apprend à maîtriser des pratiques. Les rôles de
l'enseignant sont donc de penser les aménagements, les situations ou les
interventions qui permettront une fécondité. Mais aussi de
favoriser les comparaisons, de relancer le questionnement, d'introduire le
doute, d'aider à reformuler et de favoriser les apprentissages d'ordre
pratique.
· Mode d'expérience-objet ou
d'expérimentation
(investigation empirique).
Dans ce mode, il s'agit de confronter les élèves
à un réel peu aménagé, de les aider à
problématiser ou à émettre un projet, de favoriser la mise
en cuvre effective des investigations, de favoriser les dynamismes et les
confrontations. En d'autres termes, la logique de ce mode d'investigation est
de résoudre des problèmes avec une approche qui reste ouverte.
Dans ce mode, correspondant à une transposition didactique des
démarches d'un chercheur, les situations expérimentales ont pour
but d'initier l'élève à des raisonnements scientifiques,
de lui faire utiliser les instruments et les procédures d'une telle
investigation, de lui faire approcher la résistance du réel. Pour
l'enseignant il s'agit alors de distinguer un guidage pédagogique
d'exploration et un guidage pédagogique de validation, et d'inciter les
élèves à réfléchir sur les démarches
et sur les raisonnements.
· Mode d'expérience-outil ou
d'expérience-validation
(élaboration théorique).
L'expérience, dans ce mode, peut être
considérée comme un outil mis au service de l'élaboration
théorique, pour la construction de concepts ou de modèles. Les
expériences sont envisagées dans un cadre d'apprentissage
conceptuel systématique, et ce mode est plus développé
dans les travaux pratiques. Il s'agit de mettre à l'épreuve les
constructions intellectuelles, pour en éprouver la pertinence et le
domaine de validité.
3.3.2) Rôles des activités
expérimentales.
· La nature expérimentale de
sciences-physiques. L'enseignement des sciences physiques constitue
une activité essentiellement expérimentale. Un des rôles
fondamentaux de l'expérience en sciences physiques est de valider la
théorie. Ce rôle de validation implique la construction
d'expériences, le plus souvent artificielles. L'évolution du
rôle de l'expérience entre Aristote et Galilée montre bien
le caractère construit de l'expérience et son articulation avec
le modèle (Tatchou, 2004).
D'après les propos du groupe de physique-chimie de
l'inspection générale, examinés par Tatchou (2004), les
activités expérimentales de physique-chimie doivent avoir pour
objet :
> d?abord, d?apprendre aux élèves à
observer et donc à se poser des questions,
> ensuite de les aider à acquérir des
connaissances, des savoir-faire et surtout une méthode d?analyse et de
raisonnement leur permettant de formuler avec pertinence des jugements
critiques.
Pour la plus grande partie de nos élèves, de
tels apprentissages ne peuvent être conduits que par des méthodes
actives, car sans elles, ils mobilisent difficilement leurs capacités
d'abstraction et de concentration. De ce fait, un enseignement formel et
abstrait de notre discipline conduirait de plus en plus à
l'échec. C'est avant tout pour cela que notre enseignement doit
comporter une large part d'activités expérimentales. D'ailleurs,
le proverbe chinois qui affirme «ce que j'entends, je l'oublie ; ce que je
vois, je le retiens ; ce que je fais, je le comprends », ne date pas
d'hier ?
· Roles des travaux pratiques en sciences
expérimentales. Les activités expérimentales des
élèves dans leurs apprentissages en sciences physiques et
chimiques sont primordiales.
Grâce aux travaux pratiques, les sciences
expérimentales doivent en principe stimuler des qualités
particulières chez les élèves :
> la curiosité : observer, se poser des questions
> esprit d'initiative et ténacité : concevoir et
réaliser des expériences
> sens critique : construire sa connaissance
La démarche expérimentale, en effet, aide à
:
> maîtriser les concepts qui gèrent le
fonctionnement d'un dispositif
> articuler pratiques expérimentales et appropriation
de connaissances plus théoriques.
> mémoriser (car on retient mieux lorsque l'on
fait).
Dès lors, la réponse à la question "Des TP :
Pourquoi ?" Devient évidente.
3.4) Quelques théories sur
l'expérimentation
3.4.1) La théorie des situations, le milieu
La structure classique des travaux pratiques (dans laquelle se
reconnaissent généralement les enseignants) repose sur la mise
à disposition des élèves d'une fiche d'activité et
des appareils adéquats pour étudier différents
phénomènes et ce, généralement, d'une façon
quantitative (mesures, traitements numériques, modélisation).
Dans un grand nombre de cas également (Richoux, 2000), cette
procédure repose sur l'hypothèse d'une certaine "autonomie" des
élèves : pendant une heure et demie, l'élève est
confronté à la réalité de l'expérience,
devant tour à tour mettre en oeuvre les connaissances acquises en cours,
et ainsi les consolider, ou en acquérir d'autres (savoirs et/ou
savoir-faire de physicien ou de chimiste).
3.4.2) La transposition didactique
La transposition didactique est un cadre général
introduit par Chevallard cité par Richoux, (2000, p.16) en didactique
des mathématiques pour étudier la transformation d'un "savoir
savant" en un "savoir enseigné". Ce concept est présenté
par Chevallard comme "un outil qui permet de prendre du recul, d'interroger les
évidences, d'éroder les idées simples, de se
dépendre de la familiarité de son objet d'étude". Par
là, il est utilisé pour analyser la prise en compte des concepts
dans les choix du savoir à enseigner, pour en étudier les
transformations et pour contrôler l'élaboration du savoir
enseigné sur des "choix épistémologiques"
affirmés.
La désignation d'un savoir à enseigner est, dans
le modèle de la transposition didactique, le choix d'une
"noosphère", et la transformation de ce savoir à enseigner ainsi
désigné, en un "objet d'enseignement" résulte d'un travail
de construction didactique.
Figure I : les savoirs

On retrouve, dans le schéma ci dessous, les deux
étapes qui caractérisent la transposition d'un savoir savant en
savoir enseigné. Différents travaux en didactique des sciences
expérimentales ont montré la difficulté pour les sciences
physiques du passage du savoir savant au savoir à enseigner. Ainsi outre
le fait que le savoir en physique ou en chimie est en perpétuelle
évolution (des changements théoriques parfois fondamentaux
remettant en cause les connaissances antérieures), la physique et la
chimie ne se réduisent évidemment pas à un texte du
savoir, les démarches, méthodes, instruments et savoir-faire
doivent être considérés de la même façon.
3.4.3) Le socioconstructivisme
C'est une approche complémentaire au constructivisme
(l?apprentissage résulte des constructions mentales de l'apprenant et
ces constructions répondent aux informations ou à la demande
formulée par l'enseignant ou par l'environnement. Ainsi c'est
l?élevé qui apprend et personne ne peut le faire à sa
place). Comme l'apprenant peut difficilement trouver seul toutes les
données nécessaires à tout changement de conceptions
(Loumouamou,2012) ; l'approche socio-constructivisme complète que en
situation de classe l'apprenant n'apprend pas seul, il le fait en interaction
avec les autres élèves engagés dans la même tache
que lui, le tout sur la médiation de l'enseignant.
3.5) Evaluation
Dans le domaine éducatif il existe de nombreuses
définitions du mot « évaluer ». Mais nous retiendrons
ici une vision beaucoup plus pragmatique en rapport avec une situation
concrète de l'enseignement (LOUMOUAMOU, 2011). C'est ainsi nous
définissons le concept évaluation comme un processus qui permet
d'examiner le degré d'adéquation entre un ensemble d'information
et un ensemble de critères adéquats à l'objectif
fixé en vu de prendre une décision.
· Evaluation des acquis
Comme toute action conçue avec des objectifs
affichés, l'information en retour sur son efficacité est
nécessaire aussi bien pour l'enseignent qui a conçu la
présentation des connaissances que pour les élevés qui ont
pour tache d'apprendre.
On distingue trois types d'évaluations :
l'évaluation diagnostique, l'évaluation formative et
l'évaluation sommative.
· Evaluation diagnostique
Elle a lieu avant l'acte d'enseignement et a pour rôle
de cerner les compétences et les faiblesses des élèves en
repérant leurs acquits préalables. Dans une approche
constructiviste (LOUMOUAMOU,2011) cette évaluation est d'avantage
orientée vers les élèves dans le but de leur faire prendre
conscience des conceptions dont ils sont porteurs sur le thème qui va
être étudié.
Si les résultats de ce type d'évaluation ont
pour conséquence de modifier l'enseignement initialement prévu en
tenant compte des résultats, alors l'on peut dire qu'il s'agit d'une
forme particulière d'évaluation formative ''la main à la
pâte''
http://www.lamap.fr/?Page_Id=1868.
Les informations recueillies sur les acquis des élèves permettent
d'organiser les apprentissages, de prévoir des remédiassions. Si,
en revanche, elle n'entraîne pas d'aménagement ou de modification,
ce type d'évaluation n'est ni
formative ni sommative. Elle ne sert qu?à dresser un
état des lieux et donner une information aux familles et à
l?administration du système éducatif.
· Evaluation formative
L?évaluation formative fait partie intégrante de
l?apprentissage. Elle doit s?effectuer de manière
régulière lors d?étapes prévues tout au long d?une
séquence d?enseignement. Elle peut s?appuyer sur divers supports :
exercices d?application, productions présentées par les
élèves, activités reprenant les contenus et
compétences travaillés etc.... L?objectif de ce type
d?évaluation n?est pas de donner une note, ni d?aboutir à un
classement mais dinformer l?élève sur ses
réussites et difficultés, de lui permettre de situer sa
progression par rapport à un objectif donné. A l?enseignant,
l?évaluation formative permet de mieux connaître ce qui a
été bien ou mal compris, les obstacles et difficultés
rencontrées afin de pouvoir réguler son enseignement et mettre en
place des activités individuelles ou collectives de
remédiassions. Son rôle dans ce type d?évaluation est
d?aider l?élève à faire le point sur ce qu?il a acquis et
sur ce qui lui reste à faire en analysant avec lui ses réussites
et ses erreurs hors tout jugement de valeur.
Pour l?enseignant, comme le souligne J.M. Rolando (Mapmonde
N°51, juin 2010), « Il ne faut pas s'intéresser uniquement
aux résultats des élèves mais tenter de repérer ce
qui crée le blocage, l'incompréhension, bref, s'intéresser
au processus d'apprentissage et pas seulement aux résultats ».
Dans cette forme d?évaluation, plus que dans d?autres, la qualité
de l?interaction entre l?évaluateur et l?évalué joue un
rôle primordial. Pour pouvoir communiquer et faire prendre conscience
à l?évalué des raisons de ses réussites et de ses
échecs, l?évaluateur doit s?efforcer de comprendre la situation
toujours complexe et singulière de l?élève en train
d?apprendre.
· Evaluation sommative
L'évaluation sommative intervient au terme d'un
processus d'apprentissage ou de formation. Son objectif premier est de
contrôler les acquis des élèves (connaissances et parfois
compétences) soit à la fin d'un module, soit à la fin
d'une année, soit pour un examen ou un concours. Elle se
matérialise le plus souvent par une note par rapport à certains
critères. Elle peut remplir plusieurs fonctions selon le cadre dans
lequel elle est effectuée : dresser le bilan des acquisitions d'un
groupe d'élèves, permettre un classement, autoriser le passage
dans une classe supérieure, attribuer un certificat (on parle alors
d'évaluation certificative), un diplôme. Selon aussi le cadre dans
lequel se situe cette évaluation, les évaluateurs peuvent
être soit les enseignants qui ont conçu ce contrôle, soit
des correcteurs extérieurs. La caractéristique de ce type
d'évaluation est de ne pas revenir sur le processus d'apprentissage et
sur les difficultés que les élèves ont pu rencontrer mais
de déboucher sur un jugement, même quand les élèves
sont encore en cours d'apprentissage.
CHAPITRE 2
METHODOLOGIE
CHAPITRE 2 : METHODOLOGIE
1) Méthodologie générale
Pour étudier notre problème, et donc chercher
à valider ou à invalider notre hypothèse, nous avons
réalisé nos activités dans trois (3) classes, dont une
classe témoin et deux classes expérimentales. Dans la classe
témoin, nous avons réalisé une évaluation
diagnostique pour connaitre le niveau de connaissance initial. Par la suite
l?enseignant a présenté le cours théorique sans
activité expérimentale, qui a été sanctionné
par une évaluation sommative. Dans les deux classes
expérimentales nous avons également effectué une
évaluation diagnostique, suivi de l?élaboration du cours avec
activités expérimentales. Enfin nous avons réalisé
une évaluation sommative.
Le cours avec activités expérimentales met
l?accent sur la place de la démarche expérimentale dans le
processus d?apprentissage des concepts scientifiques. Ces activités
expérimentales ont été conçues avec l?enseignant
titulaire de la classe.
2) Champ d'investigation
Le champ d'investigation de notre étude concerne
l'établissement d'enseignement général le Lycée
Chaminade.
3) La population
La population se définit en statistique comme un
ensemble d'individus de même nature faisant l'objet d'une étude
statistique (cours 2011). C?est aussi un référentiel sur lequel
va porter l?étude. En ce qui concerne notre étude la population
concerne les élèves du secondaire.
4) Échantillon
En statistique, l?échantillon est un sous-ensemble de la
population. Nous avons choisi pour notre étude travailler avec les
élèves de la seconde.
5) Les types d'activités
expérimentales.
Classiquement, les activités expérimentales ont
lieu sous trois formes :
v' la première forme appelée « Travaux
pratiques » (TP) est une séance consacrée exclusivement
à des manipulations faites par les élèves en petits
groupes en dehors du cours et sous la supervision du professeur en relation
avec un thème du programme : vérification d?une loi,
détermination d?une grandeur physique, préparations de solutions
ou de substances chimiques...;
v' les deux autres sont constituées par des
activités intégrées au cours :
A En « expériences de cours », les
manipulations sont faites prioritairement par le professeur mais celui-ci offre
parfois aux élèves la possibilité de manipuler ;
A En TP - cours les manipulations son faites prioritairement par
les élèves.
Ces séances intégrées au cours sont
destinées à aider l?élève à découvrir
et observer les phénomènes en jeu afin de construire les concepts
et comprendre les lois étudiées (Kane, 2011).
Pour notre travail (recherche) nous allons réaliser des
activités expérimentales intégrées au cours.
6) Instruments de collecte de données
Les instruments qui nous ont permis d'effectuer ce présent
travail pour collectionner les données sont :
> Un questionnaire d?évaluation adressé aux
élèves ;
> L?entretien avec l?enseignant titulaire des classes ;
> Un caméscope ;
> Un appareil photo numérique ;
> Statistique.
CHAPITRE 3 :
RESULTATS
CHAPITRE 3 : Résultats
Ce chapitre présente les différents
résultats obtenus lors des activités réalisées dans
les trois classes, dont une classe témoin et deux classes
expérimentales.
Le tableau III présente la fiche d?évaluation et
les réponses attendues auprès des apprenants.
Tableau III : Présentation de la fiche
d?évaluation et des réponses attendues.
|
Questions
|
Enoncé
|
Réponses attendues
|
|
1) cochez la bonne réponse
|
a) Un ion est un anion qui a gagné les
électrons
b) Un ion est cation qui a perdu les électrons
c) Un ion est un atome ou une molécule qui a gagné
ou perdu les électrons
|
c)
|
|
2) cochez la bonne réponse
|
La solution de nitrate d'argent contient les ions :
a) Ag+,NO3 -
b) Ag2+,2NO4 -
c) Ag, NO3
|
a)
|
|
3) cochez la bonne réponse
|
La solution de sulfate de cuivre contient les ions :
a) Cu2+, SO42-
b) Cu3+,3SO4 -
c) Cu, SO4
|
a)
|
|
4) répondez par vrai (V) ou faux
(F) les affirmations suivantes
|
L'addition de la solution de nitrate d'argent (Ag+,
NO3 -) à une solution contenant les ions chlorure (Ci) :
a) donne un précipité blanc de
chlorure d'argent AgCl
b) Donne un précipité rose de
chlorure d'argent AgCl
c) Donne un précipité vert de
chlorure d'argent AgCl
|
a)
|
|
5) répondez par vrai
(V) ou faux (F) les affirmations suivantes
|
L'addition de la solution d'hydroxyde de sodium Na+,
OH- à une solution contenant les ions cuivre II
Cu2+ :
a) Donne un précipité Vert de
d'hydroxyde de cuivre Cu(OH)2
b) donne un précipité Bleu de
d'hydroxyde de cuivre Cu(OH)2
c) donne un précipité blanc de
d'hydroxyde de cuivre Cu(OH)2
|
b)
|
NB : notre expérimentation porte
sur l?identification des ions en solution, alors le critère
d?évaluation qui se rapporte à cette activité c?est la
question n°4 et 5
3.1) Résultats de la classe témoin
3.1.1. Description du cours présenté
Le cours réalisé dans la classe théorique a
duré deux (2) heures et il s?est déroulé de la
manière suivante :
> salutation des élèves en se levant à
l?entrée du professeur dans la salle de classe ;
> Contrôle de présences ;
> Présentation et explication du professeur aux
élèves de la tache qu?ils vont accomplir pour son
évaluation ;
> Remise des questionnaires d?évaluation aux
élèves c'est-à-dire l?évaluation avant
l?enseignement (évaluation diagnostique). Cette phase n?a duré
que (7) sept minutes, ceci pour délecter les conceptions des
élèves ;
> Ramassage des questionnaires par le professeur ;
> Début de la leçon et contrôle des
pré-requis : ici le professeur essaie d?identifier les conceptions des
élèves ;
> Phase d?explications au cours de laquelle l?enseignant,
en faisant le cours (réaction chimique), a expliqué la
manière de mettre en évidence l?existence des ions dans un
composé. Il a schématisé le dispositif permettant à
identifier les ions (tube à essaie et la compte goutte) en solution ; il
a aussi répondu aux préoccupations des élèves ;
> Consolidation des notions : ici le professeur dicte le cours
;
> Enfin, redistribution des mêmes questionnaires
d?évaluation aux
élèves pour le contrôle des connaissances
après l?enseignement
(l?évaluation sommative) pour voir si la notion est
comprise.
3.1.2. Evaluation diagnostique
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 22
élèves ont donné des réponses exactes à la
question sur les 25, soit un taux de 88% et trois (3) élèves ont
donné des réponses inexactes que nous présentons dans le
tableau IV.
Tableau IV : Réponses inexactes de
l?évaluation diagnostique classe
témoin pour la question n°1
|
Réponses inexactes
|
Nombre d'élèves
|
|
Un ion est un anion qui a gagné les électrons
|
2
|
|
Un ion est un cation qui a perdu les électrons
|
1
|
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 20
élèves ont donné des réponses exactes soit un taux
de 80% dans la classe témoin ; dans le tableau V nous avons
présenté les différentes réponses inexactes
données par (5) cinq élèves.
Tableau V: Différentes réponses inexactes
dans la classe témoin pour la question n°2.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de nitrate d?argent contient les ions
Ag2+,2NO4 -
|
2
|
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
3
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Les résultats obtenus montrent que 18
élèves ont donné des réponses
exactes soit un
taux de 72% dans la classe témoin ; dans le tableau VI
nous avons présenté les différentes
réponses inexactes données par (3) trois élèves. Il
faut souligner que le taux de réponses neutres existe et a atteint
16%.
Tableau VI : Réponses inexactes
présentées par les élèves pour la question
n°3.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de sulfate de cuivre contient les ions
Cu3+,3SO4 -
|
1
|
|
La solution de sulfate de cuivre contient les ions
Cu,SO4
|
2
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que 12
élèves ont donné une réponse exacte soit un taux de
48% ; les différentes réponses inexactes sont
présentées dans le tableau VII et le taux de réponses
neutres est de 4%.
Tableau VII: Différentes réponses inexactes
présentées par les élèves dans les trois classes
pour la question n°4.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité rose de chlorure d?argent
AgCl
|
4
|
|
Donne un précipité vert de chlorure d?argent
AgCl
|
8
|
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne quel précipité
?
Les résultats obtenus montrent que 7
élèves ont donné une réponse
exacte soit un taux
de 28% ; les différentes réponses inexactes
sont
présentées dans le tableau VIII, ici le taux de
réponses neutres
remonte à 16%.
Tableau VIII : Réponses inexactes de
l?évaluation diagnostique dans les trois classes sur la question
n°5.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité vert de d?hydroxyde de cuivre
Cu(OH)2
|
7
|
|
Donne un précipité blanc de d?hydroxyde de cuivre
Cu(OH)2
|
9
|

Synthèse des résultats de
l'évaluation diagnostique
Les résultats généraux de
l?évaluation diagnostique avec les différentes catégories
des réponses (exactes -inexactes -neutres) sont traduits dans la figure
1.

Figure 1 : résultats de l'évaluation
diagnostique dans la classe témoin ou théorique
La figure 1 présente les résultats de
l?évaluation diagnostique dans la classe témoin. Elle montre
qu?au niveau de la question n°1 le taux de réponses exactes est
élevé jusqu?à 88%. Mais, aux questions n°4 et 5 le
taux de réponses inexactes domine.
On constate également que le taux des réponses
neutres est légèrement croissant et atteint 16% aux questions
n°3 et 5. Par contre, pour les questions n°1,2 et 4 ce taux est
inexistant.
Le taux de réponses exactes au niveau de la question
n°1 s?explique par le fait que les élèves connaissent la
notion ion depuis le collège. En ce qui concerne le taux de
réponses inexactes élevé au niveau des questions n°4
et 5, cela est dû au fait que ces notions ne sont pas enseignées
au collège et pour les quelques élèves qui ont pu trouver
la réponse, il peut s?agir de la culture générale ou une
anticipation sur la notion (test d?identification des ions) en classe de
3ème.
Les réponses neutres au niveau de la question n°3
sont dues aux différentes conceptions des élèves, valables
aussi pour la question n°5. Mais, il faut ajouter que certains n?ont
aucune conception car ils ne présentent aucune connaissance sur la
notion et ont préféré ne pas se prononcer sur la
question.
3.1.3. Evaluation sommative.
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 25
élèves ont donné une réponse exactes à la
question soit un taux de 100% et ici les taux de réponses inexactes et
de réponses neutres sont de 0%.
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 24
élèves ont donné une réponse exacte soit un taux de
96% dans la classe témoin ; dans le tableau IX nous avons
présenté la réponse inexacte donnée par un
élève.
Tableau IX: Différentes réponses inexactes
dans la classe témoin pour la question n°2.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de nitrate d?argent contient les ions
Ag2+,2NO4 -
|
0
|
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
1
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Les résultats obtenus montrent que 19
élèves ont donné une réponse exacte soit un taux de
76% dans la classe témoin. Dans le tableau X nous avons
présenté les différentes réponses inexactes
données par (4) quatre élèves. Il faut souligner que le
taux de réponses neutres existe et a atteint 8%.
Tableau X : Réponses inexactes
présentés par les élèves pour la question
n°3.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de sulfate de cuivre contient les ions
Cu3+,3SO4 -
|
2
|
|
La solution de sulfate de cuivre contient les ions Cu,SO4
|
2
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que 14
élèves ont donné une réponse exacte soit un taux de
56% ; les différentes réponses inexactes dont le taux est de 32%
sont présentées dans le tableau XI et le taux de réponses
neutres est de 12%.
Tableau XI: Réponses inexactes, évaluation
sommative dans la classe témoin pour la question n°4.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité rose de chlorure d?argent
AgCl
|
5
|
|
Donne un précipité vert de chlorure d?argent
AgCl
|
3
|
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne quel précipité
?
Les résultats obtenus montrent que 17
élèves ont donné une réponse exacte soit un taux de
68%. Les différentes réponses inexactes sont
présentées dans le tableau XII, ici le taux de réponses
neutres est de 4%.
Tableau XII : Réponses inexactes de
l?évaluation sommative sur la question n°5.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité vert de d?hydroxyde de cuivre
Cu(OH)2
|
3
|
|
Donne un précipité blanc de d?hydroxyde de cuivre
Cu(OH)2
|
4
|

Synthèse des résultats de
l'évaluation sommative dans la classe témoin
Les résultats généraux de
l?évaluation sommative dans la classe théorique ou témoin,
avec les différentes catégories des réponses, les
réponses exactes, inexactes et neutres, sont présentés
dans la figure 2.

Figure 2 : Résultats de l'évaluation
sommative dans la classe témoin ou théorique.
La figure 2 présente les différences qui peuvent
exister entre l?évaluation diagnostique et l?évaluation
sommative.
Elle montre qu?au niveau de la question n°1 le taux de
réponses exactes s?est amélioré et a atteint 100%. Mais
aux questions n°4 et 5 l?écart entre les réponses exactes et
inexactes n?est pas très important ou significatif par rapport à
l?écart obtenu pour les questions n°1,2 et 3 de ces
réponses.
Le taux de réponses neutres a légèrement
augmenté au niveau de la question n°4, mais en
général ce taux est toujours faible et n?atteint pas 15%.
Au regard de cette analyse, le taux de réponses exactes
au niveau de la question n°1 s?explique toujours par le fait que les
élèves ont connu cette notion ion depuis le collège et
aussi grâce à la confirmation donnée par le professeur dans
les explications de la notion.
Le taux de réponses inexactes devient faible au niveau
de la question n°4 et 5 par rapport à l?évaluation
diagnostique, ce qui justifie la compréhension de la notion. Mais, cette
compréhension n?est pas significative car elle est d?environ 60% et
nécessite un TP.
En ce qui concerne les réponses neutres au niveau de la
question n°4, il faut souligner qu?en dehors des conceptions des
élèves, il y a aussi le problème de transmission chez
l?enseignant car, pendant son intervention, il a eu du mal à mettre en
évidence les ions réagissant pour donner le
précipité et sa couleur. Cela a suscité un embarras de
choix chez les élèves. Ainsi, on n?écarte pas le
problème de la formulation de la question lors d?une
évaluation.
3.1.4 Comparaison des réponses exactes entre
l'évaluation diagnostique et sommative

Figure 3 : Comparaison des réponses exactes
avant et après
l'enseignement dans la classe
témoin
La figure 3 montre que dans la classe théorique, le
taux de réponses exactes est très élevé
après l?enseignement. Par contre, ce taux est faible avant
l?enseignement.
On peu dire que le cours théorique a permis aux
élèves de comprendre les notions enseignées. Mais, il faut
bien remarquer que cette compréhension au niveau des
4ème et 5ème questions est peu
significative et n?a atteint qu?environ 60%.
3.2) Résultats dans les classes
expérimentales
3.2.1) Description du cours avec activités
expérimentales
Les activités sont réalisées au
lycée Chaminade dans la seconde C12 et C10. Le test d?identification des
ions fait partie du chapitre de la Réaction Chimique, et l?enseignant a
développé le premier objectif général qui demande
de caractériser les ions en solution aqueuse et le second de
caractériser un ion pour son identification. Les activités se
sont déroulées au cours d?une séance de
deux heures (2) dans les deux classes. L?effectif des élèves dans
chacune des classes est de vingt cinq (25) élèves. Les
différentes photos des expériences réalisées par
les élèves sont présentées à l?annexe.
Le début de la séance a été
précédé par un entretien préalable avec
l?enseignant pour lui préciser nos attentes et lui suggérer une
stratégie. Il faut souligner que dans les deux classes
expérimentales nous avons travaillé avec le même
enseignant. Nous avons ensemble avec l?enseignant monté le protocole
expérimental et les différentes étapes de la leçon.
Dans cet entretien nous avons donné des précisions à
l?enseignant sur les stratégies de la manipulation à savoir :
v' l?évaluation écrite avant l?enseignement ;
v' le contrôle de pré-requis ;
v' la présentation de la situation problème ;
v' la phase des explications ;
v' la présentation des manipulations ;
v' la consolidation des notions ;
v' l?évaluation écrite après
l?enseignement.
L?enseignant a respecté son cheminement habituel :
salutation, contrôle des présences...à l?exception des
éléments ou stratégies précités.
3.2.2) Evaluations diagnostiques
1) Classe 1
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 19
élèves ont donné une réponse exacte à la
question et cinq (5) élèves ont donné des réponses
inexactes que nous présentons dans le tableau XIII.
Tableau XIII : Réponses inexactes de
l?évaluation diagnostique pour la question n°1
|
Réponses inexactes
|
Nombre d'élèves
|
|
Un ion est un anion qui a gagné les électrons
|
2
|
|
Un ion est un cation qui a perdu les électrons
|
3
|
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 17
élèves ont donné une réponse exacte soit un taux de
68% ; dans le tableau XIV nous avons présenté les
différentes réponses inexactes données par les
élèves. Ici le taux de réponses neutres est de 8%.
Tableau XIV: Différentes réponses inexactes
dans la classe exp.1 pour la question n°2.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de nitrate d?argent contient les ions
Ag2+,2NO4 -
|
5
|
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
1
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Le nombre des élèves donnant une réponse
exactes est de 15, soit un taux de 60% dans cette classe, mais il est de 10
élèves des réponses inexactes, sort un taux de 40% et ces
différentes réponses inexactes sont présentées dans
le tableau XV.
Tableau XV : Réponses inexactes de
l?évaluation diagnostique pour la question n°3.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de sulfate de cuivre contient les ions
Cu3+,3SO4 -
|
6
|
|
La solution de sulfate de cuivre contient les ions
Cu,SO4
|
4
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que 10
élèves ont donné une réponse exacte soit un taux de
40%. Les différentes réponses inexactes dont le taux est de 48%
sont présentées dans le tableau XVI et le taux de réponses
neutres est de 12%.
Tableau XVI: réponses inexactes, évaluation
diagnostique dans la classe expérimentale 1 pour la question
n°4.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité rose de chlorure d?argent
AgCl
|
7
|
|
Donne un précipité vert de chlorure d?argent
AgCl
|
5
|
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne quel précipité
?
Les résultats obtenus montrent que 10
élèves ont donné une réponse exacte soit un taux de
40%. Les différentes réponses inexactes sont
présentées dans le tableau XVII et ont atteint 36%, ici le taux
de réponses neutres est de 24%.
Tableau XVII : les réponses inexactes de
l?évaluation sommative sur la question n°5.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité vert de d?hydroxyde de cuivre
Cu(OH)2
|
4
|
|
Donne un précipité blanc de d?hydroxyde de cuivre
Cu(OH)2
|
5
|

Synthèse des résultats de
l'évaluation diagnostique dans la classe expérimentale
1
Les résultats généraux de
l?évaluation diagnostique avec les différentes catégories
des réponses, sont traduits par figure 4 suivant.

Figure 4 : résultats de l'évaluation
diagnostique dans la classe 1 (la première classe
expérimentale).
NB : les réponses neutres expliquent le
choix de deux réponses par les élèves pour une question ou
bien le non choix à la question.
Les résultats obtenus et traduit par la figure 4,
montrent qu?au niveau de la première question à savoir
la définition d'un ion 19 élèves
ont répondus exactes à la question sur les 25 soit un taux de
76%. Il y a eu juste 5 élèves qui ont donné de
réponses inexactes et 1 neutre.
Au niveau de la deuxième question n°2 et de la
troisième n°3 le nombre d?élèves donnant une
réponse exacte à baisser jusqu?à 60% soit 15
élèves par rapport à la première question n°1.
Par contre, le taux de réponse inexacte s?élève et croit
jusqu?à atteindre 40% soit 10 élèves. A partir de la
question n°4 le taux de réponses inexactes est en hausse et atteint
environ 50% soit 12 élèves. Par contre le taux de réponses
exactes atteint à peine 40% soit 10 élèves. A la question
n°5 nous avons à peu près les mêmes remarques
qu?à la 4ème question, cependant qu?ici les taux de
réponses exactes et inexacte sont moyennement égaux.
Il faut souligner que le taux de réponses neutres, qui
était quasiment inexistant aux questions n°1, 2 et 3, connait une
hausse exponentielle partir de la 4ème question
jusqu?à la 5ème question où il a atteint
environ 25%.
Au regard de cette analyse, le taux de réponses exactes
élevé au niveau de la question n°1 s?explique par le fait
que, les élèves ont des connaissances antérieures sur la
définition d?un ion : la notion ion est enseigné depuis la classe
de la cinquième dans le chapitre intitulé les
éléments chimiques.
A partir des questions n°2 et 3, le taux de
réponses exactes baisse tout simplement parce que les
élèves pour donner la formule d?un ion ont eu des conceptions sur
la notion.
Le taux de réponses inexactes est élevé
à partir de la question n°4 parce que la plupart des
élèves n?ont pas des connaissances y relatives. Cela est aussi
valable pour la question n°5. Nous remarquons ici, pour la justification
de la raison, qu?au niveau des questions n°4 et 5 (couleur du
précipité) la courbe de réponses neutres est en forte
croissance parce que les élèves, une fois de plus, n?ont pas des
connaissances y relatives, et ils n?ont pas voulu se prononcer sur les
questions.
2) Classe 2
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 14
élèves sur les 25 ont donné une réponse exacte
à la question, soit un taux de 56%. Dix (10) élèves ont
donné des réponses inexactes que nous avons
présentées dans le tableau XVIII et une réponse neutre.
Tableau XVIII : Réponses inexactes de
l?évaluation diagnostique pour la question n°1
|
Réponses inexactes
|
Nombre d'élèves
|
|
Un ion est un anion qui a gagné les électrons
|
3
|
|
Un ion est un cation qui a perdu les
électrons
|
7
|
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 12
élèves ont donné une réponse exacte soit un taux de
48% dans cette deuxième classe expérimentale. Dans le tableau XIX
nous avons présenté les différentes réponses
inexactes données par les élèves avec un taux est de
52%.
Tableau XIX: Différentes réponses inexactes
dans la classe expérimentale 2 pour la question n°2.
|
Réponses inexactes
|
Nombre d'élèves
|
|
La solution de nitrate d?argent contient les ions Ag2+,2NO4 -
|
8
|
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
5
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Le nombre des élèves donnant une réponse
exacte est de 13, soit un
taux de 52% dans cette classe mais il est de 10
élèves des réponses inexactes soit 40% soit 10
élèves. Les différentes réponses inexactes sont
présentées dans le tableau XIX. Enfin, nous avons obtenus 8% de
réponses neutres
Tableau XIX : Réponses inexactes de
l?évaluation diagnostique pour la question n°3.
|
Réponses inexactes
|
|
Nombre d'élèves
|
|
La solution de sulfate de
contient les ions Cu3+,3SO4 -
|
cuivre
|
5
|
|
La solution de sulfate de
contient les ions Cu,SO4
|
cuivre
|
5
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que 9
élèves ont donné une réponse exacte soit un taux de
36%. Les différentes réponses inexactes, dont le taux est de 50%,
sont présentées dans le tableau XX et le taux de réponses
neutres est de 8%.
Tableau XX: Réponses inexactes, évaluation
diagnostique dans la classe expérimental 2 pour la question n°4.
|
Réponses inexactes
|
Nombre d'élèves
|
|
Donne un précipité rose de chlorure d?argent
AgCl
|
4
|
|
Donne un précipité vert de chlorure d?argent
AgCl
|
10
|
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne quel précipité
?
Les résultats obtenus montrent que 8
élèves ont répondus exactes soit
un taux de 32%. Les
différentes réponses inexactes sont présentées
dans le tableau XXI et ont atteint 52%, le taux de
réponses neutres est de 16%.
Tableau XXI : les réponses inexactes de
l?évaluation diagnostique sur la question n°5.
|
Réponses inexactes
|
|
Nombre d'élèves
|
|
Donne un précipité vert
d?hydroxyde de cuivre Cu(OH)2
|
de
|
6
|
|
Donne un précipité blanc
d?hydroxyde de cuivre Cu(OH)2
|
de
|
7
|

Synthèse des résultats de
l'évaluation diagnostique dans la classe expérimentale
2
Les résultats généraux de
l?évaluation diagnostique avec les différentes catégories
des réponses sont traduits par la figure 5 suivant.

Figure 5 : résultats de l'évaluation
diagnostique dans la classe 2 (la deuxième classe
expérimentale).
Ces résultats montrent qu?à la question n°1
nous avons un taux élevéde plus de 56%, soit 14
élèves qui ont donné de réponses exactes.
Par
contre les réponses inexactes sont au dessous de la moyenne,
nous
observons une croissance au niveau de la question n°3,4, et 5 ; et
une
décroissance du taux de réponses exactes à
ces mêmes questions.
Les réponses neutres quasi inexistantes de
1ère à la 3ème question. Mais Au
niveau du 4ème et 5ème questions nous avons
le même comportement que dans la 1ère classe
expérimentale.
Au regard de ces résultats nous remarquons en
général les résultats obtenus ici sont analogues à
ceux de la classe 1, particulièrement aux 4ème et
5ème questions où la plupart des élèves
n?ont pas des connaissances sur la notion. La croissance du taux des
réponses neutres montre bien que les élèves n?ayant pas
des connaissances sur la notion ont préféré se retenir.
3) Comparaison entre les classes expérimentales
1 et 2
Dans cette partie nous faisons la comparaison des
réponses exactes avant le cours et TP dans les deux classes
expérimentales. La figure 6 présente les résultats obtenus
et nous donne l?écart entre les deux.

Figure 6 : Comparaison des réponses exactes
avant le cours TP dans les classes 1 et 2.
La figure 6 montre que le taux de réponses exactes dans
la première
classe (classe 1) est légèrement
supérieur à celui de la classe 2. Cette
différence
montre bien qu?on avait des élèves différents dans les
deux
classes. Mais, en général, les deux histogrammes
ont la même allure car ils décroissent et présentent en
moyenne un taux supérieur à 50% au niveau des questions
n°1,2et 3. Ces résultats s?expliquent par le fait que les trois
questions font appels aux vérifications des pré-requis et les
élèves, en majorité, ont des connaissances sur ces
notions.
A la question n°4 et 5 ce taux devient de plus en plus
faible jusqu?à atteindre environ 30% car les élèves n?ont
pas des connaissances relatives à ces deux questions qui font intervenir
la notion du test d?identification des ions en solution.
3.2.3) Evaluation sommative
1) Classe 1
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 20
élèves ont répondus exactes sur les 25, soit un taux de
80% et cinq (5) élèves ont donné des réponses
inexactes que nous présentons dans le tableau XXII.
Tableau XXII : les réponses inexactes de
l?évaluation sommative pour la question n°1
|
Réponses inexactes
|
Nombre d'élèves
|
|
Un ion est un anion qui a gagné les électrons
|
2
|
|
Un ion est un cation qui a perdu les électrons
|
3
|
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 21
élèves ont répondus exactes soit un taux de 84%, dans le
tableau XXIII nous avons présenté les différentes
réponses inexactes données par les élèves.
Tableau XXIII: réponses inexactes de
l?évaluation sommative dans la classe exp.1
|
Réponses inexactes
|
Nombres d'élèves
|
|
La solution de nitrate d?argent contient les ions
Ag2+,2NO4 -
|
3
|
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
1
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Le nombre des élèves répondant exactes
est de 23, soit un taux de 92% dans cette classe, mais celui des
réponses inexactes est 8% et sont présentées dans le
tableau XXIV.
Tableau XXIV : réponses inexactes de
l?évaluation sommative pour la question n°3.
|
Réponses inexactes
|
|
|
|
|
|
Nombres d'élèves
|
|
La solution
Cu3+,3SO4 -
|
de
|
sulfate
|
de
|
cuivre
|
contient
|
les
|
ions
|
2
|
|
La solution
Cu,SO4
|
de
|
sulfate
|
de
|
cuivre
|
contient
|
les
|
ions
|
0
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que tous les
élèves ont répondus exactes soit un taux de 100%, ici le
taux de réponses inexactes et neutres n?existent pas.
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne
quel précipité ?
Les résultats obtenus montrent que 22
élèves ont répondus exactes soit un taux de 88%, les
différentes réponses inexactes sont présentées dans
le tableau XXV et ont atteint 12%.
Tableau XXV : les réponses inexactes de
l?évaluation sommative sur la question n°5.
|
Réponses inexactes
|
|
Nombre d'élèves
|
|
Donne un précipité vert
d?hydroxyde de cuivre Cu(OH)2
|
de
|
3
|
|
Donne un précipité blanc
d?hydroxyde de cuivre Cu(OH)2
|
de
|
0
|

Synthèse des résultats de
l'évaluation sommative dans la classe expérimentale 1
Les résultats généraux de
l?évaluation sommative avec les différentes catégories des
réponses, sont traduits dans la figure 7 suivant.
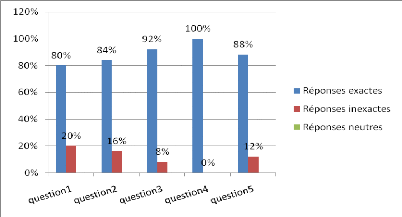
Figure 7 : résultats de l'évaluation
sommative dans la classe 1 (la première classe
expérimentale).
Ces résultats montrent que le taux de réponses
exactes est plus élevé
dans toutes les questions. Par contre le taux de réponses
inexactes est faible quasiment négligeable.
En ce qui concerne les réponses neutres aucun
élève ne s?était prononcé ce qui nous donne un taux
inexistant.
Au regard de ces résultats nous pouvons dire que pour les
questions n°1,2 et 3 le cours a permis aux élèves :
· de confirmer leurs connaissances d?une part pour ceux qui
ont trouvé les bonne réponses.
· d?améliorer leurs compétences d?autre part,
pour ceux n?ayant pas trouvé à la bonne réponse.
Mais pour la question n°4 et 5 le TP a permis aux
élèves d?expérimenter la notion étudiée en
observant, en touchant à la réalité, en manipulant...
Cette expérimentation a fait disparaitre les conceptions voila pourquoi
nous avons obtenu un taux très élevé qui est 100%.
2) Classe 2
Question 1 : qu'est ce qu'un ion ?
Les résultats obtenus montrent que 21
élèves ont répondus exactes sur les 25, soit un taux de
84% et quatre élèves ont donné des réponses
inexactes que nous présentons dans le tableau XXVI.
Tableau XXVI: les réponses inexactes de
l?évaluation sommative pour la question n°1
Réponses inexactes
|
Nombre d'élèves
|
Un ion est un anion qui a gagné les électrons
|
1
|
Un ion est un cation qui a perdu les électrons
|
3
|
|
Question 2 : La solution de nitrate d'argent
contient quels types d'ions ?
Les résultats obtenus montrent que 23
élèves ont répondus exactes soit un taux de 92%, dans le
tableau XXVII nous avons présenté les réponses
inexactes.
Tableau XXVII: réponses inexactes de
l?évaluation sommative dans la classe exp.2
Réponses inexactes
|
Nombres d'élèves
|
La solution de nitrate d?argent contient les ions
Ag2+,2NO4 -
|
1
|
La solution de nitrate d?argent contient les ions Ag, NO3
|
1
|
|
Question 3 : La solution de sulfate de cuivre
contient quels types d'ions ?
Le nombre des élèves répondant exactes
est de 10, soit un taux de 40% dans cette classe, mais celui des
réponses inexactes est 48% et sont présentées dans le
tableau XXVIII.
Tableau XXVIII : réponses inexactes de
l?évaluation sommative pour la question n°3.
Réponses inexactes
|
Nombres d'élèves
|
La solution de sulfate de cuivre contient les ions
Cu3+,3SO4 -
|
7
|
La solution de sulfate de cuivre contient les ions Cu,SO4
|
2
|
|
Question 4 : L'addition de la solution de
nitrate d'argent (Ag+,NO3-) à une solution
contenant les ions chlorure (Cl-) donne quel précipité
?
Les résultats obtenus montrent que tous les
élèves ont répondus exactes soit un taux de 100%, ici le
taux de réponses inexactes et neutres n?existent pas.
Question 5 : L'addition de la solution
d'hydroxyde de sodium Na+, OFF- à une solution
contenant les ions cuivre II Cu2+ donne quel précipité
?
Les résultats obtenus montrent que 24
élèves ont répondus exactes soit un taux de 96%, les
différentes réponses inexactes sont présentées dans
le tableau XXIX et ont atteint juste 4%.
Tableau XXIXV : les réponses inexactes de
l?évaluation sommative sur la question n°5.
Réponses inexactes
|
|
|
Nombre d'élèves
|
Donne un
Cu(OH)2
|
précipité
|
vert de
|
d?hydroxyde de cuivre
|
0
|
Donne un Cu(OH)2
|
précipité
|
blanc de
|
d?hydroxyde de cuivre
|
1
|
|

Synthèse des résultats de
l'évaluation sommative dans la classe expérimentale 2
Les résultats généraux de
l?évaluation sommative avec les différentes catégories des
réponses sont traduits par la figure 8.

Figure 8 : résultats de l'évaluation
sommative dans la classe 2 (la deuxième classe
expérimentale).
Nous remarquons une fois de plus des approximations au niveau
des résultats par rapport à la première classe
expérimentale. Le taux de réponses neutres est nul et inexistant,
car le cours TP ou les activités réalisées ont fait
disparaitre les doutes, certaines conceptions.
Le taux de réponses exactes est très
élève à la question n°4 et 5 car les
élèves en manipulant ont vu le précipité
formé à la fin de la réaction ; c?est l?apport même
des TP pour la consolidation des notions chez les élèves. Juste
un apprenant qui n?a pas donné une bonne réponse à la
5ème question.
A la question n°3 le taux de réponses inexactes
est légèrement supérieur au taux de réponses
exactes, et a atteint 48%. La justification de ce taux est le fait que
l?enseignant n?avait pas pris le soin d?expliquer la notion y relative.
3) Comparaison entre la classe 1 et la classe 2
Présentation des résultats des réponses
exactes de la classe 1 et 2 après les enseignements (cours TP) la figure
9 suivant
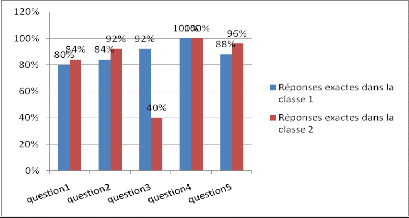
Figure 9 : Comparaison des réponses exactes
après le cours TP dans les classes 1 et 2.
Au regard de ces résultats nous remarquons que dans
les deux classes, le taux de réponses exactes est supérieur
à 80% et atteint les 100% à partir de la 4ème
question car les élèves ont manipulé en construisant le
savoir et beaucoup des conceptions ont trouvé la solution chez les
élèves.
Les deux courbes ont la même allure et
présentent un écart presque négligeable, ce ci prouve la
conformité des résultats obtenus dans ces deux classes
expérimentales. C?est ainsi, la comparaison de ces deux classes
expérimentales à la classe témoin ou théorique nous
montrera l?apport de l?activité expérimentale dans une situation
d?enseignement/ apprentissage.
3.3) Comparaison des résultats entre la classe
témoin et les classes expérimentales
Comparaison des réponses exactes de la classe
témoin à ceux des classes expérimentales après les
enseignements et elles sont traduites dans la figure 10.

Figure 10 : Comparaison des réponses exactes
de la classe témoin à ceux des classes expérimentales
après les enseignements.
La figure 10 montre que le taux des réponses exactes
est très élevé dans les deux classes expérimentales
par rapport à la classe théorique ou témoin. Cette
différence est très remarquable et importante pour les questions
n°4 et 5 qui font appels à une manipulation ou activité
expérimentale, elle traite la notion du test d?ion. Au niveau de la
question n°4 on constate un écart de 40% ente les classes A et B et
la classe théorique, cet écart est environ de 30% à la
5ème question.
A partir de ces résultats, nous pouvons dire que le
cours expérimental contribue mieux à la compréhension des
notions par les élèves que le cours théorique.
3.4) Les activités réalisées
Cette partie présente le déroulement du cours
théorique dans la classe témoin, et une synthèse du
déroulement des cours TP dans les deux classes expérimentales 1
et 2.
A) Présentation
Nous avons choisi de tester une activité
expérimentale portant sur la réaction chimique. Les objectifs
visés à notre étude sont :
· L?objectif général : caractériser
les ions en solution aqueuse ;
· L?objectif spécifique 1 : mettre en
évidence l?existence des ions dans un composé ;
· L?objectif spécifique 2 : utiliser les
caractéristiques d?un ion pour son identification.
B) Condition de réalisation
a. Présentation des classes
expérimentales
Les activités sont réalisées au
lycée Chaminade dans la seconde C12 et C10. Le test d?identification des
ions fait partie du chapitre de la Réaction Chimique, et l?enseignant a
développé le premier objectif général qui demande
de caractériser les ions en solution aqueuse et le
second à caractériser un ion pour son
identification. Les activités se sont déroulées au cours
d?une séance de deux heures (2) dans les deux classes. L?effectif des
élèves dans chacune des classes est de vingt cinq (25)
élèves. Les photos 4, 5 et 6 (voir l?annexe) représentent
la disposition des élèves dans les deux classes
expérimentales.
Le début de la séance a été
précédé par un entretien préalable avec
l?enseignant pour lui préciser nos attentes et lui suggérer une
stratégie. Il faut souligner que dans les deux classes
expérimentales nous avons travaillé avec le même
enseignant. Nous avons ensemble avec l?enseignant monté le protocole
expérimental et les différentes étapes de la leçon.
Dans cet entretien nous avons donné des précisions à
l?enseignant sur les stratégies de la manipulation à savoir :
v' L?évaluation écrite avant l?enseignement ;
v' Le contrôle de pré-requis ;
v' La présentation de la situation problème ;
v' La phase des explications ;
v' La présentation des manipulations ;
v' La consolidation des notions ;
v' L?évaluation écrite après
l?enseignement.
L?enseignant a respecté son cheminement habituel :
salutation, contrôle des présences...à l?exception des
éléments ou stratégies précités.
b. L'évaluation avant l'enseignement
Dans cette phase nous avons procédé à la
remise des questionnaires d?évaluation aux élèves, elle
est aussi appelée évaluation diagnostique : les
élèves se sont mis au travail. Le but de cette séquence
est de voir les difficultés des apprenants et elle a duré en
moyenne dans les deux classes six (6) minutes.
c. Contre des prérequis Nous avons
demandé dans cette phase à l?enseignant de poser des
questions sur la notion enseignée, afin de
repérer les différentes conceptions des élèves qui
permettront à l?enseignant de bien présenter la situation
problème.
d. Présentation de la situation
problème
Selon RAYNAL et REUNIEN (1997) la situation problème
« c?est une pédagogie conçue par l?enseignant dans le but de
créer pour des élèves, un espace d?analyse autour d?un
problème à résoudre. De permettre également aux
élèves de conceptualiser des nouvelles représentations sur
un sujet précis à partir de cet espace problème »
Pour notre travail, on peut dire que son objectif est aussi
d?identifier et de chercher les éléments pour l?explication et la
résolution du problème.
Nous avons demandé à l?enseignant de prendre
des exemples dans la vie quotidienne ou dans l?environnement des
élèves afin de leur faire percevoir l?intérêt des
activités expérimentales.
e. Les explications
Dans cette phase d?explication nous avons
suggéré au professeur d?expliquer avec précision, comment
mettre en évidence les ions dans un composé et le test qui sert
à identifier un ion en solution aqueuse. Le professeur doit ainsi briser
les conceptions des élèves sur les notions enseignées.
f. La manipulation
Nous avons présenté les différentes
stratégies de la manipulation au professeur pour le bon suivi du
protocole expérimental que nous avons monté de la manière
suivante :
Protocole
expérimental
· L'objet du TP est de savoir
identifier les ions présents dans l?eau en faisant un test.
· Matériel et produit pour la
classe
v' Solution Hydroxyde de sodium (pour les ions cuivre)
v' Solution aqueuse de nitrate d?argent (pour les ions chlorure)
v' Solution d?eau minérale contenant des ions Cl-
v' Les tubes à essais (5)
v' Compte gouttes
v' Béchers (3)
Voir à l?annexe les photos des matériels
utilisés
+ Problématique :
Comment pourrai-t-on vérifier qu?une solution contient
bien les ions indiqués.
+ Hypothèses :
L?eau minérale renferme les ions chlorure
Cl-, et la solution de sulfate de cuire contient les ions
cuivre Cu2+.
+ Protocole
On va utiliser le fait que l?addition :
-de la solution de nitrate d?argent (AgNO3) à une
solution contenant les ions chlorure Cl- donne un
précipité blanc de chlorure d?argent AgCl2 qui
noirci à la présence de la lumière.
- de la solution Hydroxyde de sodium à
une solution contenant les ions sulfate SO donne un précipité
Bleu d?hydroxyde de cuivre Cu(OH)2. Verser dans deux tubes
à essais quelques cm3 de (Cu2+,
SO42-) dans A et d'eau minérale B ; ajouter
quelques gouttes de la Soude dans A et de nitrate d'argent dans
B.
+ Observation
Apparition immédiate d?un précipité blanc
dans A de chlorure d?argent AgCl2 qui noirci à la présence de la
lumière ;
Apparition immédiate d?un précipité blanc
dans B.
+ Equations bilan
Dans le flacon A : Ag+ + Cl- AgCl
Dans le flacon B : Cu2+ + 2OH- Cu(OH)2
+ Conclusion
Les hypothèses sont vérifiées, l?eau
minérale renferme bien des ions
chlorure (Cl-) et le
sulfate de cuivre renferme bien les ions cuivre II
Cu2+
3.5) Analyse, interprétation et conclusion de
tous les résultats
Cette phase consiste à analyser, interpréter et
à discuter tous les résultats. Elle est structurée en deux
parties
> Analyse et interprétation des résultats ;
> Discussion des résultats.
1) Analyse et interprétation des
résultats
1.1) Pour les résultats des
évaluations
Au terme des évaluations sommative, nous avons
remarqué au départ un aspect important c?est que : le cours
théorique et les deux autres expérimentaux ont pratiquement
donné les même résultats car lorsque l?on regarde le taux
de réponses exactes est supérieur à 80% dans les trois
classes au début du questionnaire : les élèves ont compris
la notion.
Au regard de ces résultats nous pouvons estimer que le
cours théorique et le cours expérimentale n?ont pas de
différence pour des questions que ne relèvent pas de
l?expérimentation car les deux contribuent d?une manière
générale à la compréhension des notions le fait
d?avoir une deux classe expérimentales prouve la validité de nos
résultats. En tenant compte de cette observation, il n?est pas
évident de dire le cours expérimental a plus d?influence due le
cours théorique.
Mais quand on observe le graphe n°10 on remarque que la
différence se fait ressentir au niveau de la question n°4 et 5 :
ici les résultats obtenus dans les deux classes expérimentales
sont supérieurs et ont un taux le plus élevé à
100%. Par contre dans la classe théorique ce taux le plus est 68% et le
moins 56%. Ceci prouve que les élèves dans les classes
expérimentales ont mieux compris la notion du test d?identification des
ions en solution aqueuse.
Néanmoins, à partir de ces résultats nous
pouvons dire que les activités expérimentales occupent une place
très importante dans le processus enseignement/apprentissage des
sciences physiques car elles permettent aux élèves de bien
comprendre la notion enseignée grâce aux fixations des images et
aussi les aux travaux pratiques, les sciences expérimentales ont
stimulés des qualités particulières chez les
élèves qui sont :
> curiosité : observer, se poser des questions
> esprit d'initiative et ténacité : concevoir et
réaliser des expériences
> sens critique : construire sa connaissance
1.2) Pour les activités
expérimentales
a) l'aspect qualitatif des activités
expérimentales
Dans l?aspect qualitatif des activités
expérimentales en sciences physiques et particulièrement en
chimie il convient d?avoir tout le matériel nécessaire à
la réalisation de la manipulation et au suivi du protocole
expérimental ; ainsi donc, ces activités expérimentales
nous ont permis de constater :
+ La motivation
Cette motivation s?est faite ressentir ou remarquée
à deux niveaux à savoir : - au niveau du professeur et - au
niveau des élèves.
Au niveau du professeur, la présentation du dispositif
expérimental a suscité une grande motivation en lui. Ils ont
permis à l?enseignant de développer de nouvelles
stratégies d?enseignement ainsi que l?esprit de la
créativité. C?est ainsi à partir de ces activités
le professeur a lié la théorie à la pratique.
Au niveau des élèves, il y a une grande
motivation qui s?est accompagné d?une grande curiosité. A la vue
du matériel et des produits les élèves ont reconnu que
c?était pour la première fois qu?ils voyaient, qu?ils
manipulaient, qu?ils touchaient à la verrerie et aux produits chimiques
(composé à l?état solide)
b) l'aspect quantitative des activités
Notre étude s?est focalisée sur l?observation du
temps de manipulation par rapport au temps d?enseignement. La durée
prévue pour le cours est de deux heures (2). Mais temps mis dans la
première classe expérimentale est de deux heures huit (2h8min)
minutes et deux heures treize minutes (2h13min) dans la deuxième classe
expérimentale.
Le temps a été bien géré
malgré le léger décalage d?une dizaine de minutes dans les
deux classes expérimentales. Ce décalage du temps est du par le
fait que, le temps prévu pour le TP a débordé parce que
tous les élèves manifestaient un grand intérêt pour
la manipulation. Nous avons ainsi formé les binômes pour que tout
le monde participe à la manipulation.
2) Conclusion des résultats
Les résultats issus du questionnaire au niveau des
élèves pour les évaluations sommatives dans les trois
classes dont deux expérimentales et une théorique montrent que
l'hypothèse principale de notre travail est affirmée. Nous avons
constaté que la plupart des établissements scolaire du secondaire
(collège et lycée) que nous avons visité, avec
une note permissionnaire de l?Institut National de Recherche et
d?Action Pédagogique (INRAP), ne sont pas dotés en laboratoire
équipés.
Nous aurons dans le chapitre suivant les conclusions et les
perspectives de notre travail de recherche.
CONCLUSIONS GENERALE ET
PERSPECTIVES
CONCLUSION ET PERSPECTIVE
L?étude que nous avons menée en DEA a
porté sur les aspects relatifs à l?enseignement
expérimental en chimie. Il s?agissait d?évaluer l?impact des
activités expérimentales dans ce domaine. Pour vérifier
notre hypothèse, nous avons travaillé dans trois classes, chacune
ayant un effectif de 25 élèves, au lycée Chaminade : une
classe témoin dans laquelle on n?a pas réalisé une
expérience, et deux classes expérimentales afin de bien valider
ou invalider notre hypothèse. Nous voulons connaître le
rôle, la place, voir même l?intérêt de
l'expérimental dans l?enseignement de la chimie à travers
quelques expériences du test d?identification des ions en solution.
C?est ainsi que notre travail vise à voir comment ces
activités peuvent aider les apprenants de bien comprendre le cours et
à l?enseignant de bien dispenser le cours de réaction chimique :
lier la théorie à la pratique. Nous avons réalisé
les évaluations et des activités expérimentales en
situation d?enseignement/apprentissage et les résultats sont
satisfaisants. Ces résultats montrent que :
> les activités expérimentales contribuent
à la bonne compréhension des notions et phénomènes
chimiques ;
> les manipulations ont donné une grande motivation et
un esprit de curiosité chez les apprenants.
> L?écart entre la classe théorique et les
classes expérimentales présentées dans le graphe 10 montre
bien l?impact, l?intérêt de réaliser les activités
expérimentales intégrées au cours car la Chimie est unes
science expérimentale.
Enfin l?enseignant a pu dispenser le cours avec lucidité
en contournant certaines difficultés chez les apprenants.
Ces résultats issus des évaluations confirment
d'abord les constats faits dans la partie théorique concernant les
objectifs visés par l'expérience en sciences-physiques et nous
amènent à conclure que pendant une expérience de cours en
réaction chimique (test d?ion), l'élève peut
construire non seulement les savoirs conceptuels, mais aussi
les savoirs procéduraux. L?écart entre les résultats
obtenus dans la classe témoin et les résultats obtenus dans les
classes expérimentales confirme bien notre hypothèse.
Mais depuis des années, les activités
expérimentales dans l?enseignement des sciences physiques n?existe
presque plus dans le système éducatif congolais. Ceci par manque
de matériel didactique et de laboratoire dans les établissements
scolaires. Plusieurs recherches ont décrié ce problème de
manque de matériel, de produit de laboratoire et de leur
équipement ; notamment, l?article écrit par NTSILA, A., MASSAMBA,
A., RAMA-NIAMAYOUA, R., & SILOU, T. dans la pratique expérimentale
en sciences physiques à travers les conceptions des enseignants
Congolais.
Au vu des résultats de cette recherche descriptive, trois
implications semblent se dégager :
+ Pour les enseignants.
L'enseignant pourra aussi prendre en compte les obstacles
sous-jacents et des possibilités de compréhension des
élèves pendant la préparation de leurs activités
expérimentales. Il prendra conscience du chemin qui reste à
parcourir entre les conceptions des apprenants et les objectifs qu'il doit
élaborer pour l'enseignement.
+ Pour les décideurs en
éducation.
De l'analyse des résultats de la recherche pourraient
sortir des suggestions sur la mise en place des laboratoires de chimie dans
tous les établissements du secondaire car le manque de matériel
didactique entrave les activités expérimentales et aider les
enseignants à travers les séminaires ateliers à concevoir
et à réaliser les activités expérimentales.
+ Pour la recherche en didactique
expérimentale.
Cette étude peut servir d'appui aux différentes
réflexions didactiques sur la pratique expérimentale et notamment
l'impact, le rôle des travaux pratiques de chimie en tenant compte de
conceptions des apprenants.
Ces quelques pistes de recherches que nous avons
envisagées, sont autant de prolongements possibles pour ce travail.
REFERENCES BIBLIOGRAPHIQUES
· BEAUFILS, D. vingt années de thèses en
didactique de la physique et de la chimie. Aster, n°27, 1998, 23p-26p.
· COQUIDE, M. (1998). Les pratiques expérimentales :
propos d?enseignants et conceptions officielles. Aster, 28,
109-132.
· DUMON, A. Quelle(s) méthode(s) pour
l'enseignement
expérimental de la chimie ? In: Revue française
de pédagogie. Volume 84, 1988. pp. 29-38.
· HRAIRI, S. (2004). Forme et fonctions des
expériences dans l?enseignement de la biologie : cas de la digestion
dans le curriculum Tunisien. Thèse de doctorat de l?université de
Tunis.
· INRAP (2002) : programme des enseignements et guide
pédagogique en Sciences Physiques. Edition INRAP 76p.
· KANE, S. Les pratiques expérimentales au
lycée- Regards croisés des enseignants et de leurs
élèves. Radisma, l?Université Cheikh Anta Diop, Dakar-
Sénégal, n°7, 2011, 26p.
· LE MARÉCHAL, J.F. Difficultés des
élèves sur l?utilisation des ions dans le cadre des nouveaux
programmes. Union des Professeurs de Physique et de Chimie, vol 98,
2004, 1398p-1410p.
· LOUMOUAMOU, A. (2011). Cours de didactique des sciences.
Université Marien NGOUABI, ENS, CAPES PC5, 30p.
· MBOUKOU S. (2011). Place de l?expérimental
dans
l?enseignement/apprentissage de la géologie : cas du profil
pédologique en classe de seconde C. mémoire de DEA,
université Marien Ngouabi, ENS, 96p.
· NGOULOU, M. (2006). L?enseignement des sciences de la
vie et de la terre (S.V.T) au collège de l?enseignement
général. UMNG mémoire de CAICEG, ENS, 77p.
· NTSILA, A., MASSAMBA, A., KAMA-NIAMAYOUA, R., &
SILOU, T. La pratique expérimentale en sciences physiques à
travers les conceptions des enseignants Congolais. Annales de
l?université
Marien Ngouabi, vol 1, 2000, 91p-102p.
· REBAUD, D. Enseignement et réaction chimique : une
délicate alchimie. Aster, n°18, 1994, 03p-09p.
· RICHOUX, H. (2000). Rôles des expériences
quantitatives dans l'enseignement de la physique au lycée. Thèse
de doctorat de l?Université Paris 7.
· RICHOUX, H. & BEAUFILS, D. « Conception de
travaux pratiques par les enseignants : analyse de quelques exemples de
physique en termes de transposition didactique ». Didaskalia, n°27,
2005, 11p-39p.
· ROLANDO, J. M. L?évaluation en sciences et
technologie. MAP?MONDE : Bulletin de liaison de La main à la
pâte, n°51, juin 2010.
· TATCHOU, G. (2004). Conceptions d?élèves
du secondaire sur le rôle de l'expérience en sciences physiques :
cas de quelques expériences de cours en Electrocinétique.
Mémoire de DEA de l?Université Cheikh Anta Diop de Dakar
(ENS).
ANNAXES
FICHE DE LA DEMARCHE EXPERIMENTALE
L'objet du TP est de savoir identifier les ions
présents dans l?eau en faisant un test.
Matériel et produit pour la classe
v' Solution Hydroxyde de sodium (pour les ions cuivre)
v' Solution aqueuse de nitrate d?argent (pour les ions chlorure)
v' Solution d?eau minérale contenant des ions Cl-
v' Les tubes à essais (5)
v' Compte gouttes v' Béchers (3)
1. Problématique : Comment pourrai-t-on
vérifier qu?une contient les ions indiqués ?
2. Hypothèses :
L?eau minérale renferme les ions chlorure
Cl-, et la solution de sulfate de cuire contient les ions
cuivre Cu2+.
3. Protocole
On va utiliser le fait que l?addition :
-de la solution de nitrate d?argent (AgNO3) à une
solution contenant les ions chlorure Cl- donne un
précipité blanc de chlorure d?argent AgCl2 qui
noirci à la présence de la lumière.
- de la solution Hydroxyde de sodium à
une solution contenant les ions sulfate SO donne un précipité
Bleu d?hydroxyde de cuivre Cu(OH)2. Verser dans deux tubes
à essais quelques cm3 de (Cu2+,
SO42-) dans
A et d'eau minérale B ; ajouter quelques gouttes de
la Soude dans A et de nitrate d'argent dans B.
4. Observation
Apparition immédiate d?un précipité blanc
dans A de chlorure d?argent AgCl2 qui noirci à la présence de la
lumière ;
Apparition immédiate d?un précipité blanc
dans B
5. Equations bilan
Dans le flacon A : Ag+ + Cl- AgCl
Dans le flacon B : Cu2+ + 2OH- Cu(OH)2
6. Conclusion
Les hypothèses sont vérifiées, l?eau
minérale renferme bien des ions chlorure (Cl-) et le sulfate
de cuivre renferme bien les ions cuivre II Cu2+.
LYCEE CHAMINADE
Fiche d'évaluation des
apprenants
Nom : Prénom: Classe : Seconde
C
Sexe :
Questionnaire
Question 1 : cochez la bonne réponse
a) Un ion est un anion qui a gagné les
électrons
b) Un ion est un cation qui a perdu les électrons
c) Un ion est un atome ou une molécule qui a gagné
ou perdu les
électrons
Question 2 : cochez la bonne réponse
La solution de nitrate d?argent contient les ions :
a)
Ag+,NO3 -
b) Ag2+,2NO4 -
c) Ag, NO3 Question 3 : cochez la bonne
réponse
La solution de sulfate de cuivre contient les ions :
a)
Cu2+, SO42-
b) Cu3+,3SO4 -
c) Cu, SO4 Question 4 : répondez par vrai (V) ou
faux (F) les affirmations suivantes
L?addition de la solution de nitrate d?argent (Ag+,
NO3 -) à une solution contenant les ions chlorure (Cl-) :
a)
Donne un précipité blanc de
chlorure d?argent AgCl
b) Donne un précipité rose de
chlorure d?argent AgCl
c) Donne un précipité vert de
chlorure d?argent AgCl
Question 5 : répondez par vrai (V) ou faux (F) les
affirmations suivantes
L?addition de la solution d?hydroxyde de sodium Na+,
OH- à une solution contenant les ions cuivre II
Cu2+ :
a)
Donne un précipité Vert de
d?hydroxyde de cuivre Cu(OH)2
b) Donne un précipité Bleu de
d?hydroxyde de cuivre Cu
c) Donne un précipité blanc de
d?hydroxyde de cuivre Cu(OH)2
LISTE DES FIGURES
Figure 1 : résultats de l?évaluation diagnostique
dans la classe témoin ou théorique 36
Figure 2 :
résultats de l?évaluation sommative dans la classe témoin
ou
théorique 40
Figure 3 : comparaison des réponses
exactes avant et après
l?enseignement dans la classe témoin 42
Figure 4 : résultats de l?évaluation diagnostique
dans la classe 1 (la première classe expérimentale).
46
Figure 5 : résultats de l?évaluation diagnostique dans la
classe 2 (la
deuxième classe expérimentale). 50
Figure 6 :
Comparaison des réponses exactes avant le cours TP dans les
classes 1 et 2. 51
Figure 7 : résultats de
l?évaluation sommative dans la classe 1 (la
première classe expérimentale). 54
Figure 8 :
résultats de l?évaluation sommative dans la classe 2 (la
deuxième classe expérimentale). 57
Figure 9 :
Comparaison des réponses exactes après le cours TP dans les
classes 1 et 2. 58
Figure 10 : Comparaison des
réponses exactes de la classe témoin à
ceux des classes expérimentales après les
enseignements. 59
| 


