|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE
SCIENTIFIQUE
UNIVERSITE MENTOURI-CONSTANTINE
FACULTE DES SCIENCES EXACTES
DEPARTEMENT DE PHYSIQUE
N° d'ordre: Série :
MEMOIRE
Présenté pour obtenir le diplôme
de Magister en Physique
Spécialité : Sciences des
Matériaux
Option: Semi Conducteurs
THEME

Étude du Dopage des Couches Minces de
ZnO
Élaborées par Spray
Ultrasonique
Par:
HAFDALLAH Abdelkader
Soutenu le : / / 2007
Devant le jury:
|
Président :
|
M. S. AIDA
|
Prof.
|
Université Mentouri-Constantine
|
Rapporteur :
|
N. ATTAF
|
M. C.
|
Université Mentouri-Constantine
|
|
|
Examinateurs :
|
R. HALIMI
|
Prof.
|
Université Mentouri-Constantine
|
|
M. L. BENKHEDIR
|
M. C.
|
Centre Universitaire de Tebessa
|
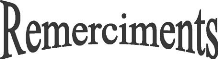
Le présent mémoire a été
réalisé au niveau du laboratoire des couches minces et interfaces
de la faculté des Sciences Exactes de l'Université
Mentouri-Constantine.
Cette étude a été effectuée
sous la direction de monsieur NADHIR ATTAF, Maître de
conférence au Département de Physique de la Faculté des
Sciences Exactes de l'Université Mentouri-Constantine, directeur de
thèse, qui m'a soutenu dans cette épreuve, il m'a surtout
encouragé à travers ses orientations, ses conseils et son
assistance dans l'élaboration du travail et l'appréciation des
résultats.
J'exprime ma profonde gratitude à Monsieur
M.S. AIDA, Professeur au Département de Physique de la
Faculté des Sciences Exactes de l'Université
Mentouri-Constantine, qui a dirigé ce travail efficacement. Ces quelques
lignes sont insuffisantes à exprimer ma reconnaissance pour la confiance
qu'il m'a témoigné, pour l'attention jamais relâchée
qu'il a porté mon travail et pour l'honneur qu'il me fait en acceptant
la présidence de ce jury.
Mes vifs remerciements à :
Monsieur R. HALIMI Professeur au
Département de Physique de l'Université Mentouri Constantine,
directeur de laboratoire des couches minces et interfaces, qui a bien voulu
accepter de faire partie du jury et d'examiner mon travail.
Monsieur M.L. BENKHEDIR Maître de
conférence au Département de Physique de Centre Universitaire de
Tebessa, qui a bien voulu accepter de faire partie du jury et d'examiner mon
travail.
Mes remerciements également à toute personne
ayant contribué de près ou de loin à la réalisation
de ce travail au niveau du laboratoire des Couches Minces et Interfaces
notamment : D. DERGHAM, M. KHECHBA, H. LEKIKET, W. DARANFED et
A. TOUIL.
Enfin, je tiens à exprimer ma gratitude à
toute l'équipe du Laboratoire des Couches Minces et Interfaces et
à mes amis des autres laboratoires, plus particulièrement :
F. HANINI et D. GUITOUM.
Dédicace
Je dédie le présent mémoire
:
?A ma mère et mon père pour
leurs
affections et amours,
?A mes soeurs et frères pour leurs
encouragements et leurs soutiens, ?A
Toute ma famille,
?A tous mes amis,
A tous ceux et celles que j'aime de
près
comme de loin.
|
Chapitre I
Couches minces d'oxyde de zinc
et Techniques de dépôts
|
Dans ce chapitre nous donnerons une description des diverses
méthodes de dépôt des couches minces et qui sera suivie
d'une étude bibliographique sur les oxydes transparents conducteurs
(TCO), dont l'oxyde de zinc (ZnO) fait partie.
I.1. Définition d'une couche mince:
Par principe, une couche mince d'un matériau
donné est un élément de ce matériau dont l'une des
dimensions qu'on appelle l'épaisseur a été fortement
réduite de telle sorte qu'elle s'exprime en Angstrom et que cette faible
distance entre les deux surfaces limites (cette quasi bidimensionnelle)
entraîne une perturbation de la majorité des
propriétés physiques [7]. La différence essentielle entre
le matériau à l'état massif et celui en couches minces est
liée au fait que dans l'état massif on néglige
généralement avec raison le rôle des limites dans les
propriétés, tandis que dans une couche mince ce sont au contraire
les effets liés aux surfaces limites qui sont
prépondérants. Il est assez évident que plus
l'épaisseur sera faible et plus cet effet de bidimensionnelle sera
important, et qu'inversement lorsque l'épaisseur d'une couche mince
dépassera un certain seuil l'effet d'épaisseur deviendra minime
et le matériau retrouvera les propriétés bien connues du
matériau massif.
L'intérêt des couches minces provient
essentiellement de l'utilisation économique des matériaux en
rapport avec les propriétés physiques et de la simplicité
des technologies mise en oeuvre pour leur réalisation. Une grande
variété de matériaux est utilisée pour produire ces
couches minces. Citons les métaux, alliages, composés
réfractaires (oxydes, nitrures, carbures), les composés
intermétalliques et les polymères.
La seconde caractéristique essentielle d'une couche
mince est que, quelle que soit la procédure employée pour sa
fabrication, une couche mince est toujours solidaire d'un support sur lequel
elle est construite (même s'il arrive parfois que l'on sépare le
film mince dudit support). En conséquence, il sera impératif de
tenir compte de ce fait majeur dans la conception, à savoir que le
support influence très fortement les propriétés
structurales de la couche qui y est déposée. Ainsi, une couche
mince d'un même matériau, de même épaisseur, pourra
avoir des propriétés physiques sensiblement différentes
selon qu'elle sera déposée sur un substrat isolant amorphe tel le
verre, ou un substrat monocristallin de silicium par exemple.
Il résulte de ces deux caractéristiques
essentielles d'une couche mince la conséquence suivante :
une couche mince est anisotrope par construction.
En pratique, on peut distinguer deux grandes familles de
méthodes d'élaboration de couches
minces, celles qui font
appel à un gaz porteur pour déplacer le matériau à
déposer d'un récipient
au substrat et qui s'apparentent aux
techniques de diffusion utilisées dans la fabrication des
composants actifs, et celles qui impliquent un environnement
à pression très réduite et dans lesquelles le
matériau à déposer sera véhiculé grâce
à une impulsion initiale de nature thermique ou mécanique.
I.2. Mécanisme de formation d'une couche
mince:
La formation d'une couche mince s'effectue par une combinaison de
processus de nucléation et de croissance. Les séquences de
croissance se décomposent comme suit [8]:
- Les espèces, au moment de l'impact
sur le substrat, perdent leur composante de vitesse de déplacement et
sont absorbées physiquement sur la surface du substrat.
- Initialement, les espèces absorbées ne sont
pas en équilibre thermodynamique avec le substrat, et se
déplacent donc sur sa surface. Pendant ces déplacements, et
lorsqu'elles arrivent dans des sites favorable elles; créant des amas
(clusters) qui iront en se développant.
- Ces amas, que l'on appelle Ilots ou noyaux, sont
thermo-dynamiquement instables et tendent naturellement à
désorber. Toutefois, si les paramètres de dépôt sont
tels que les Ilots entrent en collision les uns avec les autres, ils se
développent. Lorsqu'ils atteignent une certaine taille, les Ilots
deviennent thermo-dynamiquement stables. On dit que le seuil de
nucléation a été franchi. Cette étape, de formation
d'Ilots stables, chimisorbés, et d'une dimension suffisante, s'appelle
la nucléation.
- Les Ilots continuent à croItre en nombre et en
dimension jusqu'à ce qu'ilsatteignent une densité de
nucléation dite la saturation. Cette densité de nucléation
et la dimension moyenne des Ilots dépendent de plusieurs
paramètres tels que l'énergie des espèces incidentes, leur
quantité par unité de temps et de surface, les énergies
d'activation, d'absorption, de désorption, la diffusion thermique, la
température, la topologie et la nature chimique du substrat. Un Ilot
peut croItre parallèlement à la surface du substrat par diffusion
superficielle des espèces absorbées ou perpendiculaire par impact
direct des espèces incidentes sur l'Ilot. En général, la
vitesse de croissance latérale est bien plus grande que la vitesse de
croissance perpendiculaire.
- L'étape suivante dans le processus de formation de la
couche mince s'appelle la coalescence. Les Ilots commencent à
s'agglomérer les uns aux autres en réduisant la surface du
substrat non recouverte. La coalescence peut être
accélérée en augmentant la mobilité de surface des
espèces adsorbées, par exemple en augmentant la
température du substrat. On peut, pendent cette étape, observer
la formation de nouveaux Ilots sur des surfaces libérées par le
rapprochement d'Ilot plus anciens.
- Les Ilots deviennent des Iles qui continuent à
croItre, ne laissant que des trous ou des canaux de
faibles dimensions entre
elles. Dans cette étape, la structure de la couche passe du type
discontinu au type poreux. Peu à peu, une couche continue
se forme lorsque les trous et les canaux se remplissent.
- On peut donc résumer le processus de croissance d'une
couche mince en disant que c'est une suite statistique de nucléation,
puis une croissance par diffusion de surface et formation d'Ilots, puis une
formation d'Iles de plus grandes dimensions, et enfin la formation d'une couche
continue par remplissage de espèces entre ces Iles. Selon les
paramètres thermodynamiques du dépôts et de la surface du
substrat, les étapes de nucléation et de croissance d'Ilots
peuvent être décrites comme étant :
· Du type Iles (appelé Volmer-Weber).
· Du type couche (appelé Frank-van der Merwe).
· Du type mixte (appelé Stranski-Krastanov).
La figure I.1, présente les trois types de formation
d'une couche mince. En fait, dans la quasi-totalité des cas pratiques,
la croissance de la couche se fait par formation d'Ilots, puis d'Iles, puis
d'une surface continue. Sauf dans les cas de conditions spéciales de
dépôts (température du substrat, nature et énergie
des espèces incidentes, nature chimique du substrat,
caractéristiques du gaz ambiant,...), les orientations
cristallographiques et les détails topographiques des îlots sont
distribués d'une façon aléatoire. Ceci signifie que,
lorsque ces Ilots vont se rencontrer au cours du processus de croissance, des
joints de grains et des défauts et dislocations diverses vont être
inclus dans la couche à la suite des désaccords de configuration
géométrique et d'orientation cristallographique [9].
FigureI.1 : les trois modes de
croissance d'une couche mince [10].
Si les grains sont orientés d'une manière
aléatoire, les couches seront dites polycristallines. Toutefois, si la
dimension des grains est très faible (de l'ordre de 20°A), les
couches auront des structures amorphes (non cristallines). Il est à
noter que, même si l'orientation des différents îlots est la
même sur l'ensemble de la surface du substrat et que ce dernier soit un
monocristal, on n'obtiendra pas une couche monocristalline. Dans ce cas, la
couche sera formée de grains monocristallins orientés
parallèlement les uns par rapport aux autres et reliés par des
joints de grains à faible angle. Ces couches sont appelées
épitaxiales/ monocristallines.
D'autres causes pouvant engendrer des défauts dans les
couches minces telles que [11]
v' Une grande différence entre les paramètres de
maille de la couche et ceux du substrat. v' La présence de contraintes
importantes dans la couche.
v' La prolongation dans la couche de dislocations
présentes à la surface du substrat.
Après qu'une couche continue se soit formée, la
croissance anisotropique s'effectue perpendiculairement à la surface du
substrat sous forme de colonnes cylindriques. Le diamètre de ces
colonnes est principalement déterminé par la densité
initiale de nucléation. Toutefois, s'il se produit des
recristallisations pendant la phase de coalescence, la quantité moyenne
de grains par unité de surface de la couche sera inférieure
à la densité initiale de nucléation. Pour des couches
d'épaisseur inférieure à un micron, la dimension
perpendiculaire à la surface des grains sera pratiquement égale
à l'épaisseur de la couche. Pour des couches plus
épaisses, une nucléation se produit à la surface des
grains et chaque colonne verticale va croître d'une manière
multigranulaire, avec des déviations possibles de la croissance
perpendiculaire.
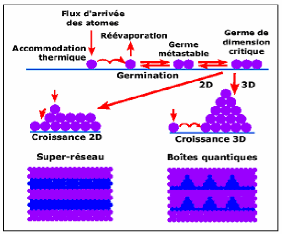
I.3. Procédure de dépôt des couches
minces:
Tous les procédés de déposition de
couches minces contiennent quatre (parfois cinq) étapes successives,
comme le montre la Figure I.2. La source qui constitue le
matériau de base du film mince à élaborer peut être
un solide, un liquide, une vapeur ou un gaz. Lorsque le matériau est
solide son transport vers le substrat s'effectue par vaporisation. Ce qui peut
être réalisé par évaporation thermique, canon
à électrons, ablation laser ou par des ions positifs
"pulvérisation". L'ensemble de ces méthodes est classé
sous le nom de dépôt physique en phase vapeur PVD " physical vapor
deposition". La source solide est occasionnellement transformée en
vapeur par voie chimique. Dans d'autre cas, le matériau de base est sous
forme d'un gaz ou d'un liquide ayant une pression de vapeur suffisante pour
qu'il soit transporté à des températures
modérées. Les procédés qui utilisent, comme
matériau de base, les gaz, les liquides évaporés ou
solides évaporés par voie chimique sont connues sous le nom de
dépôts chimiques en phase vapeur, i.e. CVD " Chemical vapor
déposition "[11].
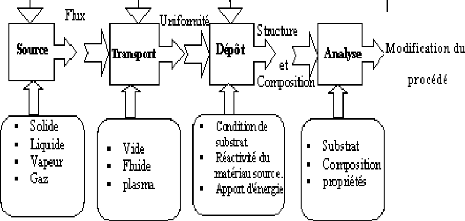
Figure I.2 : Diagramme des
étapes du procédé de fabrication de couches minces
[12].
Dans l'étape de transport,
l'uniformité du flux des espèces qui arrivent sur la surface du
substrat est un élément important, plusieurs facteurs peuvent
affecter cette uniformité et dépendent du milieu dans lequel
s'effectue le transport, un vide poussé ou un fluide "principalement des
gaz ". Dans le cas d'un vide poussé, les molécules, provenant de
la source et allant vers le substrat, traversent le milieu selon des lignes
droites, tandis que dans un milieu fluide elles subissent plusieurs collisions
au cours de leurs transports. En conséquence, dans le vide,
l'uniformité du flux qui arrive sur le substrat est
déterminée par la géométrie, tandis que dans un
fluide il est déterminé par le débit du gaz et par la
diffusion des molécules de la source dans les autres gaz
présents. Souvent, les procédés qui utilisent un vide
poussé sont équivalents aux procédés PVD alors que
ceux qui utilisent un débit fluide sont des procédés CVD.
Cette définition n'est pas toujours confirmée. Il existe
plusieurs procédés de dépôt physique en phase vapeur
qui opèrent dans un vide poussé, d'autres, comme l'ablation laser
et la pulvérisation opèrent souvent à des grandes
pressions caractéristiques du fluide. De la même manière on
trouve que la majorité des procédés de dépôts
par CVD opèrent à des pressions modérées,
l'épitaxie à transmission chimique " chemical beam epitaxy",
quant elle, opère dans un vide.
Dans cette phase, plusieurs procédés de
dépôt de couches minces utilisent un milieu plasma. En effet, la
grande quantité d'énergie contenue dans ce milieu permet,
à faible température,
l'activation de la formation des couches. La pression de
travail d'un plasma peut être celle d'un fluide ou celle d'un vide
poussé.
La troisième étape dans les
procédés d'élaboration des films minces est le
dépôt du film sur la surface du substrat. Cette phase
passe par les étapes de nucléation et de coalescence comme il est
décrit dans le paragraphe précédent (c.f paragrapheI.1).
Le comportement de déposition est déterminé par les
facteurs source, transport et aussi par les trois principales conditions de la
surface du substrat. Ces dernières sont l'état de surface
"Rugosité, niveau de contamination, potentiel chimique avec le
matériau qui arrive", la réactivité du
matériau arrivant sur cette surface " Coefficient de collage" et
l'énergie déposée sur la surface " Température de
substrat, Photons, Ions positifs".
La dernière étape dans le processus de
fabrication est la nécessité de l'analyse du film
obtenu. Le premier niveau de contrôle du matériau consiste
à effectuer des mesures directes de ses propriétés
importantes. Si les résultats de l'analyse sont insuffisants, il est
indispensable de recourir à des expériences particulières
qui permettent de lever les éventuelles ambiguïtés d'un
processus donné.
I.4. Quelques méthodes de dépôt de
couches minces de ZnO :
Les couches minces d'oxyde de zinc sont
réalisées en utilisant une grande variété de
techniques. Elles peuvent être obtenues en opérant en phase
liquide ou en phase vapeur, et par des procédés physiques ou
chimiques.
Par voie liquide, les techniques les plus fréquentes
sont : le dépôt chimique en solution [13],
l'électro-dépôt par synthèse électrochimique
[14], la voie sol-gel [15]. Par voie vapeur, on distingue les méthodes
physiques « PVD » et les méthodes chimiques « CVD
».
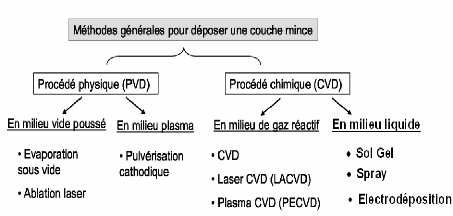
Figure I.3: Présentation des
principaux procédés de dépôt de couches minces
[16].
Dans le cadre de ce mémoire, nous présenterons
d'abord quelquestechniques utilisant la voie vapeur tout en réservant un
développement plus approfondi à la méthode par spray
pyrolytique, technique qui a été choisie pour ce travail.
I.4.1. Dépôts chimiques en phase vapeur
:
Les méthodes par CVD permettent de réaliser des
dépôts à partir de précurseurs gazeux qui
réagissent chimiquement pour former un film solide déposé
sur un substrat. Les méthodes de synthèse les plus
utilisées sont :
- Le dépôt par décomposition de
composés organométalliques (MOCVD) soit à pression
atmosphérique [17] ou à basse pression [18] ;
- Le dépôt par pyrolyse d'aérosol,
appelée aussi <<spray pyrolysis » à partir de
solutions aqueuses ou alcooliques d'un sel de zinc; cette technique est
très employée surtout pour les oxydes car les dépôts
sont élaborés sous atmosphère normale [19,20] ;
- Le dépôt par couche atomique (ALD) [21] ou
epitaxiée (ALE) [22] et la photo-ALE [23] ;
- Le dépôt chimique en phase vapeur
assisté par plasma (PECVD) [24], la photo-CVD [25], et récemment
le dépôt électrophorèse pour les films <<
nanofils » de ZnO [26].
Les principaux avantages de ces techniques sont de permettre
la cristallisation de films sans avoir recours à un recuit, de pouvoir
contrôler la composition durant le dépôt, de réaliser
un dépôt d'épaisseur et de composition uniformes
possédant en plus une excellente adhérence.
Cependant ces techniques ont l'inconvénient de donner
des films contaminés par les résidus des précurseurs et
d'avoir une température de réaction souvent
élevée.
I.4.2. Dépôts physiques en phase vapeur
:
Les procédés par PVD regroupent principalement
l'évaporation, l'ablation laser et la pulvérisation sous toutes
ses formes. Dans la réalisation d'une couche on peut distinguer les
trois étapes suivantes :
- La création de la ou des espèces à
déposer, sous forme d'atomes, de molécules ou de clusters
(groupes d'atomes ou de molécules),
- Le transport de ces espèces en phase vapeur de la
source vers le substrat,
- Le dépôt sur le substrat et la croissance de
la couche.
I.4.2.1.La pulvérisation cathodique :
Dans cette méthode, le substrat est mis dans une
enceinte contenant un gaz (en général de l'Argon) à basse
pression, dans lequel on provoque une décharge électrique. Cette
décharge a pour rôle d'ioniser les atomes de gaz. Les ions ainsi
obtenus sont accélérés par une différence de
potentiel et viennent bombarder une cathode constituée du
matériau à déposer (cible) [27,28]. Sous l'impact des ions
accélérés, des atomes sont arrachés à la
cathode et sont déposés sur le substrat. Dans certains cas, on
introduit dans l'enceinte en plus de l'argon un gaz qui va réagir
chimiquement avec les atomes pulvérisés pour former le
matériau que l'on désire obtenir. Alors, on a une
pulvérisation cathodique réactive. Cette méthode permet
d'avoir des dépôts de faible résistivité et des
couches de bonne stoechiométrie ayant une transmission moyenne dans le
visible [29].
L'avantage de la méthode de pulvérisation
cathodique est de pouvoir réaliser des dépôts sous
atmosphères contrôlées. Cependant, le coût trop
élevé de l'installation, associé à un faible taux
de production fait de la pulvérisation cathodique une technique
réservée à des applications spécifiques
réduites.
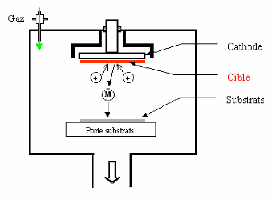
Figure.I.4: Schéma
conventionnel d'un pulvérisateur cathodique [30].
I.4.2.2. Ablation laser:
L'ablation laser (PLDPulsed Laser Deposition)
consiste à focaliser un faisceau laser sur un matériau dans le
but de le vaporiser puis de condenser les particules ionisées sur un
substrat chauffé ou non. Il est à noter que les particules
ionisées ont une haute énergie cinétique (quelques
dizaines d'électronvolts).
Le dépôt de couches minces de ZnO par PLD a
l'avantage de pouvoir utiliser des pressions d'oxygène
élevées et celui de réaliser des films cristallins de
haute qualité avec une vitesse de croissance élevée
même à basse température [28]. La microstructure, la
cristallinité, l'orientation et les propriétés optiques
des couches de ZnO sont d'autant meilleures que la pression d'oxygène
est importante. L'élévation de pression peut réduire les
défauts tels que les lacunes d'oxygène [29]. Dans ce contexte
Tomasini et al [30] ont montré que la conductivité et la
transmission optique croissent avec la pression partielle d'oxygène.Ils
ont expliqué ceci par l'augmentation de la réactivité de
l'oxygène moléculaire incorporé dans les couches de ZnO.
L'amélioration de la qualité des dépôts par cette
technique est due à la diminution des défauts et à
l'augmentation de la taille des grains [31].
L'ablation laser a toutefois des limitations dues au manque
de fiabilité des lasers, et de son coût élevé. Ceci
profite à d'autres techniques plus aisées d'utilisation telle que
la pulvérisation cathodique.

Figure .I.5 : Schéma
conventionnel d'un système d'ablation laser.
I.4.2.3. L'évaporation sous vide:
L'évaporation d'un matériau à
déposer est obtenueen le chauffant par l'un des différents moyens
: effet Joule, induction (couplage d'un générateur haute
fréquence), canon à électrons, faisceau laser ou arc
électrique. Dans le but d'augmentation la vitesse du film mince,
l'évaporation est effectuée sous un vide poussé (pression
de l'ordre de 10-3 à 10-4 Pa) [31].
Lorsque la pression n'est pas suffisamment basse les
dépôts sont peu adhérents et souvent amorphes. Comme le
flux de vapeur est localisé et directionnel, il est souvent
nécessaire de donner au substrat un mouvement de rotation ou de
translation par rapport à la source d'évaporation, de
manière à réaliser un dépôt homogène
et d'épaisseur uniforme. Les meilleurs résultats sont obtenus sur
des surfaces pratiquement perpendiculaires au flux de vapeur [32].
D'une manière générale, les principaux
problèmes rencontrés lors d'une évaporation sont:
· la dissociation des oxydes.
· la réaction des matériaux à
évaporer avec ceux avec lesquels ils sont en contact.
· les dégazages, la décomposition, les
micro-explosions des matériaux à évaporer.
· la difficulté d'obtenir des couches d'alliages
ayant la même composition que l'alliage de départ.
L'évaporation reste, toute fois, une méthode
particulièrement appréciée car on élabore ainsi des
matériaux très purs et d'autant plus purs que la pression est
faible, ce qui est le cas pour le procédé d'épitaxie par
jets moléculaires [33,34]. Cependant, elle ne convient pas à la
fabrication de films hors équilibre thermodynamique. La
littérature montre que ce procédé est aussi bien
adapté à l'élaboration des couches ZnO. En
effet différentes couches minces de ZnO dopé ou non, ont
été préparées avec succès par
évaporation sous vide [35,36].

Figure.I.6: Schema conventionnel
d'une évaporation thermique.
I.4.2.4. Spray ultrasonique :
I.4.2.4.1. Principe général du
procédé spray:
Une solution de différents composés
réactifs est vaporisée puis projetée, à l'aide d'un
atomiseur, sur un substrat chauffé. La température du substrat
permet l'activation de la réaction chimique entre les composés
[37]. L'expérience peut être réalisée à l'air
[38], et peut être préparée dans une enceinte (ou bien dans
une chambre de réaction) sous un vide, environ, de 50 Torr
[39].
La description de la formation des films par la méthode
Spray pyrolyse peut être résumée comme suit:
(1) Formation des gouttelettes à la sortie du bec.
(2) Décomposition de la solution des précurseurs
sur la surface du substrat chauffé par réaction de pyrolyse.
a- Solutions de départ (source):
La composition de la solution finale est
déterminée par les corps ou les réactifs dissous dans le
dissolvant (solution de départ) selon le rapport stoechiométrique
prédéterminé. Comme précurseurs, on emploi des
matériaux, habituellement peu coûteux, tels que les nitrates, les
chlorures et les acétates qui sont rangés dans la
catégorie des réactives [40].
L'eau distillée ou l'alcool est souvent employé
comme dissolvant.Dans la solution de base il est nécessaire
d'éliminer les problèmes de solubilité et de
ségrégation de phase, où les
différents composants se précipitent à
des temps différents. Pour pallier à cela et obtenir des
solutions homogènes, nous préconisons d'ajouter, pendant la
préparation, une petite quantité d'acide (par exemple, nitrique)
[41-42]. La concentration globale de la solution peut être variée
de 0.01 à quelque mole /litre. Notons que ce
paramètre a pour effet de changer la taille moyenne des particules
fluides éjectées [40].
D'après la littérature, quelques techniques
incluent le préchauffage de la solution.
Ce préchauffage peut, quelque fois, être utile et
favorise ou accélère la réaction sur le substrat. Ceci
permet d'accroître la vitesse de dépôt et d'améliorer
la qualité des films résultants [39].
b-Génération des gouttelettes
(transport):
L'homogénéité du matériau
déposé peut être déterminée à partir
de la taille des gouttelettes pulvérisées et de la concentration
de la solution tandis que sa morphologie peut être également
déterminée par la concentration et la vitesse des gouttelettes
produite par les atomiseurs [37-40].
Concernant l'atomiseur, dispositif de la production des
gouttelettes et leurs dispersion dans l'air, plusieurs méthodes
d'atomisation ont été employées dans les études de
spray pyrolyse, par exemples : pneumatique (l'air est le gaz vecteur) [21,27],
ultrasonique [42], par gravitation [39], etc.
Dans le dispositif de dépôt, la solution de base
peut être véhiculée jusqu'au substrat sous l'effet de la
compression d'un gaz. La conduite de gaz a deux avantages, d'une part,
l'écoulement peut être commandé avec beaucoup de
sensibilité et d'autre part, les gazutilisés peuvent,
également, être employés en tant qu'éléments
réactifs entrant dans la composition du matériau à
déposer, tel que O2 pour ZnO. Cependant, pour la plupart des
semi-conducteurs composés, de l'azote N2 ou un gaz inerte est
employé pour éviter les réactions chimiques, entre les
matériaux composés et /ou le dissolvant, qui mèneraient
à l'addition des impuretés. Dans certains cas, afin
d'empêcher l'oxydation des matériaux, un mélange binaire de
N2 et H2 est employé en tant que gaz porteur [41].
C- Réaction chimique sur le substrat
(dépôt) :
Quand les gouttelettes d'aérosol s'approchent de la
surface du substrat chauffé (200- 600°C), dans les
conditions expérimentales appropriées, la vapeur formée
autour de la gouttelette empêche le contact direct entre la phase liquide
et la surface du substrat. Cette évaporation des gouttelettes permet un
renouvellement continu de la vapeur, donc les gouttelettes subissent la
décomposition thermique et donnent la formation de films fortement
adhérents [43].
On note que la réaction de décomposition, en
phase gazeuse, se produisant sur la surface du substrat est une réaction
endothermique qui exige des températures de substrat relativement
élevées pour provoquer décomposition des gouttelettes, et
donnent la croissance de la couche.
I.4.3.4.2.Principe du procédé Spray
ultrasonique :
Une solution contenant les différents constituants du
composé est pulvérisée, en fines gouttes par un
générateur à ultrasons de 40 KHz. Il permet la
transformation de la solution au niveau du nozzle en un jet de gouttelettes
très fines de 40ìm de diamètre. Le jet arrive sur
la surface des substrats qui sont chauffé, à une
température, comprise entre 250 et 400°C, qui
permet l'activation de la réaction chimique. A ces températures,
certains produits de la réaction seront immédiatement
éliminés (des éléments volatiles), il ne reste que
le composé à former (Oxyde de Zinc) qui se dépose sur le
substrat.
I.4.2.4.3. Sol-gel:
Le procédé sol-gel est l'une des voies chimiques
de préparation des matériaux de type oxyde métallique tels
que les céramiques et les verres. Il consiste tout d'abord en la mise au
point d'une suspension stable (SOL) à partir de précurseurs
chimiques en solution. Ces " sols " vont évoluer au cours de
l'étape de gélification par suite d'interactions entre les
espèces en suspension et le solvant, pour donner naissance à un
réseau solide tridimensionnel expansé au travers du milieu
liquide. Le système est alors dans l'état " GEL ". Ces gels dits
" humides " sont ensuite transformés en matière sèche
amorphe par évacuation des solvants (on obtient alors un aérogel)
ou par simple évaporation sous pression atmosphérique
(xérogel). Le dépôt proprement dit peut être
réalisé de deux manières différentes :
· le " spin-coating" ou centrifugation (figure I.7) :
consiste à verser le sol ou le gel sur un substrat mis en rotation par
une tournette. Le liquide en excès est éjecté sous
l'action de la force centrifuge, et l'épaisseur du dépôt
est alors fonction de la vitesse de rotation du substrat et du temps de
dépôt [44].
· le " dip-coating " ou trempé :
procédé moins utilisé, il consiste à tremper le
substrat dans la solution à déposer et à le retirer
ensuite avec une vitesse constante qui conditionne l'épaisseur
du dépôt [45].
Le dépôt est ensuite séché puis
recuit pour obtenir une cristallisation.

Figure I.7 : Dispositif
expérimental de dépôt par spin
coating.
Le choix d'une technique particulière de
dépôt de couches minces dépend de plusieurs facteurs [38]
.Nous citons le matériau à déposer, la vitesse de
dépôt désirée, les limites imposées par le
substrat, telle que la températures maximum de dépôt,
l'adhérence du dépôt sur le substrat, le dépôt
sur des substrats complexes ou non, la pureté du matériau
envisagé pour la solution idéale et pour une solution de
remplacement, les considérations écologiques et la
facilité d'approvisionnement du matériau à déposer,
dans le présent et le future.
1.5. Les oxydes transparents conducteurs (TCO)
:
Il existe une famille d'oxydes qui, en plus d'être
transparents, peuvent devenir conducteurs (de type n) s'ils possèdent un
excès d'électrons dans leur réseau. Cet excès
d'électrons peut être créé soit par des
défauts de structure induisant un déséquilibre dans la
stoechiométrie de l'oxyde, soit par un dopage approprié [46]. On
appelle ces oxydes des oxydes transparents conducteurs (TCO) (transparent
conductive oxide). Ces TCO possèdent un gap élevé et
sont en fait des semiconducteurs dégénérés,
c'est-à dire que leur niveau de Fermi se situe tout proche de la bande
de conduction (BC), voire même à l'intérieur de cette
bande, pour les TCO fortement dopés. Cela signifie que la BC est
déjà bien remplie d'électrons à température
ambiante, rendant ainsi les TCO conducteurs. De plus, le gap
élevé des TCO (~ 3-4 eV) les empêche d'absorber les photons
ayant une énergie inférieure à ce du gap, et donc les rend
transparents à la lumière visible.
Les principaux TCO utilisés en tant
qu'électrodes transparentes pour les cellules solaires ont
été pendant longtemps le SnO2 et l'ITO. Depuis les années
80, un troisième TCO est de plus en plus utilisé pour ces
applications, c'est l'oxyde de zinc (ZnO) [36]. Ce dernier TCO constitue le
point central de ce travail de thèse.
1.6. L'oxyde de zinc (ZnO):
1.6.1 Le choix du ZnO :
Le principal avantage du ZnO est le fait que ses composants
sont non toxiques (contrairement, par exemple, à l'indium dans l'ITO),
et très abondants sur Terre. C'est un atout indéniable car il
permet de réduire les coûts de production. De plus, le ZnO,
lorsqu'il est exposé à un plasma d'hydrogène, est beaucoup
plus stable que le SnO2 et l'ITO, dont la transmission optique est
dégradée par ce plasma [47]. Comme les couches de silicium sont,
dans beaucoup de cas, déposées sur la couche de TCO, celle-ci est
donc obligatoirement exposée à ce genre de plasma.
I.6.2. Intérêt technologique de ZnO
:
L'oxyde de zinc présente un ensemble de
propriétés physiques susceptibles de recevoir des applications
dans le domaine de l'électronique et de l'optoélectronique. La
mise en oeuvre de technologies de fabrication de couches minces de ZnO a
conduit à de nombreuses applications dans des domaines très
divers. Nous citerons, sans prétendre être exhaustif, le domaine
des composants électroniques, celui des transducteurs pour capteurs,
l'optique, la décoration et la protection des surfaces. Selon le type
d'application les procédés de fabrication sont plus ou moins
complexes mais ils relèvent tous des procédés
décrits précédemment.
1.6.3. Le choix du procède de dépôt
:
Jusqu'à aujourd'hui, l'élaboration des couches
de ZnO utilisées en tant que TCO pour les cellules solaires ont
été principalement déposées par les méthodes
de pulvérisation cathodique d'une cible solide où par une
décharge dans un gaz, ce qui nécessite des moyens
matériels énormes. Pour cette raison, la méthode de
dépôts par projection-pyrolyse dite spray pyrolyse où
pulvérisation pneumatique [48] où pulvérisation chimique
réactive en phase liquide [49] de précurseurs dissous dans l'eau
se présente comme une alternative ayant les avantages suivants:
-Mise au point relativement simple et réalisable en
Algérie.
-Banc de dépôt non encombrant, non dangereux et
surtout à bas prix.
-Donne des résultats satisfaisants.
Toutes ces considérations nous ont amenés à
opter pour cette technique comme moyen d'élaboration des couches minces
au niveau de l'Université de constantine. Notre travail de recherche
consiste, en première étape, à réaliser le banc de
dépôt et effectuer des essais de déposition des couches. La
deuxième étape sert à l'optimisation des conditions et des
paramètres
de dépositions qui seront justifient par
l'étudede leurs effets sur la qualité des couches de ZnO ainsi
obtenues.
I.7. Applications de l'oxyde de zinc:
I.7.1 - Utilisation de poudres de ZnO :
L'industrie du caoutchouc est la plus grosse consommatrice
d'oxyde de zinc, avec 57% du marché. Une faible quantité
ajoutée, 3 à 5%, permet d'activer le processus de vulcanisation.
Une plus grande quantité, 20 à 30%, améliore la
conductibilité thermique, la résistance à l'usure, et
ralentit le vieillissement du caoutchouc. L'industrie de la peinture l'utilise
également beaucoup car il permet d'obtenir un grand pouvoir couvrant,
une meilleure rétention de la couleur, une durabilité plus grande
et une protection contre les rayons ultraviolets, du fait de sa capacité
à absorber ces rayonnements. Il entre également dans l'industrie
des céramiques, en participant à la fabrication du verre, de la
porcelaine et des frittés, car il permet de diminuer le coefficient de
dilatation et d'améliorer la stabilité en tension [49]. Il peut
servir aussi pour la fabrication de varistances car, en présence de
petites quantités d'oxydes métalliques (bismuth,
praséodyme), l'oxyde de zinc présent d'excellentes
propriétés de non linéarité électrique. Ceci
permet de l'utiliser largement dans la protection de dispositifs
électroniques et notamment dans les stations électriques à
haute tension [50].
Enfin, ce composé a d'autres atouts tels que sa non
toxicité et un faible coût d'utilisation. I.7.2 - Utilisation
de ZnO en couche mince:
Grâce à ses propriétés
semi-conductrices, piézo-électriques, optiques et catalytiques
[51], l'oxyde de zinc en couches minces a de multiples applications. Il occupe
une place importante dans l'industrie électronique. En raison de leurs
propriétés piézo-électriques, des films de ZnO
peuvent être utilisés comme détecteurs mécaniques
[52], ou dans des dispositifs électroniques tels que les redresseurs,
les filtres, les résonateurs pour les communications radio et dans les
traitements d'image [53]. En particulier, avec le développement des
télécommunications, des investigations ont été
récemment faites pour leur utilisation dans des dispositifs à
onde acoustique de surface; ceci est dû à leur coefficient de
couplage électromécanique élevé [54]. Des couches
minces d'oxyde de zinc peuvent servir également de capteurs chimiques
très sensibles dans des détecteurs de gaz, oxydés ou
réduits [55]. [56] montre que des couches minces de ZnO, dopées
à l'aluminium, présentent une très grande
sensibilité et une excellente sélectivité pour des gaz
aminés de type diméthylamine et triéthylamine.
Les propriétés optiques de l'oxyde de zinc sont
exploitées dans des capteurs intégrés de guides
d'ondes
optiques. Il peut servir aussi d'électrode transparente dans des
dispositifs
optoélectroniques (diodes émettant de la
lumière), dans des cellules solaires et des photopiles [57,58].
D'autres travaux indiquent que les couches minces de ZnO
présentent des propriétés électrochromes [59]
utiles pour la fabrication des fenêtres intelligentes qui modulent la
transmission de la lumière en fonction du rayonnement incident. [60] ont
montré la possibilité d'obtenir une émission optique laser
avec des couches minces de ZnO réalisées par jets
moléculaires assistés par plasma et de les appliquer dans les
dispositifs photoniques. Récemment, une méthode
d'électrodéposition des ions a été
développée pour les applications dans les dispositifs
photovoltaïques [61].
Des revêtements d'oxyde de zinc peuvent être
déposés sur des polymères et permettent ainsi d'augmenter
leur durabilité. Les travaux réalisés par le laboratoire
des materiaux inorganique (Université Blase Pascal) montrent la grande
efficacité des couches minces de ZnO déposées par
pulvérisation cathodique pour protéger le poly
(éthylène-téréphtalate) (PET) [62] ou le
poly(éther éther cétone) (PEEK) [63] contre la
photodégradation.
Le polycarbonate utilisé pour le vitrage plastique des
automobiles peut aussi être protégé par des couches minces
de ZnO déposées par PECVD [64]. D'autres polymères, comme
le polyester [65] et le poly (éthylène-naphthalate) (PEN) [66],
revêtus de ZnO par pulvérisation cathodique magnétron
peuvent être utilisés dans l'affichage des dispositifs
électroniques comme les ordinateurs portables et les
téléphones cellulaires.
Après avoir montré les nombreuses applications de
l'oxyde de zinc, nous allons maintenant décrire les diverses
propriétés de cet oxyde.
I.7.3. Les principaux avantages de ZnO :
Les avantages principaux de ZnO sont les suivants :
> Effet piézoélectrique élevé
(e33 = 1.2 C/m2. parmi le plus haut de tous les semiconducteurs).
> Conductivité thermique élevée de 0.54
Wcm-1K-1 (comparés a 0.5 pour la GaAs).
> La plus grande énergie de liaison d'excitons des
semiconducteurs 60 meV (émission légère stimulée
excitonique jusqu'à 550K).
> La mobilité de dérive sature à des
champs plus élevés que ceux de GaN (attrayant pour les
dispositifs à haute fréquence).
> Détecteurs UV avec une réponse spectrale
maximale à 350nm.
> Module de cisaillement très grand ~ 45.5 Gpa (indique
la stabilité de cristal), par exemples : 18.35 pour ZnSe, 32.60 pour la
GaAs, 51.37 pour le silicium.
I.8. Synthèse bibliographique des
propriétés de ZnO : I.8.1. Propriétés
cristallographiques :
I.8.1.1. Structure cristalline :
Les semi-conducteurs II-VI excepté CdO cristallisent soit
dans la structure sphalerite (CFC) soit dans la structure wurtzite
(hexagonale).
L'oxyde de zinc peut exister dans la nature sous forme de
poudre ou de cristal massif. Il se présente sous forme de minéral
[5]. Le tableau (II.1) illustre quelques propriétés
générales de ZnO.
Tableau I.1: Quelques
propriétés générales de ZnO.
Densité (g/cm3)
|
5.6
|
Point de fusion (°C)
|
1975
|
Enthalpie de formation (k cal/mole)
|
83.17
|
Solubilité dans H2O à 29°C (g/100ml)
|
0.00016
|
|
Du point de vue cristallographique le ZnO peut exister selon
les conditions d'élaboration, sous trois types de structures
différentes. La première est la structure hexagonale stable dans
les conditions normales, la seconde est la structure cubique, qui est instable
et qui apparaît sous des pressions élevées [14],
la troisième c'est la structure Rock -Salt qui apparaît
sous des pressions très élevées c'est pour ces raisons
qu'on va s'intéresser aux deux premières structures seulement,
car elles possèdent des énergies de formation très
voisines. Le tableau (II.2) illustre la différence entre ces deux
structures.
Tableau I.2:Comparaison entre les
propriétés des deux structures de ZnO.
|
Structure wurtzite
|
Structure cubique
|
Paramètre de réseau (A)
|
a=3.24
c=5.20
|
a= 4.28
|
Coordination (Z)
|
2
|
4
|
Densité (g/cm3)
|
5.6
|
6.9
|
Groupe spatial
|
P63mc
|
Fm3m
|
Condition d'apparition (kbar)
|
Pression atmosphérique
|
Haute pression p~100
|
|
ZnO cristallise selon la structure la plus stable;
c'est-à-dire la structure wurtzite; dans laquelle les ions
d'oxygène sont disposés suivant un réseau de type
hexagonal compact [15,16], et ou les atomes de zinc occupent la moitié
des positions interstitielles tétraédriques ayant le même
arrangement que les ions d'oxygène (figure I.9). En fait l'environnement
de chaque ion n'est pas une symétrie exactement
tétraédrique.
Le phénomène de la
piézoélectricité du ZnO apparaît lorsque la distance
entre les proches voisins dans la direction C est plus petite que pour les
autres voisins.

Figure .I.8 :
Représentation les structures de ZnO : (a) cubique
rocksalt, (b) cubique zinc
blendeet (c) hexagonal wurtzite.

Figure I.9: La structure
cristallographique du ZnO (wurzite) [11].
Chaque atome de zinc est entouré par quatre atomes
d'oxygène situés aux sommets d'un tétraèdre. En
fait, l'atome de zinc n'est pas exactement au centre du tétraèdre
mais déplacé de 0,11 A dans une direction parallèle
à l'axe c. Les molécules d'oxyde maintiennent donc, dans une
certaine mesure, leur individualité, contrairement à ce que l'on
attendrait d'un cristal purement ionique. Ce phénomène est
dû à l'homopolaritédes liaisons Zn -O [19].
D'après les valeurs des rayons ioniques du cation et
de l'anion, indiquées dans le tableau II.3, on peut se rendre compte que
la structure est relativement ouverte. En effet, les atomes de zinc et
d'oxygène n'occupent que 40 % du volume du cristal [19], laissant des
espaces vides de rayon 0,95 A. Il est possible que, dans certaines conditions,
des atomes de zinc en excès puissent se loger dans ces espaces
c'est-à-dire en position interstitielle. Cette caractéristique
permet d'expliquer certaines propriétés particulières de
l'oxyde, liées aux phénomènes de semiconductivité,
de photoconductivité, de luminescence, ainsi que les
propriétés catalytiques et chimiques du solide [20].
Tableau I.3: Rayons atomiques et ioniques des
atomes de zinc et d'oxygène dans ZnO.
Liaison covalente
|
Zn neutre : 1,31 A
|
O neutre : 0,66 A
|
Liaison ionique
|
Zn2+ : 0,70 A
Zn2+ : 0,78
A
Zn2+ : 0,60 A
|
O2- : 1,32 A (Pauling) [21] O2- : 1,24 A
(Goldsmith) [22] O2- : 1,38 A (Shannon) [23]
|
|
On dit que la formule de coordinence est : L'empilement de la
structure wurtzite est AaBbA de plans Zn et O successivement. La maille
élémentaire est de type prismatique, constituée de:
· deux atomes de Zn occupant les sites :(0, 0, 0) et (1/3,
2/3, 1/2)
. deux atomes de O occupant les sites : (0, 0, 3/8) et (1/3,
2/3, 7/8)
L'oxyde de zinc appartient au groupe spatial P63mc [7,18] il
possède:
· un réseau primitif
· un axe hélicoïdal 63 d'ordre 6,
parallèle à l'axe [0001], constitué d'une rotation de
?1 autour de l'axe c plus une translation de
c.
3 2

? un miroir plan de type (0 1 1 0) perpendiculaire à
l'axe [0 1 1 0] et parallèle au plan formé
par les axes a et c.

·
et parallèle au plan (0 1 1 0) , qui est
un plan de glissement c perpendiculaire à l'axe [0 1 1
0]
.
1
la combinaison d'un miroir plan m et une translation de
c
2
D'autre part le ZnO appartient à la classe cristalline
6mm.
Vu la disposition alternée des atomes, la structure
wurtzite de ZnO présente une polarité cristallographique le long
de l'axe [0001].

Figure I.10: Structure hexagonale
wurzite de ZnO l'axe c perpendiculaire à la surface
[19].
Tableau I.4: Récapitulatif
des caractéristiques de l'oxyde de zinc
|
Réseau
|
|
|
Hexagonal, wurtzite
|
|
Paramètre de maille
|
|
|
A= 3,2499 Å
c/a=1,6019
c=5,2060 Å
|
|
Distance entre O2- voisins
|
et
|
Zn+2, les plus proche
|
Suivant l'axe c d=1,96 Å
Pour les trois autres d=1,98 Å
|
|
Rayon cristallin
tétraédrique.
|
pour
|
une coordination
|
Zn+2=0,74 Å O2-=1,24 Å
|
La condition de stabilité de cette structure est
donnée par la relation suivante :
R
0 .225 ~ <
a
R c
0.4 1 4 (I.1)
Où Ra et Rc
représentent le rayon de l'anion et celui du cation respectivement.
L'origine de cette condition provient de la considération suivante:
> Pour une structure H.C, on a :

3 c 2
R a R c 8 c
+ = , ? 2 (I.2)
a 3
2 Ra -< a (I.3)
> Comme la structure HC dérive de la structure C.F.C.
de la blende, on a aussi : R a ? 0 .4 1 4 (I.4)
R c
I.8.1. 2. L'énergie cristalline de
cohésion
L'énergie de liaison est l'énergie
nécessaire pour former le cristal à partir des ions qui le
composent prés à l'état gazeux. Ou bien c'est
l'énergie totale de liaison des ions dans le cristal. En thermodynamique
cette énergie correspond à la quantité de chaleur
échangée pendant la réaction chimique pour former le
cristal. Cette quantité de chaleur est égale à la
variation de l'énergie de l'enthalpie AH, donc en peut écrire
:
E = AH (I. 5)
Cette énergie de liaison des cristaux ioniques comporte
essentiellement deux termes, un terme qui représente l'énergie
d'attraction et l'autre représente l'énergie de
répulsion.
E = Eatt +
Erép (I.6)
D'après l'approximation de Born-Mayer, l'énergie
totale E donnée en fonction de la distance r séparant les atomes
les plus proches voisins par la relation suivante :
? M ? r
2
E H
= A = _ + ?
Z Z e N a
. . . . + B . exp( )
_ (I.7)
? ?
L r ? p
Où Z , Z les nombres atomiques pour les
deux types d'ions (cation et anion),
M est la constante de Madelung.
B est une constante, qui peut être
déterminée en minimisant l'énergie E par rapport à
r.
+ ? 2
? Z Z e N M
. . . . ? P
a
E ? ? ? ? ?
(1 ) (I.8)
équi ? r r
0 j 0
pPeut être déterminé expérimentalement
en faisant appel à la compressibilité des solides [15,16]. Dans
le cas de ZnO on trouve que :
E équi= -255.98 Kcal/mol
I.8.1.3. Structure électrique de bandes
:
On rappelle que la structure électronique de
l'oxygène et de zinc a les configurations suivantes : Zn :
1s2 2s2 2p6 3s2 3p6
3d10 4s2
O : 1s2 2s2 2p4
Les états 2p de l'oxygène forment la bande de
valence, les états 4s de zinc constituent la zone de conduction.
L'observation de la figure I.11 montre que le ZnO est un semi
conducteur à gap directe [24], le minimum de la bande de conduction et
le maximum de la bande de valence est située au point IT de la zone de
brillouin. La largeur de la bande interdite est de l'ordre de 3.3eV, et lui
permet des transitions verticales entre la bande de valence et la bande de
conduction, et aussi d'avoir des transitions radiatives. D'autre part, le ZnO
possède une bande excitonique très large (=60meV) qui est la plus
large dans la famille II-VI [27]. Ce qui nous permettons de remarquer l'effet
excitonique même à la température ambiante.

Figure I.11 : Structure des bandes
d'énergie de ZnO [28].
I.8.2. Propriétés optiques et
luminescence:
Le tableau II.5 indique quelques propriétés
optiques de ZnO. Ces dernières sont très sensibles à la
présence d'impuretés, les études par photoluminescence
[28] ont montré que la présence de Li favorise une
émission visible centrale autour de 600 nm, cette émission
noté DAP résulte d'une transition radiative d'un électron
situé à un niveau donneur vers le niveau accepteur de Li. La
présence des ions de Fe+3 donne elle aussi naissance à
une émission visible centré autour de 700 nm. D'autre part on
note que les propriétés optiques de ZnO sont très
sensibles à la présence des centres isoélectroniques tel
que Hg par exemple, ces centres jouent le rôle des centres de
recombinaison pour les porteurs de charges, dans le cas de Hg l'étude
réalisé par Tomasini et al [30] a montré la
présence d'une bande d'émission situé entre 3.28 et 2.85
eV reliée directement à la présence de Hg dans le spectre
de photoluminescence.
Figure I.5. Quelques
propriétés optiques de ZnO.
|
Constante diélectrique
|
=
// 8 .7
e? =7. 8
|
|
Coefficient d'absorption
|
104 cm-1
|
|
Indice de réfraction à 560 nm
|
1.8-1.9
|
|
Indice de réfraction à 590 nm
|
2.013-2.029
|
|
Largeur de la bande excitonique
|
60 meV
|
|
Transmittance
|
> 90%
|
Les traitements thermiques tels que les recuits thermiques ont
un effet important sur les propriétés optiques de ZnO, Chen et
al. A montré que l'absorption optique de ZnO dans la région
violette et UV augmente considérablement après un recuit sous air
ou sous une atmosphère d'azote [31,32], et que l'intensité de
l'émission verte dépend fortement des conditions
d'élaboration et de la température de recuit [33,34], cette
intensité varie en fonction de la température de recuit selon une
loi d'Arrhenius:

I = I 0 exp(--E a KT
r ) (II.9)
Avec :
Tr : température de recuit
Ea : énergie d'activation =1.035eV.
D'autre partN. Pawar et al [24] ont remarqué que la
transparence optique de ZnO dans les régions visible et proche
infrarouge du spectre solaire est une conséquence de son grand gap
(Eg=3.3eV), le seuil fondamental d'absorption de ZnO se situant dans
l'ultraviolet. La forme du spectre d'absorption intrinsèque peut
être observée seulement sur les couches minces à cause de
leur grand coefficient d'absorption [28]. Cette étude a montré
une montée abrupte du coefficient d'absorption aux environs de A=385nm
(E g=3.3eV).
L'oxyde de zinc est un matériau transparent dont
l'indice de réfraction sous la forme massive est égal à 2
[29]. Par ailleurs sous forme de couche mince, son indice de réfraction
et son coefficient d'absorption varient en fonction des conditions
d'élaboration. L'indice de réfraction a une valeur qui varie
entre 1,90 et 2,20 suivant les auteurs [24,25]. L'amélioration de la
stoechiométrie de ZnO conduit à une diminution du coefficient
d'absorption et à une augmentation de l'énergie de la bande
interdite [18,19]. L'oxyde de zinc dopé entre dans la classe des oxydes
transparents conducteurs dits TCO. Très peu dopé, il peut
être utilisé en luminescence [62].
I.8.3. Propriétés électriques
:
Le tableau I.6 regroupe quelques propriétés
électriques de ZnO. L'oxyde de zinc est un semiconducteur du groupe
AIVBII qui présente une bande interdite d'environ 3,3 eV, ce
qui permet de le classer parmi les semi-conducteurs à large bande
interdite [26]. Cette valeur de bande interdite peut varier suivant le mode de
préparation et le taux de dopage, entre 3,30 eV et 3,39 eV [63,64].
Cependant, il est possible de modifier largement les propriétés
d'oxyde de zinc par le dopage :
soit en s'écartant de la stoechiométrie ZnO,
principalement par l'introduction d'atomes de zinc en excès en position
interstitielle, ou par la création de lacunes d'oxygène (les
centres créés se comportent alors comme des donneurs
d'électrons)[30] ;
soit en substituant des atomes de zinc ou d'oxygène du
réseau par des atomes étrangers de valence différente
(élément du groupe III, F-, Cl-).
Il est intéressant de noter que le dopage de ZnO avec
l'aluminium fait diminuer la concentration de Zn en position interstitielle,
réduisant de ce fait la rapidité d'oxydation du Zn [60].
En pratique, on obtient uniquement par dopage une semi
conductivité de type n. Les taux de dopage obtenus peuvent être
très élevés (de l'ordre de 1020
atomes/cm3), permettant d'atteindre des résistivités
très faibles (de l'ordre de 10-4 ?.cm) [30]. En
général, la grande conductivité des couches d'oxydes pures
est due à la forte concentration en porteurs (électrons),
étant donné que la mobilité dans ces couches est
considérablement plus faible que celle en volume du matériau
correspondant. La forte concentration en électrons est attribuée
à la déviation par rapport à la stoechiométrie (ou
défauts dans la structure). La déviation à la
stoechiométrie peut être due aux lacunes d'anions [32] ou à
un excès de cations en position interstitielle [33]. La
nature exacte des défauts de structure dans la plupart des cas est
encore incertaine. La réaction de formation de ZnO
stoechiométrique [18].
Zn + + + e + O = ZnO
1
2 (I.10)
2
2
Dernièrement la conductivité de type p a
été obtenue par Wyckoff [64], ce qui
était impossible avant.
Les propriétés électriques de ZnO ont
été étudiées depuis longtemps ce qui lui permis
d'avoir un très vaste domaine d'utilisation, mais les faibles valeurs de
la mobilité des porteurs ne lui permettent pas une quelconque
compétition dans le domaine des composants électriques. Cependant
ce problème est résolu maintenant avec l'utilisation de la
méthode SVP (Seeded Vapor Phase) dans la préparation des
monocristaux de ZnO par Eagle-Picher, où des mobilités de l'ordre
de 200 cm2/V.s à 300 K ont été remarqué
[65]. Les propriétés électriques des
cristaux de ZnO surtout les cristaux non dopés dépendent
fortement de la méthode et des conditions
thermodynamiques de croissance de ces cristaux [66,67]. L'effet
de la non stoechiométrie sur les propriétés
électriques de ZnO a été étudiée par
plusieurs auteurs dont Majumder et al [61].
De nombreuses études ont montré qu'un traitement
thermique adéquataprès la croissance des cristaux de ZnO (recuit
à haute température) peut changer considérablement les
propriétés électriques des cristaux. Par exemple il a
été remarqué que pour des cristaux de ZnO
présentant une haute résistivité et avec une grande
concentration des porteurs de charge [42, 43, 62], cependant un traitement sous
air ou sous oxygène donne un effet opposé pour des cristaux de
faible résistivité [44,45].
I.9.Différents types de défauts dans le ZnO
:
Les défauts présents dans le ZnO dépendent
de la méthode de croissance et des conditions d'élaboration de ce
matériau. On pourra énumérer les défauts
suivants:
- défauts ponctuels (interstitiels, lacunes, atomes
étrangers).
- défauts linéaires (dislocations et sous joint de
grains).
- défauts plans (macles, joints de grains).
Il existe d'autres types de défauts d'ordre thermique
(Phonon) ou électrique (électrons, trous, excitons, ).
Tableau I.6. Quelques
propriétés électriques de ZnO.
|
Nature de la bande interdite
|
|
directe
|
|
Largeur de la bande interdite à 4.2 k
|
|
3.4eV
|
|
Largeur de la bande interdite à 300 k
|
|
3.34 #177; 0.02 (eV)
|
|
Type de conductivité
|
|
n et (p)
|
|
Mobilité maximale des électrons
|
|
200 cm2/V.s
|
|
Masse effective des électrons
|
|
0.28 m0
|
|
Masse effective des trous
|
|
0.60 m0
|
|
Densité d'états dans BC
|
|
3.71 1018 cm-3
|
|
Densité d'états dans BV
|
|
1.16 1019 cm-3
|
|
Vitesse thermique des électrons
|
|
2.2 107 cm.s-1
|
|
Vitesse thermique des trous
|
|
1.5 107 cm.s-1
|
|
Résistivité maximale
|
|
106 Ù.cm
|
|
Résistivité minimale
|
|
10-1 Ù.cm
|
|
Chapitre II
Élaboration et dopage des
couches minces de ZnO
|
II.1. Introduction:
Dans ce chapitre nous portons un intérêt
particulier à la technique de déposition des couches minces par
spray ultrasonique « pulvérisation ultrasonique ». Celle ci
est une alternative relativement simple qui utilise des moyens traditionnels et
non coûteux [15,16]. Sa mise en oeuvre est localement réalisable.
Elle présente, également, l'avantage d'élaborer des
couches minces sur des surfaces importantes comme celles des cellules solaires
ou d'écrans plats [83]. A partir des avantages cités
précédemment nous avons sélectionné ce
procédé d'élaboration et nous avons opté pour son
utilisation dans notre travail.
Pour cette raison nous avons réalisé, un banc de
dépôt de couches minces par spray ultrasonique. Celui-ci sera
détaillé par la suite.
II.3. La technique de spray ultrasonique
II.2.1. Pulvérisation ultrasonique des
liquides
La pulvérisation ultrasonique est basée sur
l'exploitation de l'énergie des ondes acoustiques de haute
fréquence (les ultrasons) pour fractionner des films liquides en une
multitude de petites gouttelettes de tailles uniformes qui sortent du bec sous
forme d'un jet. Les pulvérisateurs destinés à fonctionner
à des fréquences relativement faibles (quelques dizaines de KHz)
consistent en deux éléments piézoélectriques,
générateurs de vibrations mécaniques, fixés entre
un support et un amplificateur d'amplitude des vibrations [19]. Les travaux
expérimentaux réalisés confirment les
propriétés suivantes de la pulvérisation ultrasonique des
liquides:
· distribution très étroite du
diamètre des gouttelettes;
· possibilité de contrôler le diamètre
moyen des gouttelettes et le débit du liquide à pulvériser
de manière indépendante ;
· possibilité de pulvériser de très
petits débits;
· grande facilité de transport des gouttelettes par
un gaz porteur et modification aisée de la
forme du jet des
gouttelettes ainsi que de leur concentration suivant le flux de ce gaz;
· très faible consommation d'énergie.
II.2.2. Montage expérimental utilisé
Il s'agit d'un bâti réalisé au laboratoire
des couches minces et interfaces de l'université de Constantine. Ce
dernier est construit à partir de dispositifs simples auxquels nous
avons apporté certaines modifications de façon à
réaliser des films homogènes d'oxyde de zinc. Le schéma de
principe du système de dépôt que nous avons
contribué à sa mise au point est montré sur la figure
II1.
|
|
|
|
|
|
|
Flacon porte
solution
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Contrôleur de
débit
|
|
|
|
|
|
Atomiseur
|
|
|
|
|
|
|
Générateur
ultrason
|
|
Porte substrat
|
|
|
|
|
|
|
|
|
Thermocouple
|
|
Résistance
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Régulateur de température
|
|
|
|
|
|
|
|
|
|
|
|
|
|
FigureII.1 : Le dispositif
complet de déopsition de couche mince
par la technique de Spray
Ultrasonique.
II.2.2.1. Description du rôle des
éléments du montage:
L'objectif de notre travail est tout d'abord la
réalisation d'un système de dépôt de couches minces
par la technique de spray ultrasonique et son optimisation par l'étude
des effets, des paramètres de dépôt sur la qualité
des films.
Les principaux éléments du montage sont :
? Un porte substrat : c'est un plateau de diamètre
25cm, chauffé par effet joule, dont la température peut
être régulée à l'aide d'un régulateur de
température qui est relié à un
thermocouple de type K (chromel-alumel). Cette température
consigne peut être fixée de la température ambiante
jusqu'à 500°C.
· Un flacon porte solution: alimente par gravité un
nozzle à faible débit.
· Un générateur à ultrason d'une
fréquence de 40 KHz : qui permet de transformer la solution au
niveau du nozzle en un jet de gouttelettes très fines de 40 ìm de
diamètre, placé sur un support à hauteur réglable
afin de contrôler la distance bec-substrat.
· Dans notre travail, nous avons utilisé un seul
type de solution source:
Acétate de Zinc (C4H6O4Zn. 2H2O), la solution
utilisée ont une grande pureté chimique.
II.2.3. Préparation des substrats :
II.2.3.1. Choix du substrat de
dépôt
Les couches de ZnO étudiées sont
déposées sur deux types de substrats:
i). Substrats en verre (solide glass)
Le choix du verre comme substrat de dépôt a
été adopté en raison du bon accord de dilatation thermique
qu'il présente avec le ZnO (averre =8,5 10-6
K-1, aZnO=7,2 10-6 K-1) de manière
à minimiser les contraintes à l'interface couche substrat, et
pour des raisons économiques, pour leur transparence qui s'adapte bien
pour la caractérisation optique des films dans le visible et aussi pour
des raisons économiques.
ii). Substrats en silicium monocristallin
ceux-ci sont adaptés avec la caractérisation
optique dans le domaine de l'infrarouge, ou une résistivité
élevée et une épaisseur relativement importante sont
indispensables pour éviter, respectivement, l'absorption due aux
porteurs libres et les effets d'interférence. Dans notre étude
nous avons choisi ces substrats pour la détermination de l'indice de
réfraction par ellipsometrie et éventuellement pour
l'étude électrique de l'hétérojonction ZnO/C-Si.
II.2.3.2. Nettoyage des substrats
La qualité du dépôt et par suite celle de
l'échantillon dépend de la propreté et de l'état du
substrat. Son nettoyage est donc une étape très importante : il
faut éliminer toute trace de graisse et de poussière et
vérifier, à l'oeil, que la surface du substrat ne comporte, ni
rayures ni défauts de planéité. Ces conditions sont
indispensables à la bonne adhérence du dépôt sur le
substrat, et à son uniformité (épaisseur constante).
Pour effectuer une étude opto-electrique des couches
minces de ZnO, nous avons utilisé des substrats en verre et en silicium
monocristallin dans le but d'arriver à un dépôt de couches
minces de ZnO propres ; pour ce faire, il est indispensable de passer par le
procédé de nettoyage des substrats car les
caractéristiques électriques sont très sensibles aux
techniques de préparation de la surface.
Le procédé du nettoyage de la surface des
substrats est comme suit:
· Les substrats sont coupés à l'aide d'un
stylo à pointe en diamant.
· Dégraissage dans un bain de
trichloréthylène pendant 5min.
· Rinçage à l'eau distillée et puis
à l'acétone pendant 15 min.
· Rinçage à l'eau distillée.
· Lavage dans le méthanol à
température ambiante dans un bain à l'Ultrason pour
éliminer les traces de graisses et d'impuretés collées
à la surface dusubstrat ensuite ils sont nettoyer dans un bain d'eau
distillée à l'Ultrason.
· Séchage à l'aide d'un séchoir.
Les substrats réactifs à l'air "cas de
silicium"sont préalablement décapés par voie chimique dans
un bain d'acide fluorhydrique, afin d'éliminer la couche d'oxyde ainsi
produite. Cette opération est réalisée juste avant le
dépôt afin d'éviter la formation d'oxyde durant le stockage
du substrat.
II.2.4. Préparation des solutions:
Les précurseurs (par exemple, acétates, nitrate ou
chlorures en métal ....ets.) sont dissous dans le méthanol ou
l'eau distillée (dissolvant) selon le rapport molaire
désiré.
Dans ce travail, nous avons utilisé :
Acétate de zinc
(C4H6O4Zn.2H2O), On a comme matériau source
que nous avons dissous dans du méthanol avec une concentration de
(0.1M). En plus de la couche mince ZnO non dopée, nous avons
préparé trois sériés de couches dont l'une est
dopées en Indium et deux en Aluminium. Les conditions de
préparations des couches sont présentés dans le
tableauII.1. L'objectif de ce travail est d'étudier les effets de chaque
dopant (In, Al), de sa concentration (0- 8%) dans la solution de départ,
ainsi que son origine sur les diverses propriétés des couches
ZnO. Pour plus de détail, nous présentons, ci-après, les
différentes propriétés physico-chimiques des
éléments utilisés dans la préparation de nos
échantillons. Préparé de chaque série des
différentes concentrations.

II.3. L'acétate de zinc:
FigureII.2 : L'acétate de
zinc.
II.3.1. Propriétés physiques:
Apparence : Solide cristallin, blanc à odeur d'acide
acétique
La formule moléculaire :Zn(C2H3O2)2 · 2H2O Formule
Wt. 219.50
État physique: Solide
Masse moléculaire : 209,38 (g/mole)
Densité : 1,735 g/ml à 20°C
Point de fusion : 237°C
II.3.2. Les sources des dopages :
Nous avons utilise trois sources de dopants :
· Deux sources en aluminium: Al2 (SO4)3, Al(NO3)3
· Une Source en indium: In Cl3
Aluminium Sulfate Octadecahydrate (Al2
(SO4)3.18H2O):
Le sulfate d'aluminium Al2(SO4)3 est formé
par la combinaison de deux cations
aluminium (Al3+) et de trois
anions sulfate (SO42-). Il est utilisé actuellement dans
le
traitement des eaux. On le trouve dans le commerce sous forme de
cristaux ayant les propriétés suivantes :
État physique: Solide
Apparence: blanc
pH: Acide dans la solution.
Température de décomposition: 189 °C
Solubilité: 86.9% à 32 °C
La formule moléculaire: Al2 (SO4)3.18H2O
La masse molaire: 666.377 (g/mol)
Stabilité chimique: Écurie.
Conditions éviter: matières incompatibles,
humidité.
Incompatibilités avec les autres matières:
incompatible avec les oxydant agents forts. Se décompose dans l'eau et
peut produire desquantités de chaleur ou de pression. Produits de la
Décomposition hasardeux: Oxydes de soufre, oxyde aluminium.

FigureII.3 : photo de la
source de dopage de Al2 (SO4)3
|
Nitrate d'Aluminium Nonahydrate (Al (NO3)3.9H2O):
|
Le nitrate d'Aluminiumest un sel d'aluminium et acide
nitrique, en existe normalement comme un hydrate cristallin. Il être
préparé facilement par la réaction d'hydroxyde aluminium
avec l'acide nitrique.
Propriétés physiques:
Nom systématique : Nitrate d'Aluminium Nonahydrate
Formule moléculaire : Al (NO3)3 .9H2O
Masse molaire : 375.13 g/mol
Apparence : incolore à blanc solide, hygroscopique
Densité et phase >1 g/cm3
Solubilité dans l'eau 60.0 du g/100 ml (0°C) Point
fondant : 73°C
Le point d'ébullition : se décompose à
135°C

FigureII.4 : photo de la source de
dopage de Al (NO3)3
|
le Chlorure d'Indium (In Cl3) :
|
Le chlorure d'indium est le composé chimique dont la
formule est InCl3. Ce sel incolore trouve quelque usage dans la synthèse
organique comme un Lewis acide. C'est aussi les dérivés solubles
les plus disponibles d'indium.
Propriétés physiques:
Formule moléculaire : In Cl3
Masse molaire : 221.18 g/mol
Apparence : petits cercles rouges
Densité et phase: 3.46 g/cm3, solide,
Solubilité dans l'eau : soluble, exothermique
Point fondant: 586 °C
Le point d'ébullition : 800 °C (idéalise 498
°C dans un vide)
II.4.
Conditions expérimentales
Les conditions expérimentales d'élaboration des
couches ZnO sont représentées sur le tableau .II.1 :
Tableau.II. 1 : tableau
récapitulatif des 3 séries de dépôt.
Solution
Acétate de Zinc
(C4H6O4Zn.2H2O) (0.1M)
|
Dopage
(% wt)
|
Temps de dépôt
(min)
|
Température
du
substrat
(°C)
|
Non dopé
|
0
|
10
|
350
|
Dopé à In.
Source
(Cl3)
|
2
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
Dope à Al.
Source
(NO3)3
|
2
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
Dope à Al.
Source
(SO4)3
|
2
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
|
10
|
350
|
|
II.5. Déposition des couches
La procédure de dépôt vient tout de suite
après la préparation des substrats et des solutions et se
présente en plusieurs étapes :
On place la porte substrat au dessus d'une résistance
dont l'alimentation est reliée à un régulateur de
température. Pour éviter le choc thermique des substrats le porte
substrats est chauffé progressivement de la température ambiante
progressivement jusqu'à la température choisie pour les
dépôts (350°C).. Lorsque le chauffage est
réalisé, on fixe le débit de la solution l'amplitude de
l'onde sonore et le type de pulsation (dans notre travail nous avons
utilisé des
pulsations continues). des gouttelettes très fines sont
pulvérisées sur le substrat chauffé qui provoque, par
pyrolyse, l'activation de la réaction chimique entre les
composés, le dissolvant s'évapore en raison de la réaction
endothermique des deux composés formant la couche mince. En fin du
processus de dépôt, on arrête le chauffage et on laisse les
substrats se refroidir au dessus du porte substrat jusqu'à la
température ambiante, afin d'éviter les chocs thermique qui
risquent de casser le verres, ensuite on récupère nos
échantillons.
II.6. Les paramètres modulables :
Il est important de citer les paramètres
expérimentaux qui sont modulables et qui peuvent influencer la
cinétique de croissance des couches, donc leurs
propriétés.
La méthode spray ultrasonique est un processus de
dépôt qui dépend des diverses conditions telles que, les
propriétés du précurseur, la concentration de la solution,
la distance entre le bec et le substrat, le temps de dépôts et la
température du substrat néanmoins la température et le
temps de dépôt restent les principaux paramètres influents
sur la qualité de la couche.
Dans cette technique, le changement dans les concentrations de
la solution peut être employé pour contrôler, facilement, la
taille moyenne des gouttelettes pulvérisées [11]. Le
contrôle du flux de matière, relativement peu précis et
difficile à ajuster, permet d'uniformiser le flux de matière qui
arrive sur la surface du substrat.
Dans cette étape d'optimisation de notre système
nous avons fait varier au seni de notre équipe, presque tous les
paramètres cités ci-dessus. Sauf que, d'après les
références [12], les variables les plus importantes qui
commandent la conductivité du matériau sont le dopage et la
température de substrat. C'est pourquoinous avons choisi une
température de substrat fixe à 350°C, température
optimale préconisée par des travaux ultérieurs [15,16]
effectues dans notre laboratoire. Le paramètre dopage qui constitue
l'objet de notre travail a été exploré selon le type du
dopant, Sa concentration dans la solution et sur origine afin d'obtenir des
couches ZnO suffisamment transparentes et conductrices.
II.7. Dopage en semi conducteur :
II.7.1. Conduction dans les
semi-conducteurs:
Un semi-conducteur est un solide cristallin dont les
propriétés de conduction électrique sont
déterminées par deux bandes d'énergie particulières
: d'une part, la bande de valence, qui correspond aux électrons
impliqués dans les liaisons covalentes ; d'autre part, la bande de
conduction, comprenant les électrons dans un
état excité, qui peuvent se déplacer dans le cristal
[70].
Ces deux bandes sont séparées par un gap, une
bande interdite que les électrons ne peuvent franchir que
grâce à une excitation extérieure telle que, l'absorption
d'un photon). La bande interdite correspond à une barrière
d'énergie, dont l'ordre de grandeur est l'électron-volt. Les
électrons présents dans la bande de conduction permettent la
conduction du courant. La conduction du courant peut être
considérée de façon tout à fait équivalente
en terme de trous d'électron se déplaçant dans la bande de
valence. La densité d'électrons (concentration par unité
de volume) est notée n, celle des trous p.
Dans un semi-conducteur intrinsèque, ou pur, il n'y a
aucun atome dopant. Tous les électrons présents dans la bande de
conduction proviennent donc de la bande de valence. Il y a donc autant
d'électrons que de trous : n = p = ni ;
ni est la concentration intrinsèque. Tout dopage sert à
modifier cet équilibre entre les électrons et les trous, pour
favoriser la conduction électrique par l'un des deux types de
porteurs.
|
On a toujours la loi d'action de masse:
|
|
II.7.2. Dopage de type Net de type P :
Il existe deux types de dopage : II.7.2.1. Dopage de type
N :
Les semi-conducteurs de type N sont appelés
semi-conducteurs extrinsèques. Le but d'un dopage N est de
produire un excès d'électrons porteurs dans le semiconducteur.
Afin de comprendre comment un tel dopage s'effectue, considérons le cas
du silicium (Si). Les atomes de Si ont quatre électrons de valence,
chacun étant lié à un atome Si voisin par une liaison
covalente. Si un atome ayant cinq électrons de valence, comme ceux du
groupe V (VA) de la table périodique (par exemple, le phosphore (P),
l'arsenic (As) ou l'antimoine (Sb)), est incorporé dans le réseau
cristallin, alors cet atome présentera quatre liaisons covalentes et un
électron libre. Cet électron, qui n'est pas un électron de
liaison, n'est que faiblement lié à l'atome et peut être
facilement excité vers la bande de conduction. Aux températures
ordinaires, quasiment tous ces électrons le sont. Comme l'excitation de
ces électrons ne conduit pas à la formation de trous dans ce
genre de matériau, le nombre d'électrons dépasse de loin
le nombre de trous. Les électrons sont des porteurs majoritaires
et les trous des porteurs minoritaires. Et parce que les atomes
à
cinq électrons ont un électron
supplémentaire à « donner », ils sont appelés
atomes donneurs. Les matériaux ainsi formés sont appelés
semiconducteurs de type N parce qu'ils contiennent un excès
d'électrons négativement chargés.
II.7.2.2. Dopage de type P :
Les semiconducteurs de type P sont également des
semiconducteurs extrinsèques. Le but d'un dopage P est de
créer un excès de trous. Dans ce cas, un atome trivalent,
généralement un atome de Bore, est substitué à un
atome de silicium dans le réseau cristallin. En conséquence, il
manque un électron pour l'une des quatre liaisons covalentes des atomes
de silicium adjacents, et l'atome peut accepter un électron pour
compléter cette quatrième liaison, formant ainsi un trou. Quand
le dopage est suffisant, le nombre de trous dépasse de loin le nombre
d'électrons. Les trous sont alors des porteurs majoritaires et les
électrons des porteurs minoritaires sont appelés accepteurs.
· le dopage de type N, qui consiste
à produire un excès d'électrons, qui sont
négativement chargés;
· le dopage de type P, qui consiste
à produire une carence en électrons, donc un excès de
trous, considérés comme positivement
chargés.
Les schémas suivants présentent des exemples de
dopage du Silicium respectivement par du Phosphore (dopage N) et du
Bore (dopage P). Dans le cas du Phospore (à gauche), un
électron supplémentaire est amené. Dans le cas du Bore
(à droite), il manque un électron; c'est donc un trou
d'électron qui est amené.

Figure II. 5: Dopage du silicium
par du Phosphore (N) et du Bore (P).
II.7.2.3. Atomes donneurs et accepteurs :
L'atome d'impureté provoque des effets qui
dépendent de la colonne qu'il occupe dans la classification
périodique de Mendeleïev, par rapport à la colonne de
l'atome qu'il remplace.
· Si l'atome dopant appartient à la même
colonne que l'atome qu'il remplace, ils sont isovalents (ou
isoélectriques). Les électrons de valence de l'atome
d'impureté remplacent exactement les électrons de l'atome
initial. Les propriétés de conduction électrique du
matériau ne sont pas modifiées.
· Si l'atome dopant appartient à la colonne
précédente, il manque alors un électron
périphérique pour rétablir l'ensemble des liaisons
covalentes initiales. Il apparaît alors une carence en électron,
autrement dit un trou. L'atome inséré est dit accepteur
(d'électron), car il est capable de recevoir un électron
supplémentaire, provenant de la bande de valence. C'est un dopage
P.
· Si l'atome dopant appartient à la colonne
suivante, il possède un électron supplémentaire par
rapport à l'atome initial. Les liaisons covalentes initiales sont
restaurées, mais un des électrons n'est pas utilisé dans
ces liaisons. Il est donc sur un état libre du système. L'atome
inséré est dit donneur (d'électron).
C'est un dopage N.
Un même atome dopant peut être à la fois
donneur et accepteur : il est alors dit amphotère.
C'est par exemple le cas du Silicium (Si, colonne IV), qui est un dopant de
l'Arséniure de gallium (AsGa) : si le Si se met en substitution d'un
atome de Gallium (colonne III), il est donneur d'électron. S'il est en
substitution d'un atome d'Arsenic (colonne V), il est accepteur.
Si l'énergie d'ionisation ÄE est
inférieure à l'énergie thermique ambiante kT
(où k est la constante de Boltzmann et T la
température), alors les atomes d'impuretés sont ionisés
à température ambiante.
II.7.3. Modification de la structure en bandes
d'énergie :
Le dopage provoque l'apparition de nouveaux niveaux accepteurs
et donneurs d'électrons dans la structure de bande du matériau
dopé. Ces niveaux apparaissent dans le gap, entre la bande de
conduction et la bande de valence.
Lors d'un dopage N (schéma de gauche),
l'introduction d'atomes donneurs d'électrons entraîne l'apparition
d'un pseudo niveau d'énergie situé juste sous la bande de
conduction. Ainsi, l'énergie nécessaire pour que les
électrons passent dans la bande de conduction est bien plus facilement
atteinte que dans un semiconducteur intrinsèque.
Lors d'un dopage P (schéma de droite),
l'introduction d'atomes accepteurs d'électrons entraîne, de
manière analogue, l'apparition d'un pseudo niveau situé au-dessus
de la bande de valence. L'énergie à fournir aux électrons
de valence pour passer sur ce niveau accepteur est faible, et le départ
des électrons entraîne l'apparition de trous dans la bande de
valence.


(a) (b)
Figure II. 6: (a) Dopage de type n,
(b) Dopage de type p.
II.8. Les dopants du ZnO :
II.8.1. Dopage n du ZnO :
Il y a deux groupes des dopants de type n : Groupe III:
Al, Ga, In

En substitution sur les sites Zn. Conductivité
élevée ex : 6.2 10-4 (cm)-1 Groupe
VII: Cl, I

En substitution sur les sites O.
II.8.2. Dopage p du ZnO :
Groupe I : Li, Na, K, Cu, Ag.

Lacunes des sites Zn (pb solubilité faible, niveau profond
dans le gap, pb en interstitiel : donneurs)
Groupe V : N, P, As

Lacunes en site O. (faible contribution à la conduction
p). L'approche Azote (N) est la plus prometteuse.

N2, N2O, NH3, Zn3N2.
Le dopage p du ZnO est un challenge important et une des clefs du
développement des composants en ZnO.
Non intentionnellement dopé le ZnO est un semiconducteur
de type n.
Type n :
· Zn en site O.
· Zni en site interstitiel.
· Lacune O, Vo.
· Présence de H
En général les semiconducteurs ZnO, GaN, ZnS, ZnSe
sont aisément dopés n et très difficilement p. (sauf pour
ZnTe) [71].
|
Chapitre III
Caractérisation des
Dépôts
|
Dans ce chapitre nous donnerons une description des diverses
méthodes de dépôt des couches minces et qui sera suivie
d'une étude bibliographique sur les oxydes transparents conducteurs
(TCO), dont l'oxyde de zinc (ZnO) fait partie.
III. Les méthodes des caractérisations
:
ZnO est un matériau très sensible aux
conditions de préparation. Par conséquent il ne suffit pas de
réaliser un banc de dépôt, aussi sophistiquée
soit-elle, pour être certain d'obtenir un matériau ayant de bonnes
propriétés optoélectroniques. Un réel travail
d'optimisation est nécessaire pour définir les meilleures
conditions de préparation, ce qui exige une analyse systématique
(statistique) des propriétés optiques et électriques du
matériau élaboré.
Donc pour l'étude de ZnO, il est nécessaire
d'effectuer différentes caractérisations, pour optimiser et
observer l'influence de nos paramètres de dépôts qui sont
entre autres: L'influence des sources du dopant (aluminium, indium, pourcentage
de dopage .... etc.). C'est dans ces buts que ces couches ont été
analysées par différentes techniques de caractérisations
des matériaux. La caractérisation des couches ZnO s'appuie sur
des méthodes fort variées :
· La diffraction de rayons X (DRX), pour la
caractérisation structurale.
· La spectrophotométrie UV- VIS -NIR pour
l'étude de la transmittance.
· La spectrophotométrie photoluminescence.
· L'Ellipsométrie pour les mesures
d'épaisseurs.
· La technique de deux pointes pour les mesures
électriques.
Nous présentons les différentes techniques
auxquelles nous avons eu recours pour caractériser notre
matériau.
III.1. Caractérisations optiques :
Les méthodes optiques permettent de caractériser
un grand nombre de paramètre. Elles présentent l'avantage sur les
méthodes électriques, d'être non destructives et de ne pas
exiger la réalisation, toujours délicate, de contacts
ohmiques.
On peut distinguer deux types de méthodes optiques :
· Les méthodes qui étudient la réponse
optique du matériau à une excitation telle que photo et
cathodo-luminescence.
· Les méthodes qui analysent les
propriétés optiques du matériau telles que ; les mesures
de transmittance et de réfléctance, et les mesures
éllipsomètriques. Ces mesures spectroscopiques permettent de
déterminer l'indice de réfraction optique, l'épaisseur du
matériau et le gap optique.
III.1.1. La spectroscopie UV-visible
Les domaines de la spectroscopie sont
généralement distingués selon l'intervalle de longueur
d'onde dans lequel les mesures sont réalisées. On peut distinguer
les domaines suivants : ultraviolet-visible, infrarouge et micro-onde. Dans
notre cas, nous avons utilisé un spectrophotomètre enregistreur
à doubles faisceaux, dont le principe de fonctionnement est
représenté sur la figure III.1, par lequel nous avons pu tracer
des courbes représentant la variation de la transmittance, en fonction
de la longueur d'onde dans le domaine de l'UV-visible et proche de l'infrarouge
(200-800nm). En exploitant ces courbes. Il est possible d'estimer
l'épaisseur du film, et de déterminer ses caractéristiques
optiques ; le seuil d'absorption optique, le coefficient d'absorption, la
largueur de queue de bande de valence et l'indice de réfraction

Figure .III.1 :
Représentation schématique du
spectrophotomètreUV-Visible.
III.1.2. Mesure de l'épaisseur:
On mesure l'épaisseur d'un échantillon aussi par la
Spectroscopie de transmission dans l'intervalle UV-visible. Etant donné
que cette méthode permet d'obtenir d'autresinformations
que l'épaisseur, elle est décrite dans le
paragraphe qui se rapporte à la mesure des propriétés
optiques
Nous avons utilisé deux méthodes pour mesurer
l'épaisseurde nos échantillons:
III.1.2.1. Les franges d'interférence :
Une région de forte transparence, ou on a observé
des franges d'interférence qui sont caractérisés, comme
montré sur la figure III.3, par les ondulations de la transmission.
Les mesures et les techniques d'analyse sont comme suit.
Les constantes physiques utilisées dans les calculs sont
définies dans la figure III.2

Figure III.2 : système d'une
couche mince absorbante sur le substrat transparent épais.
T est le coefficient de transmission, áest le
coefficient d'absorption du film, ë est la longueur de la lumière
incidente, n et s sont les indices de réfraction du film et de substrat
respectivement et d représente l'épaisseur du film.
En utilisant les paramètres physiques définis
dans la figure III.3 et le spectre de transmission obtenu, nous pouvons
déterminer l'épaisseur de la couche comme suit:
Dans le cas où la couche est épaisse d'une part
et lisse d'autre part, des réflexions multiples de la lumière se
font entre la surface inférieure en contact avec le substrat et la
surface libre de la couche, il en résulte dans le spectre de
transmission des franges d'interférences comme on l'a déjà
signalé avec des minima et des maxima en fonction de la longueur d'onde.
Soit ë1 et ë2 les longueurs d'ondes de deux maxima
consécutifs, et TM1 et TM2, Les
transmissions

respectives, Tm la transmission du minima qui se
trouve entre les deux (FigureIII.3). L'épaisseur de la couche est
déterminée à partir de la relation [15,16] :
d = A1 A2
2(A1n2 --A2n1 ) (III.1)
Les indices de réfraction n1 et n2 de la couche pour les
longueurs d'onde ë1et ë2 sont tirés de la relation :
n1,2 = [N+ (N2
-S2)1"2]1"2 (III.2)
S : indice de réfraction du substrat
et N1,2 peut être calculé par la relation
:
N = 2 .
S
1 , 2
2
( T T ( ?
_ ) S
1 '\
M m ? ? (III.3)
? ?
T T
. j ? 2
M m ?
?
?
?
Figure III.3: Méthode des
franges d'interférence pour la détermination de
l'épaisseur.
III.1.2.2 L'Ellipsométrie :
L'Ellipsométrie (figureIII.4) est une technique
d'analyse optique dont l'appareille est constituée d'une source à
laser (He-Ne ; ?=6328A), d'un polariseur, d'un analyseur, un compensateur, un
filtre et un détecteur. On peut fixer l'angle d'incidence du faisceau
laser à 30,50, ou 70°. Une fois l'appareil est mis en marche, on
fixe les bras du polariseur et de l'analyseur sur l'angle 70°, puis on
déplace l'échantillon pour que le rayon réfléchi
soit bien centré sur l'orifice de l'analyseur, à la fin on
manoeuvre les tambours du polariseur et de l'analyseur pour avoir une
extinction maximale du rayon réfléchi au niveau du
détecteur, et on
relève les azimuts de l'appareille, un logiciel est
utilisé pour calculer l'épaisseur de la couche et son indice de
réfraction.
|
|
|
|
|
|
|
|
Source de laser
?=632.8 nm
|
|
Photodiode
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Analyseur
|
|
|
Polariseur
|
|
|
|
|
|
|
|
|
|
|
|
|
Porte
échantillon
|
|
|
|
|
|
|
Figure III.4 :
Ellipsométre de type Controlab
(He-Ne
A=6328A).
III.1.2.3. La profilométrie (mesures
mécaniques) : ? Principe de profilométrie
:
Un palpeur à pointe diamant se déplace à
vitesse constante suivant une ligne définie sur la pièce. Ce
palpeur, en restant en contact permanent avec la pièce a un mouvement
vertical dont l'amplitude est enregistrée électroniquement
[69].
? Mesure de l'épaisseur par profilométrie
:
L'épaisseur des dépôts est mesurée
avec un profilomètre à palpeur mécanique placésur
un marbre anti-vibrations dans une salle climatisée.
L'épaisseur des couches est déterminée
grâce à une marche obtenue en fixant une pince (mince fil de
tungstène) sur le substrat de verre, (Fig.III.5). Plusieurs mesures sont
effectuées perpendiculairement à la marche, le long de
celle-ci.

Figure.III.5: Mesure de
l'épaisseur au profilomètre[38].
III.1.3.Mesure des propriétés
optiques:
Les propriétés optiques du ZnO ont
été mesurées à l'aide d'un spectromètre de
transmission:
La transmission des nos couches minces de ZnO a
été déterminée à l'aide d'un
spectrophotomètre UV-Vis (UV-3101 PC -SHIMADZU) à double faisceau
l'un pour la référence (le verre) l'autre à
l'échantillon (le verre + la couche) ; la gamme spectrale s'étend
de la longueur d'onde ë=200 à 800nm avec une résolution de
5nm.
Les spectres obtenus donnent la variation relative de la
transmittance (%) en fonction de la longueur d'onde (nm).
A partir d'un spectre de transmission obtenu dans ce domaine
où les franges d'interférences sont dues aux réflexions
multiples à l'intérieur de la couche analysée, on peut
extraire l'épaisseur de l'échantillon.
Par ailleurs, grâce aux interférences, nous pouvons
déterminer l'indice optique dans le visible. Les mesures et les
techniques d'analyse sont comme suit.
Les constantes physiques utilisées dans les calculs sont
définies dans la figure.III.6.

Figure.III.6. système d'une
couche mince absorbante sur le substrat transparent épais.
T est la transmission, á
est le coefficient d'absorption du film, ?est la
longueur d'onde de la lumière incidente, n et s
sont les indices de réfraction du film et de substrat
respectivement et d est l'épaisseur de film.
Vu la fonction de transmission T, en utilisant les
paramètres physiques définis dans la figure, l'indice de
réfraction n de film est déterminé par les relations
[97]:
|
Où :
|
n 1 , 2 =
|
]2/1
[ N + ( N - S )
2 2 1 / 2
|
)
1
?
?
( T -
M
T m
?
?
?
.Tm
T M
( +
S 2 1 ?
+ 1 ?
? 2 ?
N S
= 2 .
n : est l'indice de réfraction de la couche.
TM : la transmittance maximale.
Tm: la transmittance minimale.
Dans notre cas, nous avons utilisé un substrat en verre
qui a un indice de réfraction S=1.45. L'épaisseur du film est
déduite à partir de la relation ci-dessous :
|
d = A 1 A 2
|
|
2(A1n2 -
A2n1
|
)
|
Dans le domaine spectral où la lumière est
absorbée, et en connaissant l'épaisseur de la couche, on peut
déterminer le coefficient d'absorption on fonction de la longueur
d'onde. On définit par la suite le gap optique Eg.
Selon la loi de Beer-Lamert:
T e _a d
= (III. 4)
où:
1 1
Ln
d
a = T (III. 5)
d : épaisseur de l'échantillon. T : transmission
mesurée.
On constate qu'à partir d'un spectre de transmission dans
le visible, on peut rapidement déterminer l'épaisseur du
matériau n, ?et le gap optique.
Pour un gap direct tel que celui du ZnO, á s'exprime en
fonction du gap (Eg) selon l'équation suivante :
ah v = A( h v _Eg
)1/ 2 (III. 6)
A : constant.
Eg [eV] : gap optique.
hv : l'énergie d'un photon
Ainsi, si l'on trace 2
( ?h ? )en fonction de l'énergie d'un photon
E = hv (sachant que
hc = 12400
hv (eV) = ) et que l'on prolongela partie
linéaire de 2
a jusqu'à l'axedes abscisses
? , (Å)
(c'est-à-dire pour 2
= 0), on obtient la valeur de Eg, figure.III.7.
.

Figure.III.7 :
Détermination du gap d'énergie par
l'extrapolation à partir de la variation.
de ( ah v )
en fonction de hv pour une couche mince de ZnO.
2
III.1.3.1Détermination de l'énergie
d'Urbach:
Un autre paramètre important qui caractérise le
désordre du matériau est l'énergie de queue d'Urbach.
D'après la loi d'Urbach l'expression du coefficient d'absorption est de
la forme [23] :
exp(
hv
0 E 00
a= a ) (III .7)
En traçant ln aen fonction de hv , on peut
accéder à la détermination de la valeur de E00.
hv
Ln Ln
a = a + (III.8)
0 E
00
III.2. Mesure des propriétés structurales
:
III.2.1. Diffraction de rayons X :
La diffraction de rayons X permet d'avoir des informations sur
les directions de croissance cristallographique des couches de ZnO.
III.2.2. Principe:
Lorsqu'un faisceau de rayons X monochromatique est
dirigé sur un matériau polycristallin, il est en partie
réfléchi par les plans atomiques de certains cristaux. Pour que
la diffraction des photons X soit mesurée, l'incidence du faisceau par
rapport aux plans atomiques doit avoir lieu sous un angle particulier. Comme il
est illustré à la figure.III.8.Il faut en effet que les ondes
réfléchies soient en phase de sorte à l'interférer
de manière constructive pour ensuite être mesurées par le
détecteur,

Figure. III.8. Famille de plans
cristallins en condition de Bragg.
Les conditions nécessaires à cette
interférence constructive sont données par la loi de Bragg: 2
dhkl sinO = nA (III. 9)
Où dhkl est la distance
interéticulaire séparant les plans définis par les indices
de Miller (h, k et l), èl'angle d'incidence et donc de réflexion
par rapportà ces plans et, enfin, ë la longueur d'onde des photons
X.
Le diffractogramme est un enregistrement de l'intensité
diffractée en fonction de l'angle 2è formé avec le
faisceau direct. L'étude du diffractogramme permet de remonter à
un grand nombre d'informations sur les caractéristiques structurales et
microstructurales de l'échantillon telles que les structures
cristallines, la taille des cristallites, les taux de défauts
structuraux, les macro et micro-contraintes et la présence d'une texture
[68].
Les positions angulaires des raies de diffraction sont
caractéristiques des paramètres du réseau cristallin.
L'étude des positions des raies de diffraction permet donc de remonter
au réseau cristallin de chacune des phases cristallisées de
l'échantillon. Une fois le réseau déterminé, les
positions angulaires des raies permettent de calculer les distances
interréticulaires des plans atomiques diffractant et ainsi
d'accéder aux paramètres de maille.
Les positions et intensités des raies de diffraction de
la plupart des matériaux connus ont été
étudiées et elles sont répertoriées dans des bases
de données. La comparaison d'un diffractogramme expérimental avec
ces données permet de retrouver la nature de chaque phase constitutive
de l'échantillon.
Dans le cadre de notre étude, ont été
utilisés :

· BRUKER - AXS type D8 ; les rayons-X ont
été produits à partir d'une source de radiation
CuKá, ayant une longueur d'onde de 1.541838 Å, avec un tension
d'accélération de 30kV et uncourant de 40 mA.
Figure. III.8.
diffractomètre de type (BRUKER - AXS type
D8).
Le spectre de diffraction des rayons-X (XRD) d'une poudre de
ZnO stochiométrique standard, selon la table ASTM 36-1451, est
présenté sur la Fig.III.9 [33]. C'est sur ce spectre de
diffraction, propre au ZnO, que nous nous sommes basés pour identifier
les différents pics de diffraction mesurés sur nos
échantillons de ZnO.
20 30 40 50 60 70
20

Intensite (u.a)
160
140
120
100
40
80
60
20
0
ZnO non dopé
Figure.III.9. Spectre de
diffraction des rayons-X (XRD) de couche mince de ZnO.
III.2.3. Détermination des contraintes et de la
taille des grains:
III.2.3.1. Taille des gains
La taille des gains des différents échantillons
a été déterminée tout d'abord à partir des
spectres des diffractions. Afin de s'assure de ces valeurs de taille de grains
de nos films, nous avons utilisé la relation de Scherrer [9,10]

(III.10)
Où : D est la taille des grains ([D] = nm), ?est la
longueur d'onde du faisceau de rayon X, 0est l'angle de diffraction et â
est la largeur à mi-hauteur exprimée en radian
(Figure.III.10).

Fig.III.10: Illustration montrant
la définition de â à partir de la courbe
de diffraction
des rayons X
III.2.3.2. Détermination des contraintes
:
L'effet des contraintes se traduit sur les diffractogrammes
par un déplacement des pics de diffraction. La comparaison entre les
fiches J.C.P.D.S. L'enregistrement du spectre de l'échantillon nous
permettra de déterminer les paramètres de mailles. En effet
à chaque angle de diffraction correspond un plan réticulaire (h,
k, l) et une distance d par la formule de Bragg. Or nous savons que pour une
maille, il existe une relation reliant les plans (h, k, l) et la distance inter
réticulaire d intervenir les paramètres de maille de
l'échantillon.
Dans notre cas il s'agit de la maille hexagonale du ZnO dont
l'expression est donnée sous la forme suivante :
dhkl
a
(III.11)
4
2
2
a
h k hk l
2 + + +
2 )
(
3
2
c
a et c étant les paramètres de maille.
De cette formule, on peut déterminer le paramètre c
en prenant dans la mesure du possible les plans pour lesquels h=k=0, l=2.
La mesure des paramètres de maille donnera une
indication sur l'état de contraintes des couches
déposées si les comparaisons aux valeur
théorique c0 = 5.205 paramètre de maille de ZnO. Les contraintes
internes peuvent être calculées à partir des expressions
suivantes [69] :
couche
? ?
C C C
11 ? 12 33
13 C 13
(? ?
?
?
?
(III.12)
2C -
O. ? e zz ,
0,99 C cristal
Avec C =
33 ( ) 4
1 - e zz
couche 33
-
c
c
0
et
zz
e = ,
c0
Où Cij les constantes élastiques de ZnO
données par les valeurs suivantes : C11= 209.7GPa, C12 =
121.1GPa, C13 = 105.1 GPa, C33 = 210.9GPa
III.3. Mesure des propriétés
électriques :
Pour calculer la résistivité de nos
échantillons nous avons utilisé la méthode de deux
pointes. Cette méthode et basée sur la loi d'Ohm, on repose sur
la mesure d'un courant électrique traversant le courbe ZnO
générée par l'application d'une différent
potentiel.
III.3.1. La technique des deux pointes :
La caractérisation électrique de la couche
intrinsèque, nécessite dans le cas le plus simple, deux
électrodes métalliques entre les quelles un champ
électrique externe oriente les porteurs vers une direction bien
déterminée. Le résultat est un courant de conduction qui
varie en fonction de la tension de polarisation appliquée entre les
électrodes. Ces dernières, dans un même plan, donnent une
structure appelée coplanaire. Si les électrodes sont
intercalées par une ou plus de couches, la structure résultante
est appelée sandwich. Dans notre caractérisation, nous
avons utilisé la structure coplanaire. Sur un substrat en verre, nous
avons déposé par pulvérisation deux électrodes
métalliques en or séparées par une distance
interélectrodes valant 2mm (figure III.11). La différence de
potentielle V entre les deux points [12] est :
V = R.I (III.13)
Cette relation représente une chute de tension entre deux
points.
I : le courant qui passe entre les points.
R : la résistance de la couche.

Figure III.11 : Schéma
électrique du système deux pointes.
III.3.2. Mesure de la conductivité
Les mesures électriques que nous avons
effectuées sont principalement des caractéristiques
courant-tension (I (V)). En variant la tension de polarisation de 0-40V le
courant qui circule dans l'échantillon est mesuré à l'aide
d'un pico-ampairmétre (KEITHLEY 617) qui peut mesurer des courants
jusqu'à 10-12 A. Ces courbes nous servirons pour calculer la
résistance de la couche intrinsèque à partir de la pente
de la courbe linéaire I (V) (fig.III.12). Le calcul de la
conductivité électrique dépend de la résistance
électrique, R, de la couche intrinsèque, ainsi que des
paramètres géométriques : distance inter-électrodes
L, l'épaisseur d, et W la section de la couche conductrice. La
conductivité aest reliée à ces paramètres par la
relation suivante :
III.3.3. calcul de l'énergie
d'activation
Lorsque' on augmente la température du semi-conducteur,
les densités de porteurs libres augmentent progressivement, et par
conséquent la conductivité croit suivant la relation:
?? Ea ?
a. cr 0 . exp
= ? ? (III.15)
? KT ?
Ea : est l'énergie d'activation (eV). K :
constante de boltzmann.
En variant la température de l'échantillon de
20-80°C avec pas de 10°C, dans l'intervalle, nous avons
déterminé la conductivité pour chaque température,
suivant la relation donnée dans le paragraphe précédent.
Le tracé logarithme de la conductivité en fonction de l'inverse
de la température, donne une courbe linéaire, et l'exploitation
de la pente permet d'obtenir l'énergie d'activation (Fig. III.13).

I(mA)
20
15
10
5
0
0,0 0,5 1,0 1,5 2,0 2,5
V(volt)
Figure.III.12 : Exemple d'une
caractéristique courant-tension, pour la détermination de
la
résistance électrique du film.

Ln 6
-1,1
-1,2
-1,3
-1,4
-1,5
-1,6
-1,7
-1,8
ZnO non dopé (Ea= 0.0786 ev) DATA1A
2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5
1000/T
Figure.III.13 : Tracé du
logarithme de la conductivité en fonction de l'inverse de la
température, pour de
la détermination de l'énergie
d'activation.
|
Chapitre IV
Résultats et Discussions
|
Dans ce chapitre nous présentons les résultats
de notre travail portant sur l'élaboration et la caractérisation
de couches minces d'oxyde de zinc (ZnO) dopé et non dopé
déposées par la technique de spray ultrasonique. L'influence du
dopage sur les différentes propriétés structurales,
optiques et électriques a été étudiée.
Les films obtenus ont été
caractérisés par différentes techniques. La diffraction
des rayons X pour l'étude de la structure, la taille des grains et les
contraintes. La transmission optique dans le UV-visible pour la
détermination des propriétés optiques fondamentales, en
l'occurrence, le gap optique et l'indice de réfraction. Enfin, la
technique des deux pointes pour la conductivité électrique et
l'énergie d'activation. Notons que ces différentes
méthodes de caractérisation ont été
développées dans le chapitre III.
IV.2. Cinétique de croissance des
films:
Sur la figure IV.1 nous avons rapporté, pour trois
dopants (Al2(SO4)3, Al(NO3)3, In(Cl3)), la variation de la vitesse de
croissance en fonction du pourcentage de dopage. D'après la figure IV.1
on constate que la vitesse est très sensible à la concentration
et à la nature du dopant. La différence entre le comportement des
solutions utilisées est due à celle de l'enthalpie de
dissociation et la nature chimique de chaque précurseur. Il faut
rappeler que l'enthalpie de dissociation de l'acétate de Zinc est
égale à 0.1 Kcal/mol (0.043 eV) tandis que celle du nitrate de
Zinc est de 10 Kcal/mol (0.43 eV). Ces valeurs montrent qu'en phase de
dépôt, l'acétate se dissocie plus facilement que le
nitrate. Ceci explique, à la température de substrat de
350°C, la valeur élevée de la vitesse de croissance obtenue
dans le cas des films déposés avec l'acétate. Cette
vitesse vaut, pratiquement, le double de celle des films déposés
avec du nitrate Dans la gamme de température explorée dans cette
étude, l'influence de la température du substrat sur la vitesse
de croissance dépend de la nature du précurseur.
L'acétate de zinc a une enthalpie de dissociation
très faible (0.1 Kcal/mol), par conséquent, le contrôle de
la vitesse de croissance par la dissociation du précurseur s'effectue
à des températures plus basses que celles utilisées dans
notre étude. De ce fait, nous n'avons observé que deux gammes de
température influant sur la cinétique de croissance des films
élaborés à partir de l'acétate de zinc (figure
IV.1). Par ailleurs, dans le cas de faibles températures de substrat
200-250 °C, en étudiant la cinétique de croissance des films
ZnO déposés à partir de l'acétate, Ayouchi et al
[14] ont observé une diminution de la vitesse de croissance. Ce
résultat montre que le phénomène de dissociation de
l'acétate de zinc et son impact sur la cinétique de croissance se
fait apparaître à des températures de dépôt
plus basses que pour les autres précurseurs.
0 2 4 6 8 10

Vitesse de Croissance (A/min)
450
400
350
300
250
200
150
100
ZnO dopé avec Al(NO3)3 ZnO
dopé avec Al2(SO4)3 ZnO dopé avec In Cl3
Dopage (% wt)
Figure IV.1 : Variation de la
vitesse de croissance des films ZnO dopés
(:Al(NO3)3,
?:Al2(SO4)3, ?:InCl3) et non dopé.
IV.3. Propriétés structurales :
La caractérisation structurale des solides cristallins
peut être effectuée par plusieurs moyens et en particulier par la
diffraction de RX. Le diffractomètre utilisé pour la
caractérisation de nos échantillons est du type SIEMENS D8
advance Bruker AXS à anode en cuivre ayant un faisceau de RX de longueur
d'onde de ëKá(Cu) = 1.5405 Å et un monochromateur
en graphite.
A partir des spectres du rayon X, on peut déterminer
l'état des couches de ZnO dopées et non dopées. Ces
dernières, et selon les conditions expérimentales
utilisées dans chaque dépôt, peuvent être
cristallines, polycristallines ou bien amorphe. Dans l'état cristallin,
les films présentent une orientation préférentielle selon
l'axe c de direction (002), ce qui confirme la structure de Wurtzite des films.
Les spectres de diffraction des rayons X de trois séries de couches
minces de ZnO sont présentés ci-dessous. Elles montrent
l'influence du pourcentage de dopage des différents dopants
(Al2(SO4)3, Al(NO3)3, InCl3) sur les évolutions des pics qui
caractérisent les orientations dans le réseau.
Nous avons rapporté, sur les figures IV.2, IV.3 et
IV.4, les spectres de diffraction des rayons X du ZnO pour différents
pourcentages de dopage et pour les trois dopants. Dans
l'ensemble des films, nous n'avons pas observé une
orientationpréférentielle, mais plutôt trois directions:
[002], [100] et [101] avec des intensités variables. Notons qu'à
fort pourcentage de dopage, le pic relatif à l'orientation [002],
observé autour de 34°, est le plus intense puis diminue
progressivement, avec le dopage, pour devenir du même ordre que les pics
des autres orientations. Ce résultat découle du fait que le plan
[002] qui est parallèle à l'axe c, donc normale à la
surface libre de l'échantillon, est le plan qui exige la plus faible
énergie de formation [21]. A faible taux de dopage, on remarque qu'en
plus de la direction normale [002], il y'a émergence des pics [100] et
[101] qui correspondent à une croissance parallèle à la
surface de substrat. Ceci explique que la concentration élevée du
dopant favorise une croissance, selon [002], normale à la surface du
substrat, mais pour les faibles concentrations la croissance du film se fait,
plutôt, de manière tridirectionnelle. Ce résultat montre
que la concentration du dopant influe beaucoup sur la cinétique de
croissance des films ZnO.

ZnO Non dope
ZnO dope 2% Al2(SO4)3 ZnO dope 4% Al2(SO4)3 ZnO dope
6% Al2(SO4)3 ZnO dope 8% Al2(SO4)3 ZnO dope 10% Al2(SO4)3
40
80
60
20
0
160
140
120
100
Intensite (u.a)
20 30 40 50 60
29
Figure IV.2 : Evolution des
spectres de diffraction des rayons X des couches minces du ZnO en
fonction
du pourcentage de dopant Al2 (SO4)3.

140
(002)
120
Intensite (u.a)
100
ZnO non dopé
ZnO dopé 2% Al(NO3)3 ZnO
dopé 4% Al(NO3)3 ZnO dopé 6%
Al(NO3)3 ZnO dopé 8%
Al(NO3)3
80
60
40
20
0
20 30 40 50 60
29
Figure IV.3 Evolution des
spectres de diffraction des rayons X des couches minces de ZnO en
fonction
du pourcentage de dopant Al (NO3)3.
320
300
280
260
(002)
240
ZnO non dopé ZnO dopé 2% In ZnO dopé 4%
In ZnO dopé 6% In ZnO dopé 8% In
180
(002)
(002)
220
200
Intensite (u.a)
160
140
120
100
(002)
80
(002)
60
40
20
0
20 30 40 50 60
29
Figure IV.4 Evolution des
spectres de diffraction des rayons X des couches minces de ZnO en
fonction
du pourcentage de dopant In Cl3.

IV. 3.1 .Taille des grains:
La taille des grains des diverses couches ZnO a
été calculé à partir de la largeur à mi
hauteur du pic [002]. Notons que ce pic est le plus intense dans le cas couches
ZnO. Les résultats de la variation, en fonction du dopage, de la taille
des grains relatifs aux trois dopants sont regroupés sur la figure IV.5.
On observe une croissance de la taille des grains avec pourcentage de dopage
pour les deux précurseurs InCl3 et Al(NO3)3. Par
ailleurs, la réduction de la taille des grains observée entre le
pourcentage de dopage 0 et 4% en Al2(SO4)3 peut être
due à la formation d'une phase intermédiaire constituée
par le Zinc, le soufre et l'Aluminium.
38
ZnO dope Al2(SO4)3 ZnO dope In Cl3 ZnO dope
Al(NO3)3
36
34
Taffie de grain (nm)
32
30
28
26
24
22
20
0 2 4 6 8 10
Dopage (% wt)
Figure IV.5 : Evolution de la
taille des grains des couches ZnO avec la concentration du dopage
pour les
trois sources de dopage (? :Al(NO3)3, :Al2(SO4)3, ?:InCl3).
La réduction de la taille des grains dans le cas de
film élaboré est, probablement, causée par
l'émergence d'autres plans de croissance au détriment de
l'orientation [002] utilisée pour le calcul de la taille des grains. Les
tailles des grains déduites, à partir des évolutions des
pics, varient de 22 à 40 nm. Notons que ces valeurs de la taille des
grains dans nos films restent,
relativement plus faibles, que celle rapportée dans la
littérature [33]. Comme il a été observé par Van
Heerden et al [22] et par Bougrine et al [23], il y'a une dégradation
structurale des films déposés par spray lorsque pourcentage de
dopage est élevée. Cette dégradation est synonyme de la
disparition de l'orientation préférentielle du réseau
cristallin du film.
IV.3.2.Etude des contraintes :
D'une manière générale, la
température de dépôt et la présence des
impuretés sont des moyens très efficaces pour réduire les
contraintes internes des matériaux élaborés sous forme de
couches minces. Les contraintes dans les films ZnO ont été
estimées à partir de l'exploitation du décalage de la
position du pic (002) des spectres de diffraction X par rapport à
34°. Les valeurs des contraintes trouvées dans nos couches sont
situées entre 0.109 GPa et 0.125 GPa. La présence des contraintes
extensives est probablement due à l'insertion d'atomes étrangers
dans le réseau cristallin (les atomes des dopants en position
interstitielle....).
L'augmentation de la cristallinité et de la taille des
grains dans une couche mince de ZnO est à l'origine de la diminution des
contraintes.
IV.4. Propriétés Optiques :
Les caractérisations optiques ont été
basées sur la spectroscopie de transmission dans l'UV-Visible. En effet,
comme il a été détaillé dans le chapitre
précédent, l'exploitation des spectres nous permet de calculer le
gap optique. Sur les figures IV.6, IV.7 et IV.8 sont regroupés les
spectres de transmission, dans la gamme de 200 à 800 nm, des films
élaborés avec les différents dopants : Al(NO3)3,
Al2(SO4)3, et InCl3 respectivement. De plus, chaque figure
représente des pourcentages de dopage différents. Bien que
l'allure générale des spectres soit identique, ceux-ci sont
composés de deux régions:

Une région de forte transparence située entre
400 et 800nm, la valeur de la transmission est de l'ordre de 75 à 85%.
Cette valeur, rapportée par plusieurs auteurs [67], confère aux
couches minces de ZnO, dopé et non dopé, le caractère de
transparence dans le visible. Dans cette gamme de longueur d'onde, on observe
des franges d'interférences dans le cas des films élaborés
avec une température de substrat fixe (350 °C). Ces franges,
caractérisées par les ondulations des courbes, sont dues à
la réflexion multiple du rayonnement sur les deux interfaces du film. Ce
résultat indique que les films préparés avec ces
conditions sont homogènes et
de surfaces lisses. Ceci confirme que les températures
de dépôt optimales permettant d'obtenir des films ZnO
transparents, uniformes et stoechiométriques se situent au voisinage de
350°C. Notons que le choix de cette température de substrat optimum
est basé sur les travaux antérieurs réalisés au
sein de notre équipe par Baghriche [Magister]

Une région de forte absorption. Cette région
correspond à l'absorption fondamentale (ë<400nm) dans les films
de ZnO dopés et non dopés. Cette absorption est due à la
transition électronique inter bande. La variation de la transmission
dans cette région est exploitée pour la détermination du
gap. D'autre part, on observe, avec l'augmentation de pourcentage de dopage, un
décalage du seuil d'absorption vers les grandes énergies. Ce
décalage est dû à l'accroissement de la concentration des
porteurs libres dans le matériau [9]. Le décalage dans le seuil
d'absorption est aussi égalà la variation du gap ÄEg qui est
exprimé par la relation suivante [72] :
2
2
3
h

*
(3 )
n ?
8
AEg =
m
où h, m* et n sont respectivement la constante de
Planck, la masse effective des porteurs et la concentration des
électrons libres.
Cette relation montre que la variation du gap est,
principalement, causée par la concentration des électrons libres.
Par conséquent, les films préparés avec une
température de substrat de 350 °C et différents pourcentages
de dopage contiennent une concentration élevée
d'électronslibres [59] ce qui est, comme il sera montré dans la
suite de ce chapitre, en parfait accord avec la variation de leur gap optique
et leur conductivité électriques.

100
80
Transmittance (%)
60
40
20
ZnO non dope
ZnO dope 2% Al(NO3)3 ZnO dope 4% Al(NO3)3 ZnO dope 6% Al(NO3)3
ZnO dope 8% Al(NO3)3
0
300 400 500 600 700 800
Longueur d'onde (nm)
Figure IV.6 : Variation de la
transmittance des films de ZnO dopés avec Al (NO3)3
en fonction de la
longueur d'onde.
100
80
Transmittance (%)
60
40
20
ZnO non dope
ZnO dope 2% Al(SO4)3 ZnO dope 4% Al(SO4)3 ZnO dope 6% Al(SO4)3
ZnO dope 8% Al(SO4)3 ZnO dope 10% Al(SO4)3
0
300 400 500 600 700 800
Longueur d'onde (nm)
Figure IV.7 : Variation de la
transmittance des films de ZnO dopés avec Al2(SO4)3
en fonction de la
longueur d'onde.
300 400 500 600 700 800

Transmittance (%)
40
60
20
0
ZnO non dope ZnO dope 2% In ZnO dope 4% In ZnO dope 6% In ZnO
dope 8% In
Longueur d'onde (nm)
Figure IV.8 : Variation de la
transmittance des films de ZnO dopés avec In Cl3
en fonction de la
longueur d'onde.
IV.4.3. Désordre (Energie d'urbach):
Le spray ultrasonique est une méthode de
dépôt dans laquelle la croissance du film se fait par condensation
pyrolytique. Dans cette situation, les atomes arrivant sur le substrat peuvent
se coller au point de leur atterrissage. Par conséquent, les atomes dans
le réseau du film ne sont pas généralement dans une
position idéale, d'où l'apparition des écarts dans la
largeur de la liaison Zn-O, Dans ce cas, les bords de bande décrits dans
le cas de réseaux cristallins et délimités par
Ev et Ec peuvent disparaître. On observe ce que
l'on appelle des états localisés formés en queues de bande
aux frontières de la bande interdite dans la bande de valence et de
conduction. Pour des énergies supérieures à Ec
et inférieure à Ev, se trouvent les états
étendus (figure IV.9), cet écart est connus sous le noms de
désordre. Lorsque le désordre devient trop important (par exemple
avec l'apparition de liaisons pendantes ou d'impuretés dans le
matériau), les queues peuvent s'empiéter. Nous définirons
alors la notion de paramètre d'Urbach ( E00 ) qui
correspond à des
transitions entre les états étendus de la bande de
valence et les états localisés de la bande de conduction.

Figure IV.9 : Fonction de
distribution des états d'énergie dans les bandes [22].
Il est possible de déduire le désordre à
partir de la variation des coefficients d'absorption. Le coefficient
d'absorption est lié au désordre par la loi a=
a0 . exp(hv E00), E00 étant la
largeur
de la queue de bande qui caractère le désordre.
De même, nos valeurs de l'énergie d'Urbach sont
comparables
à celles trouvées par d'autres auteurs (0,1-0,6 eV). Bougrine
et al. [23] ont
interprété l'énergie d'Urbach
E00 comme étant la largeur des bandes des
états localisés dans la
bande interdite. L'étude menée par [24] a
montré qu'il y'a une augmentation de E00 avec le
pourcentage de dopage. Song et al. [25] proposent, comme
interprétation à cette variation, les niveaux donneurs des atomes
interstitiels de zinc.
Par ailleurs, nous avons calculé la largeur de queue
E00 dans les films dopés. Les résultats
obtenus sont représentés sur la figure IV.10.
Comme on peut le voir, le traitement est accompagné successivement, pour
les films déposés à l'ambiante, par une augmentation et
une réduction du désordre, cette dernière indiquant une
meilleure réorganisation des ces films. Il faut noter que, durant la
croissance du film, la température du substrat influe sur la
mobilité des atomes arrivant en surface. Si la température du
substrat est élevée; les atomes arrivant en surface ont
suffisamment d'énergie pour se déplacer sur celui ci et trouver
un site favorable. A température élevée, il en
résulte une meilleure organisation du film. Cela explique les valeurs
élevées de E00 déterminées dans
les films élaborés à l'ambiante. Comme il est
montré sur cette
même figure, l'augmentation du désordre
apparaît dès l'introduction des dopants (0 à 8%) dans le
réseau du ZnO. Comme celui ci a une faible taille (a=2.6650 Å et
c=4.9470 Å), l'oxygène provoque sa distorsion et c'est cette
dernière qui est à l'origine de son augmentation. Au delà
de 300°C, le film adopte une structure hexagonale avec de plus larges
cellules (a=3,2499 Å et c=
5,2060 Å) ce qui favorise, sans distorsion, l'introduction
de l'oxygène sans création de désordre dans le film.
0 2 4 6 8 10

Desordre E. (meV)
400
800
600
200
700
500
300
ZnO dopé avec Al2(SO4)3 ZnO dopé avec
Al(NO3)3 ZnO dopé avec In Cl3
Dopage (% wt)
Figure .IV.10 : Variation de
désordre en fonction de pourcentage du dopage pour les trois
sources
de dopage (?:Al(NO3)3, :Al2(SO4)3, ? :InCl3).
III.4.1. Gap optique :
Sur la figure IV.11, nous avons rapporté la variation
du gap optique des films ZnO dopés par les trois dopants (Al2(SO4)3,
Al(NO3)3, InCl3) et pour différents pourcentages de dopage. Comme
on peut le voir, l'ajout du dopant a tendance à réduire le gap
quelque soit la nature du dopant. En effet, cette diminution du gap dans
l'intervalle 2% - 10% est essentiellement due aux distorsions provoquées
dans le réseau suite à l'introduction d'impureté(dopage).
Lorsque la concentration du dopant augmente, le désordre augmente avec
et, en revanche, le gap optique se réduit de plus en plus. Cette
diminution du gap avec le dopage est causée par l'augmentation de la
concentration des électrons libres. Ceci est, éventuellement, le
résultat de l'occupation des sites interstitiels par les atomes du
dopant car ces derniers, représentent les principaux donneurs natifs
dans les films ZnO [24].

Gap optique (eV)
3,5
3,4
3,3
3,2
3,1
3,0
ZnO dopé avec Al2(SO4)3 ZnO dopé avec
Al(NO3)3 ZnO dopé avec In Cl3
0 2 4 6 8 10
Dopage (% wt)
Figure IV.11 : Variation du gap
optique dans les films de ZnO préparés avec différents
dopants
et des pourcentages de dopage variés (?:Al(NO3)3,
:Al2(SO4)3, ?:InCl3).

Desordre E. (meV)
600
3,40
ZnO dope Al2(SO4)3
550
3,35
500
Gap optique (eV)
3,30
450
3,25
400
3,20
350
3,15
300
3,10
250
0 2 4 6 8
Dopage (%wt)
Figure IV.12 : la variation, en
fonction du dopage, du gap optique et du désordre des couches
minces
de ZnO dopés (Al2(SO4)3).
III.4.2. Indice de réfraction:
Les évolutions, en fonction du pourcentage de dopage,
des indices de réfractions des films minces dopés ZnO:Al, ZnO :In
sont montrées sur la figure IV.13. Ces variations montrent que l'indice
de réfraction diminue avec la concentration du dopant. Cet abaissement
de l'indice de réfraction peut être principalement
attribuée à une augmentation de la concentration des porteurs
dans les films ZnO:Al et ZnO:In. comme confirmé par l'augmentation de
conductivité dans la Figure.IV.10. La Figure.IV.13 montre que la
conductivité augmente avec la concentration des dopants croissante, en
indiquant que la concentration du porteur augmente avec l'augmentation de la
concentration du dopant. Okuyama et Mazon et al. [45,46] a trouvé que
l'indice de réfraction est été en rapport inversement avec
la concentration du porteur. C'est bien connu [15,16] cet Al que
l'impudicité a dopé dans films ZnO peut agir comme un donateur
efficace par suite d'introduction substitutionnel d'Al3+ dans le
Zn2+ placez ou incorporation d'Al ions dans les places
interstitielles, produire des porteurs libres. Avec la concentration du dopant
croissante, la concentration du porteur dans les films ZnO:Al est
augmentée. Par conséquent, l'indice de réfraction est
diminué.
2 3 4 5 6 7 8

Indice de refraction
2,6
2,4
2,2
2,0
1,8
1,6
1,4
ZnO dope Al(NO3)3 ZnO dope Al2(SO4)3 ZnO
dope In Cl3
Dopage (% wt)
Figure.IV.13 : Variation de
l'indice de réfraction en fonction du dopage pour les trois
sources
de dopage (:Al(NO3)3, ?:Al2(SO4)3, ?:InCl3).
2 3 4 5 6 7 8

Indice de refraction
2,55
2,50
2,45
2,40
2,35
2,30
ZnO dope In Cl3
450
400
250
550
500
350
300
Desordre E. (meV)
Dopage (%wt)
Figure IV.14 : la variation de
l'indice de réfractionet le désordre en fonction de
dopage.
IV.5. Les propriétés électriques
:
Les propriétés électriques des couches
minces de ZnO dopé et non dopé sont d'un intérêt
considérable dans plusieurs applications industrielles telle que les
cellules solaires et les écrans plats. Parmi ces
propriétés on cite la conductivité électrique comme
étant le paramètre le plus important.
IV.5.1. Conductivité électrique
:
Nous avons étudié, à l`obscurité,
la variation, avec la pourcentage de dopage, de la conductivité
électrique des couches minces de ZnO dopées. Tout comme le gap
optique, l'influence du pourcentage de dopage sur la conductivité est
représentée sur la figure IV.15. Sur cette même figure nous
montrons aussi l'effet de chaque dopant sur la conductivité. On observe
des évolutions identiques pour les deux précurseurs Al(NO3)3
et In Cl3. Un faible dopage de l'ordre de 2% augmente la valeur
de la conductivité par un ordre de grandeur. Cependant, une diminution
de la conductivité dans la gamme 2%-4%. A partir de ce dernier
pourcentage elle reste pratiquement constante. Par ailleurs, on trouve un
comportement différent de la conductivité pour un faible dopage
(=2%) avec Al2(SO4)3. Au-delà de ce pourcentage, la
conductivité reste croissante. Cette augmentation de la
conductivité avec la concentration peut être
interprétée par l'accroissement du nombre des porteurs de charges
(électrons) provenant des ions donneurs qui sont incorporés dans
les emplacements substitutionnels ou interstitiels de cation de Zn2+
[73].
Comme il a été trouvé pour l'influence du
pourcentage de dopage sur la vitesse de croissance. A faible pourcentage de
dopage la vitesse de déposition est décroissante car une partie
de la solution de départ, non dissociée ou partiellement
dissociée, ne contribue pas à la formation des couches ou bien
les réactions entrant dans leurs cinétiques de croissance sont
lentes [25]. Ces deux derniers phénomènes peuvent être
à l'origine des variationsde la conductivité et du gap optique en
fonction de pourcentage de dopage. En effet, le rétrécissement du
gap est causé par l'augmentation des porteurs libres induite par
l'accroissement du désordre dans les films.
0 2 4 6 8

Conductivite (n.cm)-1
0,01
0,1
1
ZnO dopé avec Al2(SO4)3 ZnO dopé avec
Al(NO3)3 ZnO dopé avec In Cl3
Dopage (% wt)
Figure IV.15 : la variation de la
conductivité électrique de ZnO en fonction de pourcentage
de
dopage pour les trois sources de dopage (? : InCl3, :Al2(SO4)3,
?: Al(NO3)3).
Nous avons regroupé dans le tableau (IV.1) les valeurs
des propriétés fondamentales des couches ZnO
préparées par différentes techniques d'élaboration.
Nous avons trouvé une différence entre nos valeurs de la
conductivité et celles rapportées dans la littérature. On
remarque que la méthode d'élaboration influe beaucoup sur la
conductivité du film. Elle varie de 103 ( cm)-1
pour le cas de films obtenus par pulvérisation réactive
jusqu'à une valeur de l'ordre de 10-4 ( cm)-1 pour
ceux synthétisés avec la technique de sol gel. De plus, comme
rapporte les travaux de M. de la L. Olvera et al [74], la température de
substrat influe énormément sur la conductivité. Ils ont
trouvé que l'augmentation de la température fait accroître
la conductivité.
En général, la différence entre les valeurs
des propriétés optoélectriques des couches minces obtenues
par différentes techniques peut être attribuée aux facteurs
suivants :
-L'existence, le type et la source de l'impureté
(dopant).
-L'existence des pores résiduels dans les couches.
Nous avons déterminé ici les
propriétés électriques de nos couches de ZnO. La
microstructure
des couches joue un rôle important sur les
propriétés électriques d'un oxyde semiconducteur
puisque la hauteur des barrières de potentiel qui
existent entre les grains dépend essentiellement de l'état du
matériau de départ utilisé et des conditions
expérimentales de sa synthèse. Le transport dans les couches
minces de ZnO dépend de la présence des défauts, en
particulier, les lacunes d'oxygène, le Zinc en interstitiel et les
dopants. En effet, ces trois types de défauts sont responsables de
l'augmentationdes porteurs libres et par conséquent celle de la
conductivité.
IV.5.2.L'énergie d'activation:
Sur la figure IV.16 nous avons rapporté la variation de
l'énergie d'activation de la conductivité électrique pour
les trois sources des dopants. Cette dernière est déduite de la
pente de la variation de la conductivité en fonction de la
température de mesure. Cette énergie d'activation nous renseigne
sur la position du niveau de Fermi par rapport à celui de la bande de
conduction (Ea= EC-EF). L'énergie d'activation est
déduite de la mesure de la conductivité à
différentes températures. Durant la mesure de la
conductivité nous avons remarqué un fait attrayant dans un bon
nombre d'échantillons. Ce dernier se résume dans l'augmentation
rapide et continu dans le courant quant la mesure est menée à des
températures élevées, et par conséquent la valeur
de l'énergie d'activation dans certains échantillons est
déduite avec une certaine erreur. Ceci complique l'interprétation
de la variation de l'énergie d'activation en fonction de pourcentage de
dopage. La conductivité est donnée par l'expression suivante:
|
0
· 0
· 0
?
|
. exp
|
?_ Ea ?
? ?
1\KT ?
|
La valeur maximale de l'énergie d'activation
trouvée dans nos échantillons est de l'ordre de 0.145 eV. Cette
valeur, donnée par Al2(SO4)3, est très petite devant
celle du gap, ce qui indique que les films sont du type n. En effet, il est
généralement admis que les couches minces de ZnO sont nativement
du type n. On remarque sur cette meme figure que l'évolution de
l'énergie d'activation en fonction du taux de dopage varie de
manière différente pour les trois sources utilisées. Un
faible dopage en Aluminium, de l'ordre de 2%, provoque un saut rapide dans
l'énergie d'activation mais de manière différente pour les
deux précurseurs.

Energie d'activation (eV)
0 2 4 6 8 10
0,16
0,14
0,12
0,10
0,08
0,06
0,04
0,02
0,00
ZnO dopé avec Al2(SO4)3 ZnO dopé avec
Al(NO3)3 ZnO dopé avec In Cl3
Dopage (% wt)
Figure IV.16 : Variation de
l'énergie d'activation en fonction de pourcentage du dopagepour
les
trois sources de dopage (?:Al(NO3)3, :Al2(SO4)3, ?:InCl3).
La valeur de l'énergie 0,08eV pour ZnO non dopé
augmente jusqu'à 0.15eV pour un dopage de 2% en
Al2(SO4)3 mais, à l'inverse, elle diminue
jusqu'à 0.04eV pour un dopage en Al(NO3)3. Elle est
multiplié par un facteur deux dans le premier cas et elle est
divisée par un facteur deux dans le second cas. Ce résultat
montre que le type de la source utilisée pour le dopage est un facteur
important dans le déplacement du niveau de fermi et par
conséquent la valeur de l'énergie d'activation. L'accroissement
de l'énergie Ea dans le cas Al2(SO4)3 indique
qu'à faible dopage =2% il ne se produit pas un dopage effectif donnant
des couches ZnO :Al mais peut être qu'il y'a formation d'autres phases
qui peuvent provenir des réactions intermédiaires entre le Zinc,
le soufre et l'Aluminium. Ce résultat ne peut être confirmé
et justifié avec exactitude qu'avec une étude et des analyses
poussées des transformations de phases. Au fait et à la
lumière de ce résultat nous préconisons, comme
montré sur la figure IV.17, l'utilisation d'un pourcentage de dopage
supérieur à 2%.

Conductivite (n.cm)-'
Energie d'activation (eV)
2 3 4 5 6 7 8
0,30
0,25
0,20
0,15
0,10
0,05
ZnO dope Al2(SO4)3
0,14
0,12
0,10
0,08
0,06
Dopage (%wt)
Figure IV.14 : la variation de
la conductivité et l'énergie d'activationen fonction du dopage
dans le cas de Al2(SO4)3.
La décroissance de Ea avec le dopage en
Al(NO3)3 montre qu'il n'y a aucune anomalie et que le dopage
s'effectue normalement pour tout les pourcentages utilisées. Enfin,
l'évolution, en forme de U, de l'énergie d'activation avec le
dopage en InCl3 montre un minimum à 4%. Ceci indique
qu'au-delà de cette valeur il y'a une possibilité de formation
d'alliage en InO3 plutôt que de dopage en Aluminium.
|
Tableau.IV.1. Tableau
récapitulatif des propriétés des couches ZnO
élaborées par
différentes techniques.
|
|
Technique
utilisée
|
Dopage
(%wt)
|
Gap
Eg(eV)
|
Energie
d'urbach
EU (meV)
|
Indice de
réfraction
Nf
|
Conductivité
(?cmi1
|
Energie d'activation Ea(eV)
|
Réf.
|
|
Spray
ultrasonique
|
ZnO:Al
|
3,31 -2,8
|
--
|
--
|
0,01 -0,17
|
--
|
[75]
|
|
|
|
Sol gel
|
ZnO:Al
|
--
|
--
|
1,94 -1,71
|
7,1.10-5 -4.10- 4
|
--
|
|
Sol gel
|
ZnO:Zr
|
3,3 -3,27
|
143 - 167
|
--
|
2,94 -13,88
|
--
|
[77]
|
Sol gel
|
ZnO:Ga
|
--
|
--
|
--
|
10 -140
|
--
|
[78]
|
Ablation
laser
|
ZnO:Al
|
3,4 -3,3
|
50 - 110
|
--
|
10 -140
|
--
|
[79]
|
Procédé
pyrosol
|
ZnO:In
|
~ 3,3
|
--
|
1,9 - 2,1
|
0,033 - 100
|
--
|
[80]
|
|
|
Présent
travail
Spray
ultrasonique
|
ZnO
(0%)
ZnO:Al
(=10%)
ZnO:In
(=8%)
|
3,4
3,4 -3,1
3,4 -3,2
|
294
294 -698
294 - 520
|
1,46
1,68 -1,46
2,50 -1,46
|
0,2
0,2 -7,2
0,2 -5,3
|
0,078
0,078 -0,03
0,078 -0,013
|
|

Conclusion générale :
Le travail présenté dans ce mémoire porte
sur la synthèse et l'étude du dopage des couches minces d'oxyde
de zinc élaborées par spray ultrasonique. Pour réaliser
ces dépôts, nous avons utilisé la technique spray
ultrasonique à partir d'une solution d'acétate de zinc en
utilisant, séparément, différentes sources de dopants
(Al(NO3)3, Al2(SO4)3, In Cl3). Cette technique permet d'obtenir des
dépôts ayant des propriétés qui varient selon les
conditions d'élaboration,afin d'étudier les effets du dopage sur
les propriétés physiques des couches minces
réalisées.
Nous avons caractérisé les couches minces
d'oxyde de zinc (ZnO) dopées et non dopées par des
méthodes variées : la diffraction de rayons X (DRX) pour
l'étude structurale, la spectroscopie UV-Visible et
l'ellipsométrie pour l'étude des propriétés
optiques et enfin la méthode des deux pointes pour déterminer les
propriétés électriques de nos couches. Nous avons plus
particulièrement porté notre attention sur l'influence de dopage;
i.e type et concentration du dopant dans le film.
L'étude structurale des films par DRX montre, à
partir des pics du spectre, que tous les films de ZnO non dopés et
dopés obtenus sont polycristallins avec une structure hexagonale
wurtzite et d'une orientation préférentielle (002) d'axe c
perpendiculaire au substrat. D'autre part, l'analyse de ce dernier pic a
montré une légère augmentation de la taille des grains
avec le pourcentage de dopage.
Les caractéristiques optiques des couches minces de ZnO
dopées et non dopées sont aussi modifiées par le
pourcentage de dopage. L'indice de réfraction et les coefficients
d'absorption sont diminués avec le pourcentage de dopage. Ce
résultat est lié à la variation de la compacité du
matériau. La diminution de la largeur de la bande interdite avec le
pourcentage de dopage suggère la disparition des défauts et des
impuretés telles que les atomes interstitiels des dopants.
L'augmentation de l'énergie d'Urbach se traduit par l'augmentation du
désordre structural et l'amélioration de la
stoechiométrie.
Les caractéristiques électriques des couches
minces de ZnO dopées et non dopées montrent que la
conductivité augmente avec l'accroissement de la concentration des
dopants dans la solution. Ce résultat a été
interprété par l'augmentation du nombre des porteurs de charges
(électrons) provenant des ions donneurs Al3+, In3+
incorporés dans les emplacements substitutionnels ou interstitiels de
cation de Zn2+. La valeur maximale de l'énergie
d'activation
trouvée dans nos échantillons est de l'ordre de
0,14 eV. Comme cette valeur est inférieure à la moitié du
gap ce qui indique que les films sont du type n.
Au terme de cette étude, nous pouvons dire que spray
ultrasonique est une technique bien adaptée à
l'élaboration des couches minces de ZnO de bonne qualité quiont
été caractérisée par la présence d'un pic
assez intense dans leur spectre de photoluminescence.
Références :
[1] D.Royer et E. Dieulesaint. Ondes élastiques dans les
solides, ed. Masson, Tomel, (1999).
[2] J. A. Thornto. J. vac. Sci. Technol, Vol4 (6), p.
3059(1986).
[3] S.Dengyuan et al, Solar Energy Materials & Solar Celles
73, pp1- 20(2002).
[4] D.G. Baik, S. M. Cho, Thin Solid Films, Vol 354,
227(1999).
[5] P.M. Martin, M. S. Good, Thin Solid Films, 379, pp. (2000),
253-258.
[6] L.X. Shao et al, Journal of Physics and Chemistry of solids,
64 (2003)1505-1509.
[7] T. Ait Ahcene, Thèse de magister, Université
de Constantine.
[8] K. Badeker. 1907 Ann. Phys. (Leipzig) 22-749.
[9] L. A. Goodman, RCA Rev. 1974; 35:613.
[10] C. M. Lampert. Sol. Energy Mater. (1981), 6-11.
[11] K. L. Chopra. S. Major, D.K. Panday, Thin Solid Films 1983,
102-105.
[12] N. Attaf <<Etude Energétique d'une
Décharge Luminescente Utilisée dans le Dépôt de
Couches Minces de a-Si :H>> Thèse de doctorat
[13] H. J. Michel., H. Leiste., K.D. Schiei-baiim., J.
Halbritler. Appl.Surf.Sci. (1998),126-157.
[14] R. Ayouchi, D. Leinen, F. Martin, M. Gabas, E. Dalchiele,
J.R. Ramos-Barrado, Thin
[15] M. Maache Dépôt et Caractérisation de
Couches Minces de ZnO par Spray Pyrolyse (2005).
[16] Géraldine HUERTAS <<Etude de Nouveaux
Matériaux D'électrode Positive et D'électrolyte Solide
Vitreux Sous Forme de Couches minces pou des Couches Minces Microbatteries au
Lithium>> Thèse de doctorat
[17] Sihem Abed Elaboration et Caractérisation de Couches
Minces d'Oxyde de Zinc Obtenues par Spray Pyrolyse (2005).
[18] C. H. Lee, L. Y. Lin, Thin Solid films, App. Surf .Sci. 92
(1996) 163-166.
[19] G. Ferblantier, A Foucaran, CEM2-CNRS. Université,
Montpellier II, France, (2002).
[20] J. L. Deschanvres, B. Bochu et J. C. Joubert, J.Phy.I. III
France 4, (1994)1243-1251.
[21] B. J. Lokhand, M. D. Uplane, App. Surf. Sci. 167 (2000)
243-246.
[22] Van Heerden, P. Bhattacharya, R.S. Katiyar, Materials
Science and Engineering B103 (2003) 9-15.
[23] A. Bougrine, A. El Hichou, M. Addou, J. Ebothé, A.
Kachouna, M. Troyon, Material Chemistry and Physics 80 (2003) 438-445.
[24] B.N. Pawar, S.R. Jadkar, M.G. Takwal. Solar Energy
Materials & solar cell.
[25] J. Song, I-Jun Park and Kyung-Hoon Yoon, Journal of the
Korean Physical Society, (1996) pp. 219-224.
[26] J. L. Van Heerden, R.Swanepoel, Thin Solid Films 299 (1997)
72-77.
[27] B. J. Lokhande, P.S. Patil, M.D, Uplane, Materials Letters
57 (2002)573-579.
[28] Pere Roca i Cabarrocas, Thèse de Doctorat, Paris VII
(1988).
[29] Yan-mei Jiang, Thèse de Doctorat, Université
de Paris-Sud (1992).
[30] L. Tomasini (Sollac, Groupe Usinor), La Revue de
Métallurgie-CIT (2001).
[31] A. Benzagouta, Thèse de doctorat, Université
de Constantine (2004).
[32] S. J. Chen, J.G.Ma, D.X. Zhao, Z.Z. Zhi, Y.M. lu, J.Y.
Zhang, D.Z. Shen, X.W. Fa Journal of Crystal Growth 240 (2002) 467-472.
[33] J. Jacque Bessot, S. Audisio, Techniques de
l'ingénieur; traitement de surface M5,4 (1989), 1655-1660.
[34] D. Dijkkamp, Y. H. Min-Lee et W.L.Mc,Appl. Phys.Lett.51,
(1987) 619.
[35] D. Vaufrey , Thèse de doctorat, UMR CNRS 5512 ;
(2003).
[36]
www.librecours.org/document/4/402.pdf.
[37] M. S. Aida. Cours post graduation (2005).
[38] S. Zerkout, Thèse de doctorat, Université de
Constantine.
[39] G. K.Wehner, Phys.Rev. (1971) pp.690.
[40] C. Pedoussat, Thèse de doctorat, Université
Paul Sabatier-Toulouse, (1999).
[41] A. Zozime, thèse (Orsay/Villetaneuse, 1977) pp.
3.
[42] De la torre Y Ramos J. Thèse de doctorat, Institut
national des sciences appliquées de Lyon, (2003).
[43] F-Josef Haug, Thesis of doctorat, Swiss Federal Institute
of technologie Zurich (2001).
[44] I. Wuled Lengooro, Yun Chan Kang, Takafumi Komiya, Kikuo
Okuyama and Noboru Tohge, Jpn. J. Appl. Phys.(1998) pp. L 288-L 290.
[45] C. Mazon, J. Muci, A. Sa-Neto, A. Ortiz-Conde and F.J.
Garcia, CH2953-8/91/10000- 1156. IEEE (1991).
[46] K. Okuyama, I.Wuled Lenggorro,Chemical Engineering Science
58(2003)537-547.
[47] R. Schroeder, Faculty of the Virginia Polytechnic Institute
and State University, Blacksburg, (2001).
[48] S. Roy and S. Basu, Bull. Mater. Sci., (2002) 513-515.
[49] B. Corea-Lozano, Ch. Comninellis, A. De battisti, Journal
of applied electrochemistry (1996), 83-89.
[50] S. Rabaste, Thèse de doctorat, Université
Claude Bernard - Lyon 1, (2000).
[51] S. Liebus. Thèse de doctorat, université
Bernard - Lyon 1, (2000).
[52] P. Jenouvrier, Thèse de doctorat, Institut National
Polytechnique de Grenoble, (2003).
[53] J. Whao, K. H. Dahmen, H. Omarcy, L. M. Tonge, T. J. Marks,
B. W. Wessels, C. r. Kannewurf, Appl.Phys.Lett 53, 1750 (1988).
[54] M. Guilloux-Viry, Thèse de doctorat,
Université de Rennes I, (1991).
[55] M.K. Jayaraj, A. Antony and M. Ramachandran, Bull. Mater.
Sci., (2002), pp. 227-
|
|
230.
[56] S. Faÿ, Thèse de doctorat, École
Polytechnique Fédérale de Lausanne, (2003).
[57] P. Nunes, E. Fortunato, P. Tonello, F. BrazFernandes, P.
Vilarinho, R. Martins Vaccum 64(2002) 281-285.
[58] K. Ellmer. J. Appl. Phys, 33 (2000) R17-R-32.
[59] I. Ozeroy, D. Nelson, A.V. Bulgakov, W. Marine, M. Sentis,
Applied Surface Science 212-213 (2003) 349-352.
[60] Catalogue, Centre de transfert de technologies
céramique, page 43.
[61] S. B. Majumder, M. Jain, P. S. Dobal, R.S. Katiyar,
Materials Science and Engineering B103 (2003) 16-25.
[62] J. Nishino, Shigeo Ohshio, and Kiichiro Kamata, J. Am.
Ceram. Soc, 75 (1992). 3469- 72.
[63] J. D. H. Donnay and Helen.M.Ondik, Crystal data. Inorganic
Compounds, Vol 2,3ème Edition JCPOS (1973).
[64] R. W. G. Wyckoff, Crystal Structures, Inter Science
Publishers, INC.New York (1960) 19.
[65] N. Ho Kim and H. Woo Kim, Materals Letters, 58
(2004)938.
[66] M. Johan. Carlsson, Thesis for the degree of Doctor,
Chalmers University of Technology and Goteborg University, Sweden. 2002.
[67] M. Rebien, W. Henrion, M. Bar, Ch-H.Fischer, Appl. Phys.
Lett; 80 (2002) 3518.
[68] F. Ng-Cheng-Chin, M. Roslin, Z. H. Gu. T. Z. Fahidy,
J.Phys.D Appl.Phy;31(1998).
[69] K. T. Ramakrisha Reddy, T.B.S. Reddy, I. Forbes, R.W.
Miles, Surf. and Coat. Techn. 151-152 (2002) 110-113.
[70]
www.Wkipidia.com.
[71] Jean-Louis Santailler «Journée
thématique INP Grenoble - Minatec ».
[72] J. Mass, P. Bhattacharya, R.S. Katiyar Materials Sciences
and Engineering B103 (2003) 9-15
[73] S. S. Lin, J.L. Hung, P; Sajgalik; Surf.Coat. Technol.
185 (2004) 254.
[74] M. de la L. Oliva, A. Maldonao and R. Asomoza; Thin Solid
Films, 229 (1993) 196-200.
[75] Jin-Hong Lee, Byung-Ok Park; Materials Sciences and
Engineering B106 (2004) 242- 245
[76] Radhouan Bel Hadj Tahar; Jornal of the European Ceramic
Society 25 (2005) 3301-3306
[77] G.K. Paul, S. Bandyobadhyay, S.K. Sen, S. Sen; Materials
chemistry and physics 79 (2003) 71-75.
[78] G.K. Paul, S.K. Sen; Materials letters 57 (2002)
742-746.
[79] J. Mass, P. Bhattacharya, R.S. Katiyar; Materials Sciences
and Engineering B103 (2003) 9-15.
|
|
[80] A. Tiburcio-Silver, J.C. Joubert et M.
Labeau ; J. Phys. III France 2 (1992) 1267-1303.
|
Doping study of ZnO thin films deposited by
ultrasonic
spray
Abstract:
Zinc oxide (ZnO) is a binary semiconductor material with
direct band gap (3,3 eV) because of their good optoelectronics properties, ZnO
films find several applications such as: solar cells, gas sensors,
piezoelectric sensors, waves guides... etc. ZnO thin films can be prepared by
several techniques, such as: spray, thermal evaporation, reactive sputtering,
sol gel, laser ablation... etc. In the present work and in the order to obtain
conducting transparent layers, ZnO thin films were deposited by ultrasonic
spray technique on glass substrates. Our interest is on the investigation of
the doping level influence on the structural, optical and electrical properties
of ZnO thin films. One has used three dopants sources; i.e Al2(SO4)3,
Al(NO3)3, InCl3. We varied the rate of doping of 0 to 8% wt in the
starting solution. The optical characterization of deposited films was carried
out using UV-Vis spectrometry in the spectral range 200-800 nm. The analysis of
the transmittance spectra allows us to deduce the films thicknesses and optical
band gaps. Hence, the values of the gap were found to be between 3.4 to 3.1 eV.
X-ray diffraction patterns confirm that films are nanocrystalline and exhibit
the (0 0 2) direction as a preferred orientation. The electrical conductivity
and its activation energy were calculated from transport measurement in a two
probes coplanar structure.
Key Words: ZnO, thin films,
ultrasonic spray, transmission, XRD.
??? ???? ?????? ??????? ????? ????? ??????? ??????? ?????
?????
??????
|
:
|
ÕÜÎáã
|
|
???? ??.(3.3eV
|
)
|
??????? ????? ?????? ????? ?? ???? ???
ßäÒáÇ ?????
|
|
??????? ????
ÉíÓãÔáÇ ??????
|
: ???? ????? ??????? ??? ???
|
???? ??? ÉÏíÌ
|
?????????
|
|
????? ????
|
íØÈåãáÇ ????
:???? ÞÑØ ???? ??????? ??? ????
|
. ??? .. .
|
?????? ????
|
|
. ???
|
. . .
|
???????
|
????? íÑÇÑÍáÇ
?????? íÊæÕáÇ
|
|
????? ??? ?????? ??? ???? ?????? (ZnO) ??????? ??? ???? ?????
??? ??
???? ?????????? ??????? ??? ??????? ????? ????? ?? ????? ??? ??
?????? ÌÇÌÒáÇ ??
?????? ????? ??? ???????? ????
|
. ( TCO
|
)
|
??????? ????? ?? ??????? ???
|
????? ????? ?????
|
|
?? .%80 ?? ??????? ???? ???? ????
|
(Al2(SO4)3, Al(NO3)3, InCl3
|
)
|
????????
|
??
|
|
: ??????? ?????? ???? ??????? ??? ????
?????? ?? UV-Vis ???????? ???? ??????? ???? ??????? ???????
. ??????? ???? ???????? ???????? ?????
|
?????? ??? ????
|
???
|
(nm) 800
|
|
200
|
????? ????? ??? ??
ÉíæíäÈáÇ ??????? ??????
??? ??? ??????? ????? ??????
. ??????? ??? ?? ???????? ???????? ? ???????? ??? ????? ????
???????
|
???????? ?????? ??? ???? ???
|
(Deux pointes)
|
?????? ?????????? ??????? ????
|
.Ea ?????? ? ????? ??????????
|
.
|
x ???? ???????? íÊæÕáÇ
???? ÉÞíÞÑáÇ ???????
ßäÒáÇ ?? ???:
ÉÜáÇÏáÇ
ÊÇÜãáßáÇ
|
Résumé
L'oxyde de zinc (ZnO) est un matériau binaire,
semi-conducteur à large gap direct (3,3 eV) .Vu leurs bonnes
propriétés optoélectroniques, les couches minces trouvent
plusieurs applications telles que : cellules solaires, capteurs à gaz,
capteurs piézoélectrique, guides d'ondes...etc. Les films minces
ZnO peuvent être élaborés par plusieurs techniques, il faut
citer : spray pyrolyse, évaporation thermique, pulvérisation
réactive, sol gel, ablation laser...etc. Dans ce travail, des couches
minces d'oxyde de Zinc ont été déposées par la
technique de spray ultrasonique sur des substrats en verre. Notre
intérêt consiste à améliorer la qualité de
ces couches par l'étude de l'influence des dopants sur les
propriétés structurales, optiques et électriques afin
d'obtenir des couches transparentes et conductrices.). Pour cela, nous avons
utilisé trois sources des dopants (Al2(SO4)3, Al(NO3)3, InCl3).
A chaque fois, le taux de dopage a été varié de 0 à
8% en poids. La caractérisation optique des films a été
réalisée à l'aide d'un spectrométrie UV- Visible
dans la gamme spectrale allant de 200 à 800 nm. L'analyse des spectres
de transmittance nous a permis de déterminer les épaisseurs et
les gaps des films. A partir des spectres de transmittance nous avons
déduit les gaps optiques Eg des films de ZnO.
Selon les conditions d'élaboration les valeurs des gaps
obtenues varient entre 3.4 à 3.1 eV. Les
spectres de diffraction des
RX montrent que les films déposés avec différents
pourcentages du
dopage sont fortement texturés et présentent
une orientation préférentielle suivant la direction
(002). Les mesures électriques ont été
réalisées à l'aide de la technique des deux pointes
quipermet de déduire la conductivité et
l'énergie d'activation.
Mots Clés : ZnO, Couche
Mince, Spray, Transmittance, Propriété physique, DRX.
| 


