III.2. Coproculture
La diagnose des oeufs de strongle digestifs est difficile,
pour différencier au moins le genre, il convient de réaliser une
coproculture (FOURCADE, 2012). La coproculture sert à cultiver les
oeufs de strongle afin d'obtenir des larves du troisième âge (L3)
qui représentent l'élément infestant pour un animal. On
réalise ainsi au laboratoire ce qui se produit dans le milieu
extérieur quand les conditions sont favorables (température,
oxygénation, humidité). On réalise d'abord la culture des
oeufs puis la récolte des larves (GRABER et
al, 1983).
III.2.1.Culture des oeufs:
Méthode de Brumpt
C'est la plus classique des méthodes, elle consiste
à déposer dans une boite de Pétri, plusieurs
épaisseurs de papiers filtre ou papier buvard imbibé d'eau, de
manière à humidifier le substrat ; à délayer
le prélèvement fécal avec de l'eau pour obtenir une
pâte molle qu'on étale sur le papierbuvard. Les boites de
Pétri ainsi préparées sont déposées dans un
cristallisoir dont le fond est tapissé de coton fortement
humecté, le tout recouvert d'une vitre. On maintient l'enceinte à
la température de 25-27°C et la vitre est retirée chaque
jour pendant quelques minutes pour aérer le milieu. Les tampons de coton
sontré-humectés périodiquement selon l'évaporation.
L'évolution des formes parasitaires demande de 8 à 10 jours
(DORCHIES et al, 2012 cité par FOURCADE, 2012).
III.2.2. Extraction des
larves
III.2.2.1. Technique de
Baermann
C'est la technique la plus employée. Le principe de la
technique de Baermann est d'extraire des larves (L3) vivantes de la masse
fécale mis en culture, en utilisant leurs propriétés
d'hygrotropisme positif et phototropisme négatif (FOREYT, 1989
cité par MOUSSOUMI, 2014). On prélève 20g de
matière fécale qu'on place dans une gaze. La gaze est
déposée dans une passoire suspendue dans un entonnoir rempli
d'eau (le tamis doit être en contact avec l'eau, la gaze doit s'imbiber
d'eau) relié à un tube en caoutchouc fermé à son
extrémité distale afin de maintenir le volume d'eau. Laisser
reposer 6 à 24heures. Au bout de 24h, on recueille 10 ml du liquide
devant contenir les larves dans un pot. Centrifuger si possible ces 10 ml
pendant 3 mm à 1500-2000 tours/minute. Rejeter 9 ml et
homogénéiser la partie restante à l'aide d'un agitateur.
Aspirer quelques gouttes et examiner au microscope entre lame et lamelle
(GRABER et al (1984). Les larves sont facilement observables à
la loupe binoculaire (objectif x2 à x4) ou au microscope à faible
grossissement. Pour leur identification, les larvespeuvent être
immobilisées par une goutte d'iodomercurate de potassium ou une goutte
de Lugol.
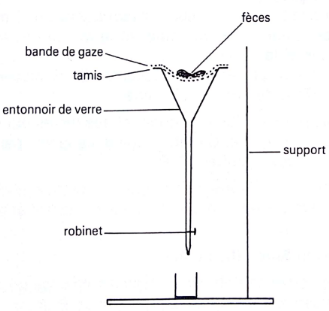
Figure 18:
Schéma de montage de Baermann
(GRABER et al, 1983)
| 


