I.3.3 Pouvoir pathogène
Le pouvoir pathogène du VFVR est variable
qualitativement ou quantitativement selon l'origine géographique et
selon les souches. En effet, on distingue des souches
viscérotropes, neurotropes ou
pantropes selon le lieu de prédilection.
La variation génétique du VFVR a
été estimée en séquences une partie de l'ARN du
segment N de 22 isolats de diverses espèces hôtes. L'ARN du
segment N de l'isolat égyptien (ZH501), a été
utilisé comme référence pour ces comparaisons.
La plupart des isolats étaient très comparables
à ZH501 aux niveaux des séquences des acides nucléiques et
des séquences déduites des acides aminés. La variation des
séquences des acides nucléiques était de 0 à 4,5%
et celle des acides aminés de 0 à 2,4%. On a identifié des
modifications spécifiques codant les acides aminés qui peuvent
jouer un rôle dans la neutralisation du virus et contribuer à sa
virulence.
Comme d'autres Arbovirus, le VFVR circule du site
d'inoculation aux ganglions lymphatiques via la circulation lymphatique.
Après réplication dans les ganglions lymphatiques, sa
dissémination dans l'organisme est assurée par la circulation
sanguine engendrant une virémie primaire et l'infection des organes
cibles. Un examen sanguin lors d'une atteinte par le VFVR est
caractérisé par une profonde leucopénie, une
élévation des enzymes hépatiques associée aux
lésions hépatiques et une thrombocytopénie.
Le foie, la rate et le cerveau sont des sites de
prédilection pour la réplication du VFVR. Dans les atteintes
aigues, le VFVR affecte principalement le foie ; les cellules
hépatiques entrent rapidement en nécrose générale
ou focale du foie, nécrose qui est caractérisée par une
décoloration du parenchyme hépatique. Les hépatocytes
infectées présentent des inclusions intranucléaires ovales
ou en bâtonnets supposées contenir les protéines NSs
(AFSSA, 2008).
I.3.4 Pouvoir antigène et immunogène
Dans la plupart des infections virales, le VFVR est
supposé induire une réponse immunitaire innée et adaptive.
L'immunité innée assure la défense de l'organisme avant la
mise en place des mécanismes d'activation. La réponse immunitaire
cellulaire est encore mal connue et il est admis que les infections à
Bunyavirus déclenchent une réponse humorale qui joue un
rôle important dans la protection du sujet infecté. La
nucléoprotéine NP est l'immunogène majeure, mais les
anticorps neutralisants, possédant un rôle protecteur, sont
dirigés contre les glycoprotéines Gn et Gc (AFSSA, 2008).
Les anticorps IgM apparaissent d'abord trois à cinq
jours après le déclenchement de l'infection de FVR, au moment
où la virémie s'arrête. Ils persistent durant un à
deux, ou trois à quatre mois chez certains animaux. Les anticorps IgG
apparaissent 10 à 14 jours après le début de l'infection
et persistent pendant au moins un à deux ans, ou durent toute la
vie.Lors de réinfection, des IgM apparaissent (même en
présence d'IgG), mais elles sont éphémères (Fig.
I.3). Cette caractéristique est mise à profit pour le
dépistage d'infections récentes.
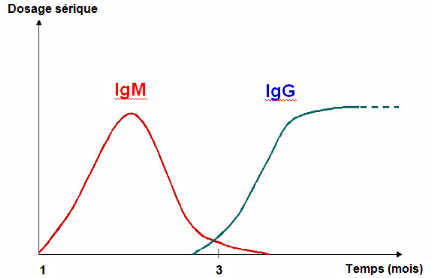
Figure I.3 : Coexistence IgG - IgM
(AFSSA, op. cit.)
| 


