|
ÉíÈÚÔáÇ
ÉíØÇÑÞãíÏáÇ
ÉíÑÆÇÒÌáÇ
ÉíÑæåãÌáÇ
íãáÚáÇ
ËÍÈáÇæ
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ

Université Ferhat Abbas Sétif 1
Faculté des Sciences de la Nature et de la Vie
1 íØÓ
ÓÇÈÚ ÊÇÍÑ
ÉÚãÇÌ
ÉÇíÍáÇæ
ÉÚíÈØáÇ
ãæáÚ Éíáß
DEPARTEMENT DE MICROBIOLOGIE N0
/SNV/2016
MÉMOIRE
Présenté par
ACHACHA Hadjer KHELLAF Besma
Pour l'obtention du diplôme de
MASTER
Filière : Biologie
Spécialité : Ecologie
microbienne
THÈME
Production de glutamate par Corynebacterium
glutamicum 2262 : Mise au point du milieu de culture à base de son
de blé.
Soutenue publiquement le 05/06/2016
|
DEVANT LE JURY
|
|
|
|
|
- ZERROUG Med. Mihoub
|
:
|
Pr. UFA Sétif-1
|
Président
|
|
- MOUFFOK Abdenacer
|
:
|
M.A.A UFA Sétif-1
|
Encadreur
|
|
- BOUSSOUALIM Naouel
|
:
|
Dr. UFA Sétif-1
|
Examinatrice
|
Laboratoire de Microbiologie
Appliquée
Remerciements
Tout d'abord, nous remercions ALLAH, notre
créateur de nos
avoir donné la force, la
volonté et le courage afin d'accomplir ce
travail modeste.
Nous adressons le grand remerciement à notre
encadreur
MOUFFOK Abdenacer qui a proposé le thème de
ce
mémoire, pour ses conseils et ses dirigés du début
à la fin de ce
travail .
Nous tenons également à remercier
messieurs les membres de
jury pour l'honneur qu'ils
nos ont fait en
acceptant de siéger à notre soutenance,
tout
particulièrement :
Pr ZARROUG Med Mihoub pour nous avoir fait
l'honneur de
présider le jury de cette mémoire.
Nous
souhaitons exprimer notre gratitude à Dr
BOUSSOUALIM Naouel pour
avoir faire
de lecteur notre mémoire, aller l'examiner et elle peut
évaluer
cette mémoire. Nous vous
remercions pour
l'intérêt que vous avez porté à ce travail
et
pour vos précieux conseils et
remarques.
Finalement, nous tenons à exprimer notre
profonde gratitude à
nos familles qui nous ont
toujours soutenues
et à tout ce qui participe de réaliser ce
mémoire.
Ainsi que l'ensemble des
enseignants qui ont contribué à notre
formation.
HADJER
Dédicace
Louanges à Allah, seigneur de l'univers ;
que les salutations d'Allah soient sur
son messager qu 'il a envoyé
en qualité de miséricorde universelle, ainsi que sur
ses
compagnons et ses frères jusqu'à la
résurrection
Longue étaient les années de labeurs
malgré cela je cueille humblement enchantée le
fruit de mon
travail et je dédie tous d'abord :
la prunelle de mes yeux, celle qui a toujours brule
pour avoir nous éclairer
le chemin de la réussite,
MAMA.
Et celui qui m'a indiqué la bonne voie, en
me rappelant que la volonté fait toujours
des miracles,
ABI.
A la mémoire de mes très chers grands
parents DHAOUIA , AHMED et
MOKHTAR qui aurait été fière
de ma réussite (Allah yarhamhome)
À ma grande mère MA
TORKIA
A la lumière de mes jours mon petit
frère Mohamed Yacine et mes soeurs Hala et
Aya sans oublié mes tantes Hanane, Khalida ,
Soria ,et Ouahiba
A la prunelle de mes yeux ma proche tante HANANE
spécialement et aussi mes
tantes KHALIDA, OUAHIBA, SORIA et leurs
maris.
A mes oncles NACEREDDIN, ABDELOUAHAB, ABDERAHIM et
leurs
épouses.
A toute mes tantes en particulier ma tante SALIMA et
son mari ABDELDJALIL.
A ma cousine IKHLAS sans oublier HASNA, RAMI, ADEL,
OUMAIMA,
ISKANDAR, KHAOULA et RAHAF.
A mes chères amies BESMA , ainsi que KENZA et
GHOZLAN Et bien sûre mes amis MOHAMED , FARES et OUSSAMA
Et tous mes collègues
d'étude
A tout ce qui j'ai oublié pardonner
moi.
(que ALLAH soit avec eux)
Dédicace
Je tiens à exprimer ma reconnaissance envers
mes parents AMMAR et NOURA, qui me
ont accompagnés, aidés et
encouragés.
Je dédie mon travail à mes
frères AHMED ISLAM et MOHAMMED SOHAIB, à mes
soeurs AHLEM,
KARIMA et AYAT-ERRAHMENE, pour leurs contribution et leurs
patience.
A mon mari OUSSAMA pour leur encouragement et leurs
conseils.
A MOHAMMED et HOUCINE.
A mes amies : HADJER, HAMIDA, KENZA, GHIZLENE, NOUR
EL-HOUDA,
GHALIA et RIMA.
A mes collègues : OUSSAMA, MOUHAMED
DHIA-EDDINE, AMINA et AMINE.
A mon professeur RAHMANI ABD-ERRAHMENE.
A
monsieur BEN MAÏZA DJAMAL.
A tout mes proches amis.
Je ne peux pas
citer tout le monde mais j'ai une pensée plus
particulière.
BESMA
SOMMAIRE
Résumé I
Liste des tableaux ...III
Liste des figures IV
Liste des abréviations V
CHAPITRE I: Etude bibliographique
|
INTRODUCTION
|
.01
|
|
I.1.Acide glutamique
|
03
|
|
I.1.1.Historique de la production de glutamate
|
.....03
|
|
I.1.1.2.Présentation de la molécule
|
........03
|
|
I.1.1.3.Utilisations du glutamate
|
04
|
|
I.1.1.4.Microorganisme producteur du glutamate
|
.04
|
|
I.1.1.4.1. Composition du milieu de culture
|
05
|
|
I.1.2.Procédés de production d'acide glutamique
|
06
|
|
I.1.2.1.-Contraintes chimiques induisant la production d'acide
glutamique
|
06
|
|
I.1.2.2-Contraintes physiques induisant la production d'acide
glutamique
|
07
|
|
I.2.Métabolisme central des corynébactéries
|
.08
|
|
I.2.1.Entrée du sucre dans la cellule
|
09
|
|
I.2.2.Glycolyse
|
.............09
|
|
I.2.3. Voie des pentoses phosphate
|
10
|
|
I.2.4.Cycle de Kreps
|
11
|
|
I.2.5.Voie de biosynthèse du glutamate
|
..12
|
|
I.3.Le son de blé
|
13
|
|
I.3.1.Structure macroscopique
|
13
|
|
I.3.2.Structure microscopique
|
..14
|
|
I.3.3.Composition chimique du son de blé
|
14
|
|
I.3.4.Effets sur la santé
|
16
|
|
I.3.5.Valorisation des sons de blé
|
......17
|
|
I.3.5.1.Alimentation humaine
|
...17
|
|
I.3.5.2.Industrie papetière
|
17
|
|
I.3.5.3.Applications diverses
|
17
|
|
I.3.6.Conversion de la biomasse lignocellulosique
|
.17
|
|
I.3.6.1.Préparation de la matière première
|
..17
|
|
I.3.6.2.Prétraitement
|
...17
|
|
I.3.6.3.Hydrolyse
|
19
|
|
I.3.6.3.1.Hydrolyse chimique
|
.....19
|
|
A-Hydrolyse à l'acide dilué
|
19
|
|
B-Hydrolyse à l'acide concentré
|
19
|
|
I.3.6.3.2.Hydrolyse enzymatique
|
19
|
|
I.4. Modèle expérimentales
|
20
|
|
I.4.1.Définition et domaine d'application des plans
d'expériences
|
20
|
|
I.4.2. Différents types des plans d'expériences
|
20
|
|
I.4.2.1.Plans de criblage
|
...20
|
|
I.4.2.1.1.Plans de Taguchi
|
20
|
|
I.4.2.1.2. Plans de Plackett et Burman (PB)
|
21
|
|
I.4.3.2. Plans de modélisation
|
.....21
|
|
I.4.3.2.1. Plans de Box-Behnken (BB)
|
21
|
|
CHAPITRE II : Matériels et Méthodes
|
|
|
II.1.Appareils et produits chimiques
|
.22
|
|
II.2.Microorganisme utilisé
|
23
|
|
II.3.Conditions de culture
|
24
|
|
II.3.1. Milieu de préculture
|
24
|
|
II.3.2. Milieu de production
|
25
|
|
II.3.3.Stérilisation
|
25
|
|
II.4. Procédé de culture discontinue
|
...25
|
|
II.4.1.Conservation de la souche
|
....25
|
|
II.4.2.Propagation de la souche (préculture)
|
25
|
|
II.4.3.Culture en Erlenmeyer
|
..26
|
|
II.4.3.1.Protocole des fermentations discontinues
|
..26
|
|
II.5. Méthode d'analyses
|
....27
|
|
II.5.1.Estimation de la biomasse
|
27
|
|
II.5.2.Dosage de glutamate
|
27
|
|
II.5.3.Dosage de sucres totaux
|
.....27
|
|
II.6.Exploitation des donnés expérimentales
|
..27
|
|
II.6.1.Calcule des paramétres cinétique en
réacteur discontinu
|
27
|
II.6.1.1.Vitesse de réaction 28
II.6.1.2.Productivité volumétrique 28
CHAPITRE III : Résultats et Discussion
III.1. Optimisation de trois paramètres d'hydrolyse
acide des sucres de son de
|
blé . .30
III.2. Validation du modèle ...34
III.3.
Cinétiques de Corynebacterium glutamicum 2262 sur milieu de
culture à
|
|
base d'hydrolysat de son de blé
|
. .38
|
|
Conclusion
|
40
|
|
Références bibliographiques
|
41
|
I
Résumé
Lors de ce travail, une mise en évidence des
paramètres opératoires importants dans l'hydrolyse acide de la
matière lignocellolosique de son de blé a été
réalisé d'une part et, d'autre part, un modèle statistique
de Box-Behnken a été appliqué, afin d'optimiser les
paramètres de cet hydrolyse. Trois facteurs (concentration d'acide
sulfurique, température d'hydrolyse et temps d'hydrolyse) à trois
niveaux ont été évalués afin de déterminer
les valeurs optimales d'hydrolyse. L'ajustement du modèle a
été vérifié par le coefficient de
corrélation (R2) qui est de 0,89. Les conditions optimales de
l'hydrolyse des sucres de son de blé estimées par
l'équation du modèle sont les suivantes : 19,13% pour l'acide
sulfurique, de 89,37 °C pour la température d'hydrolyse, de 63,29
min pour le temps d'hydrolyse. La concentration de l'acide sulfurique
estimée par le modèle (19,13%) est inferieure à la
concentration minimale proposée (20%), donc une autre optimisation par
le modèle de Box-Behnken doit être effectuée avec une
concentration maximale de l'acide sulfurique de 20 %. Après la
deuxième optimisation, la concentration maximale des sucres (35
g.l-1) se situe à 85°C pour la température
d'hydrolyse, à 68 min pour le temps d'hydrolyse et à 11% pour
l'acide sulfurique. L'hydrolysat obtenu a été ensuit
utilisée comme milieu de culture naturel pour une production de
6,63g.l-1 d'acide glutamique par Corynebacterium glutamicum
2262.
Mots clé : son de blé, glutamate,
Corynebacterium glutamicum 2262, hydrolyse acide, Box-Behnken.
II
Ig11
ÍãÞáÇ
ÉáÇÎäá
ÉÏÞÚáãÇ
ÊÇíÑßÓáá
ÉíÖãÇáÍÇ
ÉåÇãáÇÇ
ÉíáãÚ í
ÉãåáãÇ
ÉíÈíÑÌÊáÇ
áãÇæÚáÇ
ìáÚ ÁæÖáÇ
ØíáÓÊ ìáÚ
áãÚáÇ ÇÐå
Ïåí áãÇæÚ
ËáÇË ÉÓÇÑÏÈ
ßáÐ æ
ÉåÇãáÅÇ
åÊÇáå
ìáËáãÇ
ØæÑÔáÇ
ÏíÏÊÍ áÌÇ äã
íÆÇÕÍÇ
ÌÐæäã ÞíÈØÊ
Êã ìÑÎÇ ÉåÌ
äã æ ÉåÌ äã
ØæÑÔáÇ 9..0 È
ÊÑÏÞ ÉãíÞÈ
ØÇÈÊÑáÅÇ
áãÇÚÈã
ÌÐæãäáÇ ÉÞÏ
ÕÍ Ëã .
ÉåÇãáÇÇ ÉÏã
æ ÉÑÇÑáÍÇ
ÉÌÑÏ æ
ÊíÈÑßáÇ ÖÍã
ÒíßÑÊ íå
ÉÞíÞÏ 00.99 æ
ÉÑÇÑáÍÇ
ÉÌÑÏá
ÉÈÓäáÇÈ
ÉíæÆã ÉÌÑÏ .0.98
È ÌÐæãäáÇ
ÉØÓÇæÈ ÊÑÏÞ
ÍãÞáÇ ÉáÇäÎ
ÊÇíÑßÓ
ÉåÇãáÅ
ìáËáãÇ ßáÐá
)ÉÆÇáãÇÈ 09(
ÍÊÑÞáãÇ
äìÏáÇ
ÒíßÊÑáÇ äã
áÞ íÑÎáÇÇ
ÇÐå ÒíßÑÊ æ
ÊíÈÑßáÇ
ÖãáÍ
ÉÈÓäáÇÈ
ÉÆÇáãÇÈ.09 æ
ÉåÇãáÅÇ
ÉÏáã
ÉÈÓäáÇÈ
ÒíßÑÊ ÈÑß
ìáÚ áæÕáÍÇ
Êã ËíÍ
ÊíÈÑßáÇ
ÖãáÍ ÒíßÑÊ
ìÕÞß
ÉÆÇáãÇÈ 09 Úã
ÌÐæãäáÇ ÓäÈ
ìÑÎ ÉÑã
áãÇæÚáÇ ØÈÖ
Êã ÒíßÊÑá
ÉÈÓäáÇÈ
ÉÆÇáãÇÈ 11 æ
ÉåÇãáÅÇ
ÉÏáã
ÉÈÓäáÇÈ
ÞÆÇÞÏ 8. æ
ÉÑÇÑáÍÇ
ÉÌÑÏá
ÉÈÓäáÇÈ
ÉíæÆã ÉÌÑÏ .5
ÉíáÇÊáÇ
ØæÑÔáÇ í
ÊÇíÑßÓáá íå
Éíãß ÈÑß
ÊäÇß æ
ßíãÇÊæááÌÇ
ÖÍã ÌÇÊäáÇ
íÚíÈØ ÚÑÒ
ØÓæß áãÚÊÓÇ
ÌÊÇäáÇ
ÉåÇãáÅÇ
ÕáÎÊÓã æ
ÊíÈÑßáÇ
ÖÍã
ÍãÞáÇ
ÉáÇäÎ
,Box-BehnkenßíãÇÊæá
áÌÇ ÖÍã
'ÉíÖãÇáÍÇ
ÉåÇãáÅÇ
ÉíÍÇÊáãÇ
ÊÇãáßáÇ
Corynebacterium glutamicum
III
LISTES DES TABLEAUX
|
Tab.I.1. Composition de différentes
couches de son sur base humide de 12 à 14 %
|
14
|
|
Tab I.2. Compositions chimiques de sons de
blé de différentes origines
|
.15
|
|
Tab. I.3.Composition en sucre du son
désamidonné
|
.16
|
|
Tab.I.4.Teneur en fibres alimentaires dans la
farine et le son de blé
|
16
|
|
Tab. I.5.Principaux procédés de
prétraitement
|
...18
|
|
Tab.I.6.Comparaison des différentes
options d'hydrolyse de cellulose
|
20
|
|
Tab II.1.Caractères
générales de C. glutamicum
|
23
|
|
Tab. II.2. Composition de milieu BMCG
|
.24
|
Tab. III.1. Niveaux choisis pour
l'optimisation des paramètres d'hydrolyse de son de blé 31
Tab III.2. Matrice du modèle Box-
Benhken et les résultats des expériences 31
Tab. III.3. Analyse de régression des
résultats obtenus à partir du modèle Box Behnken 34
Tab. III.4. Niveaux choisis pour la
deuxième optimisation des paramètres d'hydrolyse de son
de blé 34
Tab. III.5. Matrice expérimentale du
modèle factoriel Box-Behnken ...35
Tab.III.6. Analyse de régression des
résultats obtenus à partir du modèle Box-Behnken ....37
Tab. III.7. Paramètres cinétiques de C.
glutamicum 2262 sur le milieu à base d'hydrolysat de
son de blé 39

LISTE DE FIGURES
Fig. I.1: classification hiérarchique de
la classe des Actinobactéries 4
Fig. I.2 : morphologie des cellules de C.
glutamicum cultivées dans un milieu riche et
observées au microscope électronique .....4
Fig. I.3: Cinétique de production du
glutamate au cours d'un procédé de production 6
Fig. I.4: représentation
schématique de la voie de biosynthèse du glutamate chez
Corynebacteries .....8
Fig. I.5: schéma général
d'entrés des sucres chez C. glutamicum 9
Fig. I.6: Voie de la glycolyse chez C.
glutamicum 10
Fig. I.7 : la voie des pentoses phosphates chez
C. glutamicum 11
Fig. I.8 Voies de biosynthèse du
glutamate 12
Fig. I.9: Section longitudinale d'un grain de
blé 13
Fig.I.10. (a): Surface plot, (b) : Contour plot
d'une réponse 21
Fig.II.1. Propagation de C. glutamicum
2262 26
Fig .II.2. Incubateur New Brunswick Scientific
26
Fig. III.1. Corrélation entre les sucres
observés et les sucres prévues 32
Fig.III.2. Simulation des sucres .35
Fig.III.3.Courbes d'isoréponse et surface
de réponse de la concentration des sucres de son de
blé montrant l'effet de l'interaction entre la
température et le temps d'hydrolyse 37
Fig.III.4.
Courbes d'isoréponse et surface de réponse de la
concentration des sucres de son de
blé montrant l'effet de l'interaction entre l'acide
sulfurique et le temps d'hydrolyse .37
Fig.III.5. Courbes
d'isoréponse et surface de réponse de la concentration des sucres
de son de
blé montrant l'effet de l'interaction entre l'acide
sulfurique et la température d'hydrolyse 38
Fig.III.6.
Cinétiques de croissance, de consommation des sucres et de
production de
glutamate sur le milieu testé 39
V
LISTE DES ABREVIATION
C. glutamicum: Corynebacterium
glutamicum.
MSG: Mono-sodique glutamate.
PTS : Système
phosphotransférasique.
SP: Système perméase.
PEP: Phosphoénolpyrvate.
PYR: Pyruvate.
DHAP: Dihydroxyacétone phosphate.
G6P: Glucose-6-phosphate.
G3P:
glycéraldéhyde-3-phosphate.
Ru5P: Ribose-5-Phosphate.
AK: L'acétate kinase.
PTA: phosphotransacétylase.
ODH: á-cétoglutarate
déhydrogénase.
PDH: Pyruvate déhydrogénase.
GDH: Glutamate
déhydrogénase.
GS : Glutamine synthétase.
GOGAT: Glutamine amide
á-cétoglutarate amino transférase.
NREL: National Renewable Energy
Laboratory.
PB: Plackett et Burman.
BB: Box-Behnken.
BMCG: Basal Medium Corynebacterium
Growth
CHAPITRE I
ETUDE BIBLIOGRAPHIQUE
1
Le blé est l'un des produits agricoles les plus
importantes à l'échelle mondiale avec celle du riz et du
maïs. Actuellement, plus de 600 millions de tonnes de blé sont
produites chaque année dans le monde. Il existe différentes
variétés de blé, mais la plus cultivée est le
blé tendre, ou blé mou. Le grain de blé peut être
consommé sous plusieurs formes : entier, concassé,
soufflé, en semoule, en farine, etc. malgré que le son de
blé est considéré comme déchet mais il
représente un sujet d'étude dans plusieurs domaine de recherche.
Les études de la composition chimique de son de blé montrent que
ce dernier contient 39,2% de xylose, 25,2% d'arabinose, 0,9% de mannose, 2,1 %
de galactose et 32,6% de glucose (Hromàdkovà et al.
,2008).
Le son de blé, de par leur richesse en sucre et leur
conservation relativement longue, offrent de nombreuses possibilités
technologiques suivant le traitement auquel elles sont soumises. En effet, elle
peut servir de matière première de fermentation pour la
production d'acide glutamique. L'acide aminé le plus produit dans le
monde, sa production mondiale a fortement augmenté pour atteindre
aujourd'hui une production annuelle dépassant deux millions de tonnes
(Stefen et al., 2011). Il est utilisé dans de nombreuses
industries (pharmaceutique, chimique, cosmétique). Mais son utilisation
principale est l'alimentation humaine. Il est employé comme exhausteur
de goût dans de nombreux aliments déshydratés (soupes,
bouillons ...) qui ont perdu de leur saveur lors de leur fabrication.
En 1908 le professeur japonais Kikunae Ikeda propose alors de
le nommer le 5eme goût umami. L'acide glutamique est produit
par fermentation. Les principaux producteurs mondiaux sont asiatiques. En
Europe, le leader est incontestablement la société ORSAN dont la
part sur le marché mondial est d'environ 10%.
Actuellement, plusieurs microorganismes peuvent permettre la
production du glutamate. Il y a notamment Corynebacterium glutamicum,
Brevibacterium flavum, Brevibacterium lactofermentum et
Brevibacterium divaricatum. C. glutamicum est le
microorganisme le plus utilisé à l'échelle industrielle
(Dien et al., 2003).
Dans toutes les disciplines, il est fréquent de
souhaiter étudier un phénomène dépendant de
différents paramètres. La méthode intuitive n'est pas
toujours la meilleure. Elle consiste généralement à fixer
le niveau de toutes les variables sauf une et de mesurer la réponse pour
plusieurs valeurs de la variable mobile. Si plusieurs paramètres doivent
être étudiés, il faut répéter cette technique
pour chaque paramètre. Pour résoudre ce problème, Il faut
donc réduire le nombre d'expériences à effectuer sans
perdre la qualité des résultats recherchés. L'utilisation
d'un plan d'expériences donne alors une stratégie dans le choix
des méthodes d'expérimentation.
2
Leur succès dans la recherche et l'industrie est
lié au besoin de compétitivité des entreprises, ils
permettent une amélioration de la qualité et une réduction
des coûts.
Nous commencerons dans le chapitre I par une étude
bibliographique présentant l'essentiel des connaissances sur la
fermentation glutamique, le métabolisme central de Corynebacterium
glutamicum et le son de blé et sa valorisation; et enfin une partie
sera consacrée à l'application de la méthode des plans
d'expériences.
Le Matériel et Méthodes de ce mémoire seront
décrits dans le chapitre II.
Le chapitre III inclus les résultats obtenus et leurs
discussions.
Enfin, nous terminerons ce travail par une conclusion
générale concernant l'ensemble de ce travail et permettant de le
placer dans la problématique à laquelle il se raccroche et en
laissant entrevoir les perspectives auxquelles il pourrait donner lieu.
Chapitre I Etude bibliographique
3
I.1.Fermentation glutamique
I.1.1.Historique de la production de glutamate
En 1908 le glutamate a été isolé par le
professeur japonais Kikunae Ikeda à partir d'hydrolysats d'algues brunes
comestibles nommées Kombu (Laminaria japonica) et il
déclare en 1912 à un congrès international à
Chicago : « Je crois qu'il existe au moins un goût que l'on peut
ajouter aux quatre saveurs existantes. Il s'agit de ce goût particulier
que nous appelons "UMAMI". Ce goût est caractéristique d'un
bouillon préparé à base d'algues séchées de
Kombu», il propose alors de nommer le 5eme goût,
l'UMAMI.
L'organisme Corynebacterium glutamicum a
été isolé en 1957 par Kinoshita et collègues
à partir d'un échantillon de sol recueilli au zoo d'Ueno à
Tokyo et à ce moment-là désigné comme
micrococcus glutamicus (Jutta et al., 2009).
Les principales sociétés productrices de
glutamate sont les sociétés japonaises Ajinomoto, Kyowa Haklco
Kogyo, Asahi Chemical, Takeda et Tanabe Seiyaku, la société
coréenne Cheiljedang, la société américaine
Stauîfer Chemical et la société franco-belge ORSAN-Amylum
(Burkovski et Kramer, 2002; Crueger et Crueger, 1984; Eggeling et Sahm, 1999).
La société ORSAN-Amylum représente environ 10 % de la
production mondiale annuelle d'environ un million de tonnes. La croissance du
marché de glutamate arrive à maturité avec un taux de
croissance annuel de 4 à 5 %. (Davin, 2003).
I.1.1.2.Présentation de la molécule
Le glutamate monosodique se présente sous forme de
cristaux ou de poudre cristalline
blanche. Il est inodore. Sa formule brute est C5H8NO4Na. H2O et
sa masse moléculaire est de
187.13 g/mol.
Parmi ses caractéristiques physico-chimiques on
distingue:
- Il est très soluble dans l'eau.
- Il est légèrement soluble dans
l'éthanol.
- Il est insoluble dans l'éther.
- Le pH d'une solution saturée est de 6,7-7,2.
Cette substance est naturelle et on la trouve dans : les algues,
les haricots de soja, le
gluten de maïs, de blé et la betterave à
sucre. En effet, elle est présente naturellement dans
presque tous les aliments en particulier ceux riches en
protéines :
Chapitre I Etude bibliographique
4
- les produits laitiers comme les fromages (parmesans)
- les viandes et les poissons
- les fruits de mer.
- de nombreux légumes comme les tomates, les oignons,
les champignons.
I.1.1.3.Utilisations du glutamate
L'acide glutamique est un acide aminé non essentiel
utilisé principalement comme additif alimentaire sous forme mono-sodique
glutamate (MSG, E621). Et il est largement employé dans la cuisine
asiatique comme exhausteur de goût (Jutta, 2014) et il est
considéré par les Japonais comme étant à l'origine
d'un 5ème goût : le goût UMAMI.
En Europe, la dose journalière admissible est de 0 -
120 mg /1 kg de poids corporel, alors que cette molécule est
considérée comme additif non toxique au Japon.
Le glutamate est également utilisé, en beaucoup
plus faible quantité, par les industries pharmaceutiques et
cosmétiques (Davin, 2003).
I.1.1.4. Microorganisme producteur du glutamate
Le genre Corynebacterium est un membre de la classe
des Actinobactéries, de l'ordre des Actinomycétales, de la
famille des Corynebacteriaceae (Stackebrandt et al., 1997).
(Figure I.1)
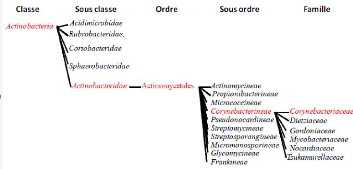
Fig.I.1: Classification hiérarchique de
la classe des Actinobactéries selon Stckebrandt et al.
(1997).

Fig. I.2. Morphologie des cellules de C.
glutamicum observées au microscope électronique. Dimension
1,4 à 2
um (Wehrmann et al., 1998).
Chapitre I Etude bibliographique
5
Actuellement, il y a environ 50 espèces validées
de Corynebacterium et certaines présentent un
intérêt industriel dont C. glutamicum.
C. glutamicum est une bactérie du sol
aérobie facultative, non pathogène, des bacilles à
Gram-positif, non sporulante (Takuo et al., 2008) immobiles et
auxotrophe pour la biotine (Sung-Jin Jo et al., 2009) et sont
caractérisés par un ADN génomique riche en guanine et en
cytosine (G+C% est compris entre 53 et 58) (Boulahya, 2010).
Cette bactérie est utilisé industriellement pour
la production à grande échelle des acides aminés, en
particulier l'acide glutamique et de la lysine (Volker et al.,
2006).
I.1.1.4.1. Composition du milieu de culture
Quand une souche a été
sélectionnée, elle doit être cultivée dans des
conditions permettant une productivité maximale en métabolite ou
en biomasse.
Il doit apporter aux micro-organismes les molécules
nécessaires pour la production d'énergie, l'augmentation de la
biomasse et la synthèse de métabolites.
a. Source de carbone Elle constitue la source
d'énergie des cellules et intervient dans la synthèse de toutes
les molécules organiques. La nature de la molécule influence la
production de biomasse ou de métabolites.
b. Source d'azote
L'influence est très importante sur la
productivité des métabolites secondaires. Comme pour les sucres,
la synthèse de certaines molécules ne débute que si la
totalité de la source d'azote facilement assimilable a été
consommée (NH4). L'addition d'une source d'azote dans un milieu de
culture influence le pH en permettant le maintien de celui-ci à une
valeur donnée en raison du pouvoir tampon de certaines molécules
azotées. (Das et al., 1995).
c. Substrats naturels complexes
L'utilisation de ce type de substrat s'explique par leur
coût moins élevé que celui des molécules organiques
ou inorganiques purs. Les produits ont également comme avantage
d'apporter aux micro-organismes des mélanges en vitamines, acides
aminés et sels minéraux. On obtient ainsi des croissances
rapides.
d. Sels
Certains sels minéraux sont très importants
comme le sulfate de magnésium indispensable à la croissance de la
membrane cellulaire ou le carbonate de calcium qui maintient le pH. (Kumagai,
2000).
Chapitre I Etude bibliographique
6
I.1.2. Procédés de production d'acide
glutamique
La production de L-glutamate par C. glutamicum
résulte de l'application des contraintes (Figure I.3).

Fig. I.3: Cinétique de production du
glutamate au cours d'un procédé de production.
Initialement, la source carbonée est utilisée
pour la croissance (synthèse de la biomasse), puis une contrainte est
appliquée aux C. glutamicum de façon à faire
excréter du glutamate parce que l'acide glutamique n'est pas
excrété spontanément par les cellules. (Boulahya,
2010).
On distingue deux types de contraintes: contraintes chimiques
et contraintes physiques.
I.1.2.1.Contraintes chimiques induisant la production
d'acide glutamique
a. Limitation en biotine
C. glutamicum est une bactérie auxotrophe
pour la biotine ,cette auxotrophie est due à l'absence du gène
bioF qui code la 7-céto-8 aminopilargonate synthétase
responsable de l'une des étapes de synthèse de la biotine chez
C glutamicum (Hatakeyama et al., 1993a; Hatakeyama et
al., 1993b) sa limitation pendant la fermentation glutamique provoque
une réduction de la synthèse des phospholipides et une
augmentation du rapport acides gras saturés / acides gras
insaturés. Cette modification métabolique permet un basculement
de la croissance vers la production du glutamate (Clément et
al., 1984 ; Clément et Lanéelle, 1986 ; Demain et
Bimbaum, 1968; Shibukawa et Ohsawa, 1966).
b. Ajout de pénicilline
La pénicilline inhibe la synthèse du
peptidoglycane mais ne modifie ni la teneur en acide gras ni la teneur en
phospholipides membranaire (Shibuvkawa
et.al, 1968).master 2013. L'ajout de
pénicilline permet de produire l'acide glutamique tout en utilisant des
matières premières riches en biotine (Sommerson et Philips,
1962).
e. Chapitre I Etude bibliographique
7
Ajout de tensioactif
L'ajout de tensioactif diminue la quantité de
phospholipides cellulaires de plus de 50% et le rapport acides gras
saturé / acides gras insaturés est augmenté contrairement
à la pénicilline (Huchenq et al.,1984 ).
l'ajout de tensioactifs comme des acides gras saturés
et ses dérivés dans un milieu riche en biotine permet
d'excréter du glutamate (Duperray et al., 1992; Takinami et
al., 1965; Takinami et al., 1968).
Marquet et al. (1986) ont montré que l'ajout
de tensioactifs tel que le polyéthyléneglycol stéarate,
polyéthyléneglycol palmitate, ou laurylamine permet d'obtenir un
titre final en glutamate compris entre 80 et 100 g.l-1. Dans un
milieu riche en biotine, l'ajout des détergents tels que
poly-oxyéthyléne sorbitane mono palmitate (Tween 40) ou le
poly-oxyéthyléne sorbitane monostéarate (Tween 60)
favorise la production de glutamate (Duperray et al., 1992 ; Takinami
et al.,1965 ).
f. Ajout d'anesthésique local
Dans un milieu riche en biotine, C. glutamicum
excrète jusque 15 g.l-1 de glutamate en présence
d'un d'anesthésique local tel que la tétracaine (Lambert et
al., 1995) ce qui provoque une altération physique de la
membrane sans aucune modification de sa composition ni ses
propriétés biochimiques.
g. Limitation en acide oléique et
glycérol
Des souches de Corynébacteries auxotrophes pour le
glycérol ou des acides gras comme l'acide oléique produisent de
glutamate (Kanzaki et al., 1967 ; Nakao et al.,1970). Dans un
milieu limité en acide oléique, 100 g.l-1 de glutamate
a été atteint avec du glucose comme source de carbone (Miescher,
1975). L'équipe de Nakao s'est intéressée à
Corynebacterium alkanolyticum auxotrophe pour le glycérol. La
carence en glycérol chez cette bactérie induit l'excrétion
d'acide glutamique quelle que soit la source de carbone utilisée (Nakao
et al.,1970).
I.1.2.2.Contraintes physiques induisant la production
d'acide glutamique
a. Température
La température reste généralement
constante lors de production du glutamate par les procédés
précédents pendent toute la fermentation. Chez C. glutamicum
2262, l'excrétion du glutamate est induite par une augmentation
brutale de la température du milieu de culture de 33°C à
39°C, ce changement est moyen efficace permet une déviation du flux
du carbone
Chapitre I Etude bibliographique
8
(métabolisme) vers une production du glutamate
(production de 85 g.l-1 de glutamate en 24h et en mode semi continu)
(Delaunay, 1999).
b. pH
Le pH optimum qui assure une vélocité maximale
de transport de glutamate par C. glutamicum est de 7,4 à 7,8.
(Shah et al., 2002).
c. Oxygène
L'oxygène (O2) est un élément important
pour la production d'acide glutamique par C.glutamicum. En
présence d'excès d'O2, le métabolisme sera orienté
vers la production de l'á-cétoglutarate (Çalik et al.,
2001; Crueger et Crueger, 1984 ; Kinoshita et Nakayama, 1978). Par contre
dans des conditions insuffisantes en O2, une quantité importante de
lactate, de pyruvate et de succinate sont accumulés (Çalik et
al., 2001; Dominguez et al., 1993).
Pour cela, plusieurs études ont été
consacrées à l'étude de l'effet de l'O2 sur la production
de glutamate. Tavakkoli et al. (2009) ont montré que le
contrôle du débit d'air à son optimum est essentiel pour
une production maximale de glutamate.
I.2.Métabolisme central des
corynébactéries
L'á-cétoglutarate est le précurseur
immédiat dans la synthèse du glutamate. Les différentes
voies classiques du métabolisme central responsables à la
synthèse du glutamate chez corynebacteries sont
schématisées dans la figure I.4.
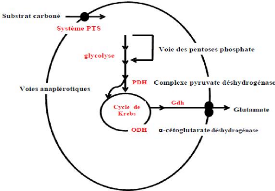
Fig. I.4: représentation
schématique de la voie de biosynthèse du glutamate chez
Corynebacteries.PTS : système
phosphotransférasique ; PDH :
pyruvate déhydrogénase ;ODH : á-cétoglutarate
déhydrogénase et Gdh :
glutamate
déhydrogénase.
Chapitre I Etude bibliographique
9
I.2.1.Entrée du sucre dans la cellule
Les sources de carbone préférées dans les
procédés biotechnologiques industriels sont les sucres, surtout
le glucose, le saccharose et le fructose. Ces sucres peuvent
pénétrer dans la cellule par deux moyens: le système
phosphotransférasique (PTS) et le système perméase (SP)
(Figure I.5).
Le PTS catalyse la phosphorylation de ces sucres (soit le
glucose-6-phosphate ou soit le fructose-6-phosphate) en utilisant du
phosphoénolpyruvate (PEP) et générant du pyruvate
(Dominguez et Lindley, 1996; Mori et Shiio, 1987).
Notons que, le fructose intracellulaire, qui est formée
au cours de la croissance à partir du saccharose, est d'abord
éliminé par un système d'exportation inconnu, puis est
repris et phosphorylé en fructose-1-phosphate par un PTS (Dominguez et
Lindley, 1996).

Fig. I.5. Schéma général
d'entrés des sucres chez C. glutamicum. PEP :
phosphoénolpyrvate ; PYR :pyruvate ;
SP : système
perméase ; PTS : système phosphotransférasique.
Le système perméase représente
jusqu'à 15% du flux total d'entrée des sucres lors d'une
croissance rapide (Cocaign-Bousquet et al., 1996). Ce système
catalyse la phosphorylation de glucose par une glucokinase (GLK). (Gourdon et
al., 2003; Park et al., 2000).
Une fois l'entrée des sucres et la phosphorylation
réalisée, le métabolisme des sucres phosphate se produit
via des voies métaboliques centrales.
I.2.2.Glycolyse
La glycolyse joue le principal rôle du
métabolisme des sucres Chez C. glutamicum. Elle est l'ensemble
des réactions enzymatique qui permettent le passage du glucose
-6-phosphate au pyruvate dans le but de générer de
l'énergie (3 ATP et 2 NADH). Elle est localisée
entièrement dans le cytoplasme et divisée en deux parties :
- Les réactions de la première partie permette
la conversion des hexoses-phosphate (G6P) en une molécule de
dihydroxyacétone phosphate (DHAP) et une molécule de
glycéraldéhyde-3-phosphate (G3P). (Gunsalus et Shuster, 1961).
Chapitre I Etude bibliographique
10
-Les réactions de la deuxième partie permette la
conversion des trioses phosphate en pyruvate.
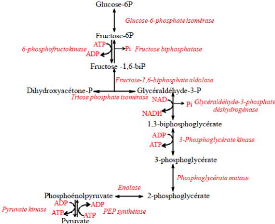
Fig. I.6. Voie de la glycolyse chez C.
glutamicum
I.2.3.Voie des pentoses phosphate
Le rôle général de la voie des pentoses
phosphate est la synthèse de précurseurs des acides
nucléiques tels que le ribose-5-phosphate et de permettre l'utilisation
des pentoses ou du gluconate comme source de carbone. Elle est
constituée de sept enzymes interagissant avec la voie de la glycolyse.
Elle ravitaille la glycolyse au niveau du fructose 6P et de
glycéraldéhyde 3P.
-Les trois premières enzymes, la glucose-6-phosphate
déshydrogénase, la 6-phosphogluconolactonase et la
6-phosphogluconate déshydrogénase constituent une voie oxydative
irréversible dans laquelle le glucose-6P est converti en ribose-5-P
(Ru5P) avec la formation de 2 moles de NADPH par mole de Ru5P.
- Les réactions suivantes sont catalysées par la
transaldolase, la transacétolase et la ribose 5-P-phosphate constituent
une voie non oxydative et réversible.
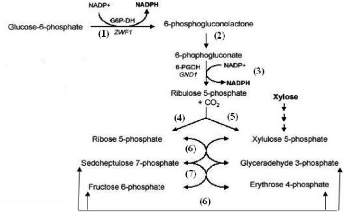
Chapitre I Etude bibliographique
11
Fig. I.7. la voie des pentoses phosphates chez
Corynebacterium glutamicum: (1)
:glucose-6-phosphate
déhydrogénase, (2) :
6-phosphogluconolactonase , (3) : 6- phosphogluconate
déhydrogénase , (4) :ribose-5-
phosphate isomérase (5), ribulose-5-phosphate
epimérase , (6) : transcétolase et (7) : transaldolase .
I.2.4. Cycle de Kreps
Généralement, l'approvisionnement du cycle de
Kreps en acétyl-CoA previent de pyruvate quand les cellules poussent sur
des sources de carbone à 5 ou 6 carbone ou du lactate.
Chez C. glutamicum, la pyruvate
déshydrogénase catalyse la décarboxylation oxydative du
pyruvate en acétyl-CoA en aérobiose.
L'acétate kinase (AK) et la
phosphotransacétylase (PTA) sont deux activités combinés
pour former l'acétyl-CoA lorsque l'acétate est utilisé
comme source de carbone par C. glutamicum. (Reinscheid et
al., 1999 ; Chiio et al., 1969).
L'acétyl-CoA est condensé avec
l'oxaloacétate pour former du citrate qui sera ensuite
isomérisé en isocitrate. Au lieu d'être
décarboxylé, isocitrate est clivé par l'isocitrate lyase
en succinate et glyoxylate.(boulahya, 2010) . L'une des enzymes clés du
cycle de Krebs impliquées dans la production du glutamate est le
2-oxoglutarate déshydrogénase (ODH). Elle
catalyse la décarboxylation irréversible de 2-oxoglutarate en
succinyl-CoA avec libération d'une molécule de NADH. Nakamura et
al. (2007) ont montré que l'activité de ce complexe
enzymatique diminue au cours de la production du glutamate par induction.
Chapitre I Etude bibliographique
12
I.2.5.Voie de biosynthèse du glutamate
Chez les microorganismes, le glutamate est
synthétisé par deux voies métaboliques :
-soit par le glutamate déshydrogénase (GDH).
-soit par la glutamine synthétase (GS) couplée avec
glutamine amide á-cétoglutarate amino transférase
GOGAT.

Fig. I.8. Voies de biosynthèse du
glutamate. GDH : glutamate déhydrogénase, GS :
glutamine
synthétase, GOGAT : glutamine amide á-cétoglutarate
amino-transférase.
La biosynthèse du glutamate chez Corynebacterium
est principalement dépendante de l'activité GDH. Celle-ci
catalyse la réaction réversible de la synthèse du
glutamate et de NADP+ à partir d'á-
cétoglutarate , de NADPH et d'ammonium lorsque ce dernier est
présent à de fortes concentrations (> 1 mM).
L'activité GS est une réaction
indésirable lors de la fermentation glutamique car elle utilise une
partie du glutamate en synthétisant la glutamine.
La synthèse du GS/GOGAT chez C. glutamicum est
induite lorsque la concentration d'ammonium diminue dans le milieu de culture
(Tesch et al., 1998; Elke et al., 1993; Börmann et
al., 1992).
Chapitre I Etude bibliographique
13
I.3. Son de blé
I.3.1.Structure macroscopique
Le grain de blé possède trois parties principales
: le germe, l'endosperme et le son.

Fig.I.9. Section longitudinale d'un grain de
blé (Boudreau et Ménard, 1992)
La plus grande partie du blé est l'endosperme avec 81-
84,5 %, suivie du son avec 1415 % et du germe avec 3 %.
Le son de blé (Triticum aestivum) est un
co-produit de la minoterie, il représente avec la farine et le germe,
l'une des trois fractions de la mouture et il sert de barrière
protectrice physique ou chimique pour l'endosperme et le germe (Hoseney, 1986;
Peterson et Fulcher, 2002). Le son de blé peut être
séparé en trois couches selon leur composition et leur position
à l'intérieur du grain : la couche à aleurone, la couche
intermédiaire et le péricarpe.
La couche à aleurone collée à
l'endosperme du grain tandis que le péricarpe est la couche externe du
grain. Chaque couche principale du son de blé (aleurone, couche
intermédiaire et péricarpe) est constituée de
matériel complexe et hétérogène, possédant
une composition distincte qui affecte la fonctionnalité et la
composition des produits (Izydorczyk et al., 2002).
Chapitre I Etude bibliographique
14
Tab.I.1. Composition de différentes
couches de son sur base humide de 12 à 14 %. Adapté de Pomeranz
(1988)
et Pyler (1988).
|
Couche aleurone
|
Couche intermédiaire
|
Coche péricarpe
|
|
Protéines (N x 507)%
|
18
|
9,7
|
5,0 - 7,6
|
|
Cendres (%)
|
14,3 - 17,2
|
n.d.
|
1,7 - 4,3
|
|
Matières grasses (%)
|
7
|
0,5
|
1
|
|
Cellulose (%)
|
6
|
23
|
32
|
|
Arabinoxylanes (%)
|
30
|
17 - 30
|
35
|
|
Activité de la protéase1
|
4,8 - 6,9
|
n.d.
|
n.d.
|
Protéase : ul de NaOH 0,1N en 24h à 37°C par
mm3 de tissu.
n.d.: non déterminé
I.3.2.Structure microscopique
D'un point de vue histologique, le son du blé est un
empilement de couches cellulaires très différentes botaniquement,
cytologiquement et biochimiquement. Il comprend le
tégument, le manteau, la couche nucellaire et la couche
aleurone (Piot, 2000).
? Le tégument est constitué du
péricarpe externe et du péricarpe interne
? Le manteau de la graine, est
constitué de la testa et d'un film pigmentaire
interpénétré. Ces deux tissus sont combinés l'un
à l'autre. La testa joue un rôle important dans la circulation de
l'eau entre l'extérieur et la graine et participe à la
régulation de la germination.
? La couche nucellaire, encore appelée
« bande hyaline » ou « épiderme du nucelle ». Elle
recouvre immédiatement la couche aleurone et forme une interface qui
limite tissus fille/tissus mère et constitue un plan de clivage lors du
broyage.
? La couche aleurone, également
appelée assise protéique, constitue d'un point de vue
histologique la couche externe de l'albumen, elle l'entoure complètement
et en fait partie, mais elle ne contient pas d'amidon. Ses rôles
physiologiques sont nombreux, en particulier au cours de la germination de la
graine.
I.3.3.Composition chimique du son de blé
La répartition des composants du son dans les
différentes couches se traduit par une grande
hétérogénéité qualitative et quantitative.
Outre les nombreuses espèces et variétés de blé, et
les divers procédés de mouture, la composition chimique est aussi
fonction de la taille de l'amande, de la maturité de la plante, de la
taille du germe, de l'épaisseur des couches
Chapitre I Etude bibliographique
15
externes, de la durée et des conditions de stockage et du
conditionnement des grains avant la mouture et des différences dans les
méthodes de dosage utilisées.
Tab I.2 : Compositions chimiques de sons de
blé de différentes origines
|
(Raynal-Ioualalen, 1996)
|
(Bataillon et al., 1998)
|
(Maréchal, 2001)
|
|
Son brut
|
Son désamidonné
|
Son brut
|
Son désamidonné
|
Son désamidonné
|
|
Cellulose*
|
9,1(1)
|
15,5(1)
|
11 ,0(2)
|
25,0(2)
|
18,7(1)
|
|
Hémicelluloses*
|
37,0(1)
|
60,0(1)
|
19,0(2)
|
45,0(2)
|
62,3(1)
|
|
Lignine*
|
6,7(1)
|
8,0(1)
|
6,0(1
|
3,0(1)
|
3,8(1)
|
|
Amidon*
|
20,0(3)
|
n.d.**
|
29,0(4)
|
1,0
|
n.d.**
|
|
Protéines*
|
14,8(5)
|
15,2(5)
|
14,0(5)
|
9,0(5)
|
15,6(5)
|
|
Lipides*
|
n.d.**
|
n.d.**
|
6,0
|
6,0
|
n.d.**
|
|
Matières minérales*
|
5,3(6)
|
1,0(6)
|
4,0(6)
|
1,0(6)
|
1,5(6)
|
* Les résultats sont exprimes en % de la matière
sèche. ** n.d. = non déterminé.
1 Cellulose, lignine et hemicelluloses dosees par la methode
de Van Soest and Wine (ADF/NDF) (Van Soest et al., 1968).
2 Determinantion simplifiee des monosaccharides neutres par
chromatographie gaz-liquide (Hoebler et al., 1989; Gruppen et
al., 1992).
3 Methode polarimetrique de Ewers (ISO, 1998).
4 Determination apres traitement termamyl et hydrolyse
enzymatique.
5 Dosees par la methode de Kjeldhal (N x 5,7 ou 6,25 selon les
sources).
6 Calcination à 550 °C.
Les hémicelluloses sont, après l'amidon, les
constituants majoritaires des sons de blé. Elles sont principalement
constituées d'arabinoxylanes, comme en témoigne la composition en
sucres simples présentée au tableau I.3. Par ailleurs, il peut
être observe qu'une part non négligeable de protéines est
présente, provenant de la couche aleurone.
Une caractéristique de ces fibres de son est que la
fraction en hémicelluloses est particulièrement importante (60 a
70 % de la somme des trois constituants de la fraction fibre) et que la
fraction de lignine est peu représentée
(généralement inferieure a 10 %) alors que la fraction cellulose
est minoritaire (Zeitoun, 2011). Une désamidonnassions
du son permet d'augmenter la proportion relative des hémicelluloses qui
représentent alors la fraction majoritaire des constituants du son.
Chapitre I Etude bibliographique
16
Tab. I.3. Composition en sucre du son
désamidonné.
|
Xylose*
|
39,2
|
|
Arabinose*
|
25,2
|
|
Mannose*
|
0,9
|
|
Galactose*
|
2,1
|
|
Glucose*
|
32,6
|
* Les résultats sont exprimes en % de la totalité
des carbohydrates doses. La composition en sucres est déterminée
après hydrolyse acide et chromatographie en phase gazeuse.
I.3.4.Effets sur la santé
Le blé, particulièrement le son de blé, est
une source de protéines, de vitamines et de minéraux. Mais c'est
surtout une source de fibres alimentaires.
Tab.I.4.Teneur en fibres alimentaires dans la
farine et le son de blé (Nandini et Salimath, 2001).
|
Type de fibres
|
Son de blé, (%)
|
|
Fibres insolubles
|
35.8
|
|
Fibres solubles
|
4.0
|
Selon Bingham et al. (2003), la consommation de
fibres alimentaires pourrait réduire le risque de cancer colorectal
Les fibres diminuent de façon modeste, mais
significative, le taux de cholestérol sanguin (Caballero et
al., 2004).
Nombreuses bactéries du tube digestif étaient
capables de métaboliser le son in vitro et, d'autre part, que
de nombreux métabolites bactériens du tube digestif
apparaissaient, disparaissaient ou étaient quantitativement modifies
quand on ajoutait du son au régime alimentaire, divers auteurs ont
postulé que cette ingestion de son était capable de modifier la
flore microbienne du tube digestif.
Chapitre I Etude bibliographique
17
I.3.5.Valorisation des sons de blé
I.3.5.1.Alimentation humaine
Le son de blé est largement utilisé dans le domaine
de l'alimentation humaine en tant que `fibres alimentaires', notamment dans le
domaine de la boulangerie sous la forme de pains et de biscuits. Ceci signifie
qu'il fait partie des aliments, mais qu'il n'est pas dégradé par
des enzymes propres à l'homme (Selvendran et al., 1980 ; Ralet
et al., 1990). I.3.5.2.Industrie papetière
Le son de blé peut être employé dans les
domaines de l'industrie papetière où sa faible teneur en lignine
peut représenter un avantage.
I.3.5.3.Applications diverses
Il pourrait être inclus comme agent de charge pour la
fabrication des panneaux de particules.
Il a aussi été étudié, pour la
fermentation en vue de produire de l'éthanol, de l'acide citrique, des
produits de cosmétologie, ou pour la production de champignons ou
d'enzymes.
Les arabinoxylanes de son de blé peuvent
gélifier grâce aux substituant d'acides phénoliques. Cette
propriété leur ouvre des applications médicales sous la
forme de gels utilisés pour recouvrir des blessures et
accélérer la cicatrisation (Greenshields, 1993). Les
propriétés filmogènes des arabinoxylanes de son de
blé permettent aussi d'envisager des débouchés dans le
domaine de l'enrobage des semences.
I.3.6.Conversion de la biomasse lignocellulosique
I.3.6.1.Préparation de la matière
première
Plusieurs opérations (broyage, séchage,
stockage...etc) sont importants dans étape de préparation de
biomasse lignocellulosique avant de l'introduire dans les principales
étapes de transformation.
Le broyage simple sert à fragmenter la biomasse dans le
but d'obtenir des tailles de 2 mm afin d'augmenter le rendement et de faciliter
la séparation des compositions.
I.3.6.2.Prétraitement
Le but de prétraitement est de rendre la cellulose
accessible à l'hydrolyse (modifier les propriétés
physiques et physicochimiques du lignocellulose) par différentes
méthodes.
Il existe trois procédés de prétraitement ;
physique, chimique, physicochimique. (Tableau II.3).
Chapitre I Etude bibliographique
18
Tab. I.5 : Principaux procédés
de prétraitement (Daniel, 2006 ; Marcos et Toshinori, 2007)
|
Description
|
|
Prétraitement
physico-
chimique
|
Thermo hydrolyse
|
Cuisson à l'eau de la biomasse à des
températures de 200-
230°C et P de 50 bar pendant 15 à 60
min.
|
|
Explosion à la
vapeur (auto-
hydrolyse)
|
Chauffage rapide de substrat (160 à 260°C) par
injection de
vapeur à (10 ou 50 bar) puis une détente brutale.
cette technique
est peu efficace dans le cas des bois tendres.
|
|
Explosion à la
vapeur en
conditions acides
|
En présence de H2SO4 ou de SO2 , meilleure
pénétration du
réactif, amélioration du
rendement, toxique, demande limitée en
énergie,
simplicité de mise en oeuvre, bonne adaptation aux
particules de
grande taille.
|
|
Explosion au CO2
|
Explosion à la vapeur dans laquelle le CO2 est un
réactif
chimique, bonne efficacité.
|
|
Procédé AFEX
(Ammonia Fiber
Explosion)
|
La matière lignocellulosique est mise en contact avec
de
l'ammoniac liquide (50-70°C) et (30 min), plus adapté
aux
plantes herbacées.
|
|
Procédés
chimiques
|
Prétraitement à
l'acide dilué
|
En présence de H2SO4 ou [H3O+
Cl-] dilué en proportion de 0,5
à 3%,
|
|
Prétraitement en
milieu alcalin
|
L'ajout de NaOH (8 à 12%) et 80 à 120°C, 30
à 60 min,
beaucoup plus efficace sur les résidus
agricoles
Nécessite de lavage et neutralisation du résidu
solide ainsi
qu'un recyclage de la soude, relativement onéreuses.
|
|
Procédé
organosolv
|
Solubilisation et extraire la lignine et les
hémicelluloses dans
un solvant organique, et conduit à un
résidu solide de cellulose,
en présence de HCl ou H2SO4,
permet de récupérer la lignine,
mais reste plus
onéreuses.
|
|
Procédés
d'oxydation
|
Les hémicelluloses sont dégradées et la
cellulose reste intacte,
limitation de la production de composés
inhibiteurs, la grande
quantité d'ozone nécessaire rendant le
procédé trop onéreux
|
|
Procédés
biologique
|
Mettant en oeuvre des enzymes, peu de consommation
d'énergie, douce sur l'environnement. coût des enzymes
lignolytique élèves.
|
|
Prétraitements physiques
|
Prétraitements
mécaniques
|
broyage mécanique, augmenter les surfaces accessibles,
énergie trop élevée pour une application industrielle.
|
|
Thermolyse
|
température < 300°C, décomposition de la
cellulose.
|
Chapitre I Etude bibliographique
19
Le choix du prétraitement est fortement dépendant
du substrat utilisé. Le procédé de prétraitement
universel et idéal n'existe pas.
I.3.6.3.Hydrolyse
Du fait de la structure de la cellulose, de sa
cristallinité et de son association avec la lignine et les
hémicelluloses encore présentes même après
l'étape de prétraitement, son hydrolyse en monomères
fermentescibles est une opération difficile qui peut être
réalisée par deux méthodes: hydrolyse chimique
catalysée par un acide ou hydrolyse enzymatique.
I.3.6.3.1.Hydrolyse chimique
A. Hydrolyse à l'acide dilué
Le NREL décrit les conditions d'utilisation suivante :
3 minutes à 190°C en présence de 0.7 % d'acide sulfurique
pour la première étape, 3 minutes à 215° C en
présence de 0.4 % d'acide sulfurique pour la seconde.
B. Hydrolyse à l'acide
concentré
Ce type d'hydrolyse est généralement plus efficace.
Elle combine deux étapes :
-Une première étape de décristallinisation
de la cellulose.
-Une seconde étape d'hydrolyse par de l'acide
concentré.
Dans le procédé Arkenol la première
étape est obtenue par l'addition de 70-77 %
d'acide sulfurique à une température <
50° C. ensuit, une dilution à 20-30 % est réalisée
par l'ajout d'eau. L'ensemble est chauffé à 100° C pendant 1
heur (Ballerini, 2006).
I.3.6.3.2.Hydrolyse enzymatique
Dans la nature, la biodégradation de la cellulose est
essentiellement réalisée par des microorganismes
(eubactéries et champignons), bien que certaines bactéries
produisent des cellulases ayant une activité spécifique (vitesse
d'hydrolyse par unité massique de protéines)
élevée.
Les enzymes produites par ces champignons sont
récupérés, puis sont mise en contact avec le
matériau prétraité en assurant
l'homogénéité de la suspension et en maintenant les
conditions optimales qui sont pour les cellulases, une température de
45-50 °C et un pH de 4,8. Le temps d'action est fonction de la
quantité d'enzymes ajoutée et de leurs activités (Daniel,
2006).
Chapitre I Etude bibliographique
20
Tab. I.6.Comparaison des différentes
options d'hydrolyse de cellulose
|
Hydrolyse
|
Conditions
|
Avantages
|
Inconvénients
|
|
Hydrolyse à l'acide dilué
|
215°C, 3min. H2SO4 < 1%.
|
Rendement 50-70%. Réaction simple.
|
Risque de dégradation des sucres, les produits.
|
|
Hydrolyse à l'acide
concentré
|
50°C , 2-6h. H2SO4 30-70%.
|
Rendement 90%,
rapide, conditions
faciles.
|
Corrosion des
matériaux, consommé
de l'énergie (recyclage de l'acide), complexité de
procédé.
|
|
Hydrolyse enzymatique
|
50°C , pH = 4,8, 1,5jour, cellulase
|
Rendement 75-95%
peu d'effluents, pas
corrosif
|
Long temps, le coût
d'enzyme.
|
I.4. Modèle expérimentales
I.4.1.Définition et domaine d'application des plans
d'expériences
Le modéle expérimentale est une méthode
de planification ou d'organisation des expériences scientifiques et
industrielles dans le but de retirer l'information correspondante à
l'objectif fixé préalablement (Pierre, 2005; Pierre, 2008). Leur
but est l'obtention un maximum d'informations avec un minimum
d'expérimentations par rapport à l'objectif que fixé.
Différents domaines des sciences comme l'agronomie, la
biologie, les calculs numériques, la chimie, l'électronique, le
marketing, la mécanique, la physique... appliquent ces plans
d'expériences (Pierre, 2005).
I.4.2. Différents types des plans
d'expériences
I.4.2.1.Plans de criblage
Il existe plusieurs types de ces plans, parmi les on site :
I.4.2.1.1.Plans de Taguchi
Afin d'obtenir des améliorations rapides de la
qualité et des coûts de production, la méthode de Taguchi
vise à combiner un ensemble de techniques. De nombreux statisticiens,
Hunter (1985), Kackar (1985), Box (1988), ont donc essayé de retrouver
dans sa présentation les idées générales de la
statistique sous-jacentes à sa démarche dont les justifications
étaient
Chapitre I Etude bibliographique
21
un peu confuses au départ. La "méthode Taguchi"
vise essentiellement à simplifier la mise en oeuvre des plans
d'expériences.
I.4.2.1.2. Plans de Plackett et Burman (PB)
Ces plans sont quelques fois dits plans de criblage ou
matrices d'Hadamard et se présentent sous forme de matrices
carrées orthogonales dont les éléments sont égaux
à #177;1. Ils sont utilisés dans le but de sélectionner
les facteurs les plus influents sur la réponse Y et où les
interactions sont négligeables ou supposées
négligeables.
I.4.3.2. Plans de modélisation
Il existe plusieurs types de ces plans, parmi les on site :
I.4.3.2.1. Plans de Box-Behnken (BB)
Box et Behnken (1960) ont introduit un type différent
de plans d'expériences pour les modèles du deuxième ordre
qui permettent l'estimation de certaines interactions.
Le modèle Box-Behnken est un modèle factoriel
fractionnaire à trois niveaux développée par Box et
Behnken (Box et Behnken, 1960). Le modèle peut être
considéré comme une combinaison entre un modèle factoriel
à deux niveaux et un modèle à blocs incomplets. Dans
chaque bloc, certain facteurs sont soumis à toutes les combinaisons du
modèle factoriel, tandis que les autres facteurs sont maintenus à
leurs niveaux centraux.
Dans la Figure I.10, le modèle polynomial du second
ordre peut être affiché comme une parcelle de surface ou un
tracé de contours en variant seulement deux niveaux de facteurs, tout en
gardant les autres niveaux de facteur constants.
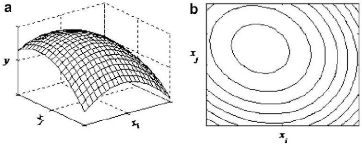
Fig.I.10. a,b (a) : Surface plot, (b) : Contour
plot d'une réponse (Wang and Wan, 2009) Xi : Facteur 1. Xj
: Facteur 2. Y : La répons
CHAPITRE II
MATéRIELS ET MéThODES
Chapitre II Materiels et Méthodes
II.1.Appareils et produits chimiques
|
Appareils
|
Produits chimiques et réactifs
|
- Incubateur avec un système d'agitation et de
régulation de température, New Brunswick Sientific.
- Autoclave, SELECTA.
- Bain-marie agité, Bioblock Scientific.
- pH mètre, MeterLab. - Spectrophotomètre,
SPECTRONIC 20 Genesys.
- Balance de précision, KERN ALJ 220-4M.
- Vortex, stuart.
- Centrifugeuse, Hettich EBA 12. - Centrifugeuse, SIGMA 3- 16 PK.
- Agitateur magnétique, Heidolph. - Agitateur magnétique,
Fisher
Scientific.
- Lecteur de microplaque, Biotek.
22
- Mg SO4.7H2O, Fluka.
- Fe SO4.7H2O, Panreac. - FeCl3.6H2O, Panreac.
- ZnSO4.H2O, Merck.
- Cu Cl2.2H2O, Riedel-de Haën. - Mn SO4. H2O, Prolabo.
- Na2 HPO4, Fluka.
- KH2PO4, SIGMA-ALDRICH.
- Na Cl, Scharlau.
- (NH4)2 SO4, SIGMA-ALDRICH.
- -CaCO3, Prolab.
- Glucose, SIGMA-ALDRICH.
- Urée, SIGMA-ALDRICH.
- Thiamine, SIGMA.
- Biotine, SIGMA-ALDRICH.
- Ca Cl2, Fluka.
- Bitaine, Sigma.
-Acide sulfurique 96%, SIGMA-ALDRICH.
- NaOH, Biochem Chemopharma.
- Kit enzymatique pour le dosage du glutamate, r-
biopharm.
Chapitre II Materiels et Méthodes
23
II.2.Microorganisme utilisé
La souche utilisée dans ce travail est un
Corynebacterium glutamicum 2262, qui a été fourni par le
laboratoire de Génie des Procédés Biotechnologique,
(Institut National Polytechnique de Lorraine Nancy - France). Les
caractéristiques de la souche sont présentées dans le
tableau (Collins et Cummins, 1986).
Caractères principaux
· Bactérie à Gram positif
· Bacille : droit ou légèrement
incurvé, ovale, massue, souvent réarrangées en V
· Colonies jaunes pâle à jaune,
régulières et lisses sur gélose
· Dimension : 0,7 à 1 um x 1 à 3 um
· Auxotrophe pour la biotine
· Non-sporulant
· Non-mobile
· Alcoolo-acido-résistantes
· Aérobie facultative
· Production d'acide glutamique
· % G+C : 53 à 58%
· Paroi : présence d'acide
méso-diaminopimétique et d'arabinogalactane Condition de
culture
· pH optimal de croissance : 7,3 à 7,4
· Température optimale de croissance : 25
à 37°C Substrats consommés (+) ou non
consommés (-)
· (+) Glucose, Frucose, Saccharose,
Maltose, Tréhalose et Mannose
· (-) Rhamnose, Galactose, Raffinose,
Arabinose, Lactose, Xylose, Dextrine, Salicine, Amidon
Activités enzymatique
caractéristiques
· (+) : Catalase, Uréase,
réduction de nitrate en nitrite, Hippurate
· (-) : Hydrolyse gélatine,
hydrolyse caséine, Esculine
Tab II.1. Caractères
générales de C. glutamicum d'après Collins et
Cummins, (1986)
Chapitre II Materiels et Méthodes
24
II.3.Conditions de culture II.3.1. Milieu de
préculture
Le milieu utilisé comme un milieu de base pour la
croissance de C. glutamicum est le BMCG (Basal Medium
Corynebacterium Growth). Les éléments qui composent ce
milieu sont donnés dans le tableau suivant
Tab. II.2. Composition de milieu BMCG
|
Eléments
|
Pré-culture (g/l)
|
|
Mg SO4
|
0,40
|
|
Fe SO4
|
0,040
|
|
Fe Cl3
|
0.004
|
|
Zn SO4
|
0,001
|
|
Cu Cl2
|
0,0004
|
|
Mn SO4
|
0,004
|
|
Na2 HPO4
|
15,00
|
|
KH2PO4
|
3,00
|
|
Na Cl
|
1,00
|
|
(NH4)2 SO4
|
8,00
|
|
Glucose
|
34,00
|
|
Urée
|
4.00
|
|
Thiamine
|
0,01
|
|
Biotine
|
0.0002
|
|
Ca Cl2
|
0,084
|
Chapitre II Materiels et Méthodes
25
II.3.2. Milieu de production
Le milieu BMCG à été remplacé par
un milieu naturel contenant de l'hydrolysat de son de blé. Le milieu est
ensuite enrichi par des sources d'azote (sulfate d'ammonium et urée),
des vitamines (biotine et thiamine) et des sels minéraux.
II.3.3.Stérilisation
La stérilisation des solutions est
réalisée par autoclavage ou par filtration. L'Erlenmeyer dans
lequel se déroule la fermentation est stérilisé à
l'autoclave avec le milieu de production. La stérilisation est
effectuée à 121°C pendant 15 minutes. Pour éviter les
réactions de brunissement non enzymatique, l'hydrolysat de son de
blé et les solutions supplémentaires (sources d'azote et sels
minéraux) sont stérilisés séparément. Les
solutions de vitamines sont stérilisées par filtration sur
filtres Minisart (0.2um).
? L'hydrolyse de son de blé
Le son de blé est tout d'abord broyé
mécaniquement jusqu'à obtention de fragments de taille
inférieure à 2 mm, puis macéré dans l'acide
sulfurique pendant 14 heurs. Le mélange est ensuit chauffé dans
un bain marrie agité. L'extrait obtenu est centrifugé à
4000 rpm pendant 20 minutes dans le but de séparer les débris
cellulosiques. Le surnageant récupéré est utilisé
en tant que source de carbone après être neutraliser (pH 7,6). Les
paramètres d'hydrolyse (concentration d'acide sulfurique, la
température d'hydrolyse et le temps) sont à optimisés.
II.4. Procédé de culture
discontinue II.4.1.Conservation de la souche
La conservation de la souche est réalisée sur
milieu à base de glycérol (glycérol stock). Une culture de
la souche C. glutamicum 2262 est effectuée en milieu liquide
BMCG. Après atteindre la phase exponentielle de la bactérie, le
glycérol stérile est ajouté à raison de 20%. La
suspension bactérienne est ensuite répartie dans des tubes
stériles (1 ml) puis congelée à - 20°C.
II.4.2.Propagation de la souche (préculture)
Les cultures stocks sont décongelées au fur et
à mesure des besoins, puis utilisées. Le tube de conservation
sert à inoculer le milieu de préculture. La préculture est
prise à l'ensemencement en phase exponentielle de croissance (14
heures).

Chapitre II Materiels et Méthodes
26
i ii iii
Fig.II.1. Propagation de C. glutamicum
2262
i-Tube de conservation à -20°C
ii-Préculture (milieu BMCG ,33°C ,14
heurs, 330 rpm) iii-Culture en Erlenmeyer (milieu de
production) II.4.3.Culture en Erlenmeyers
Après l'ajustement de pH à 7,6, le milieu de
culture est réparti dans des Erlenmeyers de 500 ml à un volume de
100 ml. Puis ils sont stérilisés à 121°C pendant 15
minutes. Le milieu de culture est inoculé par la préculture
à raison de 10% (v/v), ensuit incubé à 33°C sous
agitation de 330 rpm dans un incubateur New Brunswick Scientific. (Figure
II.2). Les cultures sont initiées à 33°C jusqu'au l'atteint
de la phase exponentielle de croissance (d'environ 5 heurs) puis un choc
thermique est réalisé à 39°C dans le but d'induire la
production du glutamate.

Fig .II.2. Incubateur New Brunswick
Scientific
II.4.3.1.Protocole des fermentations discontinues
Le volume final de réaction est fixé à
100 ml. L'inoculum est de 10%. Les conditions de culture sont :
? pH ajusté à 7,6
? Température de croissance : 33°C
Chapitre II Materiels et Méthodes
27
? Agitation : 330 rpm
? Température d'induction : 39°C
? Temps d'induction : 5h
? Les prélèvements sont effectués au
cours de la fermentation. La densité optique est lue
immédiatement et le reste de l'échantillon est centrifugé.
Le surnageant est récupéré puis congelé à
-20°C, les différents dosages étant réalisés
ultérieurement.
II.5. Méthode d'analyses
II.5.1.Estimation de la biomasse
La biomasse est suivie par la détermination de la
densité optique. Cette mesure est faite à 570 nm. Une mesure
gravimétrique a été réalisé pour
établi les corrélations entre la densité optique et le
poids sec des cellules. Le coefficient de conversion de la densité
optique en biomasse est de 0,4.
II.5.2.Dosage de glutamate
Le glutamate est dosé par un kit enzymatique
(Biopharm). Le principe de la réaction colorimétrique est la
suivante:
Glutamate déshydrogénase
Glutamate + NAD + H2O á-cétoglutarate + NADH
+NH4
Diaphorase
NADH + iodonitrotétrazolium ???????? NAD + formazan
L'apparition de formazan est détectée à
492 nm. L'intensité de coloration est proportionnelle à la
concentration en glutamate. Une courbe étalon dont la gamme
s'étend de 0 à 0,07 (g.l-1) de glutamate permet de
déterminer la concentration en glutamate des échantillons.
Au-delà de cet intervalle une dilution est nécessaire.
II.5.3.Dosage de sucres totaux
Le dosage des sucres totaux est réalisé selon la
méthode de Dubois (1956). Brièvement, la solution à
analyser est chauffée à 100° C pendant 5 minutes en
présence de phénol à 5% et d'acide sulfurique
concentré. Avant analyse, le mélange est ramené à
température ambiante. Chaque analyse est réalisée trois
fois. L'étalonnage est réalisé avec une solution de
glucose. La gamme étalon est réalisé avec 5 à 6
concentrations comprises entre 10 et 100 mg de glucose /L. Chaque point est
réalisé 3 fois. La concentration de l'échantillon est
calculée en équivalents glucose, en utilisant une courbe de
calibration construire à partir de solutions standards de D- glucose.
II.6. EXPLOITATION DES DONNES EXPERIMENTALES II.6.1
Calcule des paramètres cinétiques en réacteur
discontinu
V : Volume de milieu (l).
X : Concentration en biomasse (g/l).
S : Concentration en substrat (sucres totaux) (g/l).
P : Concentration en produit (L'acide glutamique) (g/l).

Chapitre II Materiels et Méthodes
28
Culture discontinue
II.6.1.1. Vitesse de réaction
A partir des cinétiques de croissance, de consommation des
substrats et de formation de produits, il est possible de calculer les
différentes vitesses à chaque instant t en déterminant la
dérivée de la variable considérée par rapport au
temps.
Les bilans matières de la biomasse X, du substrat S et du
produit P, donnent :
Y P
S S
S - S
YX :
YP :
Avec :



rX
vitesse de croissance (g/l.h)
vitesse de consommation du substrat (g/l.h)
vitesse de production d'un produit (g/l.h)
vitesse spécifique de croissance (h-1)
vitesse spécifique de consommation du substrat (g/g.h)
vitesse spécifique de production d'un produit (g/g.h)
Les rendements globaux Yx/s et Yp/s sont définis comme
les rapports de masse
de biomasse (poids de cellules sèches) (X) ou de
métabolites formés (P) par la masse de
substrat carboné consommé (S) depuis le
début de la fermentation:
YX
0
S
Avec :
Concentration de substrat dans le fermenteur à t = 0
(g/l)
Concentration de produit dans le fermenteur à t = 0
(g/l)
P?P0 S0
X-X0 Rendement apparent de production de biomasse
à partir du substrat (g/g)

Rendement apparent de production de produit à partir du
substrat (g/g)
P P 1
? 0

II.6.1.2. Productivité volumétrique
V d
La productivité volumétrique est la
quantité par unité de temps et de volume du fermenteur
Chapitre II Materiels et Méthodes
29
Avec :
t : durée de la fermentation (h)
: Productivité volumétrique (g/l.h).
CHAPITRE III
RéSULTATS ET DISCUSSION
Chapitre III Résultats et Discussion
30
III.1. OPTIMISATION DE TROIS PARAMETRES D'HYDROLYSE
ACIDE DES SUCRES DE SON DE BLÉ
Dans cette partie nous avons appliqué le modèle
statistique Box-Behnken à 3 facteurs et trois niveaux, afin d'optimiser
les paramètres d'hydrolyse du son de blé.
Le modèle Box-Behnken est un modèle statistique
permettant de limiter le nombre d'essais à réaliser lors d'une
expérimentation afin de déterminer une réponse pour un
grand nombre de facteurs étudiés. En effet, un
phénomène étudié peut toujours être
modélisé sous la forme mathématique : Y =
f(x1, x2,...,xn).
Y étant la réponse à
laquelle on s'intéresse et qui est dans notre cas les sucres de son de
blé et la production du glutamate, f la
fonction mathématique exprimant le mieux les variations de la
réponse selon les différentes valeurs des facteurs (ou variables
appelées xi).
Le nombre des expériences (N)
nécessaire pour le développement du modèle Box-Behnken est
défini comme N= 2k (k-1) + C0, (ou
k est le nombre des facteurs et C0 est le nombre des points
centrales). Le Box-Behnken est un bon modèle pour la Méthodologie
nommée Surface de Réponse (MSR) (Ferreira et al.,
2007):
Cette étude est basée sur deux points
essentiels, d'une part, la mise en évidence des paramètres
opératoires potentiellement importants dans l'hydrolyse acide de la
matière lignocellolosique de son de blé et, d'autre part,
l'application d'un modèle statistique de Box-Behnken à trois
niveaux, afin d'optimiser les paramètres de cet hydrolyse. L'impact de
ces trois facteurs : la concentration de l'acide sulfurique, la
température d'hydrolyse et le temps d'hydrolyse ont été
évalués (Tableau III.1). Comme le montre le Tableau III.1, les
trois facteurs choisis pour cette étude ont été
désignés comme X1, X2, X3 et prescrits
en trois niveaux, codés 1, 0, -1 pour une valeur élevée,
intermédiaire et faible, successivement.
La matrice du modèle et les résultats des
expériences sont donnés dans le Tableau III.2. L'analyse de la
régression polynomiale a été réalisée par le
logiciel JMP 11 Discovery. L'expression mathématique
caractérisant l'équation de régression est la suivante
:
Y (sucres g/l) = 27,16 - 9,67 X1 + 1,62 X2 +
3,21 X3 - 5,79 X1 X2 + 6,18 X1 X3 +
2,88 X2 X3 - 7,06 X1 2 - 4,09 X2
2 + 1,78 X3 2
Chapitre III Résultats et Discussion
31
Tab. III.1. Niveaux choisis pour l'optimisation
des paramètres d'hydrolyse de son de blé
|
Variables
|
Codes des
|
|
Niveaux des variables
|
|
|
variables
|
-1
|
0
|
1
|
|
Acide sulfurique (%)
|
X1
|
20
|
45
|
70
|
|
Température d'hydrolyse (°C)
|
X2
|
50
|
70
|
90
|
|
Temps d'hydrolyse (min)
|
X3
|
30
|
60
|
90
|
La réponse pour l'hydrolyse acide des sucres de son de
blé a montré une grande
hétérogénéité des résultats, qui
prouve l'importance de ces facteurs sur le procédé d'hydrolyse.
En effet, la concentration des sucres a changé suivant les niveaux des
facteurs dans une gamme de 4,22 à 34,33 g.l-1 (Tableau
III.2). Cette variation reflète l'importance de l'optimisation pour
atteindre une meilleure hydrolyse des sucres. En effet, l'écart de
réponse du modèle par rapport aux résultats
expérimentaux est représenté par les variations
résiduelles. Ces dernières montrent qu'en moyenne, la
différence (entre les sucres mesurés et celui simulés) des
concentrations des sucres est proche de 2, ce qui indique que le modèle
estimé est proche de la réalité expérimentale
(Figure III.1).
Tab III.2. Matrice du modèle Box- Benhken
et les résultats des expériences
|
Expériences
|
Acide
sulfurique
(%)
|
Température d'hydrolyse
°C
|
Temps
d'hydrolyse
(min)
|
Sucres
mesurés
(g/l)
|
Sucres
simulés
(g/l)
|
Variation
résiduelle
(g/l)
|
|
1
|
45
|
70
|
60
|
23,81
|
22,52
|
1,29
|
|
2
|
45
|
50
|
30
|
21,75
|
22,27
|
-0,52
|
|
3
|
45
|
90
|
90
|
29,36
|
28,84
|
0,52
|
|
4
|
20
|
70
|
30
|
34,33
|
29,6
|
4,72
|
|
5
|
70
|
70
|
90
|
12,79
|
17,51
|
-4,72
|
|
6
|
45
|
70
|
60
|
22,03
|
22,52
|
-0,49
|
|
7
|
70
|
90
|
60
|
8,56
|
6,35
|
2,2
|
|
8
|
45
|
50
|
90
|
23,04
|
19,97
|
3,06
|
|
9
|
70
|
70
|
30
|
4,22
|
5,36
|
-1,14
|
|
10
|
45
|
70
|
60
|
21,72
|
22,52
|
-0,8
|
|
11
|
45
|
90
|
30
|
15,07
|
18,13
|
-3,06
|
|
12
|
20
|
70
|
90
|
26,99
|
25,84
|
1,14
|
|
13
|
20
|
50
|
60
|
14,06
|
18,26
|
-4,2
|
|
14
|
20
|
90
|
60
|
27,71
|
29,37
|
-1,66
|
|
15
|
70
|
50
|
60
|
12,38
|
10,71
|
1,66
|
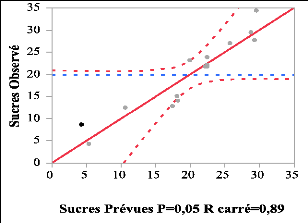
Chapitre III Résultats et Discussion
33
Fig. III.1. Corrélation entre les
sucres observés et les sucres prévues.
L'analyse de régression polynomiale
réalisée par le logiciel IMP 11 Discovery a permis de confirmer
la fiabilité du modèle quadratique. En effet, la valeur de la
probabilité P a été utilisée pour
vérifier la signification de chaque coefficient, qui indique
également les effets de l'interaction entre les variables. Plus la
valeur de P est faible, plus l'effet du paramètre
étudié est significatif. Les coefficients de régression
ainsi que les valeurs de probabilité correspondantes (P) sont
donnés dans le Tableau III.3. Dans notre cas la valeur de P du
modèle est de 5% avec un intervalle de confiance de 95%.
A partir des donnés du Tableau III.3, on peut conclure
que le coefficient linéaire du X1 (la concentration d'acide
sulfurique) est très significatif avec une valeur de P de 3%.
Les autres coefficients X2 et X3 et les coefficients
d'interaction X1.X3 et X2.X3
et le coefficient quadratique X32 ont un effet positif sur
l'hydrolyse des sucres avec une valeur de P non significative. Le
coefficient d'interaction X1.X2 et les coefficients
quadratiques X12 et X22 ont un effet
négatif sur l'hydrolyse des sucres avec des valeurs de P non
significatives.
Chapitre III Résultats et Discussion
34
Tab. III.3. Analyse de régression des
résultats obtenus à partir du modèle Box Behnken.
|
Variables
|
Estimation
|
Erreur standard
|
t ratio
|
Prob. > |t|
|
|
Constant
|
27,16
|
5,622372
|
4,83
|
0,0048*
|
|
X1
|
- 9,67
|
3,442986
|
-2,81
|
0,0376*
|
|
X2
|
1,62
|
3,442986
|
0,47
|
0,6576
|
|
X3
|
3,21
|
3,442986
|
0,93
|
0,3936
|
|
X1 X2
|
- 5,79
|
4,869117
|
-1,19
|
0,2872
|
|
X1 X3
|
6,18
|
4,869117
|
1,27
|
0,2599
|
|
X2 X3
|
2,88
|
4,869117
|
0,59
|
0,5793
|
|
X12
|
- 7,06
|
5,067937
|
-1,39
|
0,2223
|
|
X22
|
- 4,09
|
5,067937
|
-0,81
|
0,4557
|
|
X23
|
1,78
|
5,067937
|
0,35
|
0,7389
|
III.2. Validation du modèle
L'ajustement du modèle a été
vérifié par le coefficient de corrélation (R2)
qui est de 0,89, indiquant que 89% de la variabilité dans la
réponse pourraient être estimé par le modèle. Les
conditions optimales de l'hydrolyse des sucres de son de blé
estimées par l'équation du modèle sont les suivantes :
19,13% pour l'acide sulfurique, de 89,37 °C pour la température
d'induction, de 63,29 min pour le temps d'hydrolyse.
La concentration de l'acide sulfurique estimée par le
modèle (19,13%) est inferieure à la concentration minimale
proposée (20%), donc une autre optimisation par le modèle de
Box-Behnken doit être effectuée avec une concentration maximale de
l'acide sulfurique de 20 %.
Tab. III.4. Niveaux choisis pour la
deuxième optimisation des paramètres d'hydrolyse de son de
blé
|
Variables
|
Codes des
|
|
Niveaux des variables
|
|
|
variables
|
-1
|
0
|
1
|
|
Acide sulfurique (%)
|
X1
|
2
|
11
|
20
|
|
Température d'hydrolyse (°C)
|
X2
|
50
|
70
|
90
|
|
Temps d'hydrolyse (min)
|
X3
|
30
|
60
|
90
|
Chapitre III Résultats et Discussion
35
L'écart de réponse du modèle par rapport
aux résultats expérimentaux est représenté par les
variations résiduelles (Tableau III.5). Ces dernières montrent
qu'en moyenne la différence entre la concentration des sucres
mesurés et celui simulés est inférieure à 1, ce qui
indique que le modèle estimé est proche de la
réalité expérimentale (figure III.1).
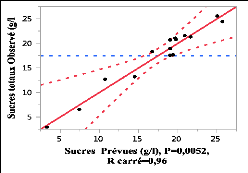
Fig.III.2. Simulation des sucres.
Tab. III.5. Matrice expérimentale du
modèle factoriel Box-Behnken.
|
Expériences
|
Acide
sulfurique
(%)
|
Température d'hydrolyse
°C
|
Temps
d'hydrolyse
(min)
|
Sucres
mesurés
(g/l)
|
Sucres
simulés
(g/l)
|
Variation
résiduelle
(g/l)
|
|
1
|
11
|
70
|
60
|
17,44
|
19,01
|
-1,57
|
|
2
|
11
|
50
|
30
|
6,55
|
7,47
|
-0,92
|
|
3
|
11
|
90
|
90
|
20,72
|
19,80
|
0,92
|
|
4
|
2
|
70
|
30
|
18,25
|
16,82
|
1,43
|
|
5
|
20
|
70
|
90
|
24,32
|
25,75
|
-1,43
|
|
6
|
11
|
70
|
60
|
20,66
|
19,01
|
1,65
|
|
7
|
20
|
90
|
60
|
21,44
|
20,93
|
0,51
|
|
8
|
11
|
50
|
90
|
12,59
|
10,78
|
1,81
|
|
9
|
20
|
70
|
30
|
21
|
19,70
|
1,31
|
|
10
|
11
|
70
|
60
|
18,92
|
19,01
|
-0,09
|
|
11
|
11
|
90
|
30
|
17,58
|
19,39
|
-1,81
|
|
12
|
2
|
70
|
90
|
13,18
|
14,49
|
-1,31
|
|
13
|
2
|
50
|
60
|
2,88
|
3,39
|
-0,51
|
|
14
|
2
|
90
|
60
|
25,47
|
25,08
|
0,39
|
|
15
|
20
|
50
|
60
|
21,29
|
21,68
|
-0,39
|
Chapitre III Résultats et Discussion
36
L'analyse de régression polynomiale
réalisée par le logiciel JMP11 Discovery a permis de confirmer la
fiabilité du modèle. En effet, la valeur de la probabilité
P a été utilisée pour vérifier la
signification de chaque coefficient, qui indique également les effets de
l'interaction entre les variables. Dans notre cas la valeur de P du
modèle est de 0,5% avec un intervalle de confiance de 99,5 %.
L'expression mathématique caractérisant
l'équation de régression est la suivante :
Y (sucres g/l) = 1,61 - 3,53 X1+5,23 X2+ 0,92
X3 - 5,61 X1X2 + 2,09 X2X3 - 0,72
X1X3 + 1,79
2
X1 2 -3,03 X2 2 + 19
X3
Les coefficients de régression, avec les valeurs de la
probabilité P correspondantes, pour le modèle des
concentrations des sucres sont présentés dans le Tableau III.6. A
partir de ces derniers, on peut conclure que les coefficients linéaire
X1 et X2 (acide sulfurique (%) et température
d'hydrolyse °C) est significatif avec une valeur de P de 0,5%, le
coefficient d'interaction X1 X2 (acide sulfurique * température
d'hydrolyse) est significatif avec un P de 0,5% Le coefficient
quadratique X22 (température d'hydrolyse) a un effet
significatif avec un P de 5%. Les coefficients d'interaction X2 X3
(température d'hydrolyse * temps d'hydrolyse) et X1 X3
(acide sulfurique * temps d'hydrolyse) ont un effet négatif sur
l'hydrolyse des sucres et c'est la même chose pour l'effet quadratique
X22 (température d'hydrolyse * température
d'hydrolyse). Le coefficient quadratique X32 (temps
d'hydrolyse * temps d'hydrolyse) et le coefficient linéaire X3
(temps d'hydrolyse) ont un effet positif sur l'hydrolyse des sucres avec
un P non significatif.
Tab.III.6. Analyse de régression des
résultats obtenus à partir du modèle Box-Behnken.
|
Variables
|
Estimation
|
Erreur
standard
|
t
ratio
|
Prob. >
|t|
|
|
Constant
|
19
|
1,2044
|
15,78
|
<,0001*
|
|
X1
|
3,53
|
0,7375
|
4,79
|
0,0049*
|
|
X2
|
5,23
|
0,7375
|
7,10
|
0,0009*
|
|
X3
|
0,92
|
0,7375
|
1,26
|
0,2635
|
|
X1 X2
|
-5,61
|
1,0430
|
-5,38
|
0,0030*
|
|
X1 X3
|
2,09
|
1,0430
|
2,01
|
0,1005
|
|
X2 X3
|
-0,72
|
1,0430
|
-0,70
|
0,5180
|
|
X1 2
|
1,79
|
1,0856
|
1,65
|
0,1591
|
|
X22
|
-3,03
|
1,0856
|
-2,79
|
0,0383*
|
|
X32
|
-1,61
|
1,0856
|
-1,49
|
0,1971
|
Chapitre III Résultats et Discussion
37
Les figures III.(3, 4 et 5) représentent l'effet la
température d'hydrolyse, le temps d'hydrolyse et la concentration de
l'acide sulfurique ainsi que leurs interactions réciproques sur la
concentration des sucres. La concentration maximale des sucres se situe
à 85°C pour la température d'hydrolyse, à 68 min pour
le temps d'hydrolyse et à 11% pour l'acide sulfurique.

Fig.III.3. Courbes d'isoréponse et
surface de réponse de la concentration des sucres de son de blé
montrant l'effet
de l'interaction entre la température d'hydrolyse et
le temps d'hydrolyse.

Fig.III.4. Courbes d'isoréponse et
surface de réponse de la concentration des sucres de son de blé
montrant l'effet
de l'interaction entre l'acide sulfurique et le temps
d'hydrolyse.
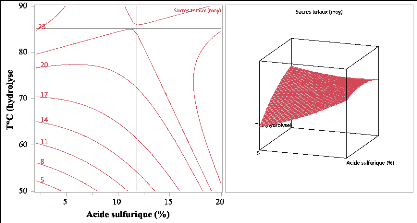
Chapitre III Résultats et Discussion
38
Fig.III.5. Courbes d'isoréponse et
surface de réponse de la concentration des sucres de son de blé
montrant l'effet de l'interaction entre l'acide sulfurique et la
température d'hydrolyse.
Validation du modèle
L'ajustement du modèle a été
vérifié par le coefficient de corrélation (R2)
qui est de 0,96, indiquant que 96% de la variabilité dans la
réponse pourraient être estimé par le modèle. Les
conditions optimales de l'hydrolyse des sucres se son de blé
estimées par l'équation du modèle sont les suivantes :
11,83 % d'acide sulfurique, 85°C pour la température d'hydrolyse et
65 min pour le temps d'hydrolyse. Afin de vérifier la validité du
modèle, les conditions théoriques optimales ont été
appliquées. La concentration des sucres obtenue sous ces conditions est
de 35 g/l.
III.3. Cinétiques de C. glutamicum 2262 sur
milieu de culture à base d'hydrolysat de son de blé
Cette partie consiste à tester le milieu de culture
à base de l'hydrolysat de son de blé et étudier les
besoins nutritionnels de C. glutamicum 2262 pour la croissance et la
production du glutamate.
Les cinétiques de croissance, de consommation des
sucres et de production de glutamate sur le milieu testé sont
montrées sur les figures III.6.
Chapitre III Résultats et Discussion
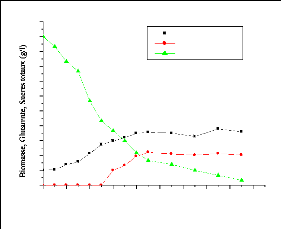
27
24
21
33
30
18
15
12
0
9
6
3
0 2 4 6 8 10 12 14 16 18
Temps (h)
Biomasse (g/l)
Glutamate (g/l)
Sucres totaux (g/l)
39
Fig.III.6. Cinétiques de croissance, de
consommation des sucres et de production de glutamate sur le milieu
testé
A partir de ces courbes, plusieurs paramètres ont
été calculés.
Tab. III.7. Paramètres
cinétiques de C. glutamicum 2262 sur le milieu à base
d'hydrolysat de son de blé.
Paramètres cinétiques Valeurs des
paramètres
X (g/l) 4,28
Glutamate (g/l) 6,63
umax (h-1) 0,20
qp (g./g.h) 0,40
ä (g./l.h) 0,66
Taux de consommation des sucres (%) 96,42
(X): biomasse, (umax): vitesse spécifique
maximale de croissance, (qp): vitesse spécifique de la
production du glutamate, (ä): productivité volumétrique de
production d'acide glutamique.
En effet pendant la croissance à 33°C, les sucres
sont métabolisés pour être transformés
principalement en biomasse. Après un choc thermique de 33 à
39°C la biomasse augmente et atteint un maximum de 4,28 g.l-1
ensuite elle diminue et se stabiliser au bout de fermentation, et le flux du
carbone se dévier vers la production de 6,63 g.l-1 du
glutamate après 10h de fermentation .La vitesse spécifique
maximale de croissance (umax) atteint une valeur de 0,20
h-1 et la quasi totalité des sucres est consommé
(96,42%)
Ces résultats montrent que l'hydrolysat de son de
blé est favorable à la croissance et à la production
d'acide glutamique à partir de C. glutamicum 2262.
40
Conclusion
L'objectif de ce travail était l'optimisation des
paramètres d'hydrolyse de son de blé dans le but de l'utiliser
comme milieu de culture naturel de C. glutamicum 2262 pour la
production glutamtique.
La première partie de ce travail a essentiellement
été basée sur l'optimisation des paramètres
d'hydrolyse de son de blé en utilisant le model statistique Box Behnken.
Nous avons montré que les valeurs optimales de l'hydrolyse sont les
suivants : 85°C pour la température d'hydrolyse, 68 min pour le
temps d'hydrolyse et 11% pour la concentration d'acide sulfurique.
Dans la deuxième partie on a démontré que
l'hydrolysat de son de blé contient les différents
éléments nutritionnels (source de carbone, source d'azote et sels
minéraux) qui peuvent être utilisés par C. glutamicum
2262 afin de produire l'acide glutamique.
Finalement, l'objectif du travail est atteint. Cependant de
nombreuses perspectives peuvent être envisagées :
- L'enrichissement de milieu de culture par d'autres sources
d'azote et de vitamine.
- Utilisation de model Plakett Burmen pour étudier
l'effet des éléments nutritionnels sur la production
glutamique.
- Utilisation le mode semi-continu ou le mode continu pour une
meilleure productivité.
- Valorisation des autres parties de blé tel que la paille
de blé.
- Utilisation des enzymes spécifiques capables
d'augmenter le rendement de l'hydrolyse de cellulose.
Références bibliographiques
|
·
41
Bataillon M, P Mathaly, A P Nunes Cardinali and F Duchiron
(1998). Extraction and purification of arabinoxylan from destarched wheat bran
in a pilot scale. Industrial Crops and Products, 8(1), 37-43.
· Bingham S A, Day N E, Luben R, Ferrari P, Slimani N,
Norat T, Clavel-Chapelon F, Kesse E, Nieters A, Boeing H, Tjonneland A, Overvad
K, Martinez C, Dorronsoro M, Gonzalez C A, Key T J, Trichopoulou A, Naska A,
Vineis P, Tumino R, Krogh V, Bueno-de-Mesquita H B, Peeters P H M , Berglund G,
Hallmans G, Lund E, Skeie G, Kaaks R, and Riboli E (2003). Dietary fibre in
food and protection against colorectal cancer in the European Prospective
Investigation into Cancer and Nutrition (EPIC): an observational study. The
Lancet, 361, 1496-1501.
· Boudreau A and Ménard G (1992). Le
Blé, Éléments Fondamentaux et Transformation.
Sainte-Foy: Les Presses de l'Université Laval.
· Boulahya Brihmouche K A (2010). Importance de
l'enveloppe cellulaire dans la régulation de production de glutamate par
Corynebacterium 2262 au cour d'un procédé thermo-induit.
Mémoire de Doctorat. Université de Nancy.
· Bormann E R, Eikmanns B J and Sahm H (1992). Molecular
analysis of the Corynebactenium glutamicum gdh gene encoding glutamate
dehydrogenase. Mol. Microbiol, 6, 317-326.
· Box G E P and Wilson K B (1951). Journal of
Statistical Royal Society, 13 (1), 1-45.
· Box G E P and Behnken D W (1960). Some new three-level
designs for the study of quantitative variables. Technometrics,
2, 455-75.
· Box G E P (1988). Signal to noise ratios. Performance
criteria and transformations (with discussion), Technometrics,
30, 140p.
· Burkovski A and Kriimer R (2002). Bacterial Amino acid
transport proteins: occurrence, functions, and significance for
biotechnological applications. Appl. Microbiol. Biotechnol.,
58, 265-274.
· Caballero B, Trugo L C, and Finglas P M (2004).
Encyclopedia of food sciences and nutrition. New York: Academic Press,
pp 1813-1858.
· Çalik G, Unlutabak F and Ozdamar T H (2001).
Product and byproduct distributions in glutamic acid fermentation by
Brevibacterium flavum: effects of the oxygen transfer. Biochem Eng,
9, 91-101.
· Clément Y, Escoffier B, Trombe M C and
Lanéeile G (1984). Is glutamate excreted by its uptake system in
Corynebacterium glutamicum: A working hypothesis. J. General
Microbiol., 130, 2589-2594.
· Clément Y and Lanéelle G (1986).
Glutamate excretion mechanism in Corynebacterium glutamicum:
triggering by biotin starvation or by surfactant addition. J. General
Microbiol., 132, 925-929.
· Cocaign-Bousquet M, Guyonvarch A and Lindley N D
(1996). Growth rate dependent modulation of carbon flux through central
metabolism and the kinetic consequences for glucose-limited chemostat cultures
of Corynebacterium glutamicum. Appl. Environ. Microbiol.,
62: 429-436.
· Crueger W and Crueger A (1984). Amino acids. In Brock
T.D. (ed.), Biotechnology: A textbook of industrial microbiology.
Madison: Science Tech, Inc., pp127-147.
· Daniel Ballerini (2006). biocarburants: Etat des lieux,
perspectives et enjeux du Développement. Chapitre 6, France, pp
264-287,
· Das K, Anis M, Mohd-Azemi B M N and Ismail N (1995).
Fermentation and recovery of glutamic acid from palm waste hydrolysate by
ion-exchange resin column. Biotechnol. Bioeng, 48,
551-555.
42
Références bibliographiques
· Davin U Y (2003). Etude cinétique et
métabolique de Corynebacterium glutamicum 2262 au cours de la
fermentation glutamique : instabilité de la production de glutamate en
procédé continu thermo-induit. Mémoire de Doctorat.
Université de Nancy.
· Delaunay S (1999). Etude et modification du
metabolisme central de Corynebacterium glutamicum productrice de
glutamate. Thèse INPL Nancy.
· Demain A L and Birnbaum J (1968). Alteration of
permeability for the release of metabolites from microbial cell. Current
Topics Microbiol. Immunol., 46, 1-25.
· Dominguez H and Lindley N D (1996). Complete Sucrose
Metabolism Requires Fructose Phosphotransferase Activity in Corynebacterium
glutamicum To Ensure Phosphorylation of Liberated Fructose. Appl
Environ Microbiol, 62(10), 3878-3880.
· Dominguez H, Nezondet C, Lindley N D and Cocaign M
(1993). Modified carbon flux during oxygen limited growth of
Corynebacterium glutamicum and the consequences for amino acid
overproduction. Biotechnol. Lett, 15, 449-454.
· Du perray F, Jezequel D, Ghazi A, Letellier L and
Shechter E (1992). Excretion of glutamate from Corynebacterium glutamicum
triggered by amine surfactants. Biochim. Biophys. Acta,
1303, 250-258.
· Eggeling L and Sahm H (1999). L-glutamate and
L-lysine: traditional products with impetuous developments. Appl.
Microbiol. Biotechnol., 52, 146-153.
· Elke R B, Bernhard J E, Marcella G and Hermann S
(1993). Glutamate Dehydrogenase is not essential for glutamate formation by
Corynebactenium glutamicum. Appl &Environ Microbiol,
59 (7), 2329-2331.
· Gabriele B, Lars N and Andreas B (2001). Glutamate
synthase of Corynebacterium glutamicum is not essential for glutamate
synthesis and is regulated by the nitrogen status. Microbiology,
147, 2961-2970.
· Gourdon P, Raherimandimby M, Dominguez H,
Cocaign-Bousquet M and Lindley N D (2003). Osmotic stress, glucose transport
capacity and consequences for glutamate overproduction in Corynebacterium
glutamicum. J Biotechnol, 104(1-3), 77-85.
· Greenshield S (1993). Gel production from plant
matter. Brevet WO 93/10158.
· Gruppen H, R J Hamer and A G J Voragen (1992).
Water-unextractable cell wall material from wheat flour. 1. Extraction of
polymers with alkali. Journal of Cereal Science,
16(1),41-51.
· Gunsalus I C and Shuster C W (1961). Energy-yielding
metabolism in Bacteria. The Bacteria, 2, 1-28.
· Hatakeyama K, Hohama K, Vertes A A, Kobayashi M,
Kurusu Y and Yukawa H (1993a). Genomic organization of the biotin biosynthetic
genes of coryneform bacteria : cloning and sequencing of the bioA-bioD genes
from Brevibacterium flavum. DNA Seq,
4,177-84.
· Hatakeyama K, Hohama K, Vertes A A, Kobayashi M,
Kurusu Y and Yukawa H (1993b). Analysis of the biotin biosynthesis pathway in
coryneform bacteria: cloning and sequencing of the bioB gene from
Brevibacterium flavum. DNA Seq, 4, 87-93.
· Hoebler C, Barry J L, David A and Delort-Laval J
(1989). Rapid acid hydrolysis of plant cell wall polysaccharides and simplified
quantitative determination of their neutral monosaccharides by gas-liquid
chromatography. Journal of Agricultural and Food Chemistry,
37(2), 360-367.
· Hromàdkovà Z, Kovàcikovà Z
and Ebringerovà A (2008). Comparison of conventional and
ultrasound-assisted extraction of phenolics-rich heteroxylans from wheat bran.
Ultrasonics Sonoochemistry, 15(6), 1062-1068.
· Hoseney R C (1986). Principles of Cereal Science and
Technology. St. Paul, MN : AACC. In Marquart, L., Slavin, J. L., & Fulcher,
R. G. (Eds.). Whole Grain Foods in Health and Disease. Chapitre 3, St-Paul,
MN : AACC., pp47-82.
Références bibliographiques
|
|
·
43
Huchenq A, Marquet M, Welby M, Montrozier H, Goma G and
Laneele G (1984). Glutamate excretion triggering mechanism : a reinvestigation
of the surfactant-induced modification of cell lipids. Ann Microbiol ( paris),
pp53-67.
· Hunter J S (1985). Statistical design applied to
product design, J. qual. technol, 17, 201-221.
· Izydorczyk M S, Symons S J and Dexter J E (2002).
Fractionation of wheat and barley. In L. Marquart, J.L. Slavin, & R.G.
Fulcher (Eds.), Whole Grain Foods in Health and Disease. Chapitre 3.
St. Paul, MN : AACC. pp47-82.
· Jutta G, Nicole R, Ulrich F, Julia S and Andreas B
(2009). Modeling and simulation of nitrogen regulation in Corynebacterium
glutamicum. Discrete Applied Mathematics, 157,
2232-2243.
· Kackar N (1985). Off-line quality control, parameter
design and the Taguchi method, J .Quality Technology,
17, 176-188.
· Kanzaki T, Okazaki H, Sugawara A and Fukada H (1967).
L.glutamic acid fermentation. Part IV. The remation between the cellular fatty
acid contents and the productivity of L glutamic acid. Agric Boil
Chem. 31, 1416-1420.
· Kinoshita S and Nakayama K (1978). Amino acid.
In: Rose A. H.(ed.), primary products of metabolism. London,
Academic Press, 209-261.
· Kumagai H (2000). Microbial
Production of Amino Acids in Japan. In: The Natural Functions of Secondary
Metabolites (69), T. Scheper, Éd., Massachusetts,
Springer.
· Lambert C , Erdmann A , Eikmanns M and Kramer R
(1995). Triggering Glutamate excretion in Corynebacterium glutamicum
by Modulating the Membrane State with Local Anesthetics and Osmotic
Gradients. Appl Environ Microbiol, 61, 4334-4342.
· Marcos A, Das N and Toshinori K (29 April 2007) State
of the Art and Future trends of Bioethanol Production , p 4, Japan.
· Maréchal P (2001). Analyse des principaux
facteurs impliqués dans le fractionnement combiné de pailles et
de sons de blé en extrudeur bivis: obtention d'agromatériaux. PhD
thesis, Laboratoire de Chimie Agro-Industrielle - UMR 1010 INRA / INP ENSIACET,
Université de Toulouse. pp 350.
· Mori M and Shiio I (1987). Phosphoenolpyruvate: sugar
phosphotransferase systems and sugar metabolism in Brevibacterium
flavum. Agric. Biol. Chem. 51: 2671-2678.
· Nakamura J, Hirano S, ItoH and Wachi M
(2007).Mutations of the Corynebacterium glutamicum NCgl1221
Gene, Encoding a Mechanosensitive Channel Homolog, Induce l-Glutamic Acid
Production. Appl Environ Microbiol. 73,
4491-4498.
· Nakao Y , Kikuchi M , Suzuki M and Doi M (1970).
Microbial production of L-glutamic acid from n-parrafin by glycerol auxotrophs.
Agric Boil Chem, 34, 18751876.
· Nandini C D and Salimath P V (2001). Carbohydrate
composition of wheat, wheat bran, sorghum and bajra with good chapati/roti
(Indian flat bread) making quality. Food Chemistry,
73, 197-203.
· Park S Y , Kim H K , Yoo S K , Oh T K and Lee, J K(2000).
Characterization of glk, a gene coding for glucose kinase of
Corynebacterium glutamicum. FEMS Microbiol Lett
188(2), 209-215.
· Peterso D and Fulcher R (2002). Variation in Minnesota
HRS wheats bran content. Journal of Food Science, 67
(1), 67-70.
· Pierre C (2005). Les plans d'expériences partie
1: Principes généraux, Revue: Contrôles- Essais-
Mesure, 69-72.
· Pierre Dagnelie (2008), Le plan d'expérience
évolue, Revue MODULAD, N° 38.
44
Références bibliographiques
· Piot O , Autran J C and Manfait A (2000). Spatial
distribution of protein and phenolic constituents in wheat grain as probed by
confocal Raman microspectroscopy. Journal of Cereal Sciences,
32, 57-71.
· Pomeranz Y (1987). Cereal Crops-General. In:
Pomeranz, Y , (Eds) VCH Publishers, Inc, New York. Modern Cereal Science
and Technology. 14-23.
· Pomeranz Y (1988). Chemical composition of kernel
structures. In Y. Pomeranz (Ed.), Wheat Chemistry and
Technology. St. Paul, MN : American Association of Cereal Chemists. pp
97-118.
· Pyler E J (1988). Baking Science and Technology.
Chicago, IL : Siebel Publishing Company.
· Ralet M C, Thibault J F and Della Valle G (1990).
Influence of extrusion-cooking on the physic-chemical properties of wheat bran.
Journal of Cereal Science, 11, 249-259.
· Raynal-Ioualalen R (1996). Procédé de
fractionnement des sons de blé. Extraction et étude des
propriétés fonctionnelles des arabinoxylanes. PhD thesis,
Laboratoire de Chimie Agro- Industrielle - UMR 1010 INRA / INP ENSIACET,
Université de Toulouse. pp 324.
· Selvendran R R, Ring S G, O'Neill M A and Dupont, M.S
(1980). Composition of cell wall material from wheat bran used in clinical
feeding material. Chemistry and Industry, 22,
885-888.
· Shah A H, Abdul Hameed Ahmed S and Madjid Khan G
(2002). Optimisation of culture conditions for L-Lysine fermentation by
Corynebacterium glutamicum. Online Journal of Biological
Science, 2 (3), 151-156.
· Shibukawa M, Kurima M, Okabe S and Ohsawa T (1968). L-
glutamic acid fermentation with molasses. Part X. On the difference in
mechanisms for the bacterial extracellular accumulation of L-glutamate between
fatty acid derivative and penicillin. Agric. Biol. Chem.
32,641-645.
· Shibukawa M and Ohsawa T (1966). L- glutamic acid
fermentation with molasses. Part VI. Effect of the saturated-unsaturated fatty
acid ratio in the cell membrane fraction on the extracellular accumulation of
L-glutamate. Agric. Biol. Chem. 30, 750758.
· Sommerson N L and Phillips T (1962)..
U.S. Patent, 30, 80-297.
· Stackebrandt, E, Rainey F A and Ward-Rainey N L
(1997). Proposal for a new hierarchal classification system, Actinobacteria
classis nov. Int. J. Syst. Bacteriol. 47, 479-49.
· Steffen N L, Gerd M S, Alexander H, Reinhard K and Volker
F W (2011). Phosphotransferase System-Independent Glucose Utilization in
Corynebacterium glutamicum by Inositol Permeases and Glucokinases.
Applied and Environmental Microbiology, 77(11),
3571-3581.
· Sung-Jin J, Chean R L, Ken'ichiro M and Seiichi T
(2009). Dual production of poly(3-hydroxybutyrate) and glutamate using variable
biotin concentrations in Corynebacterium glutamicum. Journal of Bioscience
and Bioengineering, 107, 409411.
· Takinami K, Yoshii H, Tsuri H and Odaka H (1965).
Biochemical effect of fatty acid and its derivatives on glutamic acid
fermentation. III. Biotintween 60 relationship in the accumulation of
L-glutamic acid and the growth of Brevibacterium lactofermentum. Agric.
Biol. Chem. 29,351-359.
· Takuo H, Ken-ichi H, Hisashi K and Tsuyoshi N (2008).
Changes in Enzyme Activities at the Pyruvate Node in Glutamate-Overproducing
Corynebacterium glutamicum. JOURNAL OF BIOSCIENCE AND BIOENGI NE ERING,
105, 12-19.
45
Références bibliographiques
· Tavakkoli M, Hamidi-esfahani Z and Hossein azizi M
(2009). Optimization of Corynebacterium glutamicum
glutamic acid production by response surface methodology. Food
Bioprocess Technol.
· Tesch M, Eikmanns B J, De Graaf A A net Sahm H (1998).
Ammonia assimilation in Corynebacterium glutamicum and glutamate
dehydrogenase-deficient mutant. Biotechnol. Lett, 20,
953-957.
· Van Soest P J and R H Wine (1968) . The determination
of lignin and cellulose in acid detergent fiber with permanganate .Journal
of the Association of Official Analytical Chemists,
51,780-787.
· Volker F W, Michael B, J·orn K, Marco O et
Wolfgang W (2006). Emerging Corynebacterium glutamicum systems
biology. Journal of Biotechnology, 124, 74-92.
· Wehrmann A , phillipp B , Sahm H et Eggeling L (1998).
Different modes of diaminopimelate synthesisn and their role in cell wall
integrity: a study with Corynebacterium glutamicum. J Bacteriol
180, 3159-65.
· Zeitoun R (2011). Procédés de
fractionnement de la matière végétale - Application
à la production des polysaccharides du son et de la paille de
blé. PhD. thesis, Laboratoire de Chimie Agro-Industrielle - UMR 1010
INRA / INP ENSIACET, Université de Toulouse, pp.
281.
| 


