II-2-1-1- Techniques d'étude de l'activité
antimicrobienne des huiles essentielle
La technique de détermination du pouvoir antimicrobien
des H.E a une grande influence sur les résultats. L'origine des
difficultés pratiques vient de l'insolubilité des constituants
des H.E. dans l'eau ainsi que leur caractère volatile (Bousbia,
2004). Pour réaliser ce screening antimicrobien, trois
techniques ont été mise en oeuvre.
II-2-1-1-1 - Aromatogramme
Les médecins utilisent l'antibiogramme pour analyser
l'impact d'un médicament antibiotique sur des microbes ; l'aromatogramme
(figure 5) fait recours au même principe où les
H.E remplacent les antibiotiques(Festy, 2009).
L'utilisation de cette technique est réservée
à la recherche d'huiles essentielles actives in vitro contre un microbe
infectieux donné.
Il s'agit d'une méthode en milieu gélosé
à l'agar réalisée dans une boîte de Pétri .Le
contact se fait par l'intermédiaire d'un disque de papier sur lequel on
dispose une quantité donnée d' H.E.

18
Figure 5 : Analyse de l'activité antimicrobienne
par diffusion sur milieu gélosé solide :
Aromatogramme (Zaika,
1988).
II-2-1-1-2 - Micro-atmosphère
Contrairement à la première technique, basée
sur le contact direct de l'H.E dans sa globalité avec les
micro-organismes (Laghchimi et al., 2014), dans cette
méthode(figure 6), le disque imprégné
d'H.E est déposé au centre du couvercle de la boite
renversée après fixation de l'H.E sur le disque, donc elle
s'évapore dans l'atmosphère de la boite, donc cette technique a
été réalisée dans le but d'apprécier les
propriétés bactéricide de la phase volatile de
l'essence.
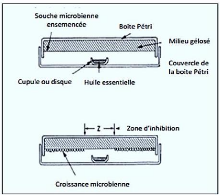
Figure 6 : Analyse de l'activité antimicrobienne
par micro-atmosphère(Zaika, 1988).
19
II-2-1-2- Mode opératoire
a- Préparation de l'inoculum
On prépare à partir des cultures jeunes
(culture de 18-24h pour les bactéries et 48h pour les levures) sur
gélose nutritive, une suspension en solution saline d'eau physiologique
stérile (0.9% NaCl) à une concentration de 107 à 108
germes/ml, par prélèvement de 3 à 5 colonies
isolées et identiques à l'aide d'une anse stérile dans 5
ml d'eau physiologique, on agite au Vortex pendant quelques secondes ; on
procède ainsi pour toutes les suspensions bactériennes et la
suspension fongique (annexe 6).
b- L'ensemencement
On trempe un écouvillon stérile dans la
suspension du micro-organisme, puis on étale en stries sur une boite de
Pétrie stérile de 100 mm de diamètre (annexe
6), coulée précédemment par le milieu de culture
approprié (annexe 5) en la tournant horizontalement
pour couvrir toute la surface.
c- Dépôt des disques et les gouttes
d'H.E
A l'aide d'une pince stérile, on prend un disque en
papier absorbant (papier buvard de 9mm de diamètre) et on le
dépose sur la surface du milieu ensemencée par les
micro-organismes à tester, on met 3 disques dans chaque boite pour
réaliser l'aromatogramme.
A l'aide d'une micropipette on dépose les volumes
croissants suivants : 20uL ,40uL ,60uL d'H.E pure sur les disques afin
d'apprécier l'effet « dose-dépendant »
de l'HE sur l'inhibition de la croissance des germes bactériens.
Pour la technique de micro-atmosphère,
on fait la même chose mais pour chaque boite on utilise un
disque qu'on le dépose au centre du couvercle ; pour chaque volume on
utilise des disques de papier filtre de diamètre croissants afin d'avoir
un bon étalement de l'huile donc une bonne évaporation ; leurs
diamètres sont : 2cm, 4cm, 6cm qui correspondent aux volumes : 20uL
,40uL ,60uL d'H.E pure chargée à l'aide d'une micropipette .On a
recouvert les bords de chaque boite de Pétri à l'aide de para
film pour ne pas avoir une évaporation de l'huile en dehors de la
boite.
En ce qui concerne la technique de dilution,
on réalise une série de dilutions : 1/2 ,1/4, 1/8
,1/16 de l'huile dans le D.M.S.O ; on dépose 4
disques pour chaque boite ensemencée précédemment par le
microbe à tester. Puis, on utilise une micropipette pour déposer
une goutte de 10 ul pour chaque concentration d'H.E diluée.
20
? Il faut noter que la préparation de l'inoculum,
l'ensemencement, l'incubation et la lecture des résultats ont
été menés de la même manière pour toutes les
méthodes réalisées.
Des antibiotiques standards (Ampicilline 10 ug/disque et
Myconasol 10 mg/ml) ont été utilisés afin de
contrôler la sensibilité des micro-organismes à tester en
les appliquant dans les mêmes conditions.
d- Lecture des résultats
Après incubation (24h pour les souches
bactériennes et 48h pour la levure) l'absence de la croissance
bactérienne se traduit par un halo translucide autour du disque pour la
méthode de l'aromatogramme et celle de la dilution, pour la technique de
micro-atmosphère elle se traduit par une zone claire sur la
gélose, de contour à tendance circulaire. On mesure avec
précision les DZI à l'aide d'une règle. La
sensibilité des souches aux différents agents antimicrobiens a
été classifiée par le diamètre de la zone
d'inhibition comme suit (Djeddi et al., 2007) :
1. Souche résistante : (-, D<8mm).
2. Souche sensible : (+, 9mm=D=14mm).
3. Souche très sensible : (++,
15mm=D19mm).
4. Souche extrêmement sensible : (+++,
D=20mm).
II-2-2- Évaluation de l'activité
anti-inflammatoire in vivo
La méthode utilisée pour réaliser cet
essai, est celle de (Halpern et Briot, 1950), intitulé
: « The carrageenan-induced paw edema».
? But :
Le but est de vérifier et mettre en évidence la
propriété « anti-inflammatoire » de l'H.E du
Romarin.
? Principe :
L'inflammation chimique a été provoquée
par l'injection de 0.1ml de carraghénine à 1% sous
l'aponévrose plantaire de la patte postérieure gauche de la
souris.
Cette inflammation est la conséquence de l'augmentation
de la perméabilité vasculaire ce qui permet la diffusion
liquidienne dans les tissus voisins. Celle-ci peut être limitée
par des substances censées être douées d'une
activité anti-inflammatoire ; administrées préalablement
(H.E de la plante étudiée).
21
| 


