Sang non coagulé prélevé à la veine
jugulaire de l'animal suspect. III.6.2.1.1.1.3. Mode
opératoire
- Déposer une gouttelette de sang d'environ 3 mm de
diamètre sur une lame
porte objets à une distance de 2 à 3 cm de l'une
des extrémités.
- Etaler ensuite la tache de sang en plaçant contre elle
l'extrémité d'une autre
lame à un angle de 45°. Le sang s'écoulera
immédiatement entre les deux lames
de verre.
- La lame servant à étaler est ensuite
déplacée en un mouvement régulier vers le
rebord le plus éloigné de l'autre lame,
étirant ainsi le sang et laissant un
étalement de forme caractéristique qui
s'achève à l'extrémité la plus
éloignée de
la gouttelette de sang.
- Laisser l'étalement sécher
complètement.
- Ecrire un numéro d'identification sur la lame.
- Fixer la préparation avec du méthanol pendant 5
minutes.
- Colorer la préparation au Giemsa (rapide).
- Laver à l'eau et sécher la lame par
égouttage en position verticale.
- Examiner la préparation au microscope avec un objectif
(x100) à immersion.
- Les trypanosomes sont reconnus et différenciés
par leur morphologie.
III.6.2.1.2. Les techniques de concentration
III.6.2.1.2.1. Technique de centrifugation
hématocrite
La centrifugation en microtubes à hématocrite est
encore appelée technique de Woo.
III.6.2.1.2.1.1. Matériel
nécessaire
- Microscope optique
- Centrifugeuse
- Microtubes capillaires à hématocrites de L=75 mm
et D = 0,5 mm
- Plasticine ou pâte à modeler
- Lame porte objet
- Abaque de lecture (figure 20)

Figure 20 : Mesure de
l'hématocrite. Source : [51]
III.6.2.1.2.1.2. Nature du prélèvement
sanguin à examiner
Sang prélevé dans un anticoagulant
(héparine ou EDTA) à l'oreille à la queue ou la veine
jugulaire de l'animal suspect.
42
III.6.2.1.2.1.3. Mode opératoire
43
- Remplir de sang aux 4/5e un microtube capillaire
à hématocrite boucher le tube à la plasticine ou avec la
pate à modeler à une extrémité
- Disposer le tube dans la centrifugeuse à
hématocrite avec l'extrémité bouchée dirigé
vers la périphérie bien que la centrifugeuse puisse accepter
jusqu'à 24 microtubes il est préférable de n'en mettre que
12 au maximum compte tenu du délai court (15 minutes) pour la lecture
des tubes après centrifugeuse.
- Centrifuger pendant 5 minutes la vitesse de rotation de la
centrifugeuse (figure 21) est calibré par le fabricant
entre 8000 et 10000 tours par minute.
Après centrifugation les trypanosomes se trouvent
à l'interface globules blancs/plasma.
- Placer le microtube dans un logement sur une lame porte objet
(figure22). - Placer une goute d'huile à immersion sur
le microtube dans la région correspondante à l'interface globule
blanc /plasma où seront concentrés des trypanosomes s'il en
existe.

Figure 21 : Centrifugeuse (photo
ALKAISSOU)

44
Figure 22 : Test de Woo. (Photo M.
Desquesnes)
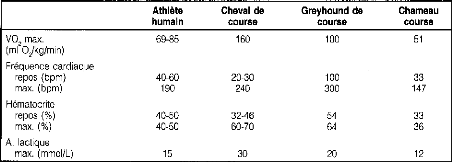
Au repos, l'hématocrite (la proportion du volume
occupé par les globules rouges) se situe normalement entre 32 et 40%. Un
individu sera anémique si l'hématocrite est trop bas. A
l'exercice, le cheval possède la capacité d'augmenter son
hématocrite de façon spectaculaire jusque vers des valeurs de 65
% par la contraction de sa rate. Au repos, la rate est un réservoir de
globules rouges qui ne sont pas en circulation. A l'exercice, la rate contient
des fibres musculaires, qui se contractent et qui vont libérer ces
globules rouges en circulation. La capacité de transport de
l'oxygène sera presque doublée par ce phénomène.
Aucune autre espèce ne possède cette adaptation de façon
aussi avancée. L'hématocrite ne peut augmenter au-delà
d'une certaine valeur sans augmenter de façon trop importante la
viscosité sanguine et compromettre l'efficacité du système
cardio-vasculaire(le sang devient trop épais pour que le coeur le pompe
facilement). Une comparaison entre diverses espèces est
présentée dans le tableau IV:
Tableau IV : Adaptation comparatives
à l'exercice de 4 espèces athlétiques Source
: [65]
III.6.2.1.2.2. La technique du Buffy Coat
III.6.2.1.2.2.1. Matériel
nécessaire
- Microscope optique avec contraste de phase ;
45
- Centrifugeuse à l'hématocrite ;
- Microtubes capillaires à hématocrite de L=75 mm
et D= 0,5 mm ;
- Plasticine ou pâte à modeler ;
- Lames porte objets ;
- Lamelles
III.6.2.1.2.2.2. Nature du prélèvement
sanguin à examiner
Sang prélevé dans un anticoagulant
(Héparine ou EDTA) à l'oreille, ou à la veine jugulaire de
l'animal suspect.
III.6.2.1.2.2.3. Mode opératoire
- Remplir de sang aux 4/5e un microtube capillaire
à hématocrite.
- Boucher le tube à la plasticine ou avec de la
pâte modeler à une extrémité. - Disposer le tube
dans la centrifugeuse à hématocrite avec
l'extrémité bouchée dirigée vers la
périphérie. Bien que la centrifugeuse puisse accepter
jusqu'à 24 microtubes, il est préférable de n'en mettre
que 12 au maximum compte tenu du délai court (15 minutes) pour la
lecture des tubes après centrifugation.
- Centrifuger pendant 5 minutes. La vitesse de rotation est
calibrée par le fabricant entre 8000 et 10000 tours/min.
Après centrifugation, les trypanosomes se trouvent
à l'interface globules blancs/plasma.
- Couper le microtube à 1 mm au dessous de l'interface
globules blancs/globules rouges (figure 23).
- Recueillir doucement sur une lame porte objet la fraction du
contenu du tube comprise entre la section précédemment
effectuée et 4 mm au dessus.
- Mélanger soigneusement et recouvrir d'une lamelle.
- Examiner au microscope à contraste de phase à
l'objectif x20. Les trypanosomes sont différenciés par leur
motilité.

46
Figure 23 : Buffy Coat.
Source : [54].
III.6.2.1.3. Détection des immunoglobulines G
par Enzyme Linked Immuno Sorbent Assay (ELISA)
Citons pour mémoire les autres techniques : la
réaction de fixation du complément, le test d'immunofluorescence
indirecte, les techniques de détection des immunoglobulines M (Ig M).
III.6.2.1.3.1. Technique Elisa
La simplicité et l'automatisation possible du test
ELISA en font un outil très répandu pour la détection
d'anticorps.
Le principe de l'ELISA (Enzyme Linked Immuno Sorbent Assay)
indirecte repose sur la sensibilisation de microplaques ELISA par des
antigènes solubles extraits du parasite, grâce à une
sonication et une ultracentrifugation.
Les anticorps spécifiques des échantillons
suspects se fixent alors sur les antigènes et sont
révélés par des antiglobulines d'espèce, et un
complexe substrat/révélateur. Tandis que, le lavage exporte le
conjugué et le puit reste
47
incolore pour les échantillons négatifs. La
lecture des plaques est ensuite faite à l'oeil nu, ou au
spectrophotomètre, à une longueur d'onde adaptée au
chromogène. Cette technique présente une très
bonne reproductibilité et un faible
coût, ce qui en fait un très bon outil pour les
enquêtes épidémiologiques. Par contre, il existe une limite
de taille à l'exploitation des résultats obtenus suite à
la recherche d'anticorps. En effet, ils permettent de détecter un
contact antérieur avec le trypanosome mais ne permettent pas de
distinguer une affection active d'une infection guérie
[27].



