I-3-3-1 : La L.T.G.S et les matériaux de
construction
La L.T.G.S est une innovation dans l'utilisation du
matériau terre. Dans chaque pays, en changeant seulement certains
paramètres, il est possible de fabriquer pratiquement tous les
matériaux utilisés dans le bâtiment (pisé
résistant à l'eau, adobes, briques, linteaux, fondations,
revêtements de sol, pavements, toitures, enduits, revêtements de
mur, et même des liants hydrauliques) [1] .
Lorsqu'ils sont élaborés convenablement, les
matériaux obtenus par L.T.G.S gardent la qualité de confort
propre aux matériaux terres [1]. Cette qualité de confort demeure
et n'est pas perturbée par les traitements à température
moyenne (85°C- 450°C) [1, 24].
Au Cameroun, très peu d'études ont
été effectuées sur l'utilisation des techniques L.T.G.S
pour la production des matériaux de construction. Ndofor [25] a pu
obtenir des résistances mécaniques à la compression de
l'ordre de 25 MPa pour une teneur en NaOH de 12% par rapport à la terre
argileuse. Par la suite, il conclut qu'une optimisation des proportions en
silice, eau et NaOH dans le mélange pour
géopolymérisation, conduirait aux produits de qualité
optimale.
I-3-3-2 : Le temps et l'énergie dans les
procédés L.T.G.S
Davidovit [24], lors de la production de divers produits
(tuiles, briques objets d'arts...) par L.T.G.S, a utilisé
différents procédés de préparation, de mise en
forme, et de traitements thermiques des pâtes. Il a
démontré que le procédé L.T.G.S permettait
d'obtenir des produits synthétiques aux propriétés
semblables à celles des produits céramiques traditionnelles,
mais, avec des gains de temps et d'énergies.
La figure 7 présente en a) la consommation
d'énergie pour la fabrication des tuiles selon les
procédés traditionnels de cuisson des produits céramiques
(classique et rapide), par procédé L.T.G.S (Géop-A),
L.T.G.S optimisé (Géop-B), et en b), les temps de production des
céramiques traditionnelles et des céramiques obtenues par
L.T.G.S.
Figure 7 : Energies et temps de production
des céramiques traditionnelles et céramiques L.T.G.S
[24].
Selon Davidovits [24], l'exploitation des techniques L.T.G.S
pour la production de « céramiques géopolymères
» offrirait des perspectives économiques intéressantes pour
l'industrie céramique, grâce aux gains d'énergie et de
temps qui pourraient conduire à une multiplication de la
productivité par un facteur de 2 à 5.
I -3-4 : Les réactions de polycondensation
La géopolymérisation est une réaction
exothermique qui consiste à la polycondensation des monomères
pour former une macromolécule de structure tridimensionnelle. Les
réactions chimiques suivent le schéma réactionnel suivant
(équations I.3 et I.4) [26, 27] :
n (Si2O5, Al2O2) + 2n SiO2 + 4n H2O + NaOH ou (KOH) Na+,
K+ + n (OH)3-Si-O-Al--O-Si-(OH)3 (I.3)
Aluminosilicate (OH)2
Précurseur géopolymérique
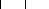
(I.4)
n (OH)3-Si-O-Al--O- Si-(OH)3 + NaOH ou (KOH)
(Na+, K+)-(-Si-O-Al--O-Si-O-) + 4n H2O
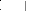
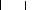
(OH)2 O O O
Réseau géopolymérique
Xu et van Deventer [26] ont proposé une théorie
de paires d'ions pour expliciter le mécanisme de dissolution des
minéraux aluminosilicates ainsi que le mécanisme de
géopolymérisation. Le processus chimique possible de dissolution
des minéraux aluminosilicates et des silicates en milieu alcalin est
présenté dans les trois équations suivantes (I.5 - I.7)
[26].
Al-Si (particule solide) + OH- (aqueux) Al
(OH)-4 + -OSi(OH)3 (I.5)
Monomère Monomère

-OSi (OH)3 + OH- -OSi (OH)2O-
+ H2O (I.6)

O-
-OSi (OH)2O- + OH - -OSi
(OH)O- + H2O (I.7)
Les réactions entre le métal alcalin
M+ et les acides ortho siliciques trivalents et divalents en vue de
compenser les charges électrostatiques de répulsion sont
présentées par les équations suivantes (I.8 - I.11)
[26]:
M+ + -OSi (OH)3 M+ -OSi (OH)3 (I.8)
Monomère Monomère
2M+ + -OSi (OH)2O- M+ -OSi
(OH)2O- M+ (I.9)
Monomère Monomère
O- O- M+
3M+ + -OSi (OH)O- M+ -OSi (OH)O-
M+ (I.10)
Monomère Monomère
M+ + Al (OH) - 4 + OH- M+ -OAl (OH) - 3 + H2O
(I.11)
Monomère Monomère
Les réactions de condensation cations - anions sont
présentées dans les équations suivantes (I.12 - I.15) [26,
27]:
-OSi (OH)3 + M+ -OSi (OH)3+ M+
M+ -OSi (OH)2-O-Si (OH)3 + MOH (I.12)
Monomère Monomère Dimère

-OSi (OH)2O- + M+ -OSi (OH)3+
M+ M+ -OSi (OH)2-O-Si (OH)2-O- + MOH (I.13)
Monomère Monomère Dimère

O- O-
-OSi (OH)O- + M+ -OSi (OH)3+
M+ M+-OSi (OH)-O-Si (OH)2-O- + MOH (I.14)
Monomère Monomère Dimère
2 silicates monomères- + 2 silicates
dimères- + 2M+ M++ trimère
cyclique- + M+ trimère linéaire-
+ 2OH- (I.15)
Barbosa dans [28] a proposé un modèle
explicitant la structure des géopolymères. Les atomes de silicium
et d'aluminium sont arbitrairement distribués dans une structure
tridimensionnelle en laissant des cavités où les cations
compensateurs Na+ peuvent se loger (figure 8).
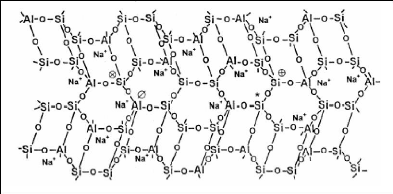
Figure 8: Modèle conceptuel
explicitant la structure des géopolymères [27].
I-3-5 : l'influence de la nature des matières
premières sur le processus de
géopolymérisation
Les compositions chimiques, minéralogiques des
matières premières, leur distribution granulométriques, et
les concentrations des éléments activateurs ont une grande
influence sur les propriétés des géopolymères [2].
La kaolinite et d'autres argiles furent initialement utilisées en 1974
et 1975 comme source d'aluminosilicates pour la fabrication des
géopolymères devant servir à l'encapsulation des
déchets radioactifs [2]. La kaolinite a une structure appropriée
à tout type de procédé de géopolymérisation.
Toutefois, lors des synthèses, une bonne partie de ce minéral ne
participe pas aux réactions de géopolymérisation [29]. Les
matériaux calcinés réagissent généralement
mieux que les matériaux non calcinés, et les impuretés
présentent dans les matières premières peuvent subir des
réactions secondaires affectant aussi bien la cinétique des
réactions que les propriétés mécaniques des
produits obtenus [2]. Les géopolymères issus du métakaolin
nécessitent plus d'eau due à une augmentation de la
porosité et deviennent alors peu résistant pour être
utilisés comme matériau de construction [2]. Toutefois, le
métakaolin est bénéfique comme additif minéral dans
les ciments géopolymères, car il améliore les
résistances mécaniques et réduit le
transport des sels et de l'eau. Il est également
utilisé dans la fabrication des géopolymères pour
application comme adhésifs [2].
Xu et van Deventer [26] ont effectué en 2000 des
recherches étendues sur l'utilisation de 16 minéraux
aluminosilicates différents, avec addition de la kaolinite pour la
fabrication des géopolymères. Ils observèrent que pour la
plupart des minéraux aluminosilicates, l'addition de la kaolinite
était nécessaire pour la formation des gels, et lorsque la
kaolinite était utilisée seul, les propriétés
mécaniques étaient médiocres. Ce résultat signifie
qu'une synergie entre les différents minéraux aluminosilicates
pourrait avoir des effets bénéfiques lors des réactions de
gépolymérisation.
I -3-5-1: L'influence de la nature des ions alcalins
dans le processus de géopolymérisation
Théoriquement, n'importe quelle alcalin ou
alcalinoterreux pourrait être utilisé pour les réactions de
géopolymérisation. Toutefois, la plupart des études ont
été centrées sur les effets des ions sodium et potassium.
Le choix du type d'ion alcalin à utiliser pour les synthèses
géopolymériques dépend de plusieurs facteurs dont les plus
importants sont l'origine, les sources de matières premières
aluminosilicates, et les applications des futurs géopolymères
[2]. La présence de cations dans les matières premières de
base ou ajoutés comme hydroxydes alcalins est considérée
comme importante à cause de leur rôle catalytique. Les
propriétés optimales des géopolymères sont obtenues
quand la concentration de sodium est suffisante pour l'équilibration des
charges lors de la substitution du silicium par l'aluminium dans les
tétraèdres, mais pas en excès pour former le carbonate de
sodium en présence du CO2 atmosphérique [2]. La grande taille de
K+ favorise la formation des oligomères silicates avec qui
Al(OH)4 - préfère se lier. Par conséquent, lorsque la
solution de KOH est utilisée, il se forme plus de précurseur
géopolymérique, facilitant une meilleure polymérisation et
des meilleures résistances en compression que les
géopolymères synthétisés dans les solutions de NaOH
[2, 31].
Les ions potassium semblent être responsables d'un
meilleur degré de condensation par rapport aux ions sodium dans les
mêmes conditions. Puisque K+ est plus basique, il permet des
grandes vitesses de dissolution des silicates. En plus, le fait que
K+ ait une sphère d'hydratation plus petite que
Na+ permet des réactions de polycondensation plus denses et
plus intimes. L'addition de KOH tendrait à améliorer le
degré de polycondensation dans la solution de silicate d'ion alcalin
alors que l'addition de NaOH augmenterait la quantité de silicates
monomères [2, 31].
| 


