I-2-3-2 : La stabilisation au ciment
La principale réaction dans un mélange sol
/ciment provient de l'hydratation des deux silicates anhydres de calcium, 3CaO.
SiO2 (C3S) et 2CaO. Si02 (C2S), constituants majeurs du ciment, qui forment
deux nouveaux composés : l'hydroxyde de calcium (chaux hydratée
appelée Portlandite) et le silicate de calcium hydraté (CSH)
principal agent liant du béton [14, 18].
La réaction est la suivante (équation I.1):
ciment + H20 ? CSH + Ca(OH)2 ( I.1)
Contrairement à la chaux, la minéralogie et la
granulométrie des sols traités au ciment influencent peu les
réactions puisque la poudre de ciment contient en elle-même tout
ce dont elle a besoin pour réagir et former des produits cimentaires. Le
ciment va créer des liens physiques entre les particules augmentant
ainsi la résistance des sols comparativement à la chaux qui a
besoin de silice et d'alumine provenant des particules argileuses pour
développer les réactions pouzzolaniques [14, 15].
Généralement, les réactions d'hydratation
des ciments sont plus rapides que celles de la chaux, mais dans les deux cas,
la résistance finale résulte de la formation de silicates de
calcium hydratés (CSH) [15].
I-3 : LA GEOPOLYMERISATION
Avant de parler des géopolymères, il est
nécessaire de présenter brièvement les zéolites,
étant donné que ces derniers sont synthétisés par
un procédé analogue à celui de la
géopolymérisation. Certains auteurs [19] ont
suggéré que les gels de géopolymère soient les
précurseurs amorphes de cristaux de zéolite. Bien que les
géopolymères soient des gels d'aluminosilicate par
définition, la structure macromoléculaire des
géopolymères ressemble au réseau cristallin de divers
zéolites [19].
I-3-1 : Les Zéolites
Les zéolites sont des aluminosilicates de structure
tridimensionnelle formés de polymères inorganiques
constitués de (Si, Al)O4 tétra coordonnés par le partage
de tous leurs atomes d'oxygène dans le réseau. La
stoechiométrie des zéolites peut être
représentée par la formule générale [20]:
M
n + 1 n [(AlO2)(SiO2)x]-
z H2O, où x représente le rapport molaire Si/Al, z le nombre de
molécules d'eau liées
physiquement. Les cations tels que H+,
Na+, K+, Cu+ et Fe(OH)+, (ici de
valence n=1) sont nécessaires pour la compensation des charges. Les
zéolites existent à l'état naturel, mais peuvent aussi
être synthétisés par voie hydrothermale à partir des
solutions alcalines de silicate de sodium, hydroxyde d'aluminium.
La synthèse des zéolites de type A par exemple est
obtenue par traitement hydrothermal de la kaolinite en solution alcaline
à 100°C suivant la réaction [20] :
100°C
Al2O3.2SiO2.2H2O + 2NaOH Na2O.Al2O3.2SiO2 + 3H2O (I.2)
Kaolinite Zéolite A
Cette méthodologie de synthèse peut
également être utilisé dans la synthèse des
géopolymères, cependant, pour la géopolymerisation le
rapport liquide/ phase solide est plus petit [20]. L'unité structurale
des zéolites A est identique à celle du Na-poly(sialate). Mais,
le zéolite A provient de la polycondensation d'un
cyclo-tétrasialate alors que le Na-poly(sialate) provient de la
polycondensation d'un cyclo-disialate [3].
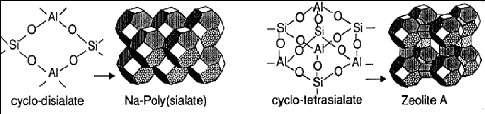
Figure 3: Structure du réseau de
Na-poly(sialate) et du zéolite A [3]
| 


