II- Procédés d'élimination des
produits pharmaceutiques
II.1. Procédés biologiques :
Les procédés d'épuration par voie
biologique sont communément utilisés pour le traitement des
produits pharmaceutiques (Gauthier et al., 2010). Ces procédés ne
sont pas toujours applicables sur les effluents industriels en raison des
fortes concentrations de polluants, de la toxicité ou de la très
faible biodégradabilité. Dans le cas des produits pharmaceutiques
non favorables au traitement biologique, il est nécessaire d'utiliser
des systèmes réactifs beaucoup plus efficaces que ceux
adoptés dans les procédés de purification conventionnels.
De plus, ces procédés biologiques génèrent des
quantités importantes de boues biologiques à traiter.
La biodégradation est favorable pour les eaux
usées présentant un rapport DCO/DBO5 < 2, par contre elle est
très limitée lorsque ce rapport dépasse 5. Le rapport
DCO/DBO5, appelé degré de dégradation biochimique, sert de
mesure pour la dégradabilité biochimique des polluants dans les
eaux usées. La quantité de composés non dégradables
biochimiquement est très élevée quand ce rapport tend vers
zéro (Bliefert et Perraud, 2001).
II.1.1. Filtration
La filtration est un procédé physique
destiné à clarifier un effluent qui contient de la matière
en suspension en le faisant passer à travers un milieu poreux. Les
particules en suspension ainsi retenues par le milieu poreux s'y accumulent ;
il faut donc nettoyer ce milieu de façon continue ou de façon
intermittente. Selon le type de filtre adopté, on recourt à
divers matériaux filtrants, comme les tissus de fibres, les toiles
métalliques ou les pierres poreuses interstices très fins. Ces
matériaux retiennent la matière en suspension en surfaces ; ils
sont rarement employés pour traiter des quantités d'eau
importantes (Micheal et al .,2012). L'inconvénient de ce type
de procédé repose sur la dégradation du polluant, et la
production de la boue (Crini et Badot,2007).
II.1.2. Procédés membranaires
Les procédés membranaires sont fortement
développés ces dernières années et constituent une
avancée majeure dans les procédés de séparation.
Une membrane permet de contrôler le transport des espèces
chimiques entre deux phases fluides qu'elle sépare.
Elle oppose une résistance inégale au transport
de différentes espèces quand une force motrice (comme par exemple
un potentiel électrique ou une pression) est appliquée aux
fluides.
10
La séparation des polluants est essentiellement
fondée sur l'affinité des espèces chimiques pour la
membrane, sur la taille et/ou sur la charge électrique des
molécules et ions. Les procédés membranaires sont au
nombre de quatre : la microfiltration, l'ultrafiltration, la nano filtration et
l'osmose inverse (Crini et Badot,2007).
Parmi ces quatre types de procédés, la nano
filtration et l'osmose inverse. Ces procédés sont les plus
adaptées à l'élimination des composés
pharmaceutiques de faible poids moléculaire tels que les antibiotiques
(Halling,2000).
II.1.3.
Coagulation/Floculation/Séparation
La coagulation/floculation/séparation est un
procédé couramment employé dans l'épuration des
eaux usées ; il permet de se débarrasser des matières en
suspension et des particules colloïdales qui ne peuvent décanter
par elles-mêmes, afin de diminuer, par exemple, les teneurs en DCO, DBO5
et COT, ou encore la turbidité de l'eau. Il implique le plus souvent
l'ajout d'un produit chimique (souvent un sel métallique trivalent comme
Al(III) ou Fe(III)), qui déstabilise les particules colloïdales et
mène à la formation de micro-flocs. Le pontage
décès micro-flocs, grâce à l'ajout d'un adjuvant de
floculation (généralement de type anionique), en fait des flocons
plus denses et volumineux, et surtout plus facilement séparables. Une
simple décantation ou une étape de flottation permet ensuite
l'élimination des flocs formés (Crini et Badot,2007).
D'importantes quantités de boues sont formées avec ce
procédé, leur régénération ou
réutilisation reste la seule issue, mais nécessite des
investissements supplémentaires.
Le but de notre travail est l'élimination d'un polluant
émergent en l'occurrence le métronidazole par adsorption. Ainsi,
nous présentons ci-dessous les généralités sur le
phénomène d'adsorption.
II.2.1. Généralité sur le
phénomène d'adsorption
L'adsorption est un phénomène d'interface
(phénomène physique de fixation de molécules à la
surface d'un solide) pouvant se manifester entre un solide et un gaz ou entre
un solide et un liquide. Le phénomène est général
pour toutes les surfaces. Aux interfaces, les attractions
intermoléculaires ne sont pas compensées dans toutes les
directions, et il subsiste par des forces résiduelles dirigées
vers l'extérieur. Ces forces représentent une large
énergie superficielle par unité de surface, comparable à
la tension superficielle des liquides. Ces forces sont neutralisées
lorsque les particules mobiles (un gaz ou un soluté) se fixent en
surface, on dit qu'elles s'adsorbent (Ghiaba,2020).
Cette adsorption se produit spontanément et
s'accompagne d'une diminution de l'énergie libre du système,
c'est un phénomène toujours exothermique. L'étude des
équilibres d'adsorption permet de connaitre le degré maximal de
séparation susceptible d'être obtenu dans des conditions
11
thermodynamiques données. La vitesse avec laquelle on
s'approche de l'état d'équilibre relève de l'étude
cinétique d'adsorption, celle-ci dépend de la vitesse avec
laquelle les constituants du mélange à séparer diffusent
dans l'adsorbant et dans le fluide.
II.2.1.1. Types d'adsorption
Suivant la nature des liaisons entre le substrat et les
particules adsorbées, les forces responsables du phénomène
d'adsorption peuvent être de nature physique ou chimique, Conduisant
ainsi à deux types d'adsorption: l'adsorption physique "physisorption"
et l'adsorption chimique " chimisorption".
Adsorption chimique (ou chimisorption)
La chimisorption s'accompagne d'une profonde modification de
la répartition des charges électroniques des molécules
adsorbées qui conduit à la rupture de liaisons chimiques entre
l'adsorbant et l'adsorbat. Celle-ci peut être covalente ou
ionique(Arris,2008). La chimisorption est donc complète lorsque tous les
centres actifs présents à la surface ont établi une
liaison avec les molécules de l'adsorbat, les forces mises en jeu sont
du même type que celles qui sont impliquées lors de la formation
des liaisons chimiques
Spécifiques (Bouziane,2007).
La chimisorption est essentiellement irréversible et
engendre une couche monomoléculaire, on peut mesurer la chaleur
d'adsorption chimique à partir des isothermes et isobares;
généralement la chaleur de chimisorption n'est pas constante mais
diminue lorsque la quantité de gaz adsorbée augmente(khir,2021).
Ce phénomène peut provenir de
l'hétérogénéité de la surface et de
l'existence d'une répulsion entre les molécules
adsorbées.
Adsorption physique (ou physisorption)
La physisorption met en jeu des liaisons faibles du type
forces de Van der Waals, il se produit bien avant que le gaz n'atteigne une
pression égale à sa tension de vapeur saturante, à des
températures assez basses et voisines du point d'ébullition de la
phase adsorbée. Elle est non spécifique et en
général réversible, où l'équilibre est
obtenu lorsque les vitesses d'évaporation et de condensation sont
égales (Khir, 2021 et Huchon, 2006)
Les majeures caractéristiques des deux types d'adsorption
sont résumées dans le tableau suivant:
12
Tableau 1:les principales différences
entre l'adsorption physique et l'adsorption chimique. (Salaa,2021)
|
Propriétés
|
Adsorption physique
|
Adsorption chimique
|
|
Types de liaison
|
Liaison de Van Der Waals (Électrostatique)
|
Liaison chimique (covalente ou ionique)
|
|
Température de processus
|
Relativement faible
comparée à la température
d'ébullition de l'adsorbat
|
Plus élevée que la température
d'ébullition de l'adsorbat
|
|
Individualité des molécules
|
L'individualité des
molécules est conservée
|
Destruction de l'individualité des molécules
|
|
Désorption
|
Facile
|
Difficile
|
|
Cinétique
|
Rapide, indépendante de la température
|
Très Lente
|
|
Chaleur d'adsorption
|
Inférieur à 5 à 10 kJ/mole
|
20 à 100 kJ/mole
|
II.2.1.2. Mécanisme d'adsorption
L'adsorption est connue comme une liaison entre les
molécules de solutés (contenue dans une phase liquide ou gazeuse)
et la surface d'un solide (adsorbant), ce type de liaison et chimique ou van
Der Waals (Bengaid,2021).
Tous les solides qui ont une structure microporeuse on peut
les classer comme un adsorbant. Les adsorbants les plus utilisés dans le
traitement des eaux sont les suivants: charbon Actif, gel de silice, argile,
tamis moléculaire36 et alumine (Bengaid,2021 ;Giles et
al.,1960)
Le procédé de l'adsorption c'est l'un des
transferts de métiers qui se fait entre le gaz ou liquide (fluide) et le
solide (adsorbant), il y a plusieurs étapes qui entrent dans le
mécanisme de ce processus. Le transfert de matière est le
déplacement de fluide (adsorbat) vers la surface solide (adsorbant). En
passant par les étapes ci-dessous (Kafi,2013) :
? Diffusion de l'adsorbat vers celle située au
voisinage de la surface de l'adsorbant.
? Transfert du soluté à travers le film liquide
vers la surface des granules (diffusion extra granulaire de la
matière).
? Transfert de la matière dans la structure poreuse de
la surface extérieure des granules vers les sites actifs (diffusion
intra granulaire).
? Une molécule est considérée comme un
élément immobile Lorsque le colorant d'adsorption est
connecté aux sites actifs.
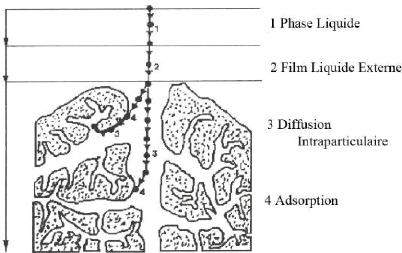
13
Figure 1:Mécanisme de diffusion de
l'adsorbat vers l'adsorbant (Sali,2018)
Facteurs influençant le processus
d'adsorption
Le processus d'adsorption dépend de plusieurs
paramètres qui peuvent influencer la capacité et la
cinétique de la rétention d'un soluté sur un adsorbant. Il
s'agit des paramètres suivants :
- Structure des adsorbants
La structure et la nature des adsorbants jouent un rôle
important pour le piégeage des différents composés
organique et inorganique présent dans les eaux. La taille des
particules, la surface spécifique et la porosité sont les
principales propriétés qui affectent l'affinité d'un
adsorbant vis-à-vis du soluté.
Parmi les adsorbants naturels qui ont fait l'objet de
nombreuses études d'adsorption, on trouve les argiles. La taille de
leurs particules fines, leur structure en feuillet et leur grande surface
spécifique sont les principales propriétés qui leur
confère une importante capacité d'adsorption. Les zéolites
sont aussi parmi les adsorbants naturels qui sont caractérisés
par une grande capacité de rétention qui est due essentiellement
à leurs structures fibreuses et à leurs surfaces
spécifiques importante.
Les adsorbants industriels font aussi partie des solides qui
possèdent des propriétés considérables d'adsorption
; notamment le charbon actif qui est caractérisé par une surface
spécifique importante et par une très forte microporosité.
D'autres adsorbants comme les hydroxydes métalliques ont aussi une
grande surface spécifique. Cette catégorie de solides sont
14
essentiellement utilisés pour adsorber les
métaux lourds vu l'affinité qu'ils ont envers ces
éléments.
- Influence de l'adsorbat
Les propriétés physico-chimiques de l'adsorbat
sont déterminantes et jouent un rôle primordial lors de son
adsorption sur une surface solide de l'adsorbant. La structure
moléculaire est l'un des principaux paramètres qui influence la
rétention des adsorbats. Plus la structure moléculaire est
volumineuse plus sa rétention par certaines phases solides est
difficile. Par ailleurs, l'adsorption des solutés est
conditionnée par la composition de la solution puisqu'en présence
simultanée de plusieurs espèces génère une
concurrence vis-à-vis des sites d'adsorption surtout pour celles qui
possèdent une structure similaire.
- Influence du pH
Le pH est un paramètre prédominant dans le
processus d'adsorption. Il affecte directement l'état de charge de
l'adsorbant et de l'adsorbat. Son effet sur la rétention des
contaminants est souvent étudié. Dans la plupart des cas, le pH
faible favorise l'adsorption des anions alors que le milieu alcalin favorise
celle des cations.
- Influence de la température
L'adsorption est un processus global résultant de
plusieurs processus à l'interface solide-liquide. Elle peut être
exothermique, endothermique ou athermique. Elle est donc conditionnée
par la température. Ainsi, l'augmentation de la température
favorise les processus de chimisorption alors que son abaissement favorise
l'adsorption physique.
II.2.1.3. Isotherme d'adsorption
Tous les systèmes adsorbant/adsorbat ne se comportent
pas de la même manière. Les phénomènes d'adsorption
sont souvent abordés par leur comportement isotherme. Les courbes
isothermes décrivent la relation existant à l'équilibre
d'adsorption entre la quantité adsorbée et la concentration en
soluté dans un solvant donné à une température
constante.
Deux types de classifications sont rencontrés dans la
littérature : celle de Gilles et d'UICPA.
Classification de Giles
Giles et al., en 1974 ont classé les
isothermes d'adsorption en phase liquide/solide en quatre classes principales
nommées : S (Sigmoïde), L
(Langmuir), H (Haute affinité) et C
(partition Constante) (Ziati, 2012).
La classe S (sigmoïde) est obtenue
lorsque les molécules du soluté ne s'accrochent au solide que par
l'intermédiaire d'un seul groupement. L'adsorption du solvant est
appréciable, du fait qu'elle devient progressivement plus facile lorsque
la quantité adsorbée croît. L'explication proposée
est qu'il existe un effet de synergie coopératif à cause de
l'attraction latérale, les
15
molécules suivantes sont adsorbées facilement,
ce qui donne une couche adsorbée dans laquelle les molécules sont
adsorbées verticalement. Cet arrangement est favorisé lorsque les
molécules de solvant rivalisent avec le soluté pour l'occupation
des sites d'adsorption (Bacha & Aichiou, 2017).
La classe L (Langmuir) est la plus
fréquente. Elle est caractérisée par une courbe concave
par rapport à l'axe des concentrations. L'élimination du
soluté devient de plus en plus difficile lorsque le degré de
recouvrement de la surface de l'adsorbant augmente. Cette isotherme
suggère que l'adsorption de la molécule de soluté se fait
à plat sur la surface de l'adsorbant et les molécules du solvant
et du soluté sont en compétition pour l'occupation des sites
d'adsorption (Dabrowski et al., 2005).
La classe H est caractérisée
par une isotherme presque verticale au début. Laquantité
adsorbée apparait importante à concentration quasiment nulle du
soluté dans la solution. Ce phénomène se produit lorsque
les interactions entre les molécules adsorbées et la surface du
solide sont très fortes. L'isotherme de classe H est observée
lors de l'adsorption de micelles ou de polymères formées à
partir des molécules de soluté.
La classe C est celle des isothermes se
caractérisant par une partition constante entre la solution et le
substrat. Cette constante signifie que les sites sont créés au
cours de l'adsorption. Ce qui implique que les isothermes de cette classe sont
obtenues quand les molécules de soluté sont capables de modifier
la texture du substrat en ouvrant des pores qui n'avaient pas été
ouverts préalablement par le solvant (Tahar et al., 2010).
La figure 2 ci-dessous représente les quatre types
d'isotherme selon Giles.
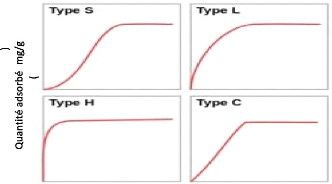
Concentration à l'équilibre (mg/L)
Figure 2:Les quatre types d'isotherme selon la
classification de Giles. (Ngakou,2019)
16
Adsorption gaz-solide
On peut décrire un processus d'adsorption à
l'aide d'une isotherme d'adsorption qui représente, à une
température donnée, la relation entre les concentrations de
soluté et d'adsorbat.
L'isotherme d'adsorption de gaz, d'équation
????????=??(?? ????), est obtenu en mesurant les
quantités
volumiques de gaz adsorbé (Vads) pour des
valeurs croissantes de la pression relative représentée par (
??????), p étant la
pression d'équilibre et p0 la pression de vapeur saturante du
gaz
à la température considérée. Dans
la plupart des cas, le gaz utilisé est l'azote, et la température
est la température d'ébullition de l'azote liquide (77 K). Les
isothermes d'adsorption d'un gaz sur un solide peuvent être
classées en cinq catégories selon la «classification de
Brunauer, L. Deming, W. Deming et Teller» appelée couramment
"classification BDDT" (Brunauer et al.,1940).
Une sixième forme concerne les isothermes à
marches. Les six formes constituent la classification de l'International Union
of Pure and Applied Chemistry (IUPAC). Ces différentes formes
d'isothermes sont caractéristiques de la texture du solide
examiné, et l'allure de ces courbes permet de définir le type de
porosité présente au niveau de l'échantillon
analysé (Figure 3 ).
L'isotherme de type I est
caractérisée par une augmentation rapide de la quantité
adsorbée dans le domaine des faibles pressions d'équilibre suivie
par un palier approximativement horizontal jusqu'à la pression de vapeur
saturante ; (Pression des molécules de gaz en équilibre avec la
phase liquide pour une température donnée). Cette isotherme est
généralement attribuée à l'adsorption sur une
surface comportant des micropores.
Mais ces mêmes courbes peuvent traduire la formation
d'une monocouche sur une surface non poreuse dans certains cas. La
quantité adsorbée correspondant au palier est la quantité
nécessaire pour former une couche monomoléculaire complète
sur la surface du solide.
Les isothermes de type II sont de loin les
plus couramment rencontrées ; elles traduisent l'adsorption sur des
surfaces non poreuses. Leur étude pour de très nombreux couples
adsorbat-
adsorbant a conduit à conclure empiriquement que la
quantité de gaz Vm adsorbée au point B (Figure
3), qui marque le coude sur l'isotherme, devrait correspondre
approximativement à l'adsorption d'une monocouche. L'adsorption
multicouche commence aux pressions plus élevées.
Les isothermes de type III sont assez rares.
Elles montrent une faible adsorption aux basses pressions liées à
un mauvais mouillage de l'adsorbant par l'adsorbat. L'adsorption devient
d'autant plus facile que la quantité déjà adsorbée
est importante. Cela s'explique à la
17
fois par une faible attraction adsorbat-adsorbant et par de
fortes attractions entre molécules adsorbées. Dans un tel cas, la
condensation est atteinte pour sa pression saturante alors que l'adsorption sur
la surface est encore limitée. C'est le cas par exemple de l'adsorption
de l'eau sur le graphite.
Les isothermes de types IV et V ont la
particularité de présenter des hystérèses qui se
manifestent lorsque les pressions d'équilibre sont différentes
lors de l'adsorption et de la désorption. Ces courbes sont obtenues
lorsque les adsorbants contiennent des pores de diamètres se trouvant
dans la catégorie des mésopores. Dans ce cas il peut se
superposer à l'adsorption proprement dite une condensation capillaire de
l'adsorbat. L'analyse de ce type d'isothermes permet d'obtenir plusieurs
informations concernant la texture poreuse du substrat.
L'isotherme de type VI correspond à
une adsorption en multicouches sur une surface non poreuse uniforme, à
chaque marche correspond l'édification d'une couche. Ce type d'isotherme
peut être observé pour l'adsorption d'azote et d'argon à
77K sur un noir de carbone graphité.
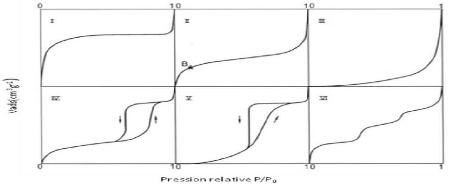
18
Figure 3:Les différents types
d'isothermes d'adsorption/désorption selon l'IUPAC (Hanen,2015).
II.2.1.4. Modélisation des isothermes
d'adsorption
Une isotherme d'adsorption est la représentation
à température constante de la quantité de soluté
adsorbée par un adsorbant en fonction de la concentration à
l'équilibre du soluté en solution. L'étude de l'isotherme
d'adsorption est fondamentale pour décrire le comportement des
interactions entre le soluté et l'adsorbant et pour évaluer la
capacité d'adsorption d'un adsorbant, elle est essentielle dans la
conception d'un système d'adsorption. Il existe un grand nombre
d'équations mathématiques qui permettent de modéliser les
isothermes d'adsorption. La littérature montre que dans la plupart des
cas, les modèles les plus adaptés sont les modèles de
Langmuir et de Freundlich.
Modèle de Langmuir
Il est un modèle simple et largement utilisé. Il
est basé sur les hypothèses suivantes (Langmuir
1918):
- l'espèce adsorbée est située sur un
site bien défini d'adsorbant (adsorption localisée). - chaque
site n'est susceptible de fixer qu'une seule espèce adsorbée.
- l'énergie d'adsorption de tous les sites est
identique et indépendante de la présence des espèces
adsorbées sur les sites voisins (surface homogène et pas
d'interactions entre espèces adsorbées).
Il est applicable à l'adsorption
mono-moléculaire du soluté à la surface de l'adsorbant
à l'équilibre. La non linéaire de l'équation de
Langmuir est :
QQ[~S =
Qm.K1.Ce
1+K1.Ce EquationI.1
Avec :
19
KL : constante d'équilibre, qm : capacité
maximale d'adsorption (mg/g) et Ce : concentration à l'équilibre
(mg/L).
Dans le cas d'une faible quantité de soluté
adsorbé, le terme (KL.Ce) peut être très inférieur
à 1 et il est alors négligé. La relation de Langmuir se
réduit alors à une relation directe entre la capacité
d'adsorption et la concentration à l'équilibre de l'adsorbat en
phase liquide :
?? = ????????????
Dans le cas d'une forte quantité de soluté
adsorbée, le terme (KL.Ce) devient largement supérieur à
1. Cela implique que q tend vers qm.
Par ailleurs, la linéarisation de l'équation nous
donne :
?? = [( ????? ? ????) ( ??????) + ( ????? ?)]
EquationI.2 ??
??
L'équation obtenue est celle d'une droite de pente
???? et d'ordonnée à l'origine
?? ;
???? ????
ce qui permet de déterminer deux paramètres
d'équilibre de la relation : qm et KL. Modèle de
Freundlich
Il s'agit d'une équation qui est souvent
employée dans la représentation pratique de l'équilibre
d'adsorption entre le soluté et la surface
hétérogène d'un solide. Elle se présente sous la
forme suivante (Freundlich 1909) :
?? = ????.??????/??
La linéarisation par changement d'échelle de la
relation de Freundlich conduit à l'équation suivante :
???????? = ???????? + ?? ???????? EquationI.3
??
Avec
qe : la quantité adsorbée (mg/g) ; Ce : la
concentration à l'équilibre (mg/L), KF : le coefficient de
Freundlich, n : l'affinité du soluté pour l'adsorbant.
Le constant 1 ?? (adimensionnel) donne une indication sur
l'intensité d'adsorption.
Il est généralement admis que les faibles valeurs
de ?? 1 (0,1 <1 ?? <0,5) sont Caractéristiques d'une bonne
adsorption, alors que des valeurs plus
élevées révèlent une adsorption
modérée(0,5 < ?? 1 < 1)
20
Modèle de
Dubinin-Kagana-Radushkevich(D-K-R)
Le modèle d'isotherme de D-K-R est
généralement utilisé pour décrire les sites
d'adsorption non homogène et fournit des informations permettant de
connaitre la nature des interactions mis enjeu entre l'adsorbant et l'adsorbat.
(Sali 2018). Son équation est la suivante :
RTIn(1 + 1 )Z
Qe = Qma exp -2E z e
Equationl.4
a
Qma :la quantité maximale pour
remplir une monocouche(mg/g)
E : l'énergie de l'adsorption qu'il faut fournir pour
déplacer l'adsorbat de la surface de l'adsorbant à l'infini de la
solution (J/mol)
Qe :la quantité de
l'adsorbant adsorbée à l'équilibre dans la phase solide
(mg /g)
R : constante des gaz parfaits (Kmol)
;
Sa formule linéaire est la suivante :
lnQe = InQmg - /3 e2 Equationl.
5
Avec le potentiel de Polanyi e = RTIn(1 +
c)
B est obtenu par le tracé de
InQe en fonction de
e2 de l'énergie moyenne
d'adsorption E (en Kj /mol peut être obtenu par la relation
ci-après :
E = (2/3)-1/2
Equationl.6
Modèle d'isotherme de Temkin
Le modèle de Temkin suppose que la chaleur d'adsorption
est due aux interactions entre l'adsorbant et l'adsorbat. De plus, ce
modèle est une application de l'adsorption de Gibbs où la surface
est considérée comme énergétiquement
homogène. L'équation de cette isotherme est donnée par
:
qe = BInKT + BlnCe Equationl.
7
Où ;
B = ????/ : constante liée
l'énergie
b??
R : Constante des gaz parfaits (8 ,314J /mol) ; T :
température(K) ;
bT : potentiel d'adsorption
(J /mol) ;
KT : constante de la liaison
à l'équilibre (L /g)
21
II.2.1.5. Etude de la cinétique
d'adsorption
L'étude d'adsorption d'un soluté en fonction du
temps de contact est souvent décrite comme comportant deux phases. La
première phase d'adsorption est non linéaire et rapide,
correspond à l'adsorption au sens strict (Bouziane ,2015). Les
phénomènes de diffusion étant négligeables. La
deuxième phase, linéaire est interprété comme
étant la phase d'adsorption lente où le processus de diffusion
sont limitantes (Bouziane 2015 , Mritteron 1996, Klan 1982)
II.2.1.5.1. Modèle cinétique de premier
ordre
Le modèle du pseudo premier ordre a été
proposé par Lagergren en 1898, il est basé sur une relation
linéaire entre la quantité de soluté (adsorbat)
fixée à la surface du matériau (adsorbant) en fonction du
temps. De nombreux auteurs ont utilisé ce modèle cinétique
de pseudo premier-ordre pour décrire l'adsorption de solutés
organiques et inorganiques sur des surfaces solides
hétérogènes. Dans la plupart des études sur les
cinétiques d'élimination, ce modèle n'est pas
adapté à toute la gamme de temps de contact, mais il est
généralement applicable au début de l'adsorption, soit
pour les 20 ou 30 premières minutes (Ghemit,2018 ;
Azizian, 2004). Au-delà, les
capacités expérimentales ne sont plus correctement
extrapolées. Le modèle pseudo-premier-ordre est donnée par
l'expression :
dg
= ????(g?? - g??) E??ua????o??l.
8
d??
Avec respectivement qt et
qe les quantités du polluant
adsorbées à un temps et à l'équilibre
Kt(min-1)
: constante de vitesse du premier ordre .
L'intégration de cette équation avec la condition
initiale q=0 et t=0 conduit à l'expression
suivante :
1n(ge - gt) = b??ge
- Kit EquationI.9
Avec :
K1 : constante de vitesse du premier
degré(min-1)
t :temps de contact(min)
qe : capacité
d'adsorption du matériau à la saturation en monocouche ;
qt : quantité
adsorbée (g/g /unité de masse du solvant à l'instant t
II.2.1.5.2. Modèle cinétique du
deuxième ordre
Le modèle pseudo second ordre suppose que la
capacité d'adsorption est proportionnelle au nombre de sites actifs
occupés par l'adsorbat. Le modèle est exprimé par
l'équation I.10 dont la linéarité est
développée par (Ho et al., 1999). Ce
22
modèle permet de décrire correctement la
fixation des molécules de soluté sur la surface solide du
matériau. L'analyse des données cinétiques, relève
qu'un modèle irréversible de second ordre fournit des
résultats de meilleure qualité que les modèles d'ordre
inférieur (Azizian., 2004).
Le modèle cinétique du deuxième ordre ou
modèle de pseudo second ordre peut être exprimée par
l'équation suivante :
???? =??z(???? - ??t)z
EquationI.10
??t
L'intégration de cette fonction suivie d'un
réarrangement nous permet d'avoir la forme linéarisée
suivante :
|
t t
= +
qt
Kzgze
|
t
Equationl.11
qe
|
Avec :
K2:Constante de la vitesse apparente du second
degré (g/g /min) ;
qe :Capacité d'adsorption du
matériau à la saturation(g/g) ;
qt : quantité adsorbée
par le matériau à l'instant t (g /g).
Le tracé de
t/qt en fonction du
temps t permet de déterminer la constante de la vitesse apparente
et la capacité d'adsorption du matériau à la
saturation qe
| 


