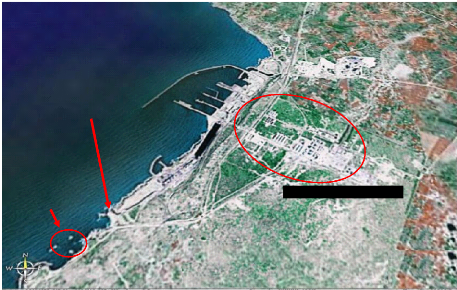
I.2. Site Oualidia (figure 10)
Le site Oualidia est situé sur le littoral atlantique
Marocain, à 45 km au sud de JL et à 10 km au nord de la ville
Oualidia, c'est un site agricole et touristique réputé pour ses
lagunes d'ostréiculture.
II. LES MOULES
II.1. Systématique
Les moules que nous avons utilisé lors de cette
étude appartiennent aux systématiques suivantes :
V' Embranchement : Mollusques.
V' Classe : Bivalves.
V' Ordre : Lamellibranches.
V' Super famille : Mytilidae.
V' Famille : Mytilidae.
V' Genre : Mytilus.
V' Espèce : Mytilus galloprovincialis
II.2. Prélèvement des
échantillons
Sur les deux sites, les moules de tailles similaires (5
à 6 cm) sont prélevées à la main à
marrée basse, à différentes périodes (juin à
octobre 2004). Elles sont rincées délicatement à l'eau de
mer sur les lieux de prélèvement, puis placées dans des
sachets de polyéthylène puis transportées au laboratoire
dans des glacière à 4 °C et stockées à
-28°C jusqu'à utilisation.
II.3. préparations des doses
les moules congelées sont décortiquées
égouttées, pesées puis séchées de
façon à former une préparation stable dans une
étuve portée à 60°C, pendant des intervalles de temps
réguliers (12h), les échantillons sont pesés
jusqu'à l'obtention d'une masse constante. On prépare une
suspension mère (SM) comme suit : 600 mg de moules séchées
et finement broyées dans un mortier, sont mises en suspension dans 10 ml
d'eau ultra pure et thuraxés à l'ultra thurax, deux fois pendant
2 min puis la SM est diluée au 1/2 et au 1/1 0.
Site de prélèvement
Emissaire des rejets
Maroc Phosphore III et IV
Figure 9 : photo prise par satellite du site de
prélèvement : Jorf Lasfar.

Oualidia
Site du prélèvement
Figure 10 : photo prise par satellite du
site de prélèvement : Oualidia.
III. DOSAGE DES METAUX
III.1. Minéralisation des
échantillons
0,5 g de moules séchées ou à 1 g
d'organes des rats (foie, rein), on ajoute 10 ml d'acide nitrique (HNO3)
concentré Merck (Parc tertiaire de la Meinau, Strasbourg ;
qualité Suprapur) et 4 ml d'acide sulfurique (H2SO4) concentré
Merck (Parc tertiaire de la Meinau, Strasbourg ; qualité Suprapur) dans
un matras. Le mélange est mis au repos pendant 12 h, puis placé
dans un digesteur à micro-ondes (Maxidigest, Prolabo, France), muni d'un
système d'addition d'eau oxygénée pour
minéralisation. Le volume de chaque minéralisât est
complété à 20 ml avec de l'eau ultra pure (Moustaid et
al., 2005 ; Vaidya et Rantala, 1996). Un essai à blanc sans moule
est traité puis analysé dans les mêmes conditions.
III.2. Dosage des métaux
Les métaux (Al, Cd, Cr, Cu et Pb) ont
été analysés comme décrit par Vaidya et Rantala
(1995) à l'aide d'un spectromètre d'Absorption Atomique
électrothermique (SAAE), avec un four graphite GTA et d'un injecteur
automatique, en utilisant un modèle Varian A 300 équipé
d'un système de correction Zeeman et un logiciel
d'autocontrôle.
IV. LES RATS
IV.1. Traitement des animaux
Les rats utilisés (35 rats) de souche Wistar (centre
d'élevage DEPRE, Saint-Doulchard, France), de masse moyenne 74,47 #177;
3 g, sont répartis en 7 lots de cinq rats (figure 11). Un contrôle
parsitologique, bactériologique et virologique a été
réalisé par l'unité vétérinaire et
agroalimentaire du laboratoire de Touraine (France), sur trois rats s'est
révélé négatif. Les rats ont été
acclimatés aux conditions expérimentales du laboratoire pendant 5
jours avant le gavage. Le traitement des rats a été fait par
intubation gastrique à l'aide d'une sonde spéciale. Des
homogénats ont été préparé à des
quantités équivalentes de différents échantillons
de moules prélevées à différentes périodes
(mai à octobre 2004) issues de chaque site OL et JL, Chaque lot est
ensuite traité avec la dose 6, 30 et 60 mg/ 100 g de poids vif, 1 fois
toutes les 24 heures pendant 28 jours. Le lot témoin a été
gavé dans les mêmes conditions avec de l'eau ultra pure.
IV.2. Prélèvement des organes
Après le dernier jour de traitement, les rats sont
placés dans des cages métaboliques pendant 24 h afin de collecter
les urines sans contamination fécale. Les animaux sont alors
pesés et sacrifiés par décapitation. Les organes (coeur,
rein, foie et cerveau) sont prélevés et pesés. Les
échantillons (urine et organes) sont immédiatement stockés
à -28 ?C jusqu'à utilisation.
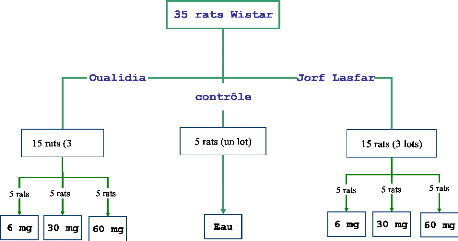
Figure. 11 : Répartition des rats destinés
au gavage avec la poudre de moules JL et OL
V. ETUDE CYTOLOGIQUE
V.1. Prélèvement des cellules et
préparation des lames
L'os fémur a été coupé aux
extrémités immédiatement, puis le tissu médullaire
est récupéré le plus vite possible dans un milieu de
culture de type RPMI1640, le culot est récupéré
par centrifugation à 4000 rpm ensuite, le culot est repris dans minimum
de milieu de culture. Sur des lames dégraissées, la suspension
cellulaire précédemment préparé est
déposé puis étalé sans écrasement des
cellules, après séchage à température ambiante,
elles sont ensuite colorées avec Giemsa diluée au 1/10.
V.2. Lecture des lames
La lecture a été réalisée sur 1000
cellules par lame au microscope photonique à l'objectif 1 00X. Puis on
réalise une formule complexe en comptant tout d'abord le taux respectif
de chaque lignée (figure 8, page 15) :
La lignée granulocytaire (neutrophile,
éosinophile et basophile): le myéloblaste, le
promyélocyte, le myélocyte, le métamyélocyte, le
granulocyte non segmenté et le granulocyte neutrophile.
La lignée lymphoïde : le
lymphoblaste, le petit lymphocyte; le grand lymphocyte et le plasmocyte.
La lignée monocytaire : le monoblaste, le
promonocyte et le monocyte.
La lignée érythrocytaire :
Proérythroblaste, Erythroblaste basophile, Erythroblaste
plychromatophile, Erythroblaste acidiphile et Erythrocyte.
VI. L'ANALYSE STATISTIQUE
Les résultats sont présentés sous forme
de moyennes #177; SEM (erreur standard sur la moyenne) et analysés pour
les différences significatives en utilisant un test non
paramétrique de :
· Wilcoxon Rank Sum Test pour p <0,05.
pour le dosage des métaux toxiques dans les moules.
· Friedman, pour p <0,05 pour
déterminer la significativité globale (résultats du dosage
des métaux dans les organes et ceux de la moelle osseuse) et avec des
comparaison multiple on utilisant la correction de Bonferroni qui permet de
repousser le seuil à partir duquel on considère que deux
échantillons sont significativement différents, en
réduisant le seuil alpha.
RESULTATS ET DISCUSSION
| 


