II. EVALUATION DE TOXICITE DES MOULES SUR LES RATS
Lors du traitement des rats par les moules
récoltées sur le site OL, plusieurs effets directs visibles ont
été observé, notamment dressement des poils,
diarrhées et stress. Nous avons aussi observé lors des essais de
prélèvement du sang que ce dernier avait une couleur
légèrement noirâtre et qu'il coagulait rapidement par
rapport au sang des rats témoins.
II.1. Taux des métaux toxiques dans le foie et les
reins
Des travaux récents réalisés par Nasser
et al., (2008) ont montrés que les extraits de moules
(lipophiles et hydrophiles), contaminées par des métaux toxiques
issues des sites JL et OL et tester in vitro sur des cellules humaines
intestinales type caco 2, perturbent la biosynthèse des
macromolécule, la viabilité cellulaire par inhibition de la
fonction mitochondriale et provoquent la fragmentation de l'ADN. Compte tenus
des teneurs très élevés en métaux toxiques dans les
moules notamment celles du Cd, sachant que ces métaux ne jouent aucun
rôle biologique et du fait que ces métaux sont
hépatotoxiques (Li et al., 2007), néphrotoxiques(Cai
et al., 2001), génotoxiques (Kim et al.,2005 ; Nasser
et al., 2008) et apoptotiques (Tersago et al., 2004 ; Mondal
et al., 2005 ; Jung et al., 2007). Nous avons étudié
l'effet du traitement par des moules contaminées par des métaux
toxiques sur la concentration en Cd, Cr et Pb dans les organes cibles à
savoir le foie et les reins des rats traités avec différentes
doses de poudres de moules issues des deux sites, une fois toute les 24 heurs.
Après 28 jours de traitement les animaux ont été
sacrifiés, le foie et les reins ont été
récupérés pour doser les métaux (Cd, Cr et Pb)
comme décrit dans le paragraphe (dosage des métaux, pages 23).
L'analyse statistique a montré une différence
significative des concentrations du Cd dans les organes des rats traités
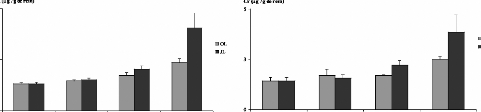
avec la poudre des moules issues des deux sites JL et OL (figures 1 3A et 14A).
En effet, les teneurs en Cd accumulées dans le foie et les reins des
rats augmentent avec la quantité de poudre de moules
administrées. Ces teneurs sont toutefois très
élevées dans les reins que dans le foie, elles sont de l'ordre de
7,3 #177; 1,3 et 4,3 #177; 0,33 .ig/g des reins des rats gavés avec 60
mg de poudre de moules issues des sites JL et OL respectivement, par 100g de
poids vifs. Dans le foie, elles sont de 2,85 #177; 0,9 et de 1,7 #177;
0,37.ig/g de foie des rats gavés avec 60 mg de poudre de moules issues
des sites JL et OL respectivement, par 100g de poids vifs. Chez le lot des rats
témoins les teneurs hépatiques et rénales ne
dépassent pas 0,97 #177; 0,14 et 2,3 #177; 0,3 .ig/g respectivement.
Dietrich et al., (2006) ont traité des souris par voie orale,
avec 1.ig de CdCl2/g/jour et pendant cinq jours, les résultats obtenus
ont montré une accumulation hépatique et rénales du Cd.
DESA MBI Résultats et Discussion
*
*
B (Cr)
A (Cd)
*
*
*
C (Pb)
*
*
*
*
Figure 13 : Teneurs en métaux
toxiques dans les reins des rats traités avec la poudre des moules JL et
OL
Cd (A), Cr (B) et Pb (C)
Les histogrammes représentent la moyenne #177; SEM en jtg
de métaux par g des reins, n = 3.
*Différence significative par rapport aux témoins
pour P < 0,05
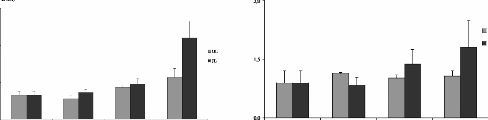
A (Cd)
B (Cr)
*
*
C (Pb)
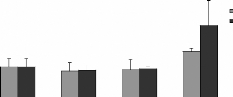
Figure 14 : Teneurs en métaux toxiques dans le
foie des rats traités avec la poudre des moules JL et OL. Cd (A), Cr (B)
et Pb (C)
Les histogrammes représentent la moyenne #177; SEM en tg
de métaux par g de foie frais, n = 3. *Différence significative
par rapport aux témoins pour P < 0,05
Toutefois ces teneurs en Cd restent inférieur a celles
que nous avons trouvés dans notre étude, cela pourrait être
expliqué par le fait que le moules utilisées pour gaver les rats
contiennent des teneurs très élevées en Cd (548,03 tg/g/
28 jours) (tableau III), ainsi que la longue durée de traitement (28
jours).
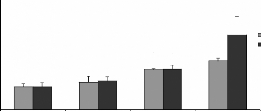
L'analyse statistique montre une variation significative des
teneurs en Cr dans les reins des rats traités par les moules issues des
deux sites JL et OL (figure 12B). D'une manière générale,
le dosage a montré des fortes concentrations rénales et
hépatiques en ce métal, elles varie aussi selon la
quantité et l'origine des moules ingérées. En effet les
teneurs en Cr sont de 3,85 #177; 0,84 et 2,5 #177; 0,15 .ig/g des reins des
rats gavés avec 60 mg de moules JL et OL respectivement, par 100g de
poids vifs. En ce qui concerne le Cr dans le foie (figure 14B) aucune variation
significative n'est observé chez les rats traités par intubation
gastrique avec les moules issues des deux sites.
Les teneurs en Pb dans le foie et les reins des rats
traités avec les moules de JL et OL sont respectivement
représentées sur les figures 13C et 14C. Les taux en Pb dans les
reins augmentent d'une manière significative avec les quantité et
l'origine des moules ingérées, ils sont de l'ordre de 4,1#177; 1,
et 2,67 #177; 0,24 15 .ig/g des reins frais des rats gavés avec 60 mg de
moules de JL et OL respectivement, par 100g de poids vifs. Dans le foie les
taux en Pb ne varient pas d'une manière significative. Les taux en Pb
dans les organes sont supérieurs a la quantités totales en Pb
dans les moules ingérés pendant les 28 jours du gavage, ceci est
surprenant (tableau III). L'explication la plus probable est une contamination
soit au niveau de la nourriture, soit nos animaux ont été
déjà contaminés.
Les teneurs en métaux toxiques (Cd, Cr et Pb) sont
supérieurs dans le foie et les reins des rats traités avec les
moules séchées issues des deux sites, par rapport aux rats
témoins, ces teneurs sont toutefois plus élevées dans les
reins que dans le foie. Les métaux tels que le Cd possèdent une
très forte affinité pour le foie et les reins, son accumulation
s'effectue principalement dans ces deux organes (Cai et al., 2001 ; Li
et al., 2007). La distributions et la retentions de ce métal
est étroitement liées à la biosynthèse des
métallothionéines. Lors d'une longue exposition aux métaux
tels que le Cd, il y a induction des métallothionéines dans le
foie et dans les reins, qui se fixent sur les métaux, le complexe
formé est ensuite éliminé par les reins, jusqu'à ce
que la capacité de ces derniers a synthétisé cette
protéines soit dépassée, les métaux vont alors
s'accumuler et entraîner une lésions dans les organes (Dietrich
et al., 2006).
Tableau III : teneurs des métaux (Cd, Cr et Pb) en
tg/g de foie et des reins frais des rats traités avec les moules JL et
OL
|
Jorf Lasfar
|
|
Oualidia
|
|
Poudre
de moules*
|
Reins
|
Foie
|
Poudre
de moules*
|
Reins
|
Foie
|
|
Cd
|
0
38,38
254,75
548,03
|
2,36 #177; 0,13
0
2,75 #177; 0,1
3,6 #177; 0,3*
7,3#177; 1,3*
|
0,97 #177; 0,14
1 #177; 0,12
1,4 #177; 0,2
2,85 #177; 0,9 *
|
0
3,13
15,70
32,00
|
2,36 #177; 0,13
2,65 #177; 0,8
3 #177; 0,26
4,3 #177; 0,34 *
|
0,8 #177; 0,2 0,83 #177; 0,16 1,28 #177; 0,08 1,7 #177; 0,37
*
|
|
0
|
1,43#177; 0,17
|
1,3 #177; 0,3
|
0
|
1,43#177; 0,17
|
1,3 #177; 0,3
|
|
1,19
|
1,57 #177; 0,16
|
1,7 #177; 0,2
|
|
1,6 #177; 0,2
|
2#177; 0,03
|
|
Cr
|
|
|
|
2,97
|
|
|
|
5,99
|
2,2 #177; 0,23
|
1,4 #177; 0,4
|
15,03
|
1,7 #177; 0,05
|
1,97 #177; 0,09
|
|
11,72
|
3,85 #177; 0,84 *
|
1,5 #177; 0,7
|
29,39
|
2,5 #177; 0,15*
|
1,5 #177; 0,1
|
|
0
|
1,25 #177; 0,22
|
0,71 #177; 0,2
|
0
|
1,25 #177; 0,22
|
0,8 #177; 0,2
|
|
0,02
|
1,58 #177; 0,21
|
0,72 #177; 0,13
|
0,01
|
1,5 #177; 0,26
|
0,7 #177; 0,2
|
|
Pb
|
0,11
|
2,21#177; 0,23*
|
0,75 #177; 0,05
|
0,05
|
2,2 #177; 0,47
|
0,73 #177; 0,26
|
|
0,21
|
4,1 #177; 1,3 *
|
1,87 #177; 0,6
|
0,10
|
2,67 #177; 0,24 *
|
1,2 #177; 0,09
|
* Calculé a partir de quantité totale de
poudre de moules ingérées au cours des 28 jours de gavage. *
Différenoe significative par rapport aux témoins pour P < 0,05
avec n= 3.
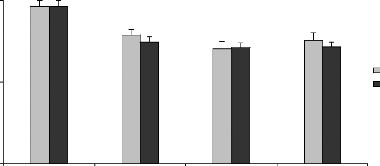
*
*
*
*
Figure 15 : Gain de poids corporel (%) des rats
traités avec la poudre de moules issues de JL et OL
L'histogramme représente la moyenne de gain de masse
corporelle #177; SEM en % * Différence significative par rapport aux
témoins pour P < 0,05 avec n= 5
Le gain de la masse est calculé selon la formule suivante
:
|
Gain de masse (%) =
|
Masse corporelle initiale - Masse corporelle finale *
100
|
|
Masse corporelle initiale du contrôle - Masse
corporelle finale du contrôle
|
II.2. Effet des moules sur la masse corporelle des
rats.
La figure 15 représente le gain de la masse corporelle
chez les rats gavés avec moules séchées (M.
galloprovincialis) issues des site JL et OL, ceci en fonction des
quantités 6,30 et 60 mg par 100 g de poids vif, administrées tout
au long des 28 jours du traitement par rapport aux rats témoins. Les
résultats obtenues montrent une baisse significative dépendante
aux doses administrée, elle est de 17,57 #177; 3,39 %, 25,75 #177; 4,23
% et de 20,70 #177; 4,81 % chez les rats traités avec les
quantités 6, 30 et 60 mg de poudres des moules OL respectivement par 100
g de poids vif, et de 21,72 #177; 3,25%, 25,03 #177; 3,01 % et de 24,79#177;
3,12% chez les rats traités avec les quantités 6, 30 et 60 mg de
poudres des moules JL respectivement, par 100g de poids vifs. Chez des souris
traitées avec des moules contaminées par des métaux
toxiques, une baisse de la masse corporelle a été observée
avec des taux élevés en créatinine dans les urines
(Moustaid et al., 2005). Sachant que la créatinine
résulte du métabolite de substance azotée non
protéique au cours du métabolisme musculaire (Whitby et
al., 1984), ces résultats concordent avec ceux observés dans
l'évolution du poids corporel des souris traitées. L'explication
la plus probable est l'existence d'une protéolyse provoquée par
l'ingestion des moules toxiques. Une telle situation provoquerait une
libération d'acides aminés libres (arginine et glycocolle),
transformés en créatine puis en créatinine, qui est
éliminée dans les urines (Kaneko, 1989).
II.3. Influence de la poudre de moules sur
l'hématopoïèse chez le rat
Plusieurs auteurs ont déjà montrés que
les métaux toxiques ont des effets néfastes sur les tissus osseux
et le système immunitaire (Burns et al., 1995 ; Tersago et
al., 2004 ; Hemdan et al., 2006). Ces polluants
métalliques sont capable de moduler le système immunitaire, cette
immunomodulation est soit une immunosuppression, soit immunopotentialisation et
qui dépend entre autres, de la nature du métal, de sa
concentration et de sa biodisponibilité (Lawrence et al., 2002
; Tersago et al., 2004 ; Lynes et al., 2006). Les
métaux toxiques ont également un effet néfaste sur le
développement des cellules souches, mais on sait peut de chose sur leur
réponse toxicologiques. Etant donné que la moelle osseuse
hématopoïétique contient des cellules matures, des
précurseurs, des progénitures et des cellules souches
multipotentes. Ces deux dernières sont également dotées
d'une capacité d'autorenouvellement et de différenciation (Rando,
2006), et elles sont impliquées dans des maladies inflammatoires
chroniques ainsi que le cancer (Reya et al., 2001 ; Dietrich et
al., 2006 ; Dalerba et al., 2007). Ces cellules peuvent
représenter une cible clé de substances toxiques en raison de la
faiblesse éventuelle de leur système de réparation de
l'ADN, ce qui pourrait faciliter la mutagenèse après expositions
toxiques (Trosko et Tai, 2006 ; Gioacchino et al., 2008). Les
réponses
toxicologiques des cellules souches sont relativement peu
connues, et différentes de celles des autres cellules en raison de leurs
propriétés biologiques uniques liées a leurs rôles
de rénovation et la répartition des tissus (Rando, 2006), de
leurs processus biochimiques ainsi que de leurs compartiments intracellulaires
(Inoue et al., 2002). Pour ces multiples raisons nous avons choisi de
déterminer l'effet de moules contaminées par des métaux
toxiques sur la moelle osseuse hématopoïétique.
Durant cette étude nous avons compté au
microscope photonique (X100) 1000 cellules du tissu médullaire sur lame
colorées au Geimsa. La lignée granulocytaire neutrophile
(myéloblaste, promyélocyte, myélocyte,
métamyélocyte, et polynucléaire neutrophile), la
lignée granulocytaire éosinophile, la lignée basophile,
lignée Monocytaire (petit monoblaste, grand monoblaste promonocyte,
monocyte basophile et monocyte) et la lignée lymphoïde
(lymphoblaste, petit lymphocyte, grand lymphocyte).
|
|



