e
Mémoire N° EDR MR 2022 0098 de Master 2
Recherche en Infectiologie Tropicale
DIVERSITE GENETIQUE ET FREQUENCES ALLELIQUES DES GENES
Pfmsp1 ET Pfmsp2 DES ISOLATS PROVENANT D' ENFANTS ASYMPTOMATIQUES ET
SYMPTOMATIQUES DE LA REGION DE LASTOURVILLE
Présentée et soutenue publiquement le
22/09/2022 par :
Sous la direction de :
MORISHO NASIBU MILAMBO MOSKI
Pr. LEKANA-DOUKI Jean Bernard,
Professeur-Titulaire CAMES/USS
Dr. OYEGUE LIABAGUI ép. ASSANGABOUA Sandrine
Lydie, Maitre- Assistant CAMES /USTM
Année Académique 2021 -
2022
DEDICACES
Je dédie ce Mémoire A
Mon défunt grand frère Daniel
MORISHO KAEYO, puisse Dieu te bénir à jamais pour
l'amour, la vie
A mes parents Béatrice MWAMINI et
l'inspecteur Adrien NEPA MORISHO, puisse Dieu vous benir
à jamais pour l'amour parental sans pareil,
A madame Esther BAMAVU, pour qui je te
serai à jamais reconnaissant, pour l'amour, les sacrifices et le soutien
sans faille.
A mes enfants et à toute la grande famille
MORISHO, pour l'amour sans cesse renouvelé, le soutien, et
surtout vos encouragements.
REMERCIEMENTS
Je remercie sincèrement le Professeur.
LEKANA-DOUKI Jean Bernard, Directeur Général du
CIRMF, qui a bien voulu m'accepter comme stagiaire au sein de la structure dont
il a la charge, et pour avoir accepté de diriger ce travail.
Mes remerciements vont également à l'endroit du
Directeur général de l'école doctorale, le
professeur Jacques LEBIBI, pour son abnégation, son
humilité et ses sages conseils .
Mes remerciements vont également à l' endroit du
Docteur OYEGUE LIABAGUI Sandrine Lydie,
chef de l'Unité d'Evolution, Epidémiologie,
Résistance Parasitaire (UNEEREP) du CIRMF, pour avoir accepté
d'encadrer ce travail.
Je voudrais exprimer toute ma gratitude à
l'ingénieur Mme KOUNA Lady Charlène, pour
m'avoir supervisé durant tout le stage. Merci pour ses conseils, sa
disponibilité et sa rigueur scientifique.
Je remercie aussi d'une manière particulière Mme
MBANI MPEGA NTIGUI Chérone, et Mr ONTOUA Steede
Seinnat, PhD Students dans le service, pour leur disponibilité
dans l'apprentissage des méthodes de recherche et leurs sympathies.
J'exprime ma gratitude à toute l'équipe de
l'UNEEREP, Dr. IMBOUMY Karl, M. OKOUGA Alain-Prince, ,ALICE, VANESSA et LUIDE,
pour l'accueil, le suivi, la convivialité, l'harmonie et la rigueur de
travail.
Mes remerciements nourris à tous les enseignants de
l'école doctorale et à tous les collègues compagnons de
lutte.
TABLE DES MATIERES
DEDICACES
ii
ABREVIATIONS
vi
LISTE DE FIGURES
vii
LISTE DES TABLEAUX
viii
GENERALITES SUR LE PALUDISME
3
I.1. Définition
3
I.2. Epidémiologie du paludisme.
3
I.3. Agents pathogènes
4
1.4. Cycle de
développement
4
1.5.3. Paludisme grave
7
1.6. Paludisme au Gabon
11
1.6.1. Epidémiologie
11
1.6.2. Marqueurs de virulence au
Gabon
11
II. LES OBJECTIFS DE L'ETUDE
13
2.1. Objectif
général
13
2.2. Objectifs
spécifiques
13
3.1. Caractéristiques de l'étude
14
Il s'est agi d'une étude observationnelle à
visée descriptive et analytique, privilégiant une approche
pluridisciplinaire qui associe l'épidémiologie et la biologie
moléculaire
14
.3.1.1. Type et période d'étude
14
3.1.2. Site de l'étude
14
3.1.3. Population
d'étude
14
3.1.4. Critères d'inclusion et de
non inclusion
14
3.2. Analyses Biologiques
15
3.2.1. Diagnostic de
l'infection plasmodiale
15
3.2.1.1. Le prélèvement :
15
3.2.1.2. Diagnostic par TDR
15
3.1.2.3. Diagnostic par microscopie:
Goutte épaisse
16
3.2. Analyses
moléculaires
16
3.2.1. L'extraction
d'ADN :
16
Amplification pour le diagnostic moléculaire
d'espèces
17
Electrophorèse
18
3.2.2 Analyse des données
19
4.1 Caractéristiques de la
population d'étude
20
4.1.1. Description de la population d'étude
20
4.2. Comparaison de la Prévalence
de l'infection plasmodiale entre symptomatiques et asymptomatiques
20
4.2.1. Distribution des espèces
plasmodiale en fonction de la symptomatologie
20
4.2.2. Caractérisation de la virulence
21
4.2.2. Infections polyclonale des
gènes Pfmsp-1 et Pfmsp-2 en fonction du statut
clinique
22
4.3. Diversité
allélique : polymorphisme de longueur de taille de
fragments
23
V. DISCUSSIONS
26
VI. CONCLUSION ET PERSPECTIVES
29
ABREVIATIONS
ADN: Acide désoxyribonucléique
AMA1 Antigène de la membrane apicale 1
CSP:Protéine circumsporozoïte
dNTP: dinucléotide triphosphate
ddNTP: didésoxyribonucléotide triphosphate
MgCl2: Chlorure de Magnésium
Msp(1,2,3): Protéine de surface du
Mérozoïte (1,2,3)
GE: Goutte épaisse
P.: Plasmodium
PfEMP1: Protéine de la membrane
érythrocytaire de Plasmodium falciparum 1
TAE: Tris Acétate EDTA
TDR: Test de diagnostic rapide
FCV Franceville
LTV Lastourville
PCR: Réaction de polymérisation en chaine.
uL: Microlitre
OMS: Organisation mondiale de la santé
%: Pourcentage
Fst: Indice de différenciation
génétique
LISTE DE FIGURES
Figure 1 : Répartirtion géographique
globale du paludisme [7]
12
Figure 2: Cycle de développement du
Plasmodium[10]
14
Figure 3: Représentation schématique du
gène Pfmsp 1 de P.falciparum montrant les 17 domaines [22]
17
Figure 4: Diagramme schématique du gène Pfmsp 2
illustrant les blocs 1 à 5 [22]
17
Figure 5: Carte du Gabon [23]
18
Figure 6: Représentation schématique de la
réalisation d'un TDR( kit-optimal-it)
21
Figure 7: Infection polyclonale du gène Pfmsp1
27
Figure 8: Diversité allélique, polymorphisme de
longueur de taille de fragments dans l'ensemble de la population
29
LISTE DES TABLEAUX
Tableau 1 : Critères de gravité du
paludisme
16
Tableau 2: Séquences des amorces utilisées pour
le diagnostic moléculaire et tailles des bandes attendues
22
Tableau 3: Programme PCR utilisés
23
Tableau 5: Fréquences des familles alléliques
des gènes Pfmsp 1 et 2
26
INTRODUCTION
Le paludisme reste la maladie parasitaire la plus mortelle et
la plus répandue au monde, malgré de nombreux efforts consentis
pour contrôler cette endémie. En effet, plus de 241 millions de
nouveaux cas dont 627000 décès ont été
déclarés à travers le monde en 2020, et le plus grand
nombre de cas et de décès a été enregistré
en Afrique Subsaharienne ou le paludisme demeure endémique [1].
Plusieurs espèces sont capables d'infecter l'homme et
de causer la maladie, cependant Plasmodium falciparum est la plus
dangereuse car elle est responsable de la quasi-totalité des cas et
décès liés au paludisme.
L'élimination du paludisme implique des stratégies
mondiales clés, notamment une prise en charge rapide et efficace des
cas, le traitement préventif intermittent (TPI) du paludisme pendant la
grossesse et la gestion intégrée des vecteurs (IVM). Cependant,
si les cas symptomatiques sont pris en charge et traités, les porteurs
asymptomatiques restent le réservoir qui alimente la transmission du
parasite. Une élimination réussie du paludisme nécessitera
de ce fait, une connaissance de la variabilité génétique
du parasite dans différentes zones géographiques et une meilleure
compréhension des facteurs qui déterminent le flux de
gènes entre les sites. Les protéines de surface du
mérozoïte-1, 2 de Plasmodium falciparum (Pfmsp 1 et
Pfmsp2), qui sont des antigènes de stade érythrocytaire
asexué, sont considérées comme des marqueurs
appropriés pour l'identification de populations parasitaires de
Plasmodium falciparum génétiquement distinctes [ 3 ].
Cependant, depuis la publication du génome complet du clone de
référence 3D7 de P. falciparum [ 4 ] et le
séquençage d'autres isolats plasmodiaux, il y a eu quelques
éclaircissements sur les variations génétiques
responsables de phénotypes tels que la chimiorésistance et la
virulence parasitaire [ 5 ]. Bien que dans ces études, les cas
symptomatiques et asymptomatiques soient pris en compte peu de travaux sur le
polymorphisme génétique et les marqueurs de virulence de P.
falciparum ont été réalisés sur des infections
asymptomatiques. Par ailleurs, les résultats des études
réalisées entre porteurs symptomatiques et asymptomatiques sont
mitigés, montrant une association de certains allèles avec la
virulence et d'autres pas.
Au Gabon, le paludisme représente respectivement 45% et
71% des motifs de consultation chez les enfants et les femmes enceintes [2].
Par ailleurs, cette maladie y reste la première cause de
décès et d'absentéisme au niveau scolaire et
professionnel. Elle est également responsable des complications
prénatales et infanto-juvéniles [2] '''''[3].
le lien entre la virulence de Plasmodium falciparum et
les marqueurs de virulence étudiés n'est pas clairement
établi. Cependant, des études sur le polymorphisme
génétique de P. falciparum ont permis
de décrire la diversité génétique de ce parasite
dans différentes régions du pays, aussi bien chez des patients
atteints de paludisme simple à grave que chez des enfants
asymptomatiques [4-6]. Ces études basées sur l'amplification des
gènes Pfmsp-1 et Pfmsp-2 visaient à caractériser
le profil génétique des isolats de Plasmodium dans le
but ultime d'éliminer le paludisme. L'étude du Pfmsp-1
montre une forte diversité allélique de ce gène, ce qui
serait compatible avec le niveau élevé de transmission du
paludisme à Libreville [5]. Cette diversité
génétique de P. falciparum est très variable
d'une région à une autre, comme par exemple à Franceville,
une faible diversité a été décrite par rapport
à Libreville [5, 6]. De plus, une prédominance de l'allèle
K1 a été rapportée au Sud Est du Gabon [4, 6]. Certaines
études montrent que RO33 était faiblement polymorphe au Gabon,
mais une étude de William et al décrit 10 allèles
différents de RO33 [4, 5, 7]. Certains auteurs ont suggéré
que la diversité allélique de Mad20 augmenterait avec la
gravité de la maladie [5]. Quant à la diversité
allélique de Pfmsp-2, la famille allélique
prédominante est 3D7 [4]. Plusieurs études ont également
montré que les infections multi-clonales peuvent varier en fonction du
statut clinique de l'individu (symptomatique ou asymptomatique) [5, 8]. Nous
émettons l'hypothèse suivante: les populations de P.
falciparum trouvées chez les sujets asymptomatiques ont des
génotypes différents de ceux trouvés chez les sujets
symptomatiques au Sud Est du Gabon. Il serait donc intéressant de
décrire le génotype de ces souches par rapport au profil
trouvé chez les patients symptomatiques et les sujets asymptomatiques
à Lastoursville. Le but de cette étude était donc
d'explorer la diversité génétique de P.
falciparum dans les infections palustres asymptomatiques et symptomatiques
à Lastoursville.
GENERALITES SUR LE PALUDISME
I.1. Définition
Le paludisme (du latin paludis c'est-à-dire marais)
encore appelé malaria (de l'italien mal'aria c'est-à-dire mauvais
air) est une érythrocytopathie parasitaire très répandue
dans le monde, notamment en Afrique sub-saharienne où le risque de
transmission est le plus élevé. Cette maladie parasitaire est
causée par un protozoaire du genre Plasmodium et transmise
à l'homme par la piqure infectante d'un vecteur, moustique
hématophage du genre Anopheles (anophèle femelle).
I.2. Epidémiologie du paludisme.
A l'échelle mondiale, environ 241 millions de cas de
paludisme ont été enregistrés en 2020 dans 85 pays
d'endémie palustre contre 227 millions en 2019 et la majeure partie de
cette augmentation provenait des pays de la Région africaine de
l'OMS[4]. La femme enceinte et le foetus sont plus vulnérables face au
paludisme. Cette vulnérabilité découle de la baisse de
l'immunité maternelle, de la séquestration placentaire qui est
à l'origine de la réduction du poids du nouveau-né
(surtout pour les primipares)[5]. La morbidité maternelle est surtout
due à l'anémie. La mort in-utero du foetus, des avortements et
des accouchements prématurés sont également des
conséquences fréquentes du paludisme gestationnel. Malgré
les efforts considérables dans la lutte contre cette endémie,
elle constitue une lourde charge pour les pays en voie de développement,
car la prise en charge et la prévention de celle-ci demandent un gros
investissement de la part des pouvoirs publics et même du patient [6]. La
répartition géographique varie en fait d'un continent à
l'autre, d'un pays à l'autre, d'une région à une autre,
d'un village à un autre etc. Actuellement, près de la
moitié de la population mondiale est à risque pour le paludisme
[7]. L'incidence des cas de paludisme (c'est-à-dire les cas pour 1000
habitants à risque) est passée de 81 en 2000 à 59 en 2015
et 56 en 2019, avant de remonter à 59 en 2020. L'augmentation en 2020 a
été associée à une interruption des services
pendant la pandémie de COVID-19. Au niveau mondial, près de 96 %
des décès dus au paludisme ont été
enregistrés dans 29 pays. Six pays ont concentré un peu plus de
la moitié des décès dus au paludisme dans le monde en 2020
: le Nigéria (27 %), la République démocratique du Congo
(12 %), l'Ouganda (5 %), le Mozambique (4 %), l'Angola (3 %) et le Burkina Faso
(3 %) [1]
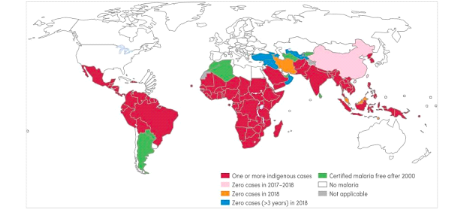
Figure 1 :
Répartition géographique globale du paludisme [1]
I.3. Agents pathogènes
Le paludisme est causé par un protozoaire
appartenant au genre Plasmodium. Il existe de
très nombreuses espèces de Plasmodium (plus de 140),
touchant diverses espèces animales, dont cinq espèces sont
habituellement retrouvées en pathologie humaine : P.
falciparum, P. vivax, P. ovale,
P. malariae et P. knowlesi qui demeure un parasite
habituel des singes d'Asie qui s'est avéré être responsable
d'une zoonose. Ces cinq espèces diffèrent par
des critères biologiques, génétiques, cliniques, ainsi que
par leur répartition géographique et leur capacité
à développer des résistances aux antipaludiques.[8]
1.4. Cycle de développement
P. falciparum est un parasite
hétéroxène ayant un cycle évolutif diphasique dont
une phase de multiplication asexuée chez l'homme (son hôte
intermédiaire) et une phase de multiplication sexuée chez
l'anophèle femelle (son hôte définitif).
1.4.1. Phase sexuée:
Au cours d'un repas sanguin chez un individu infecté,
l'anophèle femelle ingère des gamétocytes à
potentiels sexuels. Ces derniers, transportés dans la glande salivaire
s'échappent rapidement de leur enveloppe érythrocytaire. Une fois
déglutis, ils parviennent dans l'estomac de l'anophèle. Les
gamétocytes mâles se différencient en microgamètes
(4 à 8) rendus mobiles par un processus d'ex flagellation, tandis que
les gamétocytes femelles se différencient en macro-gamètes
(ovules). La rencontre de ces gamètes produit un zygote mobile:
l'ookynète. Celui- ci pénètre dans la paroi intestinale et
s'implante sous la paroi stomacale en formant l'oocyste. A l'intérieur
de cet oocyste (brève phase diploïde) se forment plusieurs
sporoblastes, dans lesquels se développent des milliers de
sporozoïtes par sporogonie. Ces sporozoïtes haploïdes et mobiles
perforent la coque de l'oocyste, puis passent dans l'hémolymphe pour
aboutir au niveau des glandes salivaires où ils vont acquérir
leur pouvoir infectieux. Cette phase dure une quinzaine de jours, suivant la
température extérieure [9].
1.4.2. Phase asexuée ou schizogonie
La phase humaine du cycle de développement de
Plasmodium est constituée de deux parties : un cycle
exo-érythrocytaire et un cycle érythrocytaire.
v Cycle exo-érythrocytaire: Cette première phase
du cycle chez l'Homme se déroule au niveau hépatique. Lors d'une
piqure, l'anophèle femelle portant des sporozoïtes infectieux dans
sa salive les injecte dans un capillaire. En moins d'une demi-heure, ces
sporozoïtes migrent rapidement vers le foie via la circulation sanguine,
et envahissent les hépatocytes dans lesquels se déroule la phase
hépatique. Dans les hépatocytes, les sporozoïtes se
développent en trophozoïtes qui subissent une multiplication
immédiate (schizogonie hépatique) pour donner des schizontes
renfermant des mérozoïtes. A maturité, les schizontes
hépatiques éclatent et libèrent des milliers des
mérozoïtes dans la circulation sanguine, capables d'infecter les
globules rouges. La phase exo-érythrocytaire est asymptomatique et dure
10 à 15 jours. Cependant, chez certaines espèces plasmodiales
(P. ovale, P. vivax), on retrouve des persistances hépatiques
(hypnozoïtes) qui peuvent rester cachées plusieurs mois ou
années sans se multiplier pour reprendre le cycle plus tard: le stade
cryptozoïte.
Cycle érythrocytaire: Les
mérozoïtes issus de la phase hépatique, présents dans
la circulation sanguine, envahissent les globules rouges. Dans ces derniers,
les mérozoïtes se développent d'abord en anneau, puis en
trophozoïte. Pendant ce stade, une intense activité
métabolique (approvisionnement en acides aminées, synthèse
nucléique et protéique) se réalise; le parasite peut
dégrader jusqu'à 75% d'hémoglobine de la cellule
hôte pour se nourrir et former le pigment malarique. Au bout d'une
trentaine d'heures après l'invasion, le parasite commence sa division
nucléaire: c'est la schizogonie érythrocytaire.
L'éclatement des schizontes mûrs libère, dans le sang, des
mérozoïtes et des déchets métaboliques (pigments et
débris cellulaires pyrogènes responsables des accès de
fièvre). Ceci s'accompagne également d'un relargage
d'antigènes parasitaires dans le sang. Cette nouvelle
génération de mérozoïtes réinfecte rapidement
les érythrocytes. La phase érythrocytaire qui dure environ 48
heures induit un spectre de symptômes chez l'homme responsable de la
morbidité et de la mortalité associés à
l'infection. Après quelques cycles érythrocytaires, des
gamétocytes se différencient en gamétocytes mâles et
femelles, lesquels ne pourront poursuivre leur évolution que chez le
moustique. Ils restent vivants une vingtaine de jours chez l'hôte humain
puis disparaissent. Ces éléments n'évolueront plus, mais
ils persisteront dans le sang de l'homme qui est alors le
« réservoir du parasite ». Avec P. falciparum, et
lui seul, toute la fin de la schizogonie se fait dans les capillaires
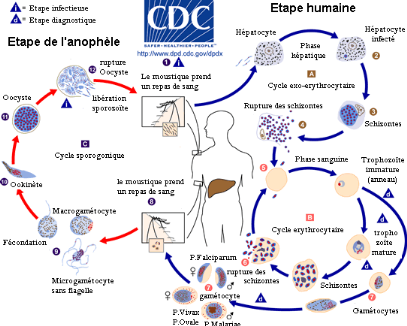
Figure 2: Cycle de développement du
Plasmodium'[10]
1.5. Physiopathologie du paludisme
1.5.1. L'infection asymptomatique :
L'infection asymptomatique ou paludisme d'infestation se
définit comme étant l'absence de manifestations cliniques chez un
individu présentant des formes asexuées du parasite à
l'examen du sang périphérique. Un tel sujet est un porteur sain
et constitue un important réservoir du parasite en zone
d'endémie. Ce portage asymptomatique peut évoluer à tout
moment vers un paludisme clinique simple ou grave.[11].
1.5.2. Paludisme simple :
C'est l'expression d'une infection symptomatique sans signes
de gravité et/ de dysfonctionnement des organes vitaux. [12]. La
période d'incubation de la maladie varie de 9 à 30 jours, selon
l'espèce plasmodiale, son mode de transmission, le statut immunitaire de
l'hôte, la chimio-prophylaxie antipaludique utilisée et la
densité des inocula parasitaire. Une période d'incubation courte
(9 à 14 jours) est typique de P. falciparum [13].
Les manifestations cliniques courantes du paludisme simple ne
sont pas spécifiques, et imitent ceux d'autres maladies telles que le
syndrome pseudo-grippal. Elles comprennent, fièvre, frissons, sueurs,
nausées et vomissements, courbatures, myalgies, céphalées,
troubles digestifs, sensation générale de faiblesse.
L'hypertrophie de la rate ou du foie, l'augmentation de la fréquence
cardiaque ou respiratoire, le jaunissement des yeux, peuvent s'ajouter. Le
syndrome fébrile reste cependant un symptôme clé dans le
diagnostic du paludisme simple.
1.5.3. Paludisme grave
Selon l'OMS, le paludisme grave se définit par la
présence de formes asexuées de P. falciparum à
l'examen microscopique du sang périphérique, associée
à une ou plusieurs des manifestations cliniques telles que
l'altération de l'état de conscience, les convulsions
généralisées et répétées,
l'anémie sévère, l'insuffissance rénale,
loedème aigu du poumon, l'hypoglycémie, collapsus circulaire,
etc. [14]:
Tableau 1 : Critères de gravité du
paludisme
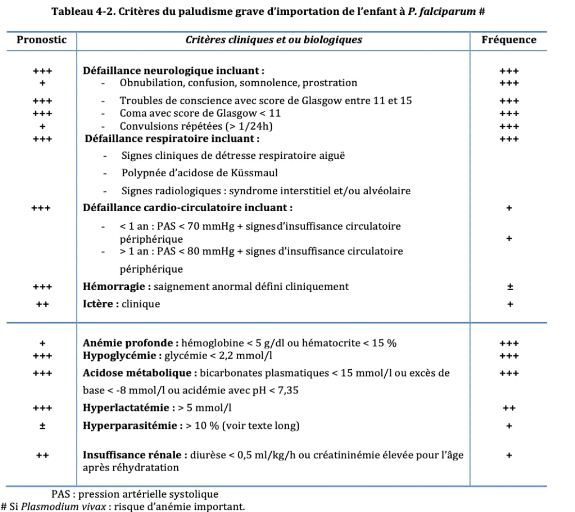
Le neuropaludisme et l'anémie
grave sont les complications majeures du paludisme à
P. falciparum. Plusieurs théories probablement
complémentaires sont actuellement retenues, notamment la
séquestration d'hématies parasitées par des formes matures
de Plasmodium, adhérant aux cellules endothéliales des
microvaisseaux, et l'intervention de cytokines ou autres
médiateurs.
Primum movens : la cytoadhérence: elle
existe entre les globules rouges parasités par les stades asexués
« matures » (trophozoïtes âgés, schizontes) et les
cellules endothéliales vasculaires. et est responsable :
· d'un ralentissement du flux sanguin dans les
capillaires (phénomène mécanique) ;
· d'une réaction inflammatoire tissulaire
cytokinique (phénomène inflammatoire).
La Séquestration consiste chez les
hématies parasitées par les stades trophozoïtes
âgés et schizontes de P. falciparum
qui ont, contrairement aux autres espèces, la
capacité de se fixer aux cellules endothéliales des capillaires
(cerveau, avec risque de coma par neuropaludisme, mais aussi reins, foie,
poumons...). Ces formes matures sont donc absentes de la circulation sanguine
périphérique. Cette séquestration est due à des
phénomènes d'adhérence cellulaire
(cytoadhérence)[15] entre les hématies
parasitées et les cellules endothéliales de ces capillaires, sous
la dépendance d'interactions entre des récepteurs
moléculaires plasmodiaux présents à la surface des
hématies parasitées (en particulier PfEMP1) et
des récepteurs spécifiques des cellules endothéliales (en
particulier ICAM1). Le blocage des hématies
parasitées dans les capillaires provoque un ralentissement
circulatoire, directement proportionnel au nombre d'hématies
parasitées (phénomène mécanique). Cette
séquestration est de plus amplifiée par une
déformabilité moindre des hématies parasitées et
par la formation de « rosettes » (agrégats constitués
d'une hématie parasitée à laquelle adhèrent
plusieurs hématies non parasitées). Le ralentissement de la
circulation capillaire provoque une hypoxie tissulaire, qui active le
métabolisme cellulaire de glycolyse anaérobie avec pour
conséquence l'acidose lactique et des
dysfonctions organiques. Une autre conséquence de cette
cytoadhérence est la mort par apoptose des cellules
endothéliales qui présentent à leur surface les
antigènes plasmodiaux exposés après la rupture du
schizonte, les restes de la membrane du globule rouge éclaté
restent « collés » à la cellule endothéliale.
Lorsque la parasitémie est élevée, la résultante de
cette apoptose intense est la perméabilisation de la
paroi des microvaisseaux avec apparition de micro-hémorragies
tissulaires (visibles à l'observation du fond d'oeil).
Contrairement aux étapes précédentes, ce
phénomène n'est pas réversible et, dans ce cas,
l'évolution est très souvent défavorable
(séquelles, décès)[16]
La pénétration et le développement
intraérythrocytaire de Plasmodium déterminent des
modifications des cellules-hôtes, et constituent la cause principale de
l'anémie palustre. Bien que non expliquées, les
modifications des érythrocytes parasités ont été
abondamment décrites Nous rappellerons l'existence de << knobs ))
ou excroissances, localisées sur le plasmalemme des hématies
parasitées Ces excroissances sont responsables de l'adhésion des
érythrocytes parasités aux endothéliums capillaires et
peuvent expliquer la séquestration des hématies parasitées
dans les capillaires viscéraux .
:1.6 Les marqueurs de
virulence de Plasmodium falciparum
La
virulence
d'un agent infectieux mesure sa capacité à se développer
dans un organisme (pouvoir invasif) et à y
sécréter des toxines (pouvoir toxique ) [17]. Dans notre
cas, c'est donc la capacité du Plasmodium falciparum à
infecter l'Homme et à induire ensuite une pathologie. La
présentation clinique de l'infection plasmodiale causée par
P.falciparum. va de l'infection asymptomatique à l'infection
fébrile aiguë modérée à l'infection grave et
compliquée avec insuffisance organique [18]. Bien que les facteurs
contribuant à ce large spectre de symptômes n'aient pas encore
été bien caractérisés, certains auteurs pensent que
la virulence parasitaire est un facteur contributeur important[19], [20]. De ce
fait, il serait donc nécessaire de déterminer les souches de
Plasmodium responsables ou pas de la symptomatologie clinique. Pour
ainsi mettre en évidence ces différentes souches et en
déterminer le lien avec la virulence du parasite, plusieurs
études ont été menées sur certains gènes
tels que le Pfmsp1, Pfmsp2, ama1, Pfmp1 etc. Or, un lien clair entre
ces gènes et la symptomatologie clinique n'a pas encore
été bien établi d'où la nécessité de
caractériser la virulence de Plasmodium en utilisant ces
marqueurs.
Pfmsp1 et 2 sont parmi les cibles du vaccin contre
le paludisme au stade sanguin jouant un rôle important dans
l'identification des espèces génétiquement distinctes des
sous-populations parasitaires de P. falciparum[21]. Ils sont
impliqués dans l'invasion des érythrocytes et sont ciblés
par les réponses immunitaires '''''''''''''''''''[22]. Pfmsp 1
est une protéine de surface de plus de 190 KDa situé sur le
chromosome 9 et contient 17 blocs de séquences flanqués de
régions conservées . Le bloc 2, qui est la partie la plus
polymorphe de Pfmsp 1, est regroupé en trois familles
alléliques à savoir K1, MDA20 et R033 . Pfmsp 2 est une
glycoprotéine situé sur le chromosome 2 et composé de cinq
blocs dont le bloc central est le plus polymorphe [18]. Lamsp2 les
allèles sont regroupés en deux familles alléliques, F7 et
3D7/IC1 [23]
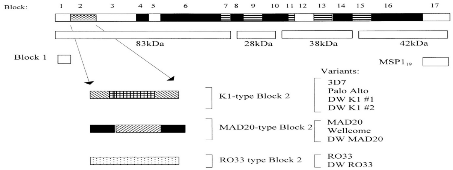
Figure 3:
Représentation schématique du gène Pfmsp 1 de P.falciparum
montrant les 17 domaines [24]

Figure 4: Diagramme
schématique du gène Pfmsp 2 illustrant les blocs 1 à 5
[24]
Figure 4:
Diagramme Schématique du gène msp-2 illustrant
les bloc 1 à 5
Autres marqueurs
D'autres marqueurs tels que ;Apical Membrane
Antigene 1, PfEMP1, Pfmsp 3, Eba 175 pourraient jouer un
rôle important dans la virulence et le polymorphisme de
P .falciparum.
1.6. Paludisme au Gabon
1.6.1. Epidémiologie
Le Gabon est un pays d'Afrique Centrale situé en zone
équatoriale, sa population est estimée à 2119000
habitants, il est limité à l'ouest par l'Océan Atlantique,
à l'est, au sud-est et au sud par la
République
du Congo, au nord-ouest par la
Guinée
équatoriale et au nord par le
Cameroun.
Figure 5: Carte du Gabon
[25]
Le climat chaud et humide que l'on retrouve au Gabon est
favorable au développement de l'anophèle. C'est une zone
où la transmission est encore hyper-endémique-----------[26],
[27]. P. falciparum est l'espèce parasitaire
prédominante au Gabon, suivie de Plasmodium malariae
------------[26]-[28]. D'après le Programme National de Lutte
contre le Paludisme (PNLP), le
paludisme est responsable de la consultation médicale
de 45% des enfants et 71% des femmes enceintes au Gabon[29].
Mais, peu de données existent sur la géographie de cette maladie
meurtrière
1.6.2. Marqueurs de virulence au Gabon
Le lien entre la virulence de Plasmodium et les
marqueurs de virulence étudiés au Gabon n'est pas clairement
établi. Cependant, des études sur le polymorphisme
génétique de P. falciparum ont permis de décrire
la diversité génétique de ce parasite dans
différentes régions au Gabon, aussi bien chez les patients
présentant un paludisme simple à sévère que chez
les enfants asymptomatiques-----[30], [31].
Ces études basées sur l'amplification des
gènes msp-1 et msp-2 avaient pour objectif de
caractériser le profil génétique des isolats de
Plasmodium dans le but ultime d'une possible élimination du
paludisme. L'étude de msp-1 montre une grande diversité
allélique de ce gène, qui serait compatible avec le niveau
élevé de transmission du paludisme au niveau de
Libreville-----[30]. Cette diversité génétique de P.
falciparum est cependant très variable d'une région
à une autre.-----[30], [31]. De plus une prédominance de
l'allèle K1 a été signalée au niveau du
Gabon[31].
II. LES OBJECTIFS DE L'ETUDE
2.1. Objectif général
L'objectif général de cette étude est de
déterminer les différents allèles associés au
statut clinique chez les enfants infectés vivants dans notre zone
d'étude..
2.2. Objectifs spécifiques
Ø Déterminer la prévalence de l'infection
plasmodiale chez les asymptomatiques et les symptomatiques ,
Ø Déterminer la prévalence des
différentes espèces plasmodiales chez les asymptomatiques et les
symptomatiques
Ø Déterminer la prévalence des
coïnfections plasmodiales chez les asymptomatiques et les symptomatiques
Ø Comparer la distribution de Pfmsp 1 et 2 des
différentes espèces plasmodiales en fonction du statut
clinique
III. MATERIELS ET METHODES
3.1. Caractéristiques de l'étude
Il s'est agi d'une étude
observationnelle à visée descriptive et analytique,
privilégiant une approche pluridisciplinaire qui associe
l'épidémiologie et la biologie moléculaire
.3.1.1. Type et période d'étude
Cette étude a été réalisée
entre Avril 2022 et Septembre 2022 au sein de l'Unité
d'Epidémiologie, d'Evolution et de Résistance Parasitaire
(UNEEREP) du Centre Interdisciplinaire de Recherche Médicale de
Franceville (CIRMF). Les échantillons analysés provenaient d'un
recueil effectué entre 2013 et 2014, dans la région de
Lastourville, incluant le centre médical de Lastourville, la ville de
Lastourville, les villages de Matsatsa, Mikouyi, Malende et Mana-Mana, dans le
département de Mulundu (province de l'Ogooué-Lolo, Sud-Est du
Gabon).
3.1.2. Site de l'étude
Les prélèvements sanguins pour les patients
symptomatiques ont été réalisés sur des enfants
reçus en consultation au Centre Médical de Lastourville. Quant
aux enfants asymptomatiques, leurs prélèvements ont
été réalisés dans les écoles au sein des
différents villages inclus dans l'étude.
Le diagnostic microscopique et immunochromatographique (TDR)
de l'infection plasmodiale a été réalisé sur les
sites de récoltes d'échantillons tandis que les analyses
moléculaires ont été réalisées au Centre
Interdisciplinaire de Recherches Médicales de Franceville (CIRMF).
3.1.3. Population d'étude
Les sujets inclus dans cette étude étaient des
enfants âgés de 6 mois à 15 ans, présentant un
syndrome fébrile ou non, recrutés dans les sites
mentionnés ci-dessus.
3.1.4. Critères d'inclusion et de non
inclusion
Pour les patients fébriles, les critères
d'inclusion étaient les suivants :avoir consulté le service de
pédiatrie externe pendant la période de l'étude , avoir
une température corporelle supérieure ou égale à
37,5°C ou une histoire de fièvre durant les 24 heures
précédents, être âgé de 6 à 180 mois ,
avoir un test diagnostique rapide (TDR) positif, et présenter au moins
un critère spécifique au paludisme selon les recommandations de
l'OMS (notamment la fièvre). Pour les asymptomatiques, les individus ne
devaient présenter aucun signe de fièvre durant les 7 jours
précédant le prélèvement. Pour les mineurs le
consentement éclairé a été signé par un
tuteur. Les enfants dont les tuteurs n'ont pas donné leur consentement
n'ont pas été inclus dans l'étude.
3.2. Analyses Biologiques
3.2.1. Diagnostic de
l'infection plasmodiale
3.2.1.1. Le prélèvement :
Le prélèvement sanguin a été
réalisé au pli du coude dans un tube contenant de l'EDTA ou par
piqure franche au bout du doigt (pulpe du doigt). Après
réalisation des différents tests de diagnostics du paludisme, les
prélèvements ont été séparés par
centrifugation à 1500 tours/ minutes afin d'obtenir le culot globulaire
et le plasma. Les culots globulaires ont été
transférés dans des tubes Eppendorff puis conservés
à -20°C, pour l'extraction de d'ADN.
Le diagnostic du paludisme a été
réalisé par la technique de la Goutte épaisse, le test de
diagnostic rapide du paludisme (TDR, kit optimal-It). Le diagnostic des
différentes espèces plasmodiales a été
réalisé par analyse moléculaire.
3.2.1.2. Diagnostic par TDR
Le test de diagnostic rapide du paludisme (TDR), est un test
immuno-chromatographique qui utilise des anticorps monoclonaux dirigés
contre la lactate déshydrogénase spécifique à
P. falciparum (pfLDH) et une LDH commune aux espèces de
Plasmodium (pan-LDH) [22]. Ce test contient un dispositif prêt
à l'emploi, constitué d'une cassette (contenant deux puits, puits
lavage et puis conjugué) et d'une bandelette. La réalisation de
celui-ci consiste à mettre une goutte de tampon dans le premier puits
(puits conjugué), 4 gouttes dans le deuxième puits (puits
lavage), qu'on laisse reposer 1 minute. Dix microlitres (10 ìl) de sang
ont été ensuite prélevé à l'aide de la
pipette et déposé dans le premier puits. Après
homogénéisation, le produit a été laissé au
repos pendant 1 minute, puis, le support de la bandelette a été
retiré et l'extrémité de la bandelette été
mise dans le puits conjugué. Après 10 minutes d'incubation, la
bandelette a ensuite été transférée dans le
puits-lavage, et a été à nouveau incubée pendant 10
minutes. Une fois le lavage terminé, la bandelette est mise dans la
pièce plastique transparente pour effectuer la lecture. Le test est
validé lorsque la bande contrôle apparait et
l'interprétation est fonction du nombre de bande qui apparait sur la
bandelette (voir Figure 6).
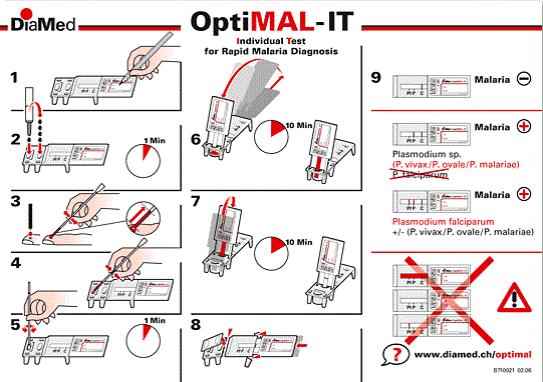
Figure 6:
Représentation schématique de la réalisation d'un TDR(
kit-optimal-it)
(1) -identification de bandelette, (2) - remplissage des puits
avec le tampon de lyse, (3) -prélèvement sanguin à la
pulpe du doigt, (4) - dépôt du sang dans le tampon, (5)
-homogénéisation et lyse, (6) - migration chromatographique (10
minutes) (7) - lavage 10 minutes, (8) mise de la bandelette dans la
pièce plastique, (9) - interprétation des résultats.
3.1.2.3. Diagnostic par microscopie: Goutte
épaisse
La goutte épaisse permet la mise en évidence des
parasites dans le sang mais aussi leur quantification. Elle a été
réalisée selon la méthode de Lambaréné qui
consiste à étaler sur une lame porte-objet propre et
dégraissée 10ìl de sang sur une surface de 18×10
mm2. Après étalement, la lame est séchée
puis colorée pendant 25 minutes au Giemsa à 20%. La lame est
ensuite lue au microscope optique à l'objectif ×100 en utilisant de
l'huile à immersion. La parasitémie a été
déterminée en nombre de formes asexuées de
Plasmodium et calculée en utilisant la formule suivante :
Parasitémie = X × 500 parasites / ìl de sang. X= moyenne de
parasites obtenus à partir de 10 champs microscopiques, 500= facteur
correcteur (varie en fonction du microscope).
3.2. Analyses moléculaires
3.2.1. L'extraction d'ADN :
L'extraction d'ADN par le kit Blood DNA
E.Z.N.A® est basée sur la chromatographie
d'affinité, elle consiste à mélanger, 250ìL du
culot globulaire, 25ìL d'OB protéase (20mg/ml), 250ìL de
tampon de lyse (BL) dans un tube Eppendorff. Le mélange est
incubé à 65°C pendant 10 minutes au minimum (on
homogénéise toutes les 3 minutes). A la fin de l'incubation,
260ìL d'éthanol absolu sont ajoutés, puis le
mélange est homogénéisé. Une colonne d'extraction
est ensuite équilibrée avec 100ìL de tampon
d'équilibration pendant 4 minutes à température ambiante
et centrifugée brièvement pendant 20 secondes. Le lysat est
transféré dans la colonne puis centrifugé pendant une
minute à 10000g. La colonne est transférée dans un nouveau
tube collecteur et 500ìL de tampon HB sont ajoutés puis
centrifugée pendant 1 minute à 10000g. Après
centrifugation, la colonne est à nouveau transférée sur un
tube collecteur et lavée deux fois avec 700ìL de DNA Wash buffer
reconstitué avec de l'éthanol à 70%. Elle est ensuite
centrifugée pendant une minute à 10000g, puis
séchée par centrifugation pendant 2 minutes à 13000g. La
colonne est ensuite placée dans un tube Eppendorff stérile de
1,5ml. Pour l'élution de l'ADN, 90ìL d'eau distillé
préchauffée à 65°C, ont été
déposé sur la colonne, que l'on laisse reposer 5 minutes à
température ambiante. La colonne est ensuite centrifugée pendant
une minute à 10000g, pour l'élution de l'ADN, l'élution
est répétée une seconde fois. L'ADN recueilli dans le tube
Eppendorff est conservé à -20°C.
Amplification pour le diagnostic moléculaire
d'espèces
La PCR est une technique de réplication in vitro
qui permet à l'aide d'amorces spécifiques d'amplifier un
fragment d'ADN extrait. Pour le diagnostic moléculaire, nous avons
utilisé la méthode de Snounou [33]. Les différentes
étapes de la PCR, ainsi que les différents couples d'amorces sont
consignées dans les tableaux 2 et 3 ci-dessous :
Tableau 2:
Séquences des amorces utilisées pour le diagnostic
moléculaire et tailles des bandes attendues
|
Espèces
|
Amorces
|
Séquences des amorces (5'-3')
|
Tailles attendues (pb)
|
|
Plasmodium spp.
|
rPLU5
|
CCTGTTGTTGCCTTAAACTTC
|
1100
|
|
|
rPLU6
|
TTAAAATTGTTGCAGTTAAAACG
|
|
|
P. falciparum
|
rFAL1
|
TTAAACTGGTTTGGGAAAACC AAATATATT
|
205
|
|
|
rFAL2
|
ACACAATGAACTCAATCATGA CTACCCGTC
|
|
|
P. vivax
|
rVIV1
|
CGCTTCTAGCTTAATCCACAT AACTGATAC
|
120
|
|
|
rVIV2
|
ACTTCCAAGCCGAAGCAAAGA AAGTCCTTA
|
|
|
P. ovale
|
rOVA1
|
ATCTCTTTTGCTATTTTTTAG TATTGGAGA
|
800
|
|
|
rOVA
|
GGAAAAGGACACATTAATTGT ATCCTAGTG
|
|
|
P. malariae
|
rMAL1
|
ATAACATAGTTGTACGTTAAG AATAACCGC
|
144
|
|
|
rMAL2
|
AAAATTCCCATGCATAAAAAA TTATACAAA
|
|
Tableau 3: Programme PCR
utilisés
|
Réaction
|
Conditions de PCR
|
|
PCR1 (P. falciparum, P. vivax, et P.
malariae)
|
Dénaturation : 95°C pendant 5minutes, et
94°C pendant1 min, hybridation à 60°C pendant 2 min, et
extension à 72°C pendant 2 min (30 cycles)
|
|
PCR1 (P. ovale)
|
Dénaturation : 95°C pendant 5minuteset
94°C pendant 30 s, hybridation à 45°C pendant 30 s, et
extension à 72°C pendant 1 min 30 s (30 cycles)
|
|
Nested -PCR (P. falciparum, P. vivax, et
P. malariae)
|
Dénaturation : 95°C pendant 5minutes et
94°C pendant 1 min, hybridation à 55°C pendant 2 min, et
extension à 72°C pendant 2 min (30 cycles)
|
|
Nested- PCR (P. ovale)
|
Dénaturation : 95°C pendant 5minutes et
94°C pendant 30 s, hybridation à 45°C pendant 30 s, et
extension à 72°C pendant 1 min 30 s (45 cycles)
|
Le milieu réactionnel contient : 0,024U de Taq
polymérase, du tampon1X (composition en annexe), 1,5mM de Mgcl2, 0,2mM
de dNTPs 0,8mM d'amorce direct et 0,8mM d'amorce reverse. Dix microlitres
(10ìL) d'ADN extrait ont été rajoutés au milieu
réactionnel pour la PCR1. Pour la deuxième PCR, le même
milieu réactionnel est utilisé, mais l'on rajoute 2ìl
d'amplicons de la première PCR. La réaction est effectuée
dans un thermocycler Bio Rad® (Mercure de coanette, France). Les fragments
d'ADN amplifiés sont analysés par électrophorèse
sur gel d'agarose à 2%.
Electrophorèse
C'est une méthode qui permet de séparer
différents fragments d'ADN en fonction de leurs poids
moléculaires. Du gel d'agarose à 2 % a été
préparé dans un volume de 150mL de TAE 1X (voir annexe) puis
chauffé dans un four à micro-onde, pendant 3 minutes. Le GelRed
(15uL) y est ajouté comme colorant nucléaire. Ce mélange
est mis dans la cuve à électrophorèse avec un peigne et
laissé à polymériser environ 20 minutes à
température ambiante. Après polymérisation le gel est
déposé dans l'appareil à électrophorèse. Les
échantillons y sont ensuite déposés après
homogénéisation avec du bleu de charge et la migration se fait
dans du tampon TAE 1X pendant 2h à 100V. La révélation est
faite sur une table à UV (560nM).
3.2.2 Analyse des données
les résultats des analyses moléculaires ont
été saisis sur un fichier Excel et analysés par le
logiciel R version 3.4.0 (2017-04-21). La fréquence allélique de
Pfmsp1 et Pfmsp2 a été calculé comme la
proportion de l'allèle détecté pour chaque famille
allélique sur le total des allèles détectés. La
fréquence d'infection polyclonale a été calculée en
utilisant le nombre d'échantillons avec plus d'un fragment
amplifié sur le total des échantillons. Le MOI moyen a
été déterminé en divisant le nombre total
d'allèles détectés dans les deux Pfmsp1 et Pfmsp2
par le nombre total d'échantillons positifs pour les deux marqueurs .Le
test du Chicarré a été utilisé pour comparer les
proportions. La signification statistique a été définie
comme p <0,05.
IV.RESULTATS
4.1
Caractéristiques de la population d'étude
4.1.1. Description de la population d'étude
Au total, 876 enfants dont 401 fébriles et 475 non
fébriles ont été inclus dans cette étude.,. La
moyenne d'âge des enfants infectés asymptomatiques était
plus élevée (59#177;2 mois) par rapport à celle des
enfants infectés symptomatiques (34,01#177;2 mois) (p= 0,03).
Par ailleurs aucune différence significative au niveau du sexe ratio n'a
été observée entre les infectés symptomatiques
(sex-ratio= 1) et les asymptomatiques (Sex-ratio= 0,7 ; p =0,3).
4.2. Comparaison de la
Prévalence de l'infection plasmodiale entre symptomatiques et
asymptomatiques
La prévalence globale de l'infection plasmodiale
était de 51,2% (N = 449). Dans cette localité, la
prévalence de l'infection asymptomatique était de 42,3% (n =
201/449) et celle de l'infection symptomatique était de 61,9% (n =
248/449). Ces deux fréquences étaient statistiquement
différentes, p = 0,002 (Tableau 7).
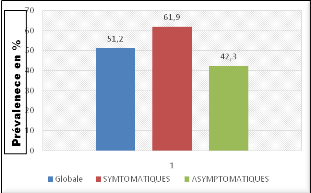
Figure 7 : Prévalence de l'infection plasmodiale
4.2.1. Distribution des espèces plasmodiale en
fonction de la symptomatologie
Le diagnostic moléculaire a permis d'identifier les
différentes espèces plasmodiales circulants dans la région
d'étude et de les répartir suivant le statut clinique. Dans
l'ensemble de nos échantillons, P. falciparum était
l'espèce plasmodiale majoritaire avec des prévalences de 99,1% (n
= 119) et de 75,12% (n=151) chez les symptomatiques et asymptomatiques,
respectivement. Cette prévalence était significativement plus
élevée chez les symptomatiques par comparaison aux
asymptomatiques (p=0,002). Pour ce qui est de P. malariae les
cas de mono infections n'ont été identifiés que chez les
asymptomatiques, avec une prévalence de 6,02% (n=10). Par contre chez
les patients symptomatiques, P. malariae n'a été
retrouvé qu'en coinfection avec P.falciparum. La
prévalence de la coinfection P. falciparum + P. malariae
était significativement différente entre les deux groupes
(p< 0,05).
4.2.2. Caractérisation de la virulence
4.2.2.1. Génotypage des gènes
Pfmsp-1 et Pfmsp-2: Fréquences des familles alléliques
des gènes Pfmsp-1-2 en fonction du statut
clinique
Sur les 186 échantillons génotypés pour
les deux gènes d'interêt; 97,9% (182/186) et 96,2% (179/186)
d'amplicons ont été obtenus pour les gènes Pfmsp-1 et
Pfmsp-2, respectivement.
Les fréquences globales des familles alléliques
du gène Pfmsp-1 n'étaient pas significativement
différentes (80%, 146/182 ; 90%, 164/182 et 78%, 142/182, pour K1,
Mad20 et RO33 respectivement; p>0,05). Cependant, la famille
allélique RO33 s'est avérée plus fréquente dans les
isolats symptomatiques (93%; 120/129) comparés aux asymptomatiques
(38% ; 22/57), p=0,001. Par contre aucune différence
significative de fréquence pour les familles alléliques K1 et
Mad20 n'a été observée entre symptomatiques
(K1=82% ,107/129 ; Mad20=91%,118/129) et asymptomatiques (K1=68%,
39/57 ; Mad20=80% ,46/57) (p > 004 ; Tableau 3)
Pour ce qui est des familles alléliques du gène
Pfmsp-2, la fréquenc de 3D7 (91%, 163/179) était
significativement plus élevée que celle de F7 (55%, 99/179)
(p=0,002). Cependant, la fréquence de la famille
allélique n'était pas significativement différente en
fonction du statut clinique.. La famille allélique F7 quant à
elle n'a été observée que dans les isolats
asymptomatiques avec une fréquence de 78%. (Tableau 3).
Tableau 4:
Fréquences des familles alléliques des gènes Pfmsp 1 et
2
|
Pfmsp1
|
Familles alléliques
|
Global % (n/N)
|
p
|
Symptomatiques
|
Asymptomatiques
|
p*
|
|
K1 %
|
80 (146/182)
|
0,6
|
82 (107/129)
|
68 (39/57)
|
0,4
|
|
Mad20 %
|
90 (164/182)
|
91 (118/129)
|
80 (46/57)
|
0,6
|
|
RO33 %
|
78 (142/182)
|
93 (120/129)
|
38 (22/57)
|
0,001
|
|
Pfmsp2
|
3D7 %
|
91 (163/179)
|
0,002
|
88 (114/129)
|
85 (49/57)
|
0,9
|
|
F7 % (N/T)
|
55 (99/179)
|
0%
|
78 (45/57)
|
<0,05
|
n=effectif de chaque allèle,
N=nombre total d'isolats testés
4.2.2. Infections polyclonale des gènes
Pfmsp-1 et Pfmsp-2 en fonction du statut clinique
Des coinfections des familles alléliques K1, Mad20 et
RO33 du gène Pfmsp1ont été
détectées dans 87% (158/182) des cas. Dans l'ensemble, la triple
infection K1_Mad20_RO33 était la plus fréquente avec une
fréquence de 69% (109/158), P<0,05, Les doubles infections
RO33-Mad20, K1_Mad20 et K1_Ro33 avaient des fréquences
inférieures à 20%.
Dans l'ensemble, la proportion d'infection polyclonale
était significativement plus importante dans les isolats d'enfants
symptomatiques (121/158 soit 76%) comparés aux asymptomatiques (37/158
soit 24%), P<0,005. Par ailleurs, la proportion des combinaisons
K1_Mad20 était significativement plus importante dans les isolats
asymptomatiques comparés aux symptomatiques. Mais aucune
différence significative de fréquence des autres combinaison
alléliques (R033 et K1-RO33) n'a été mise en
évidence entre symptomatiques et asymptolatiques.
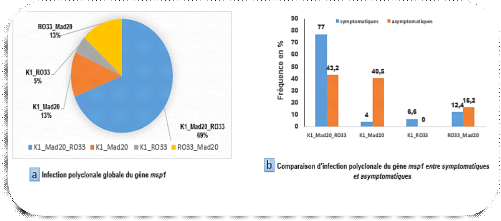
Figure 7: Infection
polyclonale du gène Pfmsp1
S'agissant du gène Pfmsp2, des combinaisons
des familles alléliques 3D7 et F7 ont été mis en
évidence dans 45% d'échantillons analysés (80/179). La
fréquence d'infections polyclonales n'était pas significativement
différente entre symptomatiques (52,5%) et asymptomatiques (47,5%) pour
cette combinaison allélique , p=0,7.
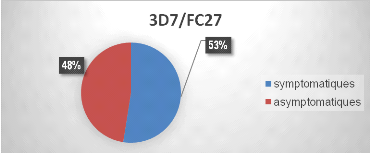
Figure 8 : Infection polyclonale du gène
msp2
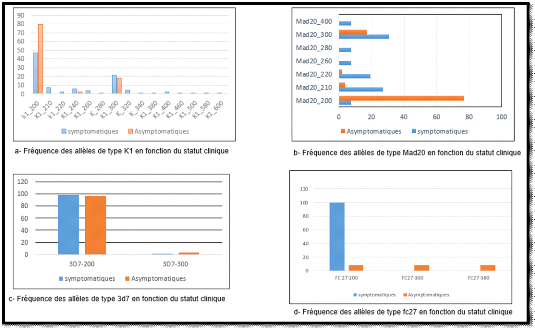
4.3. Diversité allélique : polymorphisme
de longueur de taille de fragments
Les allèles identifiés ont été
classés selon leurs tailles. Un total de 31 allèles individuels
des deux gènes ont été identifiés chez l'ensemble
de sujets. Vingt trois (23) allèles différents du gène
Pfmsp-1 ont été observés (15 pour K1, 6 pour
Mad20, et 1 pour RO33) avec des tailles de fragments allant de 200, 210, 220,
240, 260, 280, 300, 320, 340, 380, 400, 460, 500, 580, à 600 paires de
bases. De plus 8 allèles du gène Pfmsp-2
différents, avec des tailles de fragments allant également de 200
,210, 300, 320, 380, 400, 500, à 600 paires de bases ont
été trouvés, dont 2 appartenant à la famille
allélique 3D7 et 6 appartenant à la famille allélique F7.
Le gène msp-2 (24%, 8/31) était moins polymorphe que
Pfmsp-1 (74%, 23/31), La famille allélique RO33 s'est
avérée monomorphe (avec une taille de fragment amplifiée
de 200 Pb) et représentait 4,4% (1/23) de tous les génotypes
Pfmsp-1. Les allèles de types K1 et Mad20 prédominaient
avec des fréquences de 65% (15/23) et 26% ( 6/23) respectivement,
P<0,05. Parmi les 23 allèles de K1, les allèles K1_200, et
K1_300 , étaient les plus fréquents avec de fréquences
respectives de 57% et 22% . Les autres allèles avaient des
fréquences inférieures à 10%. Pour les allèles de
type Mad20, Mad20_200 (52% ) et Mad20_300 ( 21%) étaient les plus
fréquents. Dans les familles alléliques du gène
Pfmsp-2, F7_200 (91,8%), 3D7_200 (97,5%) étaient les plus
fréquemment rencontrés. La fréquence des autres
allèles était inférieure à 10%.

Figure 8: Diversité
allélique, polymorphisme de longueur de taille de fragments dans
l'ensemble de la population
Figure 9. Diversité allélique,
polymorphisme de longueur de taille de fragments dans l'ensemble de la
population
Les différents profils alléliques variaient en
fonction de la symptomatologie clinique. Pour le gène Pfmsp-2,
5 allèles différents ont été repéré
dans les isolats d'enfants asymptomatiques ( 2 de type 3D7 et 3 de type F7) et
3 allèles ont été mis en évidence dans les isolats
symptomatiques (1 de type F7 et 2 de type 3D7). Deux (2) allèles de
type F7 (F7_ 400 et F7_480) ont uniquement été observés
dans les isolat d'enfants asymptomatiques bien qu'ayant des fréquences
inférieures à 20%. Cependant, pour les allèles
identifiés à la fois dans les isolats symptomatiques et
asymptomatiques, la fréquence de l'allèle F7_200 était
significativement plus élevée dans les isolats symptotamiques
comparés aux asymptomatiques P<0,05. Aucune différence
significative de fréquences entre les deux statut pour les autres
allèles n'a été observée, P>0,05.
En ce qui concerne le gène Pfmsp-1, 7
allèles différents ont été mis en évidence
dans les isolats asymptomatiques ( 4 de type Mad20 et 3 de type K1) et 22
allèles différents ont été observés dans les
isolats symptomatiques (K1=15, Mad20=7). Les allèles Mad20_400,
Mad20_280, Mad20_260, K1_210, K1_ 220, K1_ 260, K1_ 280, K1_320, K1_ 340, K1_
380, K1_ 400, K1_460, K1_ 500, K1_ 580, K1_600 ont été
uniquement observés dans les isolats symptomatiques. Certains
allèles étaient communs aux deux groupes sans aucune
différence significative de fréquence, P>0,05. (Figure 15)
V. DISCUSSIONS
Le paludisme reste un fardeau dans diverses régions du
monde. Si les infections symptomatiques sont diagnostiquées et
traitées, le portage asymptomatique reste mal connu et constitue un
frein pour les stratégies d'élimination du paludisme. Aussi,
cette étude sur l'épidemiologie du paludisme et la virulence
parasitaire chez les enfants gabonais vivants à Lastoursville (milieu
Rural) est la première qui évalue d'une part la prévelance
de l'infection plasmodiale asymptomatique et symptomatiques et d'autre part le
polymorphisme génétique des gènes Pfmsp1 et Pfmsp2
dans cette localité.
La moyenne d'âge des enfants asymptomatiques plus
élevée que celle des enfants symptomatiques observée dans
cette étude pourrait s'expliquer par le fait que l'étude a
été réalisée au sein d'une zone
d'endémicité palustre, et l'âge est considéré
comme étant l'un des facteurs en corrélation avec la
prémunition dans les zones d'endémie palustre. En effet les
jeunes enfants sont plus vulnérables, mais les adultes et les jeunes
adolescents ayant acquis une forme d'immunité après plusieurs
expostion au parasite sont plus susceptibles d'avoir présenté des
infections asymptomatiques-'--[34]. Ils peuvent servir de réservoir de
transmission car l'immunité anti palustre acquise conduit à une
persistance de l'infection asymptomatique ou à des infections
symptomatiques faibles qui sont souvent moins prises en charge par rapport aux
infections aigues qui apparaissent chez des jeunes enfants [35] De plus, nos
résultats corroborent ceux d'études antérieures ayant
montrés que les enfants asymptomatiques sont souvent plus
âgés que les enfants symptomatiques [35] -'--[34]
Une prévalence d'infection plasmodiale
élevée a été observée dans l'ensemble de la
population, cette observation est comparable à celles déjà
décrites dans notre région d'étude
- [36]
[37]. Ceci pourrait être dû au niveau socio économique bas
et de connaissance sur le paludisme des personnes vivant en zone rurale
conduisant à une utilisation moins effective des moyens de
prévention, lesquels ont un impact significatif sur la circulation de
Plasmodium et la réduction de la prévalence de
l'infection plasmodiale. De plus La proportion d'enfants fébriles
portant une infection à plasmodiums falciparum. était
significativement plus élevée que celle des enfants non
fébriles. Cette observation Pourrait également s'expliquer par
l'acquisition d'une prémunition avec l'âge chez les jeunes
adolescents et les adultes vivants en zone endémique contrairement aux
enfants de moins de cinq ans qui sont plus susceptibles de développer un
paludisme [38]. Ces résultats diffèrent de ceux obtenus dans
une étude réalisées au Cameroun en milieu rural qui
énonce une prévalence significativement élevée chez
les enfants asymptomatiques (30,7%) comparés aux symptomatiques (17,8%),
aussi cela pouvait être du à un faible échantillon des
asymptomatiques par rapport aux enfants symptomatiques pour notre étude.
[39]. Les prévalences des infections asymptomatiques enregistrées
dans cette localité restent néanmoins non négligeables,
car les personnes atteintes d'infections plasmodiales asymptomatiques sont des
réservoirs silencieux du parasite et posent un sérieux
défi aux efforts de lutte contre la maladie en raison de leur
capacité à maintenir la transmission au sein de la population
à un faible niveau.
L'analyse du profil génétique de Plasmodium
falciparum., obtenu après PCR, en fonction du type d'infection,
peut fournir des informations utiles sur les caractéristiques de
certains clones parasitaires spécifiques afin de concevoir des
stratégies d'intervention ciblant les facteurs de virulence [40].
De façon globale, les résultats de notre
étude ont montré que les trois familles alléliques K1,
Mad20 et Ro33 du gène Pfmsp-1 et les deux familles
alléliques 3D7 et F7 du gène Pfmsp-2 étaient
présentes dans les échantillons analysés. La famille
allélique 3D7 étant la plus fréquemment rencontrée.
Des études réalisées au Gabon, au Burkina Faso et en
Côte d'Ivoire ont décrit une fréquence élevée
des familles alléliques K1 et 3D7[41] [42]. Aussi une étude
menée à Libreville a montré que la diversité
allélique de la famille Mad20 augmente avec la
sévérité de la maladie
[43] La famille allélique RO33
était la plus fréquente dans les isolats d'enfants symptomatiques
par rapport aux asymptomatiques,. Cette famille allélique pourrait jouer
un rôle important dans la survenue du paludisme, du moins au Gabon. Ceci
est différent des données décrites dans la
littérature car les familles allélique K1 et 3D7 ont souvent
été associées à l'infection symptomatique [44] que
RO33. La fréquence des familles alléliques F7 et 3D7
n'était pas différente entre symptomatiques et asymptomatiques,
ce qui prouve qu'il n'existerait pas des variant spécifiques de
Pfmsp2 qui pourraient être associés au statut clinique. Ces
résultats sont appuyés par des études qui ont
montré qu'il n'y avait pas d'association entre les familles
alléliques F7 ou 3D7 et le type d'infection [45] . A l'inverse, une
autre étude a rapporté une fréquence de la famille
'allélique F7 deux fois plus élevée dans les isolats
symptomatiques par rapport aux asymptomatiques [46]. Cependant, d'autres
études sont nécessaires pour clarifier l'interprétation de
ces résultats.
Un polymorphisme génétique élevé
à modéré au sein des familles alléliques des
gènes Pfmsp1et 2 a été observé dans les
isolats de Lastoursville (23 allèles) pour Pfmsp-1 et 8
allèles pour Pfmsp-2). Nos résultats sont
inférieurs à ceux décrits à Libreville (30
allèles), à Dielmo au Sénégal (33 allèles)
en 1995 et au Burkina Faso en 2009 (41 allèles) mais identiques à
ceux de Bakoumba près Franceville (25 allèles) en 1999 [47] [12]
--[48]. Cette diversité allélique pourrait s'expliquée par
le fait que la diversité génétique de P. falciparum
varie aussi bien d'une région à une autre et au sein d'une
même population [47]. Certains génotypes étaient communs
entre symptomatiques et asymptomatiques, parmi ceux-ci l'allèle F7_200
était en proportion plus importante dans les isolats symptomatiques,
contrairement aux autres allèles qui n'ont présenté aucune
différence significative entre les deux groupes. Cela suggère
que cet allèle pourrait avoir un lien avec la survenue de
symptômes et donc la virulence. Par ailleurs, certains génotypes
F7, différents ont été uniquement retrouvés dans
les isolats asymptomatiques et d'autres génotypes différents de
K1 et Mad20 ont été mis en évidence dans les isolats
symptomatiques uniquement. Ces résultats confortent l'idée selon
laquelle, certains clones parasitaires pourraient être responsables de
l'état clinique d'un individu. Cependant, le lien entre l'état
clinique et un génotype quelconque de P. falciparum reste un
sujet à controverse. Car, de nombreuses études ont montré
que la présence d'épisodes palustres subséquents pourrait
être due à de nouveaux parasites infectieux
[49].
VI. CONCLUSION ET PERSPECTIVES
Notre étude a montré une grande diversité
génétique et des fréquences alléliques de
Pfmsp1 et Pfmsp2 de P.falciparum dans les isolats provenant
d'enfants asymptomatiques et symptomatiques de Lastourville et ses environs. La
proportion d'enfants fébriles portant une infection à
P.falciparum. était significativement plus élevée
que celle des enfants non fébriles. K1 et 3D7 sont les familles
alléliques les plus répandues. La famille allélique RO33
était la plus fréquente dans les isolats d'enfants symptomatiques
par rapport aux asymptomatiques. La fréquence des familles
alléliques F7 et 3D7 n'était pas différente entre
symptomatiques et asymptomatiques, Plus de 50 % des infections sont
classées comme infections polyclonales pour msp1contre 1/3 pour msp2. La
grande diversité signalée peut renforcer l'utilisation de
Pfmsp1et Pfmsp2 pour distinguer les infections recrudescentes des
nouvelles infections dans les essais d'efficacité antipaludique au
Gabon. Cependant, des investigations supplémentaires avec des techniques
plus puissantes telles que l'électrophorèse capillaire, le
microsatellite et le séquençage de l'ADN sont nécessaires
pour mieux caractériser les parasites responsables du paludisme dans le
pays.
REFERENCES BIBLIOGRAPHIQUES
[1] World Health Organization, « World malaria report
2021 », World Health Organization., Geneva, 2022. Consulté le:
13 septembre 2022. [En ligne]. Disponible sur:
https://apps.who.int/iris/handle/10665/361856
[2] « UNFPA Gabon | Gabon Enquête
Démographique et de Santé 2012 ». Consulté le: 7
septembre 2022. [En ligne]. Disponible sur:
https://gabon.unfpa.org/fr/publications/gabon-enqu%C3%AAte-d%C3%A9mographique-et-de-sant%C3%A9-2012
[3] A. S. tropicale, « SNIS/GABON?: L'atelier de
restitution le système national d'information sanitaire ».
http://www.santetropicale.com/sites_pays/actus.asp?id=23543&action=lire&rep=gabon
(consulté le 7 septembre 2022).
[4] « World malaria report 2021 ».
Consulté le: 2 septembre 2022. [En ligne]. Disponible sur:
https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2021
[5] « Wild Chimpanzees Infected with 5 Plasmodium
Species - PMC ».
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3294549/ (consulté le 6
juillet 2022).
[6] « World malaria report 2021 ».
https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2021
(consulté le 2 septembre 2022).
[7] « World Malaria Report 2016 - World »,
ReliefWeb.
https://reliefweb.int/report/world/world-malaria-report-2016 (consulté
le 21 avril 2022).
[8] « Paludisme ».
https://www.who.int/fr/news-room/fact-sheets/detail/malaria (consulté le
12 avril 2022).
[9] « Plasmodium Sporozoite Biology -
PubMed ». https://pubmed.ncbi.nlm.nih.gov/28108531/ (consulté
le 23 août 2022).
[10] « Cycle de développement du Plasmodium(
d'après CDC) - Recherche Google ».
https://www.google.com/search?client=firefox-b-d&q=Cycle+de+d%C3%A9veloppement+du+Plasmodium%28+d%E2%80%99apr%C3%A8s+CDC%29+
(consulté le 27 août 2022).
[11] « Plasmodium falciparum merozoite surface protein
1 (MSP1): genotyping and humoral responses to allele-specific variants -
PubMed ». Consulté le: 4 septembre 2022. [En ligne].
Disponible sur: https://pubmed.ncbi.nlm.nih.gov/11755430/
[12] « Polymorphism in two merozoite surface proteins
of Plasmodium falciparum isolates from Gabon - PMC ». Consulté
le: 3 septembre 2022. [En ligne]. Disponible sur:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC156643/
[13] A. Mayor et al., « Plasmodium falciparum
multiple infections in Mozambique, its relation to other malariological indices
and to prospective risk of malaria morbidity », Trop Med Int
Health, vol. 8, no 1, p. 3?11, janv. 2003, doi:
10.1046/j.1365-3156.2003.00968.x.
[14] MEDECINE TROPICALE. 2ème tirage actualisé
de la 5ème édition - Marc Gentilini. Consulté le: 23
août 2022. [En ligne]. Disponible sur:
https://www.decitre.fr/livres/medecine-tropicale-9782257143945.html
[15] F. S. Touré et al.,
« Cytoadherence and Genotype of Plasmodium falciparum Strains from
Symptomatic Children in Franceville, Southeastern Gabon », Clin
Med Res, vol. 5, no 2, p. 106?113, juin 2007, doi:
10.3121/cmr.2007.696.
[16] H. L et J. At, « PfEMP1 - A Parasite Protein
Family of Key Importance in Plasmodium falciparum Malaria Immunity and
Pathogenesis », Advances in parasitology, vol. 88, avr.
2015, doi: 10.1016/bs.apar.2015.02.004.
[17] « POUVOIR PATHOGENE ».
http://www.microbes-edu.org/etudiant/pathogene.html (consulté le 3
septembre 2022).
[18] S. Chaorattanakawee et al., « Sequence
variation in Plasmodium falciparum merozoite surface protein-2 is associated
with virulence causing severe and cerebral malaria », PLoS
One, vol. 13, no 1, p. e0190418, janv. 2018, doi:
10.1371/journal.pone.0190418.
[19] « Parasite virulence and disease patterns in
Plasmodium falciparum malaria. - PMC ».
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC43652/ (consulté le 7
juillet 2022).
[20] « Sequence variation in Plasmodium falciparum
merozoite surface protein-2 is associated with virulence causing severe and
cerebral malaria | PLOS ONE ».
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0190418
(consulté le 7 juillet 2022).
[21] « Complexity and genetic diversity of Plasmodium
falciparum infections in young children living in urban areas of Central and
West Africa - PubMed ». https://pubmed.ncbi.nlm.nih.gov/12759745/
(consulté le 7 juillet 2022).
[22] A. P. V. Goran-Kouacou et al.,
« Sérologie palustre: quel apport dans un pays
d'endémie palustre comme la Côte d'Ivoire? », Pan
Afr Med J, vol. 26, p. 221, avr. 2017, doi:
10.11604/pamj.2017.26.221.11314.
[23] A. F. Somé et al., « Plasmodium
falciparum msp1 and msp2 genetic diversity and allele frequencies in parasites
isolated from symptomatic malaria patients in Bobo-Dioulasso, Burkina
Faso », Parasit Vectors, vol. 11, no 1, p. 323,
mai 2018, doi: 10.1186/s13071-018-2895-4.
[24] « Antigenicity of recombinant proteins derived
from Plasmodium falciparum merozoite surface protein 1 - PubMed ».
https://pubmed.ncbi.nlm.nih.gov/9106193/ (consulté le 16 juillet
2022).
[25] « carte_gabon.gif (Image GIF,
330 × 355 pixels) ».
http://www.afrique-planete.com/images/carte/carte_gabon.gif (consulté le
4 septembre 2022).
[26] J. B. Lekana-Douki et al., « Increased
prevalence of the Plasmodium falciparum Pfmdr1 86N genotype among field
isolates from Franceville, Gabon after replacement of chloroquine by
artemether-lumefantrine and artesunate-mefloquine », Infection,
Genetics and Evolution, vol. 11, no 2, p. 512?517, mars 2011,
doi: 10.1016/j.meegid.2011.01.003.
[27] P. Druilhe et al., « Plasmodium
falciparum drug resistance in West Africa », Ann Soc Belg Med
Trop, vol. 66, no 4, p. 297?300, 1986.
[28] « Aspects cliniques et approche epidemiologique du
paludisme de l'enfant à Libreville, Gabon. - Résultats de votre
recherche - Banque de données en santé publique ».
https://bdsp-ehesp.inist.fr/vibad/index.php?action=getRecordDetail&idt=189022
(consulté le 22 juin 2022).
[29] A. Koumba et al., « Distribution spatiale
et saisonnière des gîtes larvaires des moustiques dans les espaces
agricoles de la zone de Mouila, Gabon », International Journal of
Biological and Chemical Sciences, vol. 12, p. 1754, déc. 2018, doi:
10.4314/ijbcs.v12i4.19.
[30] C.-L. Zhang, H.-N. Zhou, Q. Liu, et Y.-M. Yang,
« Genetic polymorphism of merozoite surface proteins 1 and 2 of
Plasmodium falciparum in the China-Myanmar border region », Malar
J, vol. 18, p. 367, nov. 2019, doi: 10.1186/s12936-019-3003-8.
[31] M.-T. Ekala, H. Jouin, F. Lekoulou, S. Issifou, O.
Mercereau-Puijalon, et F. Ntoumi, « Plasmodium falciparum merozoite
surface protein 1 (MSP1): genotyping and humoral responses to allele-specific
variants », Acta Trop, vol. 81, no 1, p. 33?46,
janv. 2002, doi: 10.1016/s0001-706x(01)00188-7.
[32] « Evaluation of rapid diagnostic tests for malaria
case management in Gabon - PubMed ».
https://pubmed.ncbi.nlm.nih.gov/19846265/ (consulté le 2 septembre
2022).
[33] « Detection of malaria parasites by nested PCR in
south-eastern, Iran: Evidence of highly mixed infections in Chahbahar district
- PMC ». https://www.ncbi.nlm.nih.gov/pmc/articles/PMC111500/
(consulté le 16 juillet 2022).
[34] B. A. Mensah, J. L. Myers-Hansen, E. Obeng Amoako, M. Opoku,
B. K. Abuaku, et A. Ghansah, « Prevalence and risk factors associated
with asymptomatic malaria among school children: repeated cross-sectional
surveys of school children in two ecological zones in Ghana »,
BMC Public Health, vol. 21, p. 1697, sept. 2021, doi:
10.1186/s12889-021-11714-8.
[35] « The complexities of malaria disease
manifestations with a focus on asymptomatic malaria | Malaria Journal | Full
Text ».
https://malariajournal.biomedcentral.com/articles/10.1186/1475-2875-11-29
(consulté le 3 septembre 2022).
[36] S. Maghendji-Nzondo et al., « Malaria in
urban, semi-urban and rural areas of southern of Gabon: comparison of the Pfmdr
1 and Pfcrt genotypes from symptomatic children », Malar J,
vol. 15, p. 420, août 2016, doi: 10.1186/s12936-016-1469-1.
[37] « No evidence of decline in malaria burden from
2006 to 2013 in a rural Province of Gabon: implications for public health
policy | BMC Public Health | Full Text ».
https://bmcpublichealth.biomedcentral.com/articles/10.1186/s12889-015-1456-4
(consulté le 3 septembre 2022).
[38] « High prevalence of asymptomatic plasmodium
infection in a suburb of Aba town, Nigeria | Annals of African
Medicine ». Consulté le: 3 septembre 2022. [En ligne].
Disponible sur: https://www.ajol.info/index.php/aam/article/view/8372
[39] R. B. Nyasa, D. Zofou, H. K. Kimbi, K. M. Kum, R. C. Ngu, et
V. P. K. Titanji, « The current status of malaria epidemiology in
Bolifamba, atypical Cameroonian rainforest zone: an assessment of intervention
strategies and seasonal variations », BMC Public Health,
vol. 15, no 1, p. 1105, nov. 2015, doi:
10.1186/s12889-015-2463-1.
[40] C. Flück et al., « Strain-Specific
Humoral Response to a Polymorphic Malaria Vaccine », Infect
Immun, vol. 72, no 11, p. 6300?6305, nov. 2004, doi:
10.1128/IAI.72.11.6300-6305.2004.
[41] I. Soulama et al., « Plasmodium
falciparum genotypes diversity in symptomatic malaria of children living in an
urban and a rural setting in Burkina Faso », Malaria
Journal, vol. 8, no 1, p. 135, juin 2009, doi:
10.1186/1475-2875-8-135.
[42] W. Yavo et al., « Genetic Polymorphism of
msp1 and msp2 in Plasmodium falciparum Isolates from Côte d'Ivoire versus
Gabon », J Parasitol Res, vol. 2016, p. 3074803, 2016, doi:
10.1155/2016/3074803.
[43] M. K. Bouyou-Akotet, N. P. M'Bondoukwé, et D. P.
Mawili-Mboumba, « Genetic polymorphism of merozoite surface protein-1
in Plasmodium falciparum isolates from patients with mild to severe malaria in
Libreville, Gabon », Parasite, vol. 22, p. 12, 2015, doi:
10.1051/parasite/2015012.
[44] I. Soulama et al., « Plasmodium
falciparum genotypes diversity in symptomatic malaria of children living in an
urban and a rural setting in Burkina Faso », Malaria
Journal, vol. 8, no 1, p. 135, juin 2009, doi:
10.1186/1475-2875-8-135.
[45] A. Cortés, M. Mellombo, A. Benet, K. Lorry, L. Rare,
et J. C. Reeder, « Plasmodium falciparum: distribution of msp2
genotypes among symptomatic and asymptomatic individuals from the Wosera region
of Papua New Guinea », Exp Parasitol, vol. 106,
no 1?2, p. 22?29, févr. 2004, doi:
10.1016/j.exppara.2004.01.010.
[46] « Sequence variation in Plasmodium falciparum
merozoite surface protein-2 is associated with virulence causing severe and
cerebral malaria | PLOS ONE ». Consulté le: 7 juillet 2022.
[En ligne]. Disponible sur:
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0190418
[47] « Genetic polymorphism of merozoite surface
protein-1 in Plasmodium falciparum isolates from patients with mild to severe
malaria in Libreville, Gabon - PubMed ». Consulté le: 7
juillet 2022. [En ligne]. Disponible sur:
https://pubmed.ncbi.nlm.nih.gov/25786326/
[48] A. F. Somé et al., « Plasmodium
falciparum msp1 and msp2 genetic diversity and allele frequencies in parasites
isolated from symptomatic malaria patients in Bobo-Dioulasso, Burkina
Faso », Parasit Vectors, vol. 11, p. 323, mai 2018, doi:
10.1186/s13071-018-2895-4.
[49] S. Srisutham et al., « Genetic diversity
of three surface protein genes in Plasmodium malariae from three Asian
countries », Malar J, vol. 17, no 1, p. 24, janv.
2018, doi: 10.1186/s12936-018-2176-x.
RESUME
Notre étude portait sur la diversité
génétique et la fréquence allélique des
gènes Pfmsp 1 et 2 des isolats provenant d'enfants
asymptomatiques et symptomatiques de la région de Lastourville. Nous
avons utilisé deux marqueurs pour vérifier si une famille
allélique de Pfmsp-1 ou 2 pouvait être
spécifiquement associée aux symptômes du paludisme.
L'objectif de cette étude était de déterminer les
différents allèles associés au statut clinique chez les
enfants infectés vivant dans notre zone d'étude. Nous avons
mené une chez des enfants âgés de 6 mois à 15 ans
fébriles et non fébriles à travers leurs isolats et un
prélèvement sanguin a été effectué pour la
réalisation d'une GE / FM et /ou TDR , L'extraction de l'ADN a
été réalisé ensuite les espèces
ont été identifiées à l'aide de la PCR
nichée.,les gènes de Pfmsp1 et 2 ont été
amplifiés par réaction en PCR nichée et les produits de la
PCR ont été analysés par électrophorèse sur
un gel d'agarose à 2 %. Les allèles ont été
classés en fonction de leur poids moléculaire.
La caractérisation de la virulence avec les
marqueurs Pfmsp1 et 2, a permis de mettre en évidence un
important polymorphisme génétique au sein de ces deux
gènes .
Notre étude a donc montré une grande
diversité génétique et des fréquences
alléliques de Pfmsp1et Pfmsp2. Cependant, des
investigations supplémentaires avec des techniques plus puissantes sont
nécessaires pour mieux caractériser les parasites responsables du
paludisme dans le pays.
Mots clefs: diversité génétique,
fréquences des allèles, Pfmsp 1 et 2
ABSTRACT
Our study focused on the genetic diversity and allelic
frequency of the Pfmsp 1 and 2 genes of isolates from asymptomatic and
symptomatic children in the Lastourville region. We used two markers to test
whether a Pfmsp-1 or 2 allelic family could be specifically associated with
malaria symptoms. The objective of this study was to determine the different
alleles associated with clinical status in infected children living in our
study area. We conducted a study in febrile and non-febrile children aged 6
months to 15 years through their isolates and a blood sample was taken for the
realization of a GE / FM and / or TDR, DNA extraction was performed then the
species were identified using nested PCR., the Pfmsp1 and 2 genes were
amplified by nested PCR reaction and the PCR products were analyzed by
electrophoresis on a 2% agarose gel. The alleles were classified according to
their molecular weight.
The characterization of the virulence with the markers
Pfmsp1 and 2, made it possible to highlight an important genetic
polymorphism within these two genes.
Our study therefore showed a great genetic diversity and
allele frequencies of Pfmsp1 and Pfmsp2. However, further
investigations with more powerful techniques are needed to better characterize
the parasites responsible for malaria in the country.
Keywords: genetic diversity, allele frequencies, Pfmsp 1 and
2



