1. INTRODUCTION
Le diabète de type 2 est une des maladies non
transmissibles plus courante dans le monde entier, avec plus de 80% de ses
porteurs vivants dans le pays à faible revenu et à revenu
intermédiaire. Parmi les patients diabétiques les complications
micro vasculaires et micro vasculaires sont les plus fréquentes qui
causent la morbidité et la mortalité. L'un des facteurs
contribuant à ces complications potentielles est l'anomalie dans les
propriétés physiques et biologiques des cellules sanguines.
(February, 2016)
Le diabète de type 2, qui touche les deux sexes, concerne
les individus souvent entre 30 et 50 ans, surtout les personnes
âgées de plus de 50ans, ils sont entre eux en surpoids et les
autres en obésité. Mais les stratégies
thérapeutiques offrent une meilleure qualité de vie aux
diabétiques. La diététique se situe au premier plan des
outils thérapeutiques chez les patients atteints de diabète non
insulinodépendant ,l'objectif essentiel du traitement est d'obtenir une
perte de poids ,seul garant d'un équilibre métabolique .Il
est établi que des mesures de prévention simples permettent de
réduire la charge de morbidité de cette maladie, elles passent
par l'adoption de mode de vies sains à travers le recours à un
régime alimentaire sain, la pratique régulière d'une
activité physique, et le maintien d'un poids
normal .(OMS,2018) .
2. PROBLEMATIQUE
Malgré ces progrès de la médecine et
l'amélioration des conditions de vie, on assiste aujourd'hui à la
propagation des maladies non transmissibles (MNT), tels que les maladies
cardiovasculaires, les cancers, le diabète..., qui deviennent de plus en
plus problématiques dans de nombreux pays. Une de ces pathologies non
transmissibles est le diabète sucré, qui, selon l'OMS, est une
épidémie silencieuse à cause de son augmentation sensible
en termes de prévalence et d'incidence. Le diabète constitue un
problème de santé public majeur. On assiste au cours des
dernières décennies à une augmentation constante du nombre
de cas de diabète et de la prévalence de la maladie. Le
diabète pourrait devenir la 7 ème cause de décès
dans le monde d'ici 2030.
Le diabète sucré est une maladie chronique,
invalidante et coûteuse qui s'accompagne de graves complications. L'une
des quatre maladies non transmissibles (MNT) prioritaires identifiées
par l'OMS, reconnue comme épidémie mondiale, le diabète
inflige aujourd'hui un lourd fardeau aux systèmes de santé,
déjà fort dépourvus, de pays à bas et moyens
revenus.
A' L'échelle mondiale, on estime que 425 millions
d'adultes vivaient avec le diabète en 2018 (dont en moyenne, 10% vivent
avec un diabète de type1et 90% avec le diabète de type 2)
comparé à 108 millions en 1980(4.7 %). Ce premier rapport
mondiale de L'OMS sur le diabète souligne l'énorme ampleur du
problème de diabète ainsi que la possibilité d'inverser
les tendances actuelles (OMS 2014).
La France fait partir des pays où le taux de
diabète est assez bas. Mais en seulement 10 ans, le nombre des personnes
diabétiques est passé de 1,6 à 2,9 millions, dont 600.000
diabétiques qui s'ignorent. La prévalence actuelle de
diabète gestationnel y est estimée entre 2 et 6%. Elle est en
augmentation constante. (Passeport santé.net, Out brain 2016). Selon le
bulletin épidémiologique hebdomadaire 2009, environ 34000
décès y était liés au diabète ou à
ses complications (INVS, 2016). Actuellement, on y compte environ 3,5 millions
de diabétiques soit près de 5,3% de la population
(Santé-médecine. Journal des femmes.fr, 2018).
Au Canada on estime que près de 7% de la population est
atteinte d'une forme ou l'autre de diabète dont 10% des
diabétiques de type 1 et 90% des diabétiques de type 2. Le
diabète gestationnel touche de 6 à 8% des femmes enceintes. Dans
90% des cas, il disparait peu de temps après l'accouchement mais, dans
plus de 50% des cas, la femme ayant connu un épisode de diabète
gestationnel développera le diabète de type 2 quelques
années plus tard (Fédération canadienne chargée de
diabète 2020).
En Chine, une augmentation de 104% est prévue, le Canada
devrait connaitre la deuxième augmentation la plus importante des pays
analysés, avec 77%, même s'il ne comptait que deux millions de
diabétiques en 2000 (OMS, 2015).
En Afrique, la prévalence du diabète semble varier
entre 1% à l'Ouest et 3% au Maghreb. Ces chiffres restent
inférieurs à ceux de l'Europe et de l'Amérique du Nord qui
se situent entre 2-3%, mais des chiffres fiables manquent pour l'Afrique noire,
mais dans les villes, la prévalence est certainement supérieure
à 2% (SAUVENET, 2019).
Le continent Africain « doit faire de la prise en charge du
diabète, une priorité de santé publique au même
titre que le SIDA, la tuberculose et le paludisme » comme dans les pays
riches, le nombre des personnes avec surpoids ou obèses explose de sept
millions en 2003 à 15 millions en 2005 (OMS, 2016). Le diabète
sucré (insuline dépendant et non insuline dépendant ou
type 1 et type 2) constitue une source d'inquiétude grandissante pour
les pays en développement. Il faut l'évaluation de la
qualité de soins en vue d'améliorer de façon continue les
soins de santé dispensés aux diabétiques (SAUVENET,
2016).
La R.D.C compte environ 800000 diabétiques, soit 7
à 8% de sa population, selon les statistiques du programme national de
lutte contre le diabète. Le responsable de cette structure Dr MPOYI
Muteba parle de deux sortes de diabètes : celui du type1, qui
essentiellement héréditaire dû, précise le
médecin, à la destruction pancréas ; et celui du
type2, qu'on peut éviter dans 80% des cas, et qui est causé par
une mauvaise alimentation. C'est ce type qui est prédominant en
République démocratique du Congo 85% contre 15% pour le type
1.
En R.D.C, la prévalence du diabète sucré est
de 35.5% et le taux de mortalité en milieu hospitalier rural est de 12%.
En effet, la R.D.C est un pays post-conflit où la
dégradation du tissu socio-économique ne permet pas une prise en
charge correcte de cette maladie très couteuse en termes de soins.
D'autre part, selon la Banquier Africaine de Développement la R.D.C,
malgré ses immenses potentialités reste un des pays les plus
pauvres du monde. En province Orientale, la ville de Kinshasa ne font pas
exception, la grande partie de la population n'a pas accès aux soins
dans les hôpitaux. Les données disponibles en rapport avec la
morbi-mortalité soient peu connues.
Dans la province du Haut-Katanga, plus précisément
dans la ville de Lubumbashi, on estime la prévenance hospitalière
est de 5% et un taux de mortalité de 27,5%. Dans la ville de Lubumbashi,
le niveau de dépistage du diabète sucré s'est
avéré plutôt faible. Quant à la prise en charge des
malades, le problème se pose pour les facteurs de risque comme
l'obésité, hypertension, les antécédents familiaux
et le vieillissement. Tous ces facteurs sont associés au diabète
de type 2 (Marcellin bugeme, 2014).
3. QUESTION DE RECHERCHE
Partant de ces constants, la présente étude se
propose de répondre à la question suivante :
ü Quelles seraient les caractéristiques
socio-sanitaires associées au diabète de type II au Centre de
Diabétologie Mellitus/CEDIA de Lubumbashi ?
4. HYPOTHESES
Le diabète de type II est devenue une
réalité dans les milieux urbains par son ampleur et sa
complexité sur la vie des adultes et les adolescents dont les causes
sont les prestiges.
Nous pensons que, l'alimentation, la sédentarité,
les antécédents familiaux, la génétique, le stress,
le mode de vie et les maladies du pancréas influencent beaucoup le
diabète de type II dans la Ville de Lubumbashi.
5. CHOIX ET INTERRET DU SUJET
a. Choix
Plusieurs raisons nous ont poussés à nous
intéresser au problème de diabète de type II dans la
ville de Lubumbashi, Cependant, lors de nos pratiques sur terrain de stage,
nous avons de plus en plus constaté que, la fréquence de
Diabète de type 2 prend une ampleur et progresse dans notre milieu
d'étude ; ce qui nous fait croire que malgré les
interventions qui s'implique pour réduire le taux de Diabète dans
le Haut-Katanga/ville de Lubumbashi , cette affection reste et demeure toujours
un problème dans notre milieu et aussi plusieurs études
consultées ainsi que les différents rapports du Bureau central
publié sur cette pathologie montrent toujours la prévalence
élevée.
b.Intérêt
· Intérêt personnel :
Cette étude nous aidera à approfondir nos connaissances sur cette
pathologie, sa prise en charge sur le plan Nutritionnel et Médical et
aussi de prévenir l'évolution de ses complications qui alternent
l'organisme.
· Intérêt Scientifique :
cette étude pourrait servir comme source de documentations pour les
autres chercheurs qui viendront après nous et procurer des informations
qui peuvent se révéler indispensable pour effectuer les
recherches ultérieures. Il servira encore à interpeler la
conscience de Nutritionniste-Diététiciens et les autres
personnels de Santé d'assurer une bonne prise en charge de
Diabète de type 2 afin de sauver la vie de la population et d'en assurer
la prophylaxie.
· Intérêt social : Du point de
vue social, cette étude est intéressante afin de donner la
lumière à la population sur les effets néfastes de
Diabète de type 2 qui aboutit à plusieurs complications pour
toute la vie et aussi aux Diabétiques de respecter et pratiquer leur
régime alimentaire normalement.
6. OBJECTIFS
a. ObjectifGénéral
Cette étude a pour objectif de déterminer les
caractéristiques socio-sanitaires associées au diabète de
type II au Centre de Diabétologie Mellitus/CEDIA de Lubumbashi.
b. Objectifs Spécifiques
Pour atteindre le but poursuivi de cette étude, nous nous
sommes fixés les objectifs suivants :
· Identifier leurs caractéristiques
sociodémographiques ;
· Connaitre leur poids moyen ;
· Déterminer les types de traitements ;
· Vérifier le respect de traitement nutritionnel chez
les diabétiques ;
· Proposer des actions correctrices.
7. SUBDIVISION DU TRAVAIL
Hormis l'introduction, les suggestions et la conclusion, Notre
travail comprend deux grandes parties :
· L'Approche théorique qui traite sur la Recension
des écrits pertinents ;
· L'Approche pratique constituée de trois chapitres
:
§ Le premier chapitre est consacré à la
méthodologie de recherché ;
§ Le deuxième chapitre celui de la
présentation des résultats ;
§ Le troisième chapitre parlera des discussions.
CHAPITRE PREMIER : RECENSION DES ECRITS
I.1.DEFINITION DES CONCEPTS
I.1.1. ETUDE :
C'est un approfondissement de connaissances sur un sujet
quelconque. Effort intellectuel orienté vers l'observation et la
compréhension des êtres, des choses et des
événements (LAROUSSE, 2018).
I.1.2. CARACTERRISTIQUES :
C'est un signe distinctif, un trait particulier permettant
d'identifier un personnage. Propriété morphologique,
physiologique, voir comportementale d'un organisme (DICTIONNAIRE MEDICAL,
2020).
I.1.3. ASSOCIEES :
Ce terme est un participe passé féminin pluriel du
verbe associé qui veut dire avoir une liaison.
I.1.4. DIABETE DE TYPE II :
Est une maladie caractérisée par une
hyperglycémie chronique, c'est-à-dire par un taux trop
élevé de glucose dans le sang. (LEXIQUE MEDICAL, 2O28)
I.2. GENERALITRES SUR LE DIABETE DE TYPE II
Le diabète de type 2 (également appelé
« diabète non insulinodépendant » (DNID) ou «
diabète gras »), plus fréquent que celui de type 1, touche
essentiellement les personnes de plus de 35 ans. Cette maladie est grave par
ses complications, notamment sur le coeur, les vaisseaux sanguins, les reins et
les nerfs. Sa prise en charge repose sur des mesures
hygiéno-diététiques (alimentation équilibrée
et activité physique), ainsi que sur des traitements
médicamenteux. Ses symptômes peuvent similaires à ceux du
diabète de type 1, mais sont souvent moins marqués. De ce
fait, la maladie peut être diagnostiquée plusieurs années
après son apparition, une fois les complications déjà
présentes (FID, 2014).
L'insuline c'est une hormone essentielle à la
régulation de la glycémie, est normalement produite par des
cellules spécialisées du pancréas : les cellules ß
des îlots de Langerhans.
Son rôle est d'assurer le transport du glucose depuis la
circulation sanguine vers les muscles, le foie ou le tissu adipeux. Le
déficit en insuline ou l'incapacité des cellules de l'organisme
à y répondre correctement, se traduit par une
élévation prolongée de la concentration de glucose dans le
sang. (Hau ,2010).
Il est aujourd'hui généralement admis qu'il existe
trois grands types de diabète :
§ Le diabète de type 1 : l'organisme ne produit plus
assez d'insuline.
§ Le diabète de type 2 : l'organisme n'utilise pas
correctement l'insuline produite.
§ Le diabète gestationnel : l'hyperglycémie se
déclare pendant la grossesse (OMS,2019)
Les différents types de diabète
|
DIABÈTE DE TYPE 1
|
DIABÈTE DE TYPE 2
|
|
Antécédents familiaux de même type
|
Rares
|
Fréquents
|
|
Age de survenue
|
Souvent avant 35 ans
|
Souvent à partir de 40 ans
|
|
Démarrage
|
Rapide et brutal
|
Lent et insidieux
|
|
Symptomatologie
|
Bruyante
|
Pauvre voire absente
|
|
Corpulence
|
Normale ou maigre
|
Surcharge pondérale, obésité
|
|
Hyperglycémie au diagnostic
|
Majeure (>3g/L)
|
Souvent <2g/L
|
|
Cétose
|
Souvent présente
|
Souvent absente
|
|
Principale cause de mortalité
|
Insuffisance rénale
|
Maladies cardiovasculaires
|
|
Etiologie
|
Facteurs immunologiques et environnementaux
|
Facteurs génétiques, nutritionnels,
sédentarités, et antécédents familiaux
|
|
Fréquence
|
5-10 %
|
90 %
|
Tableau 1 : Caractéristiques respectives des
diabètes de type 1 et 2
1. ETHIOLOGIES DE DIABÈTE GRAS
Il n'existe pas une cause précise mais c'est la
combinaison de plusieurs facteurs qui entraîne l'apparition de la
maladie. (Ékoé J, 2018).
2. FACTEURS FAVORISANTS OU DE RISQUES
Ces facteurs peuvent troubler l'équilibre
glycémique et être également à l'origine de
complications du diabète, touchant notamment les artères et les
vaisseaux sanguins et pouvant ainsi être à l'origine de
pathologies comme l'hypertension artérielle ou les maladies
cardiovasculaires. Cependant, il est possible de contrôler efficacement
ces facteurs de risque, en modifiant ses habitudes de vie et/ou par des
traitements médicamenteux adaptés (FID, 2020). Parmi les facteurs
de risque sur lesquels on peut agir :
A. FACTEURS GÉNÉTIQUES
Prédispositions familiales avec un parent du premier
degré (mère, père, frère et soeur) atteint de
diabète de type 2, mais également des populations
particulièrement touchées par la maladie, notamment les personnes
d'origine Africaine, Latino-Américaine, Amérindienne et
asiatique. (Philippe J, 2012)
B. ÂGE :
Le risque augmente à mesure que l'on vieillit ; Sur un
plan physiopathologique, l'augmentation progressive de
l'insulinorésistance avec l'âge est supposée
consécutive à l'augmentation de l'adiposité abdominale et
à l'accumulation des déséquilibres du mode de vie
(alimentation, sédentarité) (Beltrand J et Al,2016).
C. La SÉDENTARITÉ
Qui favorise la survenue de l'obésité et donc du
diabète, se caractérise par une très faible dépense
énergétique. Son niveau journalier correspond au temps
cumulé que vous passez en position assise : ordinateur,
télévision, tablette ou jeux vidéo. Le temps journalier de
sédentarité devient néfaste pour la santé quand il
dépasse régulièrement 7 à 8 heures. (Haute
Autorité de Santé, 2020).
D.LE TABAGISME :
En cours ou interrompu depuis moins de 3 ans. En plus
d'entraîner des cancers et d'altérer la circulation sanguine par
une atteinte des artères, fumer augmente également le risque de
survenue d'un diabète de type 2 de 37 à 44%. Il majore
l'insulinorésistance, même en cas de tabagisme passif. Plus encore
que pour l'ensemble de la population, le tabac favorise l'installation de
l'athérosclérose, et il augmente le risque d'infarctus du
myocarde, d'accident vasculaire cérébral, d'artérite des
membres inférieurs et de décès. Enfin, il est
également néfaste pour les reins et les yeux, favorisant la
progression de la néphropathie et de la rétinopathie
diabétique. (Fédération internationale des
Diabétiques, 2009).
E. LE SURPOIDS et L'OBÉSITÉ :
Sont les conséquences directes d'une alimentation
déséquilibrée, riche en sucre et en graisses et d'un
manque d'activité physique régulière. L'excès de
graisses au niveau de la taille et du ventre mesuré par le tour de
taille, est un bon indicateur de l'importance de l'insulinorésistance et
augmente significativement le risque cardiovasculaire (Binaut R, 2021).
F.LA DYSLIPIDÉMIE :
Une anomalie des lipides dans le sang existe chez la plupart des
patients diabétiques de type 2 dès le moment du diagnostic.
L'augmentation du LDL cholestérol est particulièrement
néfaste. Il s'agit du « mauvais cholestérol » qui
s'oppose au HDL cholestérol dénommé le « bon
cholestérol ». Une élévation des triglycérides
est fréquemment associée (Sandrine, 2018).
G. LE MICROBIOTE INTESTINAL :
Qui dépend de prédispositions
génétiques et qui est très sensible au mode de vie de son
hôte pourrait constituer à lui seul un facteur de risque, on parle
de signature de micro biote de patient diabétique. Tout comme la
nourriture, le stress et les médicaments déséquilibre
également votre micro biote intestinal (Binaut R, 2021).
3. PHYSIOPATHOLOGIE
Le développement du diabète de type 2 se fait
très progressivement et insidieusement sur de nombreuses années
en 3 étapes :
Ø Tout d'abord, les cellules de l'organisme deviennent
résistantes à l'insuline. Cette résistance est normale
avec l'âge mais elle est aggravée par l'excès de tissus
gras en cas de surpoids et d'obésité. À ce stade, on parle
d'insulino-résistance ;
Ø L'organisme tente alors de s'adapter et, dans un premier
temps, il augmente la production d'insuline par le pancréas. On parle
alors d'hyperinsulinisme ;
Ø Après plusieurs années (10 à 20
ans), le pancréas s'épuise et ne peut plus sécréter
suffisamment d'insuline pour réguler le taux de sucre dans le sang ;
c'est le stade d'insulino-déficience (Institut national de la
santé et de la recherche médicale, 2014).
Ces deux grands mécanismes en cause,
insulino-résistance et insulino-déficience, vont continuer
à évoluer tout au long de la vie du patient, de sorte que
celui-ci voit sa pathologie en constante dégradation.
4. SYMPTÔMES
Le diabète de type 2 évolue souvent en silence
(sans aucun symptôme) pendant plusieurs années, car la
glycémie augmente très progressivement. Le plus souvent, le
diagnostic est fait par hasard, à l'occasion d'une analyse de sang ou
lors d'un dépistage du diabète. Des symptômes existent
parfois et sont susceptibles de vous alerter. Ils peuvent apparaître
progressivement, après plusieurs années d'évolution.
(Fédération internationale des Diabétiques, 2014) :
· Polyurie
La polyurie correspond à une augmentation du volume des
urines. Le diabète se traduisant par une quantité de glucose trop
importante dans le sang, celui-ci est filtré par les reins et le glucose
est éliminé dans les urines. Pour accompagner ce passage de
glucose, de l'eau est également éliminée.
· Polydipsie
La polydipsie est une augmentation de la soif. Elle est la
conséquence directe de la polyurie. Le corps cherche à compenser
les sorties d'eau dans les urines.
· Polyphagie
La polyphagie se traduit par une forte augmentation de la faim.
En cas de diabète, l'insuline est insuffisante ou ne remplit plus sa
fonction : le glucose n'alimente plus les cellules. Ces dernières
envoient donc un signal au cerveau leur indiquant qu'elles sont en état
de jeûne et qu'elles ont besoin d'une recharge en glucose.
· Une grande fatigue (asthénie) ;
· La vision trouble,
· Des douleurs abdominales,
· Des crampes nocturnes,
· Des infections, notamment des muqueuses (gencives, vessie,
vagin, vulve, pénis) ;
· La peau est sèche et gratte ;
· Douleurs thoraciques ;
· Troubles urinaires (infection urinaire) et
· Des démangeaisons au niveau des organes
génitaux.
5. DIAGNOSTIC
Il est important de dépister le diabète de type 2
pour le traiter le plus tôt possible. Cette pathologie longtemps
asymptomatique présente comme risque majeur de voir évoluer
à bas bruit des complications souvent décelées trop tard.
Le diagnostic est souvent posé lors de l'apparition de complications
dégénératives microangiopathiques (rétinopathie,
protéinurie, insuffisance rénale) ou macroangiopathiques (HTA,
accidents cardiovasculaires), décelées à l'occasion d'un
examen de santé pratiqué à titre systématique
(recherche de glycosurie dans le cadre de la médecine du travail,
glycémie systématique ou chez un sujet à risque). Des
complications infectieuses récidivantes ou sévères peuvent
également révéler l'existence d'un diabète
(infections urinaires, génitales, dentaires). Il est désormais
recommandé selon l'HAS, de dépister un diabète de type 2
chez les patients asymptomatiques de plus de 45 ans qui présentent au
moins une des caractéristiques suivantes (OMS, 2016) :
v Un surpoids ou une obésité ;
v Antécédent de diabète familial au premier
degré ;
v Origine géographique non caucasienne ou
migrante ;
v Femmes avec antécédents de diabète
gestationnel ou naissance d'un enfant pesant plus de 4 kg ;
v Sédentarité (activité physique
inférieure à 30 minutes 3 fois par semaine) ;
v Hypertension artérielle traitée ou non (pression
artérielle > 140/90 mmHg) ;
v Dyslipidémie traitée ou non (HDLc< 0,35 g/L ou
triglycéridémie> 2g/L) ;
v Traitement médicamenteux pouvant induire un
diabète (antipsychotiques atypiques, corticoïdes...) ;
v Situation pré diabétique : glycémie
à jeun comprise entre 1,1 g/L et 1,26 g/L ;
v Situation de précarité déterminée
par un score de précarité EPICES > 30.
Le test de dépistage biologique du diabète de type
2 de référence est la mesure de la glycémie veineuse
après un jeûne de 8h, au sein des populations cibles
asymptomatiques.
Selon le parcours de soins établit par l'HAS en 2014, le
dépistage du diabète de type 2 doit être renouvelé
:
· Tous les 3 ans en cas de résultat
négatif ;
· Entre 1 et 3 ans si la glycémie veineuse
à jeun est < 1,10 g/l mais que le sujet présente plusieurs
facteurs de risque du diabète ;
· Tous les ans pour les sujets ayant un pré
diabète (la glycémie veineuse à jeun est comprise entre
1,10 et 1,25 g/l).
Il existe des situations urgentes qui doivent interpeller sur la
présence d'un état diabétique (HAS, 2017) :
· Le patient présente des symptômes
cliniques d'hyperglycémie (syndrome cardinal) sans cétose ou une
complication du diabète ;
· Le patient présente un syndrome cardinal avec
cétose > 1,5 mmol/l ou signes de cétoacidose (nausées,
vomissements, douleurs abdominales, polypnée). Le diabète est une
maladie chronique nécessitant l'adhésion du patient pour une
prise en charge optimale (alliance thérapeutique). Pour ce faire, il est
actuellement recommandé d'utiliser une approche centrée sur le
patient. Le bilan de santé de routine est la première source de
dépistage du diabète de type 2.
L'objectif de la prise en charge d'un sujet diabétique
nouvellement diagnostiqué est double (Drouin P.et Al, 2012) :
· Rechercher les complications liées au
diabète étant donné que le début de la maladie est
souvent méconnu et que les complications peuvent être
présentes dès le diagnostic ;
· Rechercher les comorbidités pouvant aggraver le
pronostic, étant donné que ces pathologies concomitantes peuvent
accélérer l'installation des complications. Dans tous
les cas, il est important de rechercher et de contrôler les facteurs de
risques cardiovasculaires associés et modifiables comme le tabac, la
dyslipidémie, l'hypertension artérielle.
Le dépistage du diabète de type 2 requiert
l'utilisation de matériel spécifique (Simon D, 2008) :
? Auto piqueur et lancettes : Ils permettent de prélever
une goutte de sang, Il est préférable d'utiliser des autos
piqueuses jetables afin d'éviter tout risque de contamination
croisée. Ceux-ci comportent une lancette incorporée ;
? Lecteur de glycémie et bandelettes : La goutte de sang
prélevée au moyen de l'auto piqueur est analysée par le
lecteur de glycémie grâce à une bandelette
réactive.
Le dépistage du diabète à l'officine permet
d'informer, de faire prendre conscience d'une situation à risque mais
aussi, et surtout, de parler des moyens dont dispose le patient pour
prévenir l'apparition de cette pathologie ou éviter ses
complications.
6. EVOLUTION :
Le diabète de type 2 évolue naturellement en 3
étapes (HAS ; 2014) :
- Une étape de pré-diabète qui se
caractérise par des anomalies de la glycorégulation avec une
glycémie à jeun supérieure à la normale mais
inférieure à 1,26 g/l [7,0 mmol/l] ;
- Une phase infra clinique asymptomatique, relativement longue
(=10 ans) ;
-Une phase clinique avec symptômes et complications
chroniques.
7. COMPLICATIONS
7.1.Complications aigües
a.L'hypoglycémie
C'est une complication fréquente et
désagréable survenant le plus souvent chez les diabétiques
de type 1 et qui peut, dans de rares cas, engager le pronostic vital du patient
en provoquant un coma hypoglycémique. Le diagnostic de
l'hypoglycémie se base sur la triade de Whipple (SFE, 2013) :
·Glycémie veineuse basse ;
·Signes de neuroglucopénie (carence en glucose au
niveau du système nerveux) ;
·Correction des symptômes lors de la normalisation
de la glycémie.
Le seuil glycémique retenu pour conclure à une
hypoglycémie est une glycémie veineuse < 0,7 g/L ou < 4
mmol/L) (GERMAN C et al, 2013). L'hypoglycémie se caractérise par
des signes cliniques de neuroglucopénie (GERMAN C et al, 2014) :
· Périphériques : mains moites, sueurs,
pâleur, angoisse, faim brutale, crampes, tachycardie, palpitations,
tremblements, asthénie ...
· Centraux : trouble de la conscience, de la vision,
difficulté de concentration, trouble du langage, troubles moteurs,
troubles du comportement ...
Sa survenue peut être consécutive à une
alimentation inadaptée, la consommation d'alcool, une activité
physique intense ou inhabituelle, une insuffisance rénale ou
hépatique ou encore par la prise de médicaments
hypoglycémiants (insuline mal dosée, sulfamides
hypoglycémiants et glinides) (AMIEL S.A ,2000).Lorsque le patient
est conscient, le traitement de l'hypoglycémie consiste à
ingérer immédiatement du sucre rapide par voie orale : 3
carrés de sucre ou 2 cuillères à soupe de miel ou de
confiture (à consommer seuls pour exercer leur effet
hyperglycémiant) (BOLES JM, 2010).
b.L'acidocétose
L'acidocétose diabétique est une des complications
aigües les plus sévères du diabète, pouvant aboutir
au coma voire à la mort du patient : elle constitue une urgence
médicale.Elle survient essentiellement chez les diabétiques de
type 1 (> 90%) mais aussi chez les diabétiques de type 2 en situation
de stress biologique ou insulinoréquérent. Conséquence
d'une carence profonde en insuline, elle induit une accumulation de substances
chimiques toxiques pour l'organisme, les corps cétoniques, qui vont
être responsables d'une acidification métabolique (baisse du pH
sanguin) à l'origine des signes cliniques (DORCHY et al, 2010).
Le diagnostic est posé en cas d'hyperglycémie
marquée (> 2,55 g/L) associée à une cétonurie et
une glycosurie (présence de corps cétoniques et de glucose dans
les urines) (SFE, 2016).
On distingue 3 stades successifs : (CACHOT V et al,
2008) :
· La cétose : présence de corps
cétoniques dans le sang et les urines ;
· L'acidocétose : cétose entrainant une baisse
du pH (< 7,30) ou du bicarbonate (< 15 mmol/L) ;
· Le coma acidocétosique : acidocétose
accompagnée de troubles de la conscience.
Lors de la cétose, les premiers symptômes qui vont
apparaître sont une polyurie, une polydipsie, un amaigrissement rapide,
des crampes nocturnes, des nausées et des vomissements provoquant une
perte d'appétit ainsi que des douleurs abdominales intenses. Quand
l'acidocétose diabétique devient sévère, des signes
d'hyperventilation et de détresse respiratoire (dyspnée de
Kussmaul) se manifestent chez le patient, il se déshydrate et son
haleine prend une odeur caractéristique d'acétone qui se
rapproche de l'arôme de la pomme (CACHOT V et al, 2008).
Le traitement préventif consiste à établir,
en cas de cétose, des règles éducatives pour le patient
(maintien des injections même si inappétence, supplément en
insuline rapide, recherche de corps cétoniques à la bandelette
urinaire). Le traitement curatif, une fois que l'acidocétose
diabétique est installée, requiert une hospitalisation du patient
et repose sur l'injection à la seringue électrique d'insuline
rapide par voie intraveineuse, associée à une
réhydratation pour restaurer l'équilibre hydro
électrolytique du patient (SFE, 2016).
c.Le coma hyperosmolaire
Le coma hyperosmolaire, forme grave de décompensation du
diabète, survient majoritairement chez le sujet âgé atteint
de diabète de type 2. Malgré une prise en charge adaptée,
la mortalité du coma hyperosmolaire reste encore élevée :
entre 20 et 40% en raison des complications et du terrain largement
dominé par les sujets âgés (Carlier A. et al, 2018).Il
survient en général suite à une cause déclenchante,
le plus souvent une infection mais aussi les diarrhées et vomissements,
venant aggraver une mauvaise accessibilité aux boissons (maisons de
retraite, état de démence ...). Au niveau médicamenteux,
les diurétiques et les corticoïdes peuvent êtres des facteurs
déclenchant. (Orban J., 2008)
L'absence des signes de cétose, notamment l'haleine
cétonique et d'acidose métabolique (pas de dyspnée de
Kussmaul) permet de différencier le coma hyperosmolaire du coma
acidocétosique.
Le diagnostic biologique du coma hyperosmolaire s'établit
en cas d'une : (SFE, 2016)
· Hyperglycémie importante (= 6 g/L) ;
· Profonde déshydratation avec hyperosmolalité
plasmatique (> 350 mOsm/kg) ;
· Absence d'acidose et de cétonémie.
Sa prise en charge nécessite une hospitalisation d'urgence
avec 2 objectifs (PETER V. et al, 2018) :
· La correction rapide de la déshydratation à
l'aide de solutés de réhydratation orale (NaCl 0,9% puis G
2,5%) ;
· La réduction de l'hyperglycémie par
l'administration d'insuline
d.L'acidose lactique
L'acidose lactique est définie par un tableau clinique et
métabolique d'acidose sévère consécutif à
une accumulation d'acides lactiques dans l'organisme. C'est une complication
rare mais de pronostic sévère avec une mortalité
évaluée à 50%. Elle survient le plus souvent chez un
diabétique âgé de type 2 traités par metformine
(biguanides) sans respect des contre-indications de ce médicament et
plus rarement suite à l'absorption excessive de cet
antidiabétique oral (ORBAN et al, 2003).
L'acidose lactique dépend de différents facteurs,
mais l'insuffisance rénale est le facteur le plus souvent
retrouvé ; elle entraine une accumulation de metformine normalement
éliminée dans les urines. Les autres causes peuvent être
l'insuffisance hépatique, l'insuffisance cardiaque ou respiratoire
sévère, voire l'alcoolisme. En effet, l'alcool majore les effets
de la metformine sur la glycémie entrainant une hausse de la
lactatémie (TAMION F., 2009).
·Une acidose métabolique organique avec un pH
< 7,35 ;
·Une hyperlactatémie> 5 mmol/L des troubles
digestifs (nausées, vomissements, diarrhées) ainsi que de vives
douleurs abdominales et thoraciques (PILLON et al, 2013).
7.2.Complications chroniques
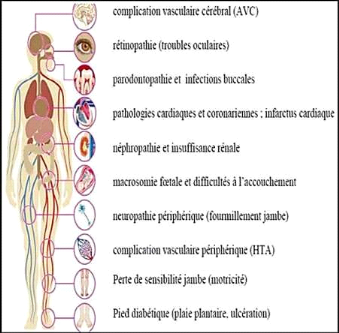
Figure 1 : Localisation des différentes
complications micro et macro angiopathiques associées au diabète
de type 2 (Jolio, 2014).
a.Micro angiopathies
Les micros angiopathies sont des complications spécifiques
du diabète qui regroupent les atteintes des petits vaisseaux sanguins de
l'oeil (rétinopathie), du rein (néphropathie) et du
système nerveux (néphropathie). Elles peuvent causer des troubles
de la vision jusqu'à la cécité, une insuffisance
rénale, ou encore des lésions nerveuses. Les micros
angiopathies sont précédées par des années
d'hyperglycémie chronique qui vont progressivement provoquer une
altération des parois des capillaires à l'origine des signes
cliniques (RACCAHD., 2003).
Leur apparition va dépendre de la durée du
diabète et de l'intensité de l'hyperglycémie.
L'hypertension artérielle, et plus globalement les facteurs de risque
cardiovasculaire (surpoids, augmentation des taux de lipides sanguins,
tabagisme) peuvent aussi constituer des facteurs d'aggravation des micros
angiopathies (LERMUSIAUX ,2006).
Un bon équilibre de l'hémoglobine glyquée
(HbA1C), le traitement de l'hypertension artérielle et la mise en place
de mesures hygiéno-diététiques vont limiter le risque
d'apparition des micros angiopathies et en retarder l'aggravation. Il n'y a
cependant pas de seuil d'HbA1c au-dessous duquel il n'existe aucun risque de
complications du diabète. (Larger E., 2019)
1.La rétinopathie diabétique
La rétinopathie diabétique est la première
cause de cécité avant l'âge de 50 ans. Elle est la
conséquence d'une atteinte des petits vaisseaux sanguins capillaires de
la rétine lorsque le diabète est mal équilibré
(HbA1c trop élevée) depuis plus de 10 ans.Certains facteurs
peuvent l'aggraver, notamment l'hypertension artérielle mais aussi la
grossesse, les fluctuations brutales de la glycémie et la puberté
(Delyfer M., 2018).
La rétinopathie diabétique se développe
silencieusement jusqu'à provoquer une baisse de l'acuité
visuelle, témoin d'un état déjà bien avancé.
Il est donc essentiel d'éduquer le patient diabétique sur
l'importance de réaliser un examen annuel systématique du fond
d'oeil. L'examen ophtalmologique doit être complet, car,
indépendamment de la rétinopathie, le diabète s'accompagne
d'unefréquence accrue de cataracte et de glaucome (FOUGERE, 2019).
Au-delà des effets sur la qualité de vie et
l'autonomie des patients, une telle baisse de vision peut augmenter le nombre
de chutes, de fractures, de plaies et de troubles de la cicatrisation et donc
avoir des conséquences sur la morbi-mortalité (Gallice M.et al,
2016).
Les mesures préventives consistent à maintenir un
équilibre glycémique et tensionnelle correct. Le traitement de la
rétinopathie diabétique repose sur la technique de photo
coagulation au laser. Il a pour but de sauvegarder la vision menacée en
retardant la survenue d'accidents graves, mais ne guérit pas les
lésions rétiniennes (MASSIN, 2018).
2. La néphropathie diabétique
La néphropathie diabétique est la complication
dégénérative la plus grave des micro angiopathies car elle
engage le pronostic vital du patient.Le diabète est la première
cause d'insuffisance rénale dans les pays industrialisés. Son
diagnostic confère d'emblée un risque cardiovasculaire
élevé : la présence d'une néphropathie multiplie
par 3 à 4 le risque cardiovasculaire chez les diabétiques de type
2 et elle est souvent associée à une augmentation de la pression
artérielle. Comme pour la rétinopathie diabétique,
l'atteinte rénale est silencieuse et asymptomatique, d'où
l'importance d'un dépistage annuel récure (ROUSSEL R, 2011). La
néphropathie diabétique est due à l'atteinte des petits
vaisseaux des glomérules du rein, causée par
l'hyperglycémie chronique.
La première manifestation biologique décelable de
la néphropathie diabétique est une augmentation de l'albumine
dans les urines, d'abord très infime (micro albuminurie : 30 à
300 mg/24 heures), puis plus importante (protéinurie > 300 mg/24
heures) avec une diminution progressive de la capacité du rein à
filtrer (stade d'insuffisance rénale) qui peut aboutir à la
dialyse (stade d'insuffisance rénale chronique terminale). Ce traitement
est très contraignant, les séances de dialyse durent plusieurs
heures et sont répétées plusieurs fois par semaine. Quand
l'atteinte rénale devient trop importante, la dernière
alternative thérapeutique repose sur la greffe de rein (BURON F.,
2017).
Concernant le dépistage de l'insuffisance rénale
chez le diabétique (Rigalleau,2011) :
Il convient de pratiquer 1 fois par an, chez le diabétique
de type 2, la recherche d'une protéinurie par la bandelette urinaire
standard.
·Il convient de mesurer 1 fois par an la micro
albuminurie, si le test par la bandelette urinaire standard est
négatif.
|
Stade 1 :
|
|
|
|
|
|
Hypertrophie rénale,
Hyper filtration glomérulaire
|
Stade 2 :
Phase silencieuse
|
Stade 3 :
Néphropathie incipiens
|
Stade 4 :
Néphropathie
|
Stade 5 :
Insuffisance rénale
|
|
Années après le
|
|
|
|
|
|
|
Diagnostic
|
1
|
2 à 6
|
7 à 15
|
15 à 20
|
20 à 30
|
|
Albuminurie
|
Normale
|
Normale
|
Microalbuminurie
|
Protéinurie
|
Protéinurie massive
|
|
Pression artérielle
|
Normale
|
Normale
|
Légèrement augmentée
|
Souvent élevée
|
Souvent élevée
|
|
Filtration glomérulaire
|
Elevée de
20 %
|
Elevée à normale
|
Normale ou légèrement basse
|
Baisse de 10mL/min/an
|
Basse à effondrée
|
Tableau 2 : Classification des néphropathies
diabétiques (SFE, 2016)
Le diagnostic de la néphropathie diabétique est
histologique. Cependant, la ponction-biopsie rénale est rarement
pratiquée car invasive.En présence d'une rétinopathie
ainsi qu'une excrétion urinaire d'albumine augmentée de
façon répétée et progressivement croissante, on
retiendra le diagnostic de néphropathie diabétique (BINAUT R.et
al, 2014).
La prise en charge de la néphropathie diabétique
s'appuie sur un bon équilibre du diabète avec (GUEUTIN V.,
2016) :
· Le contrôle de la glycémie : HbA1c < 6,5
% ;
· Le contrôle de la pression artérielle <
130/80 mmHg ;
· L'utilisation d'inhibiteurs de l'enzyme de conversion IEC
(diabétiques de type 1) ou de sartans (diabétiques de type 2)
dont l'efficacité est démontrée sur la micro
albuminurie ;
· La prévention des risques cardiovasculaires tels
que le tabac, le surpoids et la sédentarité ;
· Un régime alimentaire sans sel pour lutter contre
l'hypertension artérielle ainsi qu'un apport limité en
protéines (un excès de protéines augmente le travail du
rein).
3. La neuropathie diabétique
La neuropathie diabétique est la forme de neuropathie la
plus fréquente des pays occidentaux. C'est une complication plutôt
tardive, elle touche la plupart des malades après 15 ou 20 ans de
diabète. Il existe différents facteurs de risque de la
neuropathie diabétique. Les deux principaux facteurs sont : la
durée du diabète (on estime sa prévalence à 50 %
chez les diabétiques dont la maladie évolue depuis plus de 20
ans) et le mauvais équilibre glycémique du diabète (TOTH
C. et al, 2003).
D'autres facteurs de susceptibilité individuelle
interviennent également, parmi eux : (Nejmeddine K.et al,
2020) :
· L'âge, la majorité des neuropathies
diabétiques surviennent après l'âge de 50 ans ;
· Le sexe masculin ;
· La grande taille (en raison de la longueur des fibres
nerveuses) ;
· Un tabagisme ou un alcoolisme associé ;
· Des facteurs nutritionnels (carences vitaminiques,
dénutrition) ;
· L'hérédité peut augmenter le risque
de survenue des neuropathies.
Le diagnostic de la neuropathie diabétique repose sur
l'examen clinique, en particulier l'interrogatoire qui se base sur le
questionnaire DN4. C'est un outil simple dont le but est de rechercher la
présence de douleurs neuropathies chez le patient. D'autres
critères moins spécifiques comme les plaintes fonctionnelles dues
aux troubles du transit ou la dysfonction érectile sont à prendre
en considération.
L'examen des pieds à l'aide d'un test au mono filament est
systématique. Il s'agit d'un fil de nylon rigide que l'on applique en
appuyant doucement jusqu'à ce qu'il se plie, sur la face plantaire des
pieds. On évalue ensuite le résultat en fonction du nombre
d'applications détectées par le patient. De plus, un ECG est
réalisé annuellement au minimum chez tout diabétique. (GIN
H., 2002) Le respect strict de l'équilibre glycémique du
diabète reste à l'heure actuelle le seul traitement
préventif spécifique de la neuropathie réellement efficace
car l'hyperglycémie abaisse le seuil de la perception douloureuse.
L'arrêt de la consommation éventuelle de tabac et d'alcool ainsi
que la supplémentation en vitamine B permet de réduire les
risques d'apparition ou d'aggravation des complications neuropathiques. Le
traitement symptomatique des douleurs neuropathiques passe par l'utilisation
d'antalgiques classiques mais aussi de certains antiépileptiques
(gabapentine, prégabaline) et de certains antidépresseurs
(fluoxétine, paroxétine) (JEANNE S.et al, 2012).
b.Macro angiopathies
Les macros angiopathies regroupent les atteintes vasculaires des
artères musculaires de moyen et gros calibre (> 200 microns). Elles
sont dues à la sclérose des vaisseaux
(athérosclérose) secondaires à un dépôt
à l'intérieur des vaisseaux, appelé plaque
d'athérome. Ce dépôt entraîne un
rétrécissement des artères qui va être à
l'origine de nombreux signes cliniques. Les macros angiopathies se distinguent
dans le diabète par leur précocité
(athérosclérose accélérée), leur plus grande
fréquence et leur sévérité (par exemple, les
infarctus du myocarde sont plus souvent mortels). Parallèlement aux
progrès des traitements hypoglycémiants et anti-infectieux,
l'athérosclérose est devenue la principale cause de
décès des diabétiques, bien avant les comas
métaboliques et les complications infectieuses (BERTIN E., 2000).
Les artères qui vont être les plus touchées
se situent : (BERTIN E., 2000)
§ Au niveau du coeur, ce sont les artères coronaires
qui se bouchent (coronaropathie), entraînant l'angor ou angine de
poitrine avec un risque d'infarctus du myocarde multiplié par 3 chez les
patients diabétiques. Différents examens vont permettre de
détecter ces complications coronaires, parmi lesquels un ECG de repos,
une épreuve d'effort tous les 3 ans ou encore une coronarographie (avec
injection de produits de contrastes iodés) ;
§ Au niveau des artères des jambes, le risque de
développer une artérite oblitérante des membres
inférieurs (AOMI) avec ses complications de gangrène pouvant
aboutir à l'amputation est multiplié par 10 chez le
diabétique. Ces artérites apparaissent en général
vers l'âge de 35 ans, leur apparition étant favorisée par
le tabac et un régime riche en lipides et en glucides. Le
dépistage se fait à l'aide d'une échographie de Doppler
des artères des membres inférieurs ou d'une
artériographie.
§ Au niveau des artères du cou, le risque majeur est
la survenue d'un accident vasculaire cérébral (AVC), avec toutes
les séquelles que cela implique comme l'hémiplégie par
exemple. Le diabète de type 2 est un facteur prédictif majeur
d'AVC dont le risque est multiplié par 3. Ce risque relatif est encore
plus important chez la femme ou le sujet jeune.
L'étape du dépistage des macros angiopathies
consiste à identifier les facteurs de risque cardiovasculaire (VALESIN
et COSSON E., 2014) :
ü L'âge (> 50 ans chez l'homme et > 60 ans chez
la femme) ;
ü La durée du diabète : au-delà de 10
ans, le risque s'accroît et ce de façon très marquée
si le diabète a été mal contrôlé ;
ü Les antécédents familiaux d'accident
cardiovasculaire précoce : infarctus du myocarde, AVC ou mort subite
avant 55 ans chez le père ou chez un parent du 1er
degré de sexe masculin ; infarctus du myocarde, AVC ou mort subite avant
65 ans chez la mère ou chez un parent du 1er degré de
sexe féminin ;
ü Le tabagisme (tabagisme actuel ou arrêté
depuis moins de 3 ans) ;
ü L'obésité (IMC > 30 kg/m2) ;
ü La sédentarité (manque d'activité
physique régulière) ;
ü La consommation excessive d'alcool (plus de 3 verres de
vin par jour chez l'homme, et 2 verres par jour chez la femme) ;
ü L'hypertension artérielle, traitée ou non,
favorise l'artérite, l'infarctus du myocarde et l'accident vasculaire
cérébral LDLc< 1,9 g/L est réservé aux patients
sans aucun facteur de risque additionnel, dépourvus de micro
angiopathies et dont le diabète évolue depuis moins de 5 ans.
ü LDLc< 1,6 g/L chez les patients présentant 1
seul facteur de risque additionnel.
ü LDLc< 1,3 g/L chez les patients présentant au
moins deux facteurs de risque additionnels à un diabète
évoluant depuis moins de 10 ans ;
ü LDLc< 1 g/L chez les patients ayant une atteinte
rénale ou un diabète évoluant depuis plus de 10 ans et au
moins deux facteurs de risque cardiovasculaire. Ces patients ont un risque
supérieur à 20 % de faire un événement coronarien
dans les 10 prochaines années ;
ü L'association entre risque vasculaire et augmentation
même modérée de la glycémie est
démontrée. Cependant, même un contrôle correct de la
glycémie et de la tension ne permet pas à lui seul de
prévenir ce risque. L'application de règles
hygiéno-diététiques comprenant la lutte contre la
sédentarité et le surpoids, la pratique d'activité
physique régulière.
c.Le pied diabétique
La survenue d'une plaie du pied est une complication
redoutée par les patients diabétiques. Le pied diabétique
a la particularité d'être une association entre les micro
angiopathies et les macro angiopathies. Trois mécanismes sont
impliqués : la neuropathie avec perte de la sensibilité, les
blessures passant alors inaperçues, l'artériopathie, qui expose
à une ischémie des plaies retardant la cicatrisation et
l'infection, favorisée par le déséquilibre
glycémique. Au cours de sa vie, un diabétique sur dix subira au
moins une amputation d'orteil. Au moins la moitié pourrait être
évitée : la prévention est primordiale pour éviter
la survenue de plaie du pied (RICHARD J., 2009).
Les manifestations du pied diabétique sont
différentes et varient en fonction de la personne et de la
gravité du diabète. Parmi les symptômes les plus courants
de cette complication, on retrouve (Ha VAN G.et al, 2011) :
§ Picotements ou sensations de petites décharges
électriques au niveau des pieds (particulièrement la
nuit) ;
§ Sensibilité douloureuse et thermique réduite
au niveau des pieds (neuropathie sensorielle) ;
§ Hyperkératose, cors, durillons et ampoules
fréquentes entraînent un risque de fragilisation osseuse.
· Coupures et blessures cutanées résultant
d'un dysfonctionnement du système cardiovasculaire. Elles
entraînent un risque accru d'infections et d'ulcères
hémorragiques, qui peuvent, s'ils ne sont pas pris en charge
correctement, évoluer en gangrène en très peu de
temps ;
· Cicatrisations difficiles causées par une maladie
artérielle périphérique ;
· Déformations des pieds causées par une
diminution de la capacité musculaire. Cela peut entraîner un
changement de posture qui entraine une répartition du poids sur
différents points du pied ;
· Altérations de la couleur des pieds dues à
des problèmes circulatoires au niveau des membres
inférieurs ;
· Pieds constamment froids ;
· Infections bactériennes et fongiques du pied, plus
fréquentes en raison de l'excès de glucose dans le sang qui
affecte le système immunitaire.
Tout patient diabétique doit avoir chaque année un
test au mono filament. Si le patient ne ressent pas à 2 reprises la
pression du mono filament, il est à risque de plaie (MARTINI J.,
2008).
En plus du contrôle régulier de la glycémie
une hygiène soignée du pied est toujours indispensable pour
prévenir et prendre en charge les symptômes du pied
diabétique. Le pronostic des pieds diabétiques est globalement
mauvais, les plaies récidivent souvent. Les mesures préventives
concernent les patients à risque de pied diabétique, autrement
dit ceux souffrant d'une obstruction des artères de la jambe et du pied
(artérite des membres inférieurs) et ceux souffrant de
neuropathie car celle-ci altère les sensations de douleur et modifie la
sensibilité (MARTINI J., 2008).
Tout patient diabétique à risque podologique doit
bénéficier d'un programme d'éducation thérapeutique
pour recevoir une éducation spécifique pour la prévention
des plaies du pied (BOUILLET B., 2020) :
v Ne pas marcher pieds nus ;
v Ne pas couper les ongles mais plutôt les limer ;
v Ne pas enlever les cors ou les callosités avec des
instruments tranchants mais les poncer ;
v Ne pas utiliser de substances corrosives telles que des
coricides ;
v Ne pas utiliser de bouillotte ou de coussin électrique
pour se réchauffer les pieds ;
v Inspecter les pieds chaque jour, avec l'aide d'un miroir si
nécessaire ;
v Vérifier l'absence de corps étranger dans les
chaussures avant de les enfiler ;
v Laver les pieds chaque jour à l'eau tiède et les
sécher soigneusement, surtout entre les orteils ;
v Hydrater les pieds quotidiennement en cas de sécheresse
de la peau (crème hydratante) ;
v Recourir régulièrement à des soins de
pédicurie auprès d'un podologue ;
v Porter des chaussures adaptées en cuir, larges, avec des
semelles souples, sans brides ou lanières, sans coutures
intérieures, et fermées ;
v Porter des chaussettes de coton, de laine, ou de soie ;
v Eviter les élastiques qui sert le mollet ;
La mise en décharge des plaies du pied diabétique
jusqu'à guérison totale est une composante fondamentale de toutes
les recommandations de prise en charge en association aux soins locaux.
L'antibiothérapie n'est pas systématique, mais
réservée aux plaies infectées cliniquement (LEPEUT M,
2016).
8. STRATEGIE THERAPEUTIQUE ET PRISE EN CHARGE DU DIABETE DE
TYPE 2
La mise en place de mesures
hygiéno-diététiques efficaces est un préalable
essentiel au traitement médicamenteux du contrôle
glycémique. Elles doivent être initiées en première
intention et leur application doit être poursuivie tout au long de la
prise en charge du sujet diabétique, sous peine d'inefficacité
relative des autres traitements.
La stratégie générale du traitement d'un
diabétique de type 2 doit être globale et multifactorielle.
D'après les dernières recommandations de la FID, 2013 :
·Au moment du diagnostic du diabète, mise en
place des règles hygiéno-diététiques avec notamment
un régime alimentaire adapté et la pratique d'une activité
physique régulière ;
·En cas d'échec du régime seul (HbA1c >
6,5 %), recours à la monothérapie orale (metformine) ;
·En cas de résultats insuffisants de la
monothérapie, recours à la bithérapie orale (sulfamides +
metformine ou metformine + glitazones ou sulfamides + glitazones) ;
·En cas d'échec de la bithérapie orale,
recours à la trithérapie orale : sulfamides + Metformine +
glitazones ;
·Lorsque la trithérapie se révèle
insuffisante pour équilibrer la glycémie, recours à
l'insulinothérapie en dernière intention.
8.1.LES MESURES HYGIENO-DIETETIQUES
L'ensemble du corps médical s'accorde sur le fait que les
mesures diététiques restent la pierre angulaire du traitement du
diabète de type 2. Les objectifs généraux du traitement du
diabète de type 2 sont : ramener les glycémies à des
valeurs aussi proches que possible de la normale et réduire au maximum
le risque d'apparition ou d'évolution des complications
dégénératives en agissant sur l'hyperglycémie,
d'une part, et sur les facteurs de risque qui sont fréquemment
associés au diabète (hypertension artérielle,
dyslipidémie, troubles de la coagulation...), d'autre part.
8.1.1 LES OBJECTIFS
v Réduire l'insulino-résistance
Il est clairement démontré que la perte de poids et
les régimes de restriction calorique entraînent une augmentation
de la sensibilité à l'insuline des tissus
périphériques (Laakso et al., 2020) ainsi qu'une diminution de la
production hépatique de glucose (Henry et al.,2020).
v Réduire les excursions glycémiques
postprandiales
Chez un sujet sain, les périodes postprandiales durent
environ 4 heures après une prise alimentaire, la montée
glycémique au-dessus de la ligne basale durant environ 2 heures. Pour un
diabétique, dont l'HbA1c est comprise entre 7,5 % et 9 %, les
contributions respectives des hyperglycémies à jeun et
postprandiales sont de l'ordre de 50 %. Chez les diabétiques ayant un
équilibre correct, soit une HbA1c aux environs de 7 %, la contribution
de l'hyperglycémie postprandiale devient prédominante, à
70 % contre 30 % pour l'hyperglycémie à jeun. En revanche, cette
proportion s'inverse lorsque l'HbA1c est supérieure à 9 %
(Monnier et al.,2003).
On constate qu'il est donc important de contrôler ces
hyperglycémies postprandiales en jouant sur les glucides alimentaires,
ceci en diminuant leur quantité à chaque repas et en
privilégiant ceux à pouvoir hyperglycémiant faible ou
modéré (index glycémique des aliments) (Wolever, 2010).
v Contrôler les autres facteurs de
risque
L'hyperglycémie est le facteur prépondérant
des complications microvasculaires. En revanche, les complications cardiaques
et macrovasculaires sont issues de multiples facteurs, tels que l'hypertension
artérielle, les dyslipidémies, la diminution de la fibrinolyse...
Ces facteurs sont, certes, en partie dépendants de
l'hyperglycémie, mais pas totalement ; c'est pour cette raison que sont
souvent envisagées des mesures diététiques
spécifiques, qui peuvent être, en outre, associées à
des mesures pharmacologiques.
8.1.2. LES MOYENS
v Restriction calorique
Compte tenu de la fréquence de la surcharge
pondérale dans le diabète de type 2 et du rôle
physiopathologique joué par l'insulino-résistance induite par
cette surcharge pondérale, on peut affirmer que le contrôle et la
restriction des apports caloriques constituent, dans la majorité des
cas, le dénominateur commun des mesures diététiques. Face
à ce constat, différentes stratégies ont fait leur
apparition : régimes traditionnels, régimes sélectivement
restrictifs en glucides ou en lipides... La plupart de ces stratégies
sont décevantes à long terme ; en effet, des régimes
à très basse teneur calorique entraînent une perte de poids
rapide allant de pair avec une forte diminution de la glycémie, mais on
constate que cette dernière remonte dès que le poids se
stabilise. En revanche, les régimes à restriction calorique
modérée s'accompagnent d'une baisse glycémique plus
progressive et durable.
C'est ce type de régime qui est recommandé, d'une
part, parce que les résultats à long terme sont meilleurs et,
d'autre part, parce que les pertes de poids trop rapides (supérieures
à 4 kg par mois) s'accompagnent d'une perte de masse maigre, de fatigue,
éventuellement de carences et, à moyen terme, d'un effet rebond.
Ceci témoigne de l'adaptation à la restriction calorique par une
diminution des dépenses énergétiques qui aboutit au
rééquilibrage de la balance énergétique. Cette
adaptation relève de plusieurs mécanismes. Il existe une relation
linéaire entre la dépense énergétique et le poids,
et particulièrement, le poids de masse maigre. La perte de poids
contribue donc à diminuer la dépense énergétique de
repos. En second lieu, la diminution de la ration alimentaire est
associée à une diminution de la thermogenèse alimentaire,
au moins dans sa composante obligatoire. Enfin, le coût de
l'activité physique étant lié positivement au poids
mobilisé, la perte de poids réduit les dépenses
énergétiques dues à l'activité physique. En
revanche, le rendement énergétique du travail musculaire accompli
ne diffère pas avant et après perte de poids (Université
Numérique Francophone des Sciences de la Santé et du Sport,
2011). En outre, la composition du poids perdu sous l'effet des régimes
restrictifs touche à la fois la masse grasse et la masse maigre, et la
contribution respective de ces masses au poids perdu varie
considérablement d'un sujet à l'autre. D'une façon
schématique, plus la masse grasse initiale du sujet soumis à une
restriction calorique est importante, plus la contribution de la masse grasse
au kilo de poids perdu sera élevée.
v La balance glucides/lipides
La détermination du niveau énergétique d'un
régime hypocalorique ne suffit pas pour définir totalement le
régime. En effet, l'apport alimentaire doit respecter un certain
équilibre entre macronutriments : glucides, protides et lipides. Les
apports conseillés en protéines sont de l'ordre de 15 % de la
ration énergétique totale, ce qui correspond, en
général, à l'apport constaté dans l'alimentation
spontanée. Ensuite, il convient de choisir les apports optimaux en
glucides à faible et fort pouvoir hyperglycémiant, et entre
acides gras saturés, polyinsaturés et mono-insaturés. Pour
couvrir les besoins énergétiques du système nerveux et des
tissus gluco-dépendants, il est nécessaire de fournir un minimum
de 140 g de glucides par jour. En outre, si on veut éviter de trop
stimuler la néoglucogenèse, déjà en
suractivité lors d'un diabète de type 2, il est important de
maintenir un apport en glucides supérieur à 40 % des calories
totales. Si cette valeur minimale fait l'objet d'un consensus, ce n'est pas le
cas pour la valeur maximale. En effet, une augmentation de la proportion de
glucides au-delà de 55 % de l'apport énergétique
amènerait à une proportion de lipides inférieure à
30 %, et donc une altération de la palatabilité des aliments,
celle-ci étant liée en grande partie à l'apport lipidique.
Nous l'avons déjà vu, la réduction des excursions
glycémiques postprandiales est très importante dans
l'équilibre du diabète de type 2. Pour y parvenir, on peut agir
sur plusieurs facteurs.
v Le poids corporel
Il a été montré qu'une perte de poids d'au
moins 10 % est associée à une baisse globale des glycémies
pré- et postprandiales. Cela semble indiquer que l'amélioration
de la glycémie postprandiale après une perte de poids n'est due
qu'à la baisse de la glycémie à jeun, car on sait qu'une
glycémie donnée est toujours dépendante, au moins en
partie, de la glycémie qui la précède (Polonsky et al.,
2014). Il apparaît donc qu'une perte pondérale n'entraîne
qu'une faible amélioration des glycémies postprandiales, mais
reste importante pour la glycémie à jeun. Toutefois, la notion de
poids doit être discutée avec chaque patient. En effet, il est
préférable de parler de poids « raisonnable » à
atteindre, car il est souvent inutile d'imposer des mesures de restriction
calorique à des diabétiques en léger surpoids exempts de
dyslipidémie et ayant une pression artérielle normale. Il est
alors préférable de substituer aux mesures quantitatives des
recommandations purement qualitatives.
v La quantité de glucides ingérés
à chaque repas
Celle-ci conditionne en partie la montée de la
glycémie postprandiale. En effet, 50 g de glucides alimentaires
entraînent une réponse glycémique deux fois plus forte que
celle d'une quantité deux fois moins importante (Jenkins et al., 2016).
Cette constatation plaide en faveur d'une limitation de l'apport en glucides au
cours de la journée, ainsi qu'un étalement de celui-ci en
respectant les repas quotidiens habituels et, éventuellement, en y
ajoutant des collations interprandiales. Cependant, suite à la
constatation que l'absence ou la présence de collations n'entraîne
aucune différence à long terme au niveau glycémique chez
les patients diabétiques de type 2 (Monnier et al., 2002), on
considère que c'est au patient de déterminer, en fonction de ses
préférences personnelles, s'il est nécessaire de
fragmenter les prises alimentaires par l'ajout de collations ; ceci en prenant
en compte le moment de la journée. En effet, la collation de milieu de
matinée n'a que peu d'intérêt pour un diabétique de
type 2, elle peut même aggraver les dérives
hyperglycémiques suivant le petit-déjeuner, point faible de la
journée chez la plupart des diabétiques (Monnier et al., 2012).
Les collations en fin d'après-midi ou en début de nuit (avant le
coucher) sont justifiées s'il y a un risque hypoglycémique
à ces moments-là, risque rencontrer notamment chez les patients
traités par insulino-sécrétagogues.
v La nature de ces glucides
On sait que des quantités identiques de glucides contenues
dans des aliments différents peuvent conduire à des
réponses hyperglycémiques très variables (Jenkins et al.,
2018). L'index glycémique (IG) reste, à ce jour, la
méthode de référence pour estimer le pouvoir
hyperglycémiant d'un aliment. Il s'agit d'un critère de
classement des aliments contenant des glucides, basé sur leurs effets
sur la glycémie durant les deux heures suivant leur ingestion. L'IG d'un
aliment est donné par rapport à un aliment de
référence auquel on attribue l'indice 100 : du glucose pur
(Foster-Powell et Brand-Miller, 2019).
Sont classés hyperglycémiants (index de plus de
50), par exemple, le riz à cuisson rapide (85), le pain blanc (70) et
les bananes (60). Parmi les aliments à faible index glycémique,
on retrouve les flocons d'avoine (40), les figues sèches (35) et les
haricots verts (30).
Les recommandations classiques pour limiter les excursions
glycémiques postprandiales consistent à privilégier la
consommation d'aliments ayant des index glycémiques faibles. Ainsi, la
majorité des apports glucidiques devrait être assurée par
des féculents (riz, pâtes, légumes secs, pommes de
terre...), du lait, des fruits ou des légumes ; la consommation de pain,
notamment le pain blanc, devra être contrôlé car son pouvoir
hyperglycémiant est voisin de celui du saccharose.
La consommation d'aliments contenant des glucides très
hyperglycémiants ne doit pas être interdite chez le patient
diabétique de type 2, mais il est préférable de rester
dans des limites raisonnables. Par conséquent, les pâtisseries ou
les confiseries ne doivent être consommées que de manière
occasionnelle. Et il est également préférable
d'éviter la consommation d'aliments à fort pouvoir
hyperglycémiant aux moments de la journée où les
dérives hyperglycémiques sont les plus marquées (Monnier
et al., 2012), ce qui est, en général, le cas après le
petit-déjeuner, période caractérisée par une
montée excessive de la glycémie qui est due à
l'hyperproduction de glucose hépatique qui passe par un maximum en fin
de nuit (Bolli et Gerich, 2014) et à l'effet hyperglycémiant des
aliments du petit-déjeuner qui sont souvent à index
glycémique élevé en France. En revanche, les aliments
à pouvoir hyperglycémiant élevé, tel que le pain,
pourraient être réservés aux repas où le risque
d'excursion hyperglycémique postprandiale est plus faible :
déjeuner ou dîner. Cependant, la simple connaissance du pouvoir
hyperglycémiant des aliments glucidiques à partir des index
glycémiques semble insuffisante car ceux-ci peuvent varier sous
l'influence de plusieurs facteurs : la cuisson, l'ébullition, le
broyage, la réduction en purée ou en compote, ainsi que tous les
autres procédés susceptibles d'entraîner une
dégradation mécanique ou thermique des aliments amylacés,
augmentant le pouvoir hyperglycémiant (Monnier, 2019).
À l'inverse, certains procédés industriels
sont destinés à réduire le pouvoir hyperglycémiant
des aliments ; c'est ce qui est obtenu lorsque l'on remplace une partie des
glucides par des édulcorants. C'est à partir de ces substituts
que sont fabriqués les produits dits « allégés en
sucres ».
v La place du fructose dans l'alimentation
Le saccharose est composé pour moitié de glucose et
de fructose. Cependant, depuis quelques dizaines d'années, en
Amérique du Nord, un procédé d'isomérisation
enzymatique du glucose en fructose à l'échelle industrielle a
été développé et utilisé par l'industrie
agro-alimentaire. Ce procédé aboutit à des sirops de
maïs dits « enrichis en fructose » ; en effet, la forme la plus
couramment utilisée contient 55 % de fructose. Or, l'utilisation de ces
sirops a augmenté en Amérique du Nord ; des études ont
donc été menées afin de savoir si le fructose était
plus bénéfique que le glucose. Le rôle prédominant
du fructose peut être expliqué par le métabolisme
particulier de cet hexose. Le fructose est transporté dans
l'hépatocyte, où il est initialement transformé en
fructose-1-phosphate sous l'action de l'enzyme phosphofructokinase,
caractérisée par une très haute affinité pour le
fructose, puis scindé en trioses-phosphate
(glycéraldéhyde-3-phosphate et
di-hydroxyacétone-phosphate) par l'enzyme aldolase B. La haute
activité de ces deux enzymes, qui ne sont pas contrôlées
par l'insuline, et l'absence de rétrocontrôle sur ces
réactions a pour conséquence que la quasi-totalité du
fructose ingéré est transformée en trioses-phosphate dans
l'hépatocyte. L'ingestion de fructose en quantité importante
entraîne donc une production massive de triosesphosphate dans les
hépatocytes, et, secondairement, une stimulation de la
néoglucogenèse, de la synthèse de glycogène
(glycogénogenèse) et de la synthèse de novo d'acides gras.
Les acides gras néo-formés dans l'hépatocyte
représentent une portion mineure du métabolisme du fructose, mais
peuvent avoir des conséquences fonctionnelles importantes en participant
à la sécrétion de VLDL-triglycérides
(lipoprotéine de très basse densité) et à la
déposition de triglycérides intrahépatiques. Chez l'homme,
plusieurs études, portant chacune sur de petits nombres d'individus, ont
évalué les effets d'un supplément de fructose. Ces
études ont généralement été
effectuées en condition d'apport énergétique largement
supérieur aux besoins nécessaires, et avec des apports de
fructose très importants (correspondant au contenu en fructose de
plusieurs litres de soda par jour). Ces études ont clairement
indiqué qu'un excès d'apport alimentaire sous forme de fructose
pouvait entraîner une augmentation des concentrations de
triglycérides à jeun et postprandiales, une stimulation de la
lipogenèse hépatique de novo, une résistance
hépatique à l'insuline et une intolérance au glucose. On
observe aussi une déposition de triglycérides
«ectopiques», c'est-à-dire stockés dans le cytoplasme
de cellules non adipocytaires, en particulier au niveau du foie et des muscles.
De tels dépôts de lipides ectopiques semblent être, de
manière générale, en relation étroite avec le
développement d'une résistance à l'insuline. S'il
apparaît clairement qu'un excès de sucrose (saccharose) ou de
fructose peut perturber le métabolisme, lipidique en particulier, dans
des conditions expérimentales, il faut cependant garder à
l'esprit qu'il existe une grande diversité dans notre population, autant
en ce qui concerne les facteurs génétiques que l'environnement
(Tran et Tappy, 2012).
v La teneur en fibres des aliments
L'Agence Nationale de Sécurité Sanitaire de
l'Alimentation, de l'Environnement et du Travail (ANSES) définit les
fibres alimentaires ainsi :
§ Des polymères glucidiques (DP = 3) d'origine
végétale, associés ou non dans la plante, à de la
lignine ou à d'autres constituants non glucidiques (polyphénols,
cires, saponines, cutine, phytates, phytostérols...) : cellulose,
hémicellulose, gommes végétales, pectines, inuline,
lignine...
§ Des polymères glucidiques transformés
(physiquement, enzymatiquement ou chimiquement) ou synthétiques (DP = 3)
: fructooligosaccharides, oligofructoses, amidon résistant... DP =
degré de polymérisation (Agence Nationale de
Sécurité Sanitaire de l'Alimentation, de l'Environnement et du
Travail, 2012).
En outre, les fibres alimentaires ne sont ni
digérées, ni absorbées dans l'intestin grêle. Elles
présentent l'une au moins des propriétés suivantes :
ü Augmentation de la production des selles ;
ü Stimulation de la fermentation colique ;
ü Diminution de la cholestérolémie à
jeun ;
ü Diminution de la glycémie et/ou de
l'insulinémie post-prandiale(s).
v ALIMENT TENEUR EN G/100 G D'ALIMENT
Céréales :
· Pain de mie complet 7,23
· Pain de mie blanc 2,96
· Riz complet 2,16
· Flocons d'avoine 1,68
Légumineuses :
· Haricot blanc 6,30
· Petit pois 6,00
· Pois chiche 4,80
· Lentille 4,20
Légumes :
· Artichaut 5,05
· Chou vert 2,40
· Pomme de terre 2,21
· Carotte 2,00
· Laitue 1,83
Fruits :
· Amande 12,60
· Groseille 7,40
· Pruneau 5,83
· Noix 5,70
· Banane 3,10
· Poire 3,03
· Pomme 1,95
· Fraise 1,87
· Tomate 1,41 (Agence Nationale de Sécurité
Sanitaire de l'Alimentation, de l'Environnement et du Travail, 2013).
La teneur en fibres alimentaires semble agir sur la
disponibilité des glucides alimentaires (Monnier, 2002). En effet,
l'ajout de fibres alimentaires semble améliorer les glycémies
(Chandalia et al., 2020). D'un point de vue quantitatif, l'apport total en
fibres alimentaires devrait se situer aux alentours de 20 à 30 g par
jour, soit une supplémentation de 10 g car l'alimentation
spontanée n'apporte que 10 à 20 g de fibres par jour. Ce niveau
s'avère en général suffisant pour obtenir le
résultat escompté, tout en évitant les effets
indésirables (ballonnements, nausées, diarrhées...)
rencontrés à des doses plus élevées. Pour cette
supplémentation, il est préférable d'utiliser des aliments
naturels, car les fibres, contenues dans les céréales
complètes ou les légumes secs, ralentissent l'hydrolyse des
glucides assimilables qui sont enveloppés dans le réseau fibreux
et dont la destruction partielle est nécessaire pour que les
polysaccharides soient lysés par les enzymes de l'appareil digestif.
À l'inverse, l'ajout de fibres sous forme de poudre ou de
granulés semble être beaucoup moins efficace.
v Apports protidiques
Nous l'avons vu, les calories d'origine protidique doivent
représenter environ 15 % de l'apport énergétique global.
En revanche, chez les patients soumis à des régimes de
restriction calorique, il est conseillé de porter ce pourcentage
à 20 % afin d'éviter de négativité la balance
azotée. À l'inverse, cet apport doit être limité
chez les patients ayant une néphropathie diabétique, même
si elle ne s'accompagne pas d'altération de la filtration
glomérulaire ; chez les sujets micro- ou macroprotéinuriques, la
ration protidique devrait être comprise en 0,6 et 0,8 g/kg de poids
corporel idéal. Cette mesure semble ralentir l'évolution de la
néphropathie vers l'insuffisance rénale chronique.
v Apports en minéraux, vitamines et
antioxydants
Lorsque l'apport alimentaire est équilibré, les
besoins sont, en général, largement couverts. Cependant, l'apport
sodé doit être réduit en cas d'hypertension et une
restriction potassique peut être nécessaire en cas d'insuffisance
rénale chronique ou de traitement par inhibiteur de l'enzyme de
conversion (IEC). À ce jour, toutes les tentatives de
supplémentation en antioxydants, vitamines et minéraux se sont
soldées par des échecs quels que soient les objectifs
visés :
Protection contre les complications cardiovasculaires, sauvegarde
de l'insulino-sécrétion endogène, amélioration de
la sensibilité des tissus périphériques à
l'insuline et amélioration du profil glycémique en agissant sur
la tolérance glucidique postprandiale. Or, une absence
d'efficacité ne signifie pas absence de toxicité (Franz et al.,
2013). Il est donc préférable d'éviter toutes les
préparations « miraculeuses » dont la sécurité
d'emploi est loin d'être prouvée.
v En cas d'activité physique
En général, une activité physique normale ne
nécessite pas d'apport glucidique complémentaire, car il est rare
qu'un diabétique de type 2 pratique une activité physique
intense. Toutefois, lors d'une marche prolongée à un rythme
soutenu, un supplément de 7 g/h de glucose (soit l'équivalent
d'une biscotte) peut s'avérer nécessaire ; on doublera cet apport
lors d'activité physique de type sport de loisir.
Selon les recommandations de l'HAS en 2014, la pratique
d'activité physique hebdomadaire se résume :
·Pour les 18-65 ans : au moins 30 minutes
d'activité physique d'intensité modérée, au minimum
5 jours par semaine ;
·Pour les plus de 65 ans : au moins 30 minutes de marche
à minimum 3 fois par semaine. La marche normale est
considérée comme une activité physique d'intensité
modérée.
Chez les sujets âgés ou chez ceux ayant des
difficultés de mobilité, la moindre augmentation du niveau
d'activité procure un bénéfice, tant que celle-ci est
tolérée du point de vue cardiovasculaire et n'augmente pas le
risque de complications liées au pied diabétique (Gonzalez B. et
Al, 2010).
v La place des édulcorants
Le Larousse définit un édulcorant comme une «
substance d'origine naturelle ou de synthèse donnant une saveur
sucrée ».
On distingue deux catégories d'édulcorants
(Clarisse et al., 2019) :
ü Les édulcorants de masse, également
appelés édulcorants de charge, ou polyols : on retrouve, au sein
de ce groupe, l'isomalt, le sorbitol, le mannitol et le xylitol. Ce sont des
sucres-alcools obtenus par hydrogénation de matières
amylacées ou du saccharose ; ils ont un effet de masse qui leur permet
de remplacer le saccharose, le glucose ou le fructose, au sein d'un aliment.
Leur pouvoir sucrant (PS) est proche de celui du sucre de table (saccharose)
;
ü Les édulcorants de synthèse,
également appelés édulcorants intenses, artificiels ou non
nutritifs : on peut trouver, entre autres, la saccharine, le cyclamate,
l'aspartame et l'acésulfame K. Ils sont obtenus par synthèse
chimique ou sont extraits de végétaux. Leur pouvoir sucrant est
très supérieur à celui du saccharose.
La prise en charge diététique et l'activité
physique constituent la pierre angulaire du traitement initial du
diabète et doivent être renforcés à chaque
étape de la prise en charge thérapeutique.
8.2.LES ANTIDIABETIQUES ORAUX ET NON INSULINIQUES
a.Les biguanides
Lorsque les mesures hygiéno-diététiques ne
sont pas suffisantes pour rétablir l'équilibre glycémique,
le traitement médicamenteux de première intention du
diabète de type 2 repose sur l'utilisation de la metformine. Cette
monothérapie entraîne une baisse de 1 à 1,5% de l'HbA1c
à terme en diminuant la production hépatique de glucose et en
augmentant l'insulinosensibilité et l'utilisation
périphérique du glucose (Foretz M. et al, 2009).
La prise de metformine se fait préférentiellement
en fin de repas pour limiter les effets secondaires digestifs (douleurs
abdominales, diarrhées et nausées notamment). De plus, les
patients ressentent souvent un goût métallique à l'origine
de désagréments. Les troubles digestifs associés à
la metformine, pourtant transitoires, restent la première cause
d'arrêt du traitement (Tielmans, Laloi et al, 2006).
Le traitement par metformine doit être interrompu pour une
durée de 48 heures après l'injection d'un produit de contraste
iodé mais il n'est plus recommandé de l'interrompre 48 heures
avant l'examen. Le traitement sera réintroduit après
contrôle de la fonction rénale (Virally M. et al, 2007).
b.Les sulfamides hypoglycémiants
Les sulfamides hypoglycémiants sont des
antidiabétiques oraux qui ont l'intérêt de constituer une
classe thérapeutique sur laquelle on a beaucoup de recul.Ce sont des
hypoglycémiants puissants qui améliorent l'HbA1c en moyenne de 1
à 1,5%. Comparés à d'autres hypoglycémiants oraux
tels que la metformine ou les glitazones, ils sont plus rapidement efficaces,
dès le premier jour.
Les sulfamides hypoglycémiants agissent en stimulant la
sécrétion d'insuline pancréatique à jeun et en
amplifiant la réponse insulinique au cours des repas. Le risque
principal induit par les sulfamides est le risque d'hypoglycémie,
majoré en périodes de jeûne, notamment en fin de
journée (17-18h), la nuit et parfois en fin de matinée. La prise
de sulfamides hypoglycémiants se fait préférentiellement
avant le repas pour pallier ce risque. Une prise de poids de 1 à 3 kg
est également régulièrement observée au
démarrage du traitement, secondaire à la stimulation de
l'insulinosécrétion (MARRE M,2017).
La prescription de sulfamides hypoglycémiants
nécessite une auto surveillance glycémique du patient, dans le
but de détecter et prendre en charge les hypoglycémies, de fin de
journée notamment. Lorsqu'elles entraînent une perte de
connaissance, une hospitalisation en urgence s'impose. Elle consiste à
perfuser le patient avec un soluté de réhydratation orale
glucosé pendant au moins 48h. La prise de sulfamides est
contre-indiquée en cas de grossesse, d'insuffisance rénale ou
hépatique (Faure S., 2011).
d.Les glinides
Les glinides ont le même mode d'action que les sulfamides
hypoglycémiants. Ils diffèrent par leur durée d'action,
les glinides stimulant l'insulinosécrétion de façon plus
brève et plus rapide que les sulfamides hypoglycémiants. Le
risque d'hypoglycémie sévère consécutif à la
prise de glinides est donc inférieur au risque lié aux sulfamides
hypoglycémiants. La prise de glinides se fait 15 à 30 minutes
avant chaque repas pour réduire ce risque d'hypoglycémie
iatrogène. Les glinides sont mieux tolérés, ils ne
provoquent pas de prise de poids et entraînent une diminution de l'HbA1c
de 1% en moyenne. Ils réduisent la glycémie en période
postprandiale principalement et dans une moindre mesure, la glycémie
à jeun (Faure S.,2007).
L'effet indésirable le plus fréquent est
l'hypoglycémie, en particulier chez la personne âgée, en
cas de jeûne, d'exercice physique intense, d'interaction
médicamenteuse ou de consommation d'alcool. D'autres effets
indésirables comme les douleurs abdominales, les diarrhées et
nausées peuvent aussi se manifester.
d.Les inhibiteurs des á-glucosidases
Les inhibiteurs des á-glucosidases sont une classe
d'hypoglycémiants oraux actifs sur la seule hyperglycémie
postprandiale. Le principal représentant est l'acarbose. Il agit en
inhibant la digestion et donc l'absorption des sucres complexes au niveau
intestinal et en précipitant leur élimination dans les selles.
L'unique effet de l'acarbose est d'écrêter les pics
glycémiques postprandiaux observés en cas de repas riches en
sucres complexes. Ils doivent, pour cela, être administrés en
début de repas. L'effet hypoglycémiant engendré est
moindre que celui obtenu avec les autres classes d'antidiabétiques oraux
(Faure S, 2017).
Les inhibiteurs des á-glucosidases induisent une baisse
moyenne de 0,5 % de l'HbA1c. Les inhibiteurs des á-glucosidases sont
utilisés en traitement de deuxième intention en association avec
la metformine ou les sulfamides hypoglycémiants. Ils peuvent être
utiles à certains stades très précoces du diabète
quand l'hyperglycémie postprandiale prédomine. Ils
présentent l'avantage de ne pas induire d'hypoglycémie et de
prise de poids chez le patient (Brogard et al, 2000).
La prise d'á-glucosidases est contre-indiquée en
cas d'insuffisance rénale, d'insuffisance hépatique, de maladies
inflammatoires chroniques de l'intestin, de grossesse et d'allaitement (Andres
,2001).
e.Les inhibiteurs de la DPP-4
Les inhibiteurs de la DDP-4 agissent essentiellement sur la
glycémie postprandiale.
Les 3 représentants de cette classe médicamenteuse
sont la saxagliptine, la sitagliptine et la vildagliptine. Ils augmentent le
taux d'incrétines en inhibant la DPP-4, zyme responsable de la
dégradation des incrétines et diminuent la
sécrétion de glucagon. Il en résulte une diminution de la
glycémie. Les incrétines sont des hormones qui vont stimuler la
sécrétion d'insuline lors d'un repas. La stimulation de
l'insulinosécrétion se fait uniquement lorsque la glycémie
est élevée. De ce fait, il n'y a pas de risque
d'hypoglycémie liée à la prise d'inhibiteurs de DPP-4. Ils
présentent aussi l'intérêt de ne pas provoquer de prise de
poids chez le patient. Ils entraînent une diminution moyenne de l'HbA1c
de 0,5 à 1% (Waget et al,2011).
La prise d'inhibiteurs de la DDP-4 est contre-indiquée en
cas de grossesse, d'allaitement, d'insuffisance rénale, d'insuffisance
hépatique, d'insuffisance cardiaque ou encore d'antécédent
de réaction d'hypersensibilité grave avec un inhibiteur de la
DPP-4 (Charbonnel B.,2008).
f.Les analogues de GLP-1
Le GLP-1 est une hormone sécrétée par
l'intestin lors du passage des nutriments. Son rôle principal est
d'augmenter la sécrétion d'insuline lors des repas, donc lorsque
la glycémie s'élève. Cette hormone fait partie de la
famille des incrétines, découverte suite à l'observation
physiologique selon laquelle la sécrétion d'insuline est plus
importante lors de l'administration de glucose par voie orale que par voie
veineuse : c'est l'effet incrétine. Cette observation suggérait
qu'un facteur intestinal potentialisait la sécrétion d'insuline,
le GLP-1. C'est un insulinosécréteurglucodépendant.
Contrairement aux sulfamides hypoglycémiants, la sécrétion
d'insuline stimulée par le GLP-1 se réduit lorsque la
glycémie baisse. Cette spécificité explique en partie que
le risque d'événement hypoglycémique quasi nul avec les
analogues du GLP-1. (Choukem et al,2007)
L'effet incrétin témoigne de l'adaptation de la
sécrétion d'insuline lors des repas. Il est réduit chez un
grand nombre de patients atteints de diabète de type 2.
Augmenter la sécrétion d'insuline en particulier
lors des repas est un objectif thérapeutique important dans la prise en
charge du diabète de type 2. Les analogues de GLP-1, en association avec
un autre médicament hypoglycémiant, sont efficaces sur la
glycémie en réduisant l'HbAlc de 1 à 1,5 % (Burcelin et
Bertolini ,2012).
En plus de son action sur la sécrétion d'insuline,
le GLP-1 a également d'autres propriétés, notamment
(Gautier et al,2008) :
·Le ralentissement de la vidange de l'estomac. Ceci
participe à la réduction de la glycémie postprandiale en
ralentissant la diffusion des glucides alimentaires vers le
duodénum ;
·La réduction de la vidange de l'estomac augmente
également la satiété, réduit la sensation de faim
et la prise alimentaire. Ce mécanisme à un effet
bénéfique sur la perte de poids ;
·Une réduction de la sécrétion de
glucagon. Cet effet important peut-être la conséquence d'un effet
direct du GLP-1 sur les cellules alpha des îlots pancréatiques
(cellules sécrétrices de glucagon) ou d'un effet indirect (le
GLP-1 améliorant la sécrétion d'insuline, celle-ci inhibe
au sein de l'îlot la sécrétion de glucagon). La persistance
d'une hyperglucagonémie relative expose au mauvais contrôle
glycémique car le glucagon augmente la production hépatique de
glucose ;
·Un effet cardioprotecteur : réduction
significative des événements cardiovasculaires majeurs, en
particulier coronariens et de la mortalité cardiovasculaire.
Les analogues de GLP-1 ont une efficacité importante sur
les glycémies postprandiales et l'insuline basale sur les
glycémies à jeun. L'association de ces deux classes
thérapeutiques dans le diabète de type 2 permet de
rétablir ces deux déséquilibres.
g.Les inhibiteurs de SGLT-2
Au cours des dernières années, les
stratégies de prise en charge de l'hyperglycémie dans le
diabète de type 2 se sont enrichies de l'apport de nouvelles classes
thérapeutiques, notamment celle des inhibiteurs du cotransporteur
sodium-glucose de type 2 (SGLT-2) aussi appelés gliflozines. Cette
classe médicamenteuse va agir sur la recapture du glucose au niveau
rénal (Bonnet F.,2009).
Les inhibiteurs des SGLT-2 vont aussi être à
l'origine d'une baisse de la tension artérielle chez le patient. Ils ont
démontré leur efficacité dans la prévention
cardiovasculaire notamment en réduisant le risque de survenue ou
d'aggravation de l'insuffisance cardiaque et un ralentissement de la
néphropathie diabétique (Verges B.,2019).
L'utilisation des inhibiteurs des SGLT-2 est
contre-indiquée en cas de (Gourdy P., 2015) :
·Prédispositions du patient aux infections
génitales ou urinaires ;
·Association avec d'autres diurétiques, surtout
chez les patients âgés et fragiles (risque de
déshydratation) ;
·Insuffisance rénale ;
·Grossesse et allaitement.
8.4.L'INSULINOTHERAPIE
Les effets des traitements antidiabétiques oraux diminuent
progressivement et inéluctablement au fil des années. Le recours
à l'insulinothérapie devientindispensable lorsque les traitements
oraux et non insuliniques ne permettent plus d'atteindre l'objectif
glycémique fixé. L'insuline est l'agent pharmacologique
hypoglycémiant le plus puissant. Il entraîne une diminution du
taux d'HbA1c de l'ordre de 1,5 à 3,5 %. Son effet hypoglycémiant
est dose dépendant (Marinier F.,2016).
Les deux principaux inconvénients de
l'insulinothérapie sont le risque hypoglycémique
élevé si le dosage d'insuline est mal adapté au patient et
la prise de poids généralement observée. Cette
dernière s'avère problématique en cas
d'obésité pré existante. Ces possibles effets secondaires,
le caractère injectable et la complexité du traitement sont
souvent source de réticence du patient et nécessitent de disposer
d'une offre d'éducation thérapeutique (Baurduceau B.,2015).
Les insulines peuvent s'administrer de façon discontinue
par voie sous-cutanée (avec un stylo ou à la seringue) ou, pour
les analogues rapides, en continu par pompe à insuline. Lors du passage
à l'insuline, il est recommandé de débuter par une
injection quotidienne d'analogue lent de l'insuline en raison d'un moindre
risque hypoglycémique et d'une moindre variabilité
glycémique. La mise en route d'une insulinothérapie
nécessite une phase de préparation (co-décision avec le
patient), ainsi qu'une éducation thérapeutique du patient et de
son entourage. Un suivi rapproché devra être proposé pour
vérifier la bonne réalisation, l'efficacité et la
tolérance de l'insulinothérapie, modifier le protocole
d'adaptation des doses si nécessaire et adapter les traitements
antidiabétiques associés (Riveline et al, 2019).
Il existe 3 schémas principaux d'insulinothérapie
chez le diabétique de type 2 (Bosquet,2004) :
·L'insulinothérapie basale : 1 injection, matin
ou soir. Le principe est de normaliser la glycémie de nuit, ce qui
entraîne souvent dans la journée une diminution parallèle
des glycémies postprandiales ;
·L'insulinothérapie basale-bolus comporte la
même insuline basale mais on y ajoute 1 injection d'analogue rapide avant
chaque repas. Ce schéma s'impose si les glycémies postprandiales
sont mal contrôlées par une seule injection par jour d'insuline
basale. Il est efficace mais souvent mal accepté par les patients car il
comporte 4 injections quotidiennes ;
·Les insulinothérapies à 2 injections,
matin et soir, constituent un bon compromis.
L'instauration d'une insuline intermédiaire ou analogue
lente pourra se faire avec les règles de pratiques suivantes (Lagrange
F.,2014) :
·Prescription d'une dose initiale faible, de 6 à
10 UI par 24 heures ;
·Mise en place d'une auto surveillance glycémique
pour la prévention des hypoglycémies et l'adaptation des doses
d'insuline (au moins 2 mesures glycémiques capillaires par jour à
l'initiation de l'insulinothérapie : au coucher pour prévenir les
hypoglycémies et au réveil pour suivre l'objectif) ;
·Définition d'un objectif pour la glycémie
à jeun au réveil selon l'objectif d'HbA1c du patient ;
·Adaptation des doses d'insuline tous les 3 jours en
fonction des glycémies au réveil et de l'objectif fixé ;
la dose peut être augmentée ou réduite de 1 ou 2
UI ;
·Réévaluation du traitement en cas
d'hypoglycémies fréquentes ou d'une hypoglycémie
sévère ;
·Recours éventuel à un(e) infirmier pour
réaliser l'insulinothérapie (adaptation des doses selon la
prescription...)
Il existe plusieurs types d'insulines qui varient selon
(Hartemann et Grimaldi,2019) :
·Le délai d'action ;
·Le pic d'action ;
·La durée d'action.
L'insuline peut être dispensée sous la forme de
stylos pré-remplis ou de cartouches à insérer dans des
stylos réutilisables. Ils vont permettre de réaliser une
injection d'insuline beaucoup plus simplement qu'avec une seringue.
8.5.L'EDUCATION THERAPEUTIQUE DU PATIENT DIABETIQUE
La démarche d'éducation thérapeutique fait
partie intégrante de la relation de soin, elle accorde une place
prépondérante au patient en tant qu'acteur de sa santé.Le
contenu ciblé de l'entretien et le mode de relation établi
permettent d'inscrire le patient dans un parcours éducatif.
L'éducation thérapeutique permet aux patients de mieux prendre
soin d'eux mais aussi de mieux vivre avec leur maladie.
L'OMS définit l'éducation thérapeutique
comme un processus continu, dont le but est d'aider les patients à
acquérir ou maintenir les compétences dont ils ont besoin pour
gérer au mieux leur vie avec une maladie chronique. Elle fait partie
intégrante et de façon permanente de la prise en charge du
patient.
Elle comprend des activités organisées, y compris
un soutien psychosocial, conçues pour rendre les patients conscients et
informés de leur maladie, des soins, de l'organisation et des
procédures hospitalières, et des comportements liés
à la santé et à la maladie.
Ceci a pour but de les aider (ainsi que leurs familles) à
comprendre leur maladie et leur traitement, collaborer ensemble et assumer
leurs responsabilités dans leur propre prise en charge dans le but de
les aider à maintenir et améliorer leur qualité de vie
(WHO, 2021).
Il y a plusieurs niveaux de compétences à
acquérir par le patient grâce à l'éducation
thérapeutique (Simon C., 2009) :
· Savoir : connaissances sur le diabète, le risque de
complications, le traitement ;
· Savoir-faire : savoir mesurer sa glycémie, utiliser
une pompe à insuline, réaliser une injection d'insuline ou
d'analogue du GLP-1, adaptation autonome du traitement en cas d'activité
physique, de maladie, d'hypoglycémie ...
· Savoir-être : travailler sur la confiance en soi,
gérer les émotions, le stress, savoir annoncer son diabète
à un proche...
Selon les recommandations de l'HAS en 2007, un programme
d'éducation thérapeutique du patient se définit comme un
ensemble coordonné d'activités d'éducation
destinées à des patients et à leur entourage et
animées par une équipe pluridisciplinaire de professionnels de
santé (médecin traitant, diabétologue, pharmacien,
psychologue, podologue, nutritionniste-diététicien...).
Il implique une alliance thérapeutique entre
l'équipe soignante et le patient qui sont des partenaires engagés
ensemble sur le long chemin de la maladie chronique, au rythme du patient et
dans le respect de ses choix. Cette alliance doit rester dynamique.
L'éducation thérapeutique est proposée au patient sous la
forme d'un programme personnalisé avec des ateliers collectifs ou
individuels.
Selon l'HAS, les objectifs de l'éducation
thérapeutique du patient sont de :(HAS, 2021)
·Renforcer par une prise en charge multidisciplinaire
les connaissances théoriques et les compétences techniques du
patient afin de lui permettre d'être un acteur de sa prise en
charge ;
·Améliorer l'équilibre glycémique
et la qualité de vie et réduire le risque ou retarder
l'apparition de complications aiguës et chroniques du patient.
Les champs de l'éducation thérapeutique à
explorer avec le patient :
· L'alimentation et la diététique ;
· L'activité physique ;
· Le traitement médicamenteux ;
· La gestion des complications ;
· Les difficultés à prendre des
traitements ;
· L'organisation du suivi médical ;
· Le vécu de la maladie ;
· L'apprentissage des gestes d'auto-soins (injections
d'insuline, auto surveillance et autocontrôle glycémique)
(Legrand, 2014).
L'éducation thérapeutique du patient fait partie
intégrante de toutes les étapes de la prise en charge du patient
diabétique, quel que soit le type de diabète. Elle l'aide
à accepter et à comprendre sa maladie, à réaliser
ses objectifs thérapeutiques et à adhérer au traitement.
La gestion de sa maladie par le patient lui-même lui assure un meilleur
vécu de la maladie et une qualité de vie satisfaisante. Il faut
rendre le patient proactif vis à vis de sa pathologie, qu'il se
l'approprie (RUIZ et al, 2011).
I.3. CADRE CONCEPTUEL
|
Facteurs génétiques :
Un des parents diabétique ;
Deux parents diabétiques ;
Obésité gestationnelle ;
Surpoids ;
Diabète gestationnelle.
|
|
Facteurs environnementaux :
Sédentarité ;
Réduction du temps de sommeil ;
Tabagisme ;
Microbiote intestinale ;
Excès des aliments trop gras.
|
|
Apport calorique excessif
|
|
Hyper insulinémie
|
|
Taux sanguins AGL et TG élevés, dépôts
lipidiques ectopiques
|
Foie
Cellule beta
Tissus adipeux
Muscle
Insulinorésistance
Augmentation progressive de l'insulinorésistance
Compensation par la cellule beta
Altération de l'expression de gènes et des
facteurs de transcription de la cellule beta
Epuisement de la cellule beta
Diabète de type II
Source : élaboré par le chercheur lui seul
CHAPITRE II : MÉTHODOLOGIE
II.1 DEVIS DE LA RECHERCHE
Nous menons une étude Rétro-prospective
quantitative à viser Descriptive au Centre de diabétologie
Mellitus/CEDIA en vue de déterminer les caractéristiques
socio-sanitaires associées au diabète de type 2 dans la Ville de
Lubumbashi.
II.2. PRESENTATION DU MILIEU DE RECHERCHE
Il est question à ce stade de présenter le Centre
de diabétologie Mellitus/CEDIA de Lubumbashi en ce qui concerne sa
situation géographique, son historique, ses objectifs, son organisation
et son fonctionnement administratif.
II.2.1 SITUATION HISTORIQUE
Le centre Mellitus/ CEDIA a vu le jour en 2006 comme cabinet de
diabétologieprivé sous ladirection du médecin responsible,
le Docteur KASONGO Germain. En 2010 le centre sera transformé en une
Organisation Non-Gouvernemnentale (ONG)/AsblMellitus/CEDIA. Le centre compte
àce jour deux médecins et quatre paramédicaux.
II.2.2 LES OBJECTIFS
Le Centre dediabétologie Mellitus/CEDIA de Lubumbashi a
pour objectifs :
1. Prendre en charge les personnes vivant avec le diabète
sucré en ce qui concerne letraitement médicamenteux au
quotidian;
2. Assuer leur éducation continue ainsi que celle de leur
famille et leurs prochespour une gestion autonome de leur condition ;
3. Fournir aux gens vivant avec la condition, du matéiel
pour l'auto surveillancedans le but de rendre cette autonomie plus accessible
à toutes les categoriessociales ;
4. Sasciter un partenariat motivé pour rendre
I'accès aux anti-diabétiques oraux et àI'insalince moins
coûteux ;
5.Tendre à rendre gratuit la prise en charge des enfants
et adolescents à cause de
l'esperance de vie et du poids quasi insoutenable des soins;
6. A la fin contribuer à la diminution de l'impact
financier de cette maladie chronique sur les individus et la
société congolaise en vue du developpement.
II.2.3 SITUATION GÉOGRAPHIQUE
Le centre de diabétologie Mellitus/ CEDIA de Lubumbashi se
trouve dans l'enceinte dubátiment de I'institut national de
sécurité sociale (INSS/ Katanga I) sur l'avenue
MunongoNumero2234, dans la commune de Lubumbashi, Ville de Lubumbashi, province
du Haut-Katanga.
Ses limites géographiques sont déterminées
comme suit :
Ø Au Nord par 1'avenue Munongo ex Kasaï ;
Ø Au Sud par les bâtiments commerciaux de l'avenue
Sendwe;
Ø Al'Est et à l'Ouest par bâtiments
commerciaux.
II.2.4 ORGANISATION ET FONCTIONNEMENT
1.Medecin Responsable
Le Médecin Responsable a pour rôle :
Ø La consultation et éducation des malades
diabétiques ;
Ø La prescription des médicaments essentiels pour
les diabétiques ;
Ø La prescription des examens de laboratoire ;
Ø La coordinationde toutes les activités
médicales, paramédicales et financières du cabinet.
2.Assistant du Médecin
L'assistant du médecin responsable a aussi pour rôle
:
Ø Assiste le médecin responsable en ce qui concerne
les points 1 à 3 ci-dessus ;
Ø Joue I'intérim du médecin responsable en
son absence.
3.Administrateur du Centre
L'administrateur du centre a pour tâche :
Ø De veiller au bon fonctionnement administratif et
technique du cabinet médical auquotidien ;
Ø De procéder à I'achat des
médicaments essentiels, des intrants de laboratoire etd'autres
fournitures utiles ;
Ø De recevoir le rapport de comptabilité et de
finance au quotidien ;
Ø De faire un rapport détaillé au
médecin responsable.
4.Comptable et Caissier
Je comptable et caissier a pour tâche :
Ø De recevoir de l'argent et d'établir un
reçude chaque consultation, laboratoire;
Ø D'élaborer des rapports journaliers et mensuels
;
Ø De faire rapport journalierà l'administrateur.
5. Technicien de laboratoire :
Le technicien de laboratoire a pour rôle :
Ø De prélever les échantillons analyser sur
les malades lui adressés ;
Ø De faire rapport au médecindemandeuraprès
analyses ;
Ø De suppléer aux actes de Nursing en de son
absence.
6.Chef de Nursing :
Le chef de nursing joue les rôles que ci-haut :
Ø D'aider les malades à observer les soins leurs
prescrits par le médecin ;
Ø D'éduquer les malades et leur famille ;
Ø De soigner les malades qui sont en observation ;
Ø D'administrer aux malades les
médicamentsnécessaires ;
Ø En cas d'absence du titulaire il prélève
des échantillons pour laboratoire.
7. Chargé Des Fournitures Essentielles Pour Les
Patients Diabétiques De Type II
Le chargé des fournitures joue le rôle :
· De contrõler et de donner aux enfants les
fournitures dont ils ont besoin Aprèsvisitemédicale ;
· De percevoirde l'argent de vente des boissons et autres
fournitures ;
· De faire le rapport journalier à
l'administrateur.
8.Organisation De Prestation Du Personnel
Le centre Mellitus/ CEDIA est une institution hospitaliere qui
fonctionne chaque jour pendant
8heures de temps de la manieresuivante :
· Lundi-vendredi 08h30'-1Sh30' ;
· Samedi 08h30'- 12h00.
II.3 POPULATION CIBLE ET ÉCHANTILLONNAGE
II.3.1 POPULATION CIBLE
La population cible est l'ensemble de sujets ou des
éléments définis par les critères établis
pour l'étude. Ils ont en commun une ou plusieurs caractéristiques
(OMAYONDO. MC, 2019).
Selon AMULI (2013), c'est l'ensemble des unités
concernées par l'objet d'étude auquel on peut tirer
l'échantillon. C'est l'ensemble des individus auxquels on veut influer
les résultats des observations faites sur l'échantillon. Donc
c'est une population spécifique de l'étude.
Pour notre étude, elle est constituée de toutes
personnes Diabétiquesfréquentant le Centre de
DiabétologieMellitus/CEDIA etrésidant dans la ville de
Lubumbashi.
II.3.2. CRITÈRES DE SÉLECTION
A. Critères d'inclusion
Pour faire partie de notre échantillon, un sujet
d'étude devrait répondre à chacun des critères
d'éligibilité suivant :
· Être Diabétique habitant dans la ville de
Lubumbashi ;
· Avoir été enregistré pour un cas de
Diabète de type 2 au Centre de Diabétologie Mellitus/CEDIA de
Lubumbashi.
B. Critères d'exclusion
Toute personne n'étant pas Diabétique et n'ayant
pas un cas de diabète de type 2 sera exclue de notre étude.
II.3.3 ÉCHANTILLONNAGE
C'est une opération qui consiste à identifier un
sous-groupe d'individus dans une population cible afin d'y récolter les
données statistiques : les informations obtenues sur
l'échantillon sont censées être celles très proches
de la réalité de la population. (AMULI J. 2012)
Ainsi pour notre étude nous avons parcouru à
l'échantillonnage probabiliste du type aléatoire simple.
II.3.4 TAILLE DE L'ÉCHANTILLON
OMANYONDO (2014), affirme que l'échantillon, est un groupe
d'objets ou de sujets provenant d'une population cible et ayant les mêmes
caractéristiques que celle-ci.
La taille de l'échantillon est calculée à
partir de la prévalence de diabète de type 2 observée dans
le Haut-Katanga, précisément dans la ville de Lubumbashi.
Ainsi, dans les données récentes il y a un
pourcentage pour le Diabète de Type 2 dans la ville de Lubumbashi ;
qui est de 5%( Centre de diabétologie Mellitus/CEDIA).
Selon notre cas, nous avons calculé la taille de
l'échantillon à l'aide de la formule de
« FICHER » :
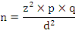
n : Taille de l'échantillon ;
  : Degré de précision voulu ; : Degré de précision voulu ;
P : Proportion des personnes touchées par le
Diabète de type 2 ;
q : Proportion des personnes qui ne sont pas touchées
par le Diabète de type 2(q=1-p) ;
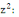 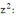 Coefficient de confiance. Coefficient de confiance.
NB :  
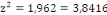
P=5%=0,05
q=1-0,05=0,95
n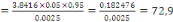 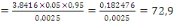
Nous ajoutons le dix (10%) à notre taille pour minimiser
les erreurs, ainsi nous obtenons de 80
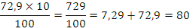
II.4. MÉTHODES, TECHNIQUES ET OUTILS DES COLLECTES
DES DONNEES
II.4.1. MÉTHODES
Toute recherche ou application des caractères
scientifiques doit être appuyée par l'utilisation des
procédés opératoires bien adaptés au genre des
problèmes et des phénomènes en étude.
Pour collecter les données, nous avons recouru à
l'analyse documentaire (fiches et registres des Diabétiques) et la
Grille de Recherche, pour parvenir à la possibilité de recueillir
les données en rapport avec les variables de l'étude.
II.4.2 TECHNIQUES
Les techniques représentent les étapes
d'opérations limitées, liées à des
éléments pratiques, concrets, adaptés à un but
définit d'une étude. Par ailleurs, c'est l'ensemble des
procédés méthodologiques exploités par le chercheur
à la phase de collecte de données qui intéresse une
étude afin d'atteindre le but fixé.
Ainsi nous avons utilisé les techniques d'observation
directe, participante et interview qui a consisté à poser les
questions aux enquêtés préétablies sur une Grille de
Recherche.
II.4.3 OUTILS DES COLLECTES DES DONNEES
Pour collecter nos données nous avons recourus aux
instruments suivants :
· Les fiches et registres des Diabétiques ;
· Le stylo ;
· Les papiers ;
· La Grille de Recherche.
II.5. DÉROULEMENT DE L'ETUDE
Pour réaliser la collecte des données lors de notre
étude, nous nous étions servi de l'attestation de recherche nous
décernée par le Secrétaire général
Académique de l'ISTM-Lubumbashi, de qui nous avons eu l'autorisation de
rencontrer le responsable de Centre de diabétologie Mellitus/CEDIA de
Lubumbashi et y remplir certaines formalités administratives et
financières à qui nous avons expliqués la pertinence de
l'étude, à son tour il nous a présenté les fiches
et registres et aussi les enquêtés pour échanger avec eux
concernant notre étude.
Ainsi nous avions collecté nos données tout en
restant strict aux critères d'inclusion.
II.6 ANALYSE DES DONNÉES
Au regard de l'objectif général
préalablement fixé, nous avons fait recours à l'analyse
descriptive pour traiter les données recueillies auprès des
enquêtés. Ceci a consisté à la transcription des
opinions recueillies en donnant la signification des verbatim des
enquêtés. Nous avons procédé d'abord au
dépouillement manuel en circonscrivant les différentes variables
constituant le sujet de l'étude et après les données ont
été saisies grâce au logiciel de Microsoft Word et les
analyses ont étéfaites avec le logiciel EPI-INFO.
Signalons que les fréquences répertoriées
seront transformées en pourcentage (%).
II.7. CONSIDÉRATIONS ÉTHIQUES
Durant notre recherche, nous avons tenu compte de quelques
valeurs morales et éthiques auprès de notre population en
respectant le processus ci-après :
v La participation volontaire à l'étude ;
v La confidentialité des données ;
v Le respect de la dignité ;
v L'anonymat de résultats.
Le secret professionnel reste la base de notre Déontologie
Médicale.
CHAPITRE III. RESULTATS
III .1. CARACTERISTIQUES SOCIODEMOGRAPHIQUES
III.1.1. AGE DES DIABETIQUES
Figure 1. Histogramme de l'âge des Diabétiques.
L'âge moyen des Diabétiques était de 50,73
#177; 10,95 ans avec un âge minimal de 30 ans et un âge maximal de
75 ans.
III.1.2. SEXE DES DIABETIQUES.
Tableau I. Répartition des Diabétiques selon le
sexe
|
SEXE
|
FREQUENCE
|
POURCENTAGE
|
|
F
|
46
|
57,50%
|
|
M
|
34
|
42,50%
|
|
Total
|
80
|
100,00%
|
Ce tableau montre que 57,50% des diabétiques Etaient de
sexe féminin contre 42,50% des diabétiques de sexe masculin. Le
sexe ratio Femme-Homme des diabétiques était d'un homme pour 1,4%
Femme.
III.1.3. ETAT CIVILE DES DIABETIQUES
Tableau II. Répartition des diabétiques selon leur
état civil
|
ETAT CIVIL
|
FREQUENCE
|
POURCENTAGE
|
|
CELIBA
|
4
|
5,00%
|
|
DIVORCE
|
7
|
8,75%
|
|
MARIE
|
61
|
76,25%
|
|
VEUF
|
1
|
1,25%
|
|
VEUVE
|
7
|
8,75%
|
|
Total
|
80
|
100,00%
|
IL sied de ce tableau que la majorité des
diabétiques soit 76,25% étaient mariés contre 1,25% qui
était le veuf.
III.1.4. NIVEAU D'INSTRUCTION DES DIABETIQUES
Tableau III. Répartition des diabétiques
selon le niveau d'instruction
|
INSTRUCTION
|
FREQUENCE
|
POURCENTAGE
|
|
PRIMAIRE
|
3
|
3,75%
|
|
SECONCOD
|
30
|
37,50%
|
|
SUPERIEUR
|
47
|
58,75%
|
|
Total
|
80
|
100,00%
|
Ce tableau prouve que les universitaires étaient
majoritaires soit 58,75% contre 3,75% des diabétiques de niveau
primaire.
III.1.5. LES PROFESSIONS DES DIABETIQUES
Tableau IV. Répartition des diabétiques
selon la profession
|
PROFESSION
|
FREQUENCE
|
POURCENTAGE
|
|
COMMERCT
|
43
|
53,75%
|
|
CULTI
|
1
|
1,25%
|
|
FON D'ETAT
|
22
|
27,50%
|
|
LIBERAL
|
14
|
17,50%
|
|
Total
|
80
|
100,00%
|
Ce tableau montre que la majorité des Diabétiques
soit 53,75% étaient les commerçants contre 1,25% de
cultivateur.
III.1.6. RESIDENCE DES DIABETIQUES.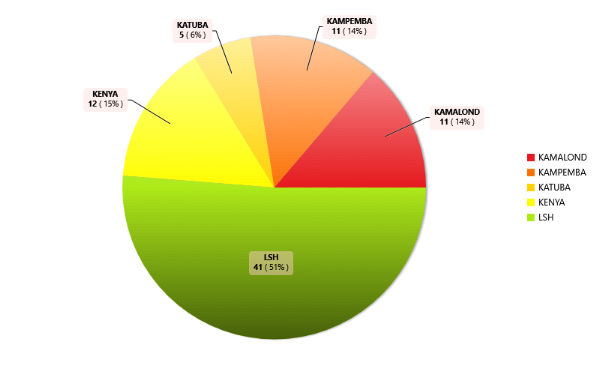 Figure 2. Répartition des Diabétiques selon la
résidence Figure 2. Répartition des Diabétiques selon la
résidence
Cette figure montre que la majorité des Diabétiques
soit 51% provenaient de la commune de Lubumbashi contre 5% des
Diabétiques Qui provenaient de la commune de Katuba.
III.2. LES PARAMETRES
III.2.1. POIDS DES DIABETIQUES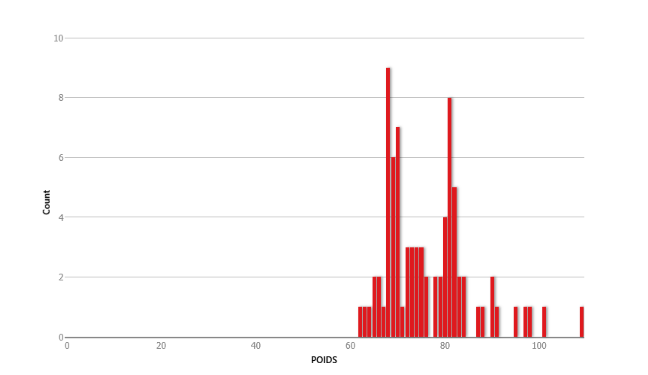 Figure 3 Répartition des diabétiques selon leur poids Figure 3 Répartition des diabétiques selon leur poids
Il ressort de cette histogramme que le poids moyen des
diabétiques Étaient de 76,39 #177; 9,30 kg avec un poids minimal
de 62 kg et un poids maximal de 109 kg.
III.2.2 TAILLE DES DIABETIQUES
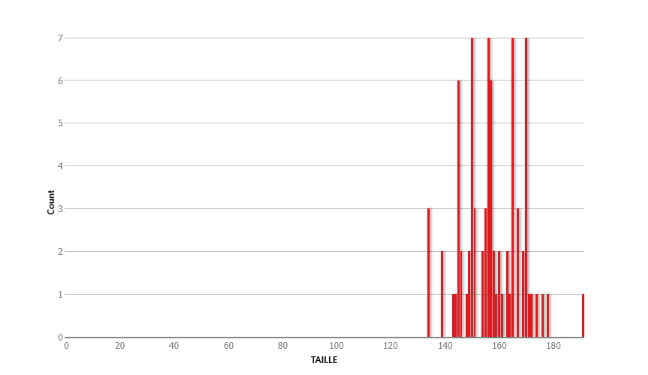 Figure 4 Répartition des diabétiques selon leur taille Figure 4 Répartition des diabétiques selon leur taille
Cette figure montre que la taille moyenne des diabétiques
était de 157,21 #177; 10,94 cm avec une taille minimale de 134 cm et une
taille maximale de 191 cm.
III.2.3. ANCIENNETE DE LA MALADIE DES DIABETIQUES
Tableau V. Répartition Des Diabétiques
Selon L'ancienneté De La Maladie
|
ANC DE MALADIE
|
FREQUENCE
|
POURCENTAGE
|
|
1
|
12
|
15,00%
|
|
2
|
9
|
11,25%
|
|
3
|
6
|
7,50%
|
|
4
|
26
|
32,50%
|
|
5
|
8
|
10,00%
|
|
6
|
4
|
5,00%
|
|
7
|
5
|
6,25%
|
|
8
|
4
|
5,00%
|
|
9
|
3
|
3,75%
|
|
10
|
2
|
2,50%
|
|
12
|
1
|
1,25%
|
|
Total
|
80
|
100,00%
|
L'analyse de ce tableau montre que la majorité des
Diabétiques soit 32 ,50% étaient diabétiques depuis 4
ans contre 1,25% étaient des Diabétiques y a déjà
12 ans.
III.2.4. ANCIENNETE DE TRAITEMENT DES DIABETIQUES
Tableau VI. Répartition Des Diabétiques
Selon L'ancienneté De Traitement
|
ANCIENNETE DE TRAITEMENT
|
FREQUENCE
|
POURCENTAGE
|
|
1
|
15
|
18,75%
|
|
2
|
8
|
10,00%
|
|
3
|
12
|
15,00%
|
|
4
|
25
|
31,25%
|
|
5
|
5
|
6,25%
|
|
6
|
3
|
3,75%
|
|
7
|
4
|
5,00%
|
|
8
|
3
|
3,75%
|
|
9
|
3
|
3,75%
|
|
10
|
1
|
1,25%
|
|
12
|
1
|
1,25%
|
|
Total
|
80
|
100,00%
|
L'analyse de ce tableau montre que la majorité des
Diabétiques soit 31,25% étaient sous traitement depuis 4 ans
contre 1,25% qui était aussi sous traitement depuis 10 et 12ans.
III.2.5 TRAITEMENT DES DIABETIQUES
Tableau VII. Répartition des diabétiques
selon les types de traitements
|
TYPE DE TRAITEMENT
|
FREQUENCE
|
POURCENTAGE
|
|
MED
|
42
|
52,5%
|
|
NUTR
|
38
|
47,50%
|
|
Total
|
80
|
100,00%
|
Ce tableau montre que le traitement administré aux
diabétiques était médical à 52,5% contre le
traitement nutritionnel qui était à 47,5%.
III.2.6. RESPECT DE TRAITEMENTS DES DIABETIQUES
Tableau VIII. Répartition Des Diabétiques
Selon Le Respect De Traitement Médical
|
RESPECT TRAITEMENT MED
|
FREQUENCE
|
POURCENTAGE
|
|
NON
|
10
|
12,50%
|
|
OUI
|
70
|
87,50%
|
|
Total
|
80
|
100,00%
|
87,50% des diabétiques respectaient le traitement
médical contre 12,50% des diabétiques qui ne respectaient pas le
traitement médical.
Tableau IX. Répartition Des Diabétiques
Selon Le Respect De Traitement Nutritionnel
|
RESPECT TRAITEMENT NUT
|
FREQUENCE
|
POURCENTAGE
|
|
NON
|
17
|
21,25%
|
|
OUI
|
63
|
78,75%
|
|
Total
|
80
|
100,00%
|
78,75% soit 63/80 des diabétiques respectaient le
traitement nutritionnel contre 21,25% des diabétiques qui ne
respectaient pas.
III.2.7. APPLICATION DE SPORT DES DIABETIQUES
Tableau X. Répartition Des Diabétiques
Selon La Pratique De Sport
|
EXCERCICE PHYSIQUE
|
FREQUENCE
|
POURCENTAGE
|
|
NON
|
30
|
37,97%
|
|
OUI
|
49
|
62,03%
|
|
Total
|
79
|
100,00%
|
La majorité des diabétiques soit 62,03%
pratiquaient les exercices physiques contre 37,97% qui ne pratiquaient pas le
sport.
III.2.8. LES CAUSES/FACTEURS DE DIABETE
Tableau XI. Répartition Des Diabétiques
Selon Les Causes
|
CAUSES/FACTEURS
|
FREQUENCE
|
POURCENTAGE
|
|
HEREDITAIRE
|
17
|
21,25%
|
|
AUTRES
|
27
|
33,75%
|
|
FACTEURS ENV
|
36
|
45,00%
|
|
Total
|
80
|
100,00%
|
Il ressort de ce tableau que la majorité des
diabétiques soit 45,00% avaient eu le diabète à travers
les facteurs environnementaux contre 21,25% d'héréditaires.
III.2.9 L'HYPERTENSION ARTERIELLE CHEZ LES DIABETIQUES
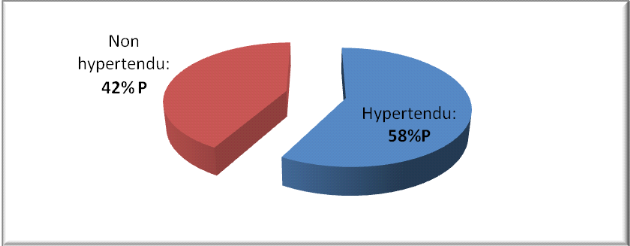
Figure 5 : Répartition des patients en fonction de
L'HTA.
L'hypertension artérielle était présente
chez 58% des patients.
III.3. ANALYSES BIVARIEES
Tableau I. ASSOCIATION ENTRE SEXE ET LE RESPECT DE REGIME
|
SEXE
|
RESPECT TR NUT Test
Epidémiologique
|
|
NON
|
OUI
|
Total
|
Pe= 21,74%
Pne= 21,25%
RP= 0,4
OR= 1,0714[0,36-3,2]
|
|
F
|
10
|
36
|
46
|
|
M
|
7
|
27
|
34
|
|
TOTAL
|
17
|
63
|
80
|
Les diabétiques de sexe féminin avaient 1,071% plus
de risque de diabète comparer aux diabétiques de sexe masculin,
et cette différence était statistiquement significative.
CHAPITRE IV : DISCUSSION
Le diabète est une maladie métabolique
caractérisée par une hyperglycémie chronique
résultant d'un défaut de sécrétion et/ou d'action
de l'insuline, responsable à long terme des complications micro et
macro vasculaires. Notre sujet portant sur « étude des
caractéristiques socio-sanitaires associées au diabète de
type 2 dans la ville de Lubumbashi » à montre les
résultats suivants :
IV.1. AGE DES DIABETIQUES
L'âge moyen des Diabétiques était de 50,73
#177; 10,95 ans avec un âge minimal de 30 ans et un âge maximal de
75 ans.
Des résultats similaires ont été
retrouvés dans l'étude de Djellaliet al (2019) qui ont
montré que la majorité des patients appartenaient à la
tranche d'âge de 50 à 55 ans. Les variations observées au
niveau des effectifs restent significatives. Le risque de développer la
maladie augmenterait avec l'âge. Ce risque s'accroît encore lorsque
l'âge est associé à l'obésité du fait
à la fois d'une augmentation de la résistance à l'insuline
et d'une réduction de sa sécrétion.
IV.2. SEXE DES DIABETIQUES
Ce tableau montre que 57,50% des diabétiques Etaient de
sexe féminin contre 42,50% des diabétiques de sexe masculin. Le
sexe ratio Femme-Homme des diabétiques était d'un homme pour 1,4%
Femme.
Ces résultats concordent avec ceux de Mwepu (2019) qui
dans son étude a respectivement trouvé une prédominance
féminine (soit sex ratio de 1,3%) mais diffèrent de ceux de Demba
(2019) qui dans son étude a trouvé un sex-ratio de 2,4% en faveur
des femmes.
IV.3. ETAT CIVILE DES DIABETIQUES
IL sied de ce tableau que la majorité des
diabétiques soit 76,25% étaient mariés contre 1,25% qui
était le veuf.
En effet nos données sont semblables à celles
trouvées par Keita (2020) ; 70,43% étaient des mariés
et que les veufs étaient à 3%.
IV.4. NIVEAU D'INSTRUCTION DES DIABETIQUES
Ce tableau prouve que les universitaires étaient
majoritaires soit 58,75% contre 3,75% des diabétiques de niveau
primaire.
Contrairement aux résultats trouvés parAlpha, il
prouve dans son étude que la majorité soit 42% des
diabétiques étaient sans niveau d'instruction.
Nous pouvons nous demander si cela n'influence pas sur leur
compréhension de la maladie et la représentation qu'ils en
ont.
IV.5. LES PROFESSIONS DES DIABETIQUES
Ce tableau montre que la majorité des Diabétiques
soit 53,75% étaient les commerçants contre 1,25% de
cultivateur.
Cette même prédominance des commerçants a
été observée par CISSE 43,2% ; Touré 49,3% ;Keita
47,62%.Ceci pourrait s'explique par le fait que ces commerçants sont
dans la boutiques immobiles pendants plusieurs heurs et font plusieurs
collations.
IV.6. RESIDENCE DES DIABETIQUES
Cette figure montre que la majorité des Diabétiques
soit 51% provenaient de la commune de Lubumbashi contre 5% des
Diabétiques Qui provenaient de la commune de Katuba.
Nos données recueillies sont appuyées par celles de
BankaminaKandonde sur connaissance et pratique de l'alimentation des
diabétiques dans la ville de Lubumbashi ; il avait conclu que
49,76% étaient des diabétiques qui provenaient de la commune de
Lubumbashi.
IV.7. POIDS DES DIABETIQUES
Il ressort de cette histogramme que le poids moyen des
diabétiques Étaient de 76,39 #177; 9,30 kg avec un poids minimal
de 62 kg et un poids maximal de 109 kg.
Par contre Belletavait trouvé 78,35#177;10,26kg.Ceci
s'explique par la consommation importante des graisses par les patients.
IV.8 TAILLE DES DIABETIQUES
Cette figure montre que la taille moyenne des diabétiques
était de 157,21 #177; 10,94 cm avec une taille minimale de 134 cm et une
taille maximale de 191 cm.
Comparativement à une étude menée par
Lupangu Bernard (2021), sur les facteurs influençant les diabètes
dans la Zone de Santé de Lubumbashi, ildémontre que la taille
moyenne de ces enquêtés était de 160#177;8,56cm.
IV.9. ANCIENNETE DE LA MALADIE DES DIABETIQUES
L'analyse de ce tableau montre que la majorité des
Diabétiques soit 32 ,50% étaient diabétiques depuis 4
ans contre 1,25% étaient des Diabétiques y a déjà
12 ans.
Cette ancienneté du diabète à était
retrouvée par Coulibaly Ismaël qui était inférieur
à 5 ans soit 40%, contrairement à l'Europe ou la durée
moyenne d'évolution a été de 10 ans pour MOUKOURI EDN et
al. Ceci pourrait s'expliquer par le fait que le diabète est
découvert généralement tard chez nos patients.
IV.10. ANCIENNETE DE TRAITEMENT DES DIABETIQUES
L'analyse de ce tableau montre que la majorité des
Diabétiques soit 31,25% étaient sous traitement depuis 4 ans
contre 1,25% qui était aussi sous traitement depuis 10 et
12ans.Conformément à ce qu'a montré l'étude de
UKPDSet celle de D.Duhot et al réalisée à partir des
données de l'observatoire de médecine générale.
Plus le diabète est ancien plus on dure encore sous traitement Ceci
pourrait s'expliquer par le fait que plus le patient vit longtemps avec le
diabète, plus il a une lassitude par rapport à la prise en charge
de la maladie.
IV.11. RESPECT DE TRAITEMENTS DES DIABETIQUES
78,75% soit 63/80 des diabétiques respectaient le
traitement nutritionnel contre 21,25% des diabétiques qui ne
respectaient pas.
Ces résultatsse rapprochent de ceux indiqués par
une étude réalisée en îlede France. Nous avons pu
remarquer que 76%de nos patients respectaient les mesures
hygiéno-diététiques avec un taux de non observant à
26,32%. Ceci pourrait s'expliquer par le manque d'argent, le déni de la
maladie et ceux qui profitent du caractère asymptomatique du
diabète surtout en période d'équilibre pour ne pas suivre
une bonne hygiène diététique.
IV.12. APPLICATION DE SPORT DES DIABETIQUES
La majorité des diabétiques soit 62,03%
pratiquaient les exercices physiques contre 37,97% qui ne pratiquaient pas le
sport.
Nos résultats sont en accord avec l'étude
menée par de Silvera en île de France60% des patients pratique
l'activité physique contre 39,8%. Parmi les 30 patients qui disent ne
pas avoir d'activité physique certains le déplore et l'explique
:
ï Je suis asthmatique quand je fais du sport j'ai des
difficultés à respirer.
ï Je me suis fracturé le col du fémur lors
d'une chute dès lors je n'ai plus d'activité physique.
ï Mon fils est diabétique et il m'encourage qu'on
fasse la marche ensemble mais je suis toujours saisie par la paresse.
Il est difficile d'évaluer la fréquence et la
durée de la pratique s'il est ou non conforme aux recommandations
émises par l'ALFEDIAM et l'HAS, car nos patients
n'évaluent pas la durée ni la fréquence de
l'activité physique.
IV.13. LES CAUSES/FACTEURS DE DIABETE.
Il ressort de ce tableau que la majorité des
diabétiques soit 45,00% avaient eu le diabète à travers
les facteurs environnementaux contre 21,25% d'héréditaires.
Contrairement à CISSE, Touré et Diakité
Schez lesquels le facteur ou la cause était héréditaire.
Ceci pourrait s'expliquer par le fait que notre étude a porté sur
les diabétiques de type 2 et encore Ceci pourrait s'expliquer par la
sédentarité actuelle de la population et que la prise de poids
est considérée comme une réussite sociale, un signe de
bonne santé, de prospérité dans notre milieu
d'étude.
IV.14. L'HYPERTENSION ARTERIELLE CHEZ LES DIABETIQUES
L'hypertension artérielle était présente
chez 58% des patients.
Ce résultat ne se diffère pas de celui de
Mwepu(2019) qui a montré que l'hypertension artérielle
était la maladie la plus associée au diabète avec une
fréquence de 33,3 %. Cependant, Maurier (2017) a trouvé une
fréquence plus élevée (51%) attribuable à la
situation sociale précaire des populations cibles. Les principaux
facteurs de risques associés au diabète étaient :
l'âge, le surpoids, l'obésité,l'alimentation et le mode de
vie des patients tous ces facteurs peuvent influencés l'hypertension
artérielle chez les diabétiques de type 2.
CONCLUSION
Le diabète est donc dû à une insuffisance
d'insuline ou au mauvais fonctionnement de cette hormone, Malgré
l'évolution de la recherche médicale qui avance tous les jours,
le diabète reste une maladie qui se soigne très bien mais qui ne
se guérit pas. Il faut donc, toute sa vie, se surveiller, garder de
bonnes habitudes alimentaires, pratiquer une activité physique et
prendre régulièrement son traitement. Un diabétique peut
donc être un malade en bonne santé. Cela à motiver notre
attention de mener une étude
intitulée : « étude des
caractéristiques socio-sanitaires associées au diabète de
type 2 dans la ville de Lubumbashi »
Cette étude a pour objectif de déterminer les
caractéristiques socio-sanitaires associées au diabète de
type II envie de contribuer à l'amélioration de la
prévention de ce fléau dans notre communauté.
Pour atteindre le but poursuivi de cette étude, nous nous
sommes fixés les objectifs suivants :
· Identifier leurs caractéristiques
sociodémographiques ;
· Connaitre leur poids moyen ;
· Déterminer les types de traitements ;
· Vérifier le respect de traitement nutritionnel chez
les diabétiques ;
Nous avons fait recours à la méthode d'analyse
documentaire (fiches et registres des Diabétiques) et la Grille de
Recherche, la technique utilisée était interview. Ainsi notre
échantillon était de 80 sujets.
Apres analyse et interprétation des données nous
avons abouti aux résultats suivants :
§ 50,73 #177; 10,95 ans était âge moyen, avec
un âge minimal de 30 ans et un âge maximal de 75 ans ;
§ 76,39 #177; 9,30 kg étaient le poids moyen des
diabétiques avec un poids minimal de 62 kg et un poids maximal de 109
kg ;
§ 157,21 #177; 10,94 cm était la taille moyenne des
diabétiques, avec une taille minimale de 134 cm et une taille maximale
de 191 cm ;
§ 52,5% des diabétiques étaient
administrés au traitement médicalcontre 47,5% de traitement
nutritionnel ;
§ 78,75% soit 63/80 des diabétiques respectaient le
traitement nutritionnel contre 21,25% des diabétiques qui ne
respectaient pas.
Par ailleurs, les patients n'ont pas toujours pleinement
conscience de leur rôle capital et de l'importance de leur implication
« active » dans la prise en charge de leur maladie, qui est une
condition indispensable pour une prévention efficace, car si le
rôle du médecin est de conseiller, de guider, de motiver, le
rôle du patient est d'agir. Or, aucune action n'est efficace que si elle
est consciemment décidée. En définitive, le médecin
ne peut pas agir seul ; il doit impérativement faire équipe avec
son patient pour maîtriser et influencer favorablement l'évolution
de cette affection chronique.
RECOMMANDATIONS
1.AUX AUTORITES PROVINCIALES :
· Etablir des directives pour l'application correct des
mesures hygiéno-diététiques ;
· Multiplier la formation des personnels soignants aux
dépistages et la prise en charge du diabète ;
· Assurer la disponibilité des
Diététiciens-Nutritionnistes dans les unitésde la prise en
charge du diabète.
2.AUXMEDECINS TRAITANTS :
· Aborder les mesures
hygiéno-diététiques comme une amélioration du mode
de vie en vue d'éviter des complications en précisant que
celles-ci s'appliquent à tous et pas seulement aux patients atteints de
diabète ;
· Ecrire l'activité physique et la planification
alimentaire en premier sur l'ordonnance à chaque fois ;
· Faire en sorte que les patients diabétiques
assistent à plusieurs consultations annuelles consacrées à
l'éducation thérapeutique.
3.AUX PATIENTS DIABETIQUES :
· De prendre conscience de leur maladie et s'impliquer dans
la bonne observance des mesures
hygiéno-diététiques ;
· De ne pas abandonner le programme d'exercice par lassitude
ou manque de stimulation ;
· D'Augmenterla consommation des fruits et
légumes ;
· Comprendre qu'un diabétique peut vivre aussi
longtemps qu'un non diabétique ;
· De préparer et surveiller son repas.

| 


