3.2.1.1. Synthèse
Les liposomes peuvent être préparés par
plusieurs méthodes :
? Hydratation d'un film mince «
méthode de BANGHAM »
Consiste à évaporer une solution organique de
lipide puis remettre le résidu en suspension dans un solvant aqueux,
à une température supérieure à la
température de transition de phase du lipide ce qui conduit à la
formation de (MLV) 1-5 ìm.
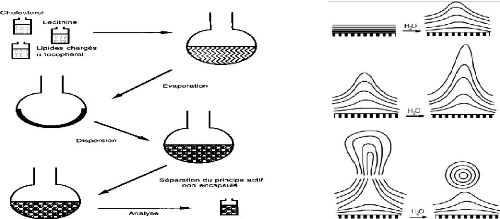
Figure 5: Préparation des liposomes par
la méthode de BANGHAM [57].
Chapitre I Nanotechnologie Et
Nanomedecine

9
? Emploie d'un Co-solvant.
Consiste à additionner une solution organique de lipide
dans une solution aqueuse sous forte agitation et
éliminer le solvant par évaporation, pour donner
une émulsion ou une dispersion de liposomes.
? Sonication ou extrusion des MLV.
Elle est appliquée à travers une membrane en
polycarbonate, à une température supérieure à la
température de transition de phase des lipides à
fin d'obtenir des SUV.
? Congélation/décongélation des MLV.
Consiste à fragiliser la membrane des MLV pour qu'elles se
recombinent en liposomes LUV.
3.2.1.2. Inclusion du principe actif
? De façon passive
Par incorporation directe du PA hydrophobe dans une solution
de lipides lors de la formation des liposomes avec une efficacité
d'inclusion de 5 à 15%.
Par hydratation de film mince « un solvant de
réhydratation contient le PA hydrophile qui est encapsule lors de la
formation des liposomes. Le taux d'inclusion est faible mais peut être
amélioré lors de la formation de SUV par extrusion, en utilisant
comme solvant d'extrusion une solution aqueuse de PA ». ? De façon
active
Par addition d'une solution organique de PA hydrophobe dans
une solution aqueuse de liposomes, suivie d'une dialyse pour éliminer le
solvant et le PA.
Inclusion par gradient de pH utilisée dans le cas d'un
PA hydrophile faiblement basique et consiste à créer un gradient
de pH entre l'intérieur et l'extérieur de la diffusion qui
continuera de l'extérieur à l'intérieur jusqu'à
inclusion de la totalité du PA ou jusqu'à la disparition du
gradient de pH. Des taux d'inclusion importants peuvent être atteints.
3.2.1.3. Relargage des principes actifs
Le relargage de PA hydrophiles est gouverne par la structure du
liposome, et en particulier par
? L'épaisseur de la membrane, qui dépend du PM du
lipide.
? La perméation de l'eau à travers la membrane
qui dépend de la mobilité des chaines hydrophobes. Les liposomes
auront des temps de relargage courts pour réduire la mobilité,
des molécules de cholestérol sont ajoutées à la
solution de phospholipide [5].
Les liposomes sont des véhicules de principes actifs
importants principalement dans la prise en charge de molécules
hydrophiles. La fonctionnalisation par des PEG et des ligands de ciblage permet
à ces objets d'atteindre les tissus tumoraux et de libérer les
médicaments sur la cible thérapeutique [5].
Chapitre I Nanotechnologie Et
Nanomedecine
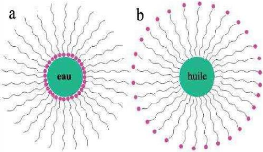
Figure 6: Structure de la micelle
inverse (a) et directe(b) [2].
3.2.2. Micelles
La première utilisation de micelles polymères
pour le traitement du cancer était en début des années
1980 par Ringsdorf et ses collègues.
Ces particules sphériques sont de taille
nanométrique (10-100 nm) formé à partir de
l'auto-assemblage des amphiphile biocompatible des copolymères à
blocs dans les milieux aqueux à partir d'une concentration donnée
appelée
concentration micellaire critique (CMC).

10
Cette CMC dépend de la nature de la molécule
amphiphile et des conditions expérimentales [4].
L'architecture coeur-couronne est importante pour les
médicaments pour des fins de vectorisation, parce que le noyau
hydrophobe peut agir comme un réservoir de médicaments insolubles
dans l'eau, tandis que l'enveloppe extérieure protège la micelle
de la libération rapide du PA (Fig8).
Bien que plusieurs aspects fonctionnels des blocs constitutifs
ont été explorées (température ou pH sensibles),
les critères les plus importants sont la biocompatibilité et /ou
biodégradabilité.
Globalement, il existe deux types de micelles :
? Les micelles à coeur hydrophobe dispersibles dans un
solvant aqueux.
? Les micelles à coeur hydrophile dispersibles dans un
solvant apolaire [4].
Les micelles de polymères permettent l'utilisation
in vivo de médicaments déjà existants par
ailleurs jugé trop hydrophobe ou toxiques, sans avoir à manipuler
le produit chimique ou la structure de l'agent. De plus, l'encapsulation du
médicament dans le noyau de polymère et la CMC très faible
(typiquement de l'ordre de 10-610-7M), permet la
stabilité du médicament en entravant la dégradation
enzymatique et l'inactivation [6].
Chapitre I Nanotechnologie Et Nanomedecine
| 


