II.1.2. FORMATION DES UNITES
ISOPRENIQUES
Le mévalonate est phosphorylé de façon
séquentielle par l'ATP grâce à trois kinases, et
après décarboxylation (figure 4), il y a formation de
l'unité isoprénique activée, l'isopentényl
disphosphate.
II.1.3. UNITES ISOPRENIQUES
FORMENT LE SQUALENE
Il y a isomérisation de l'isopentényl
disphosphate par déplacement de la double liaisons et formation du
diméthylallyl diphosphate, qui est ensuite condensé avec une
autre molécule d'isopentényl diphosphate pour former le
géranyl diphosphate un intermédiaire à 10 atomes de
carbone (figure 4). Une autre condensation avec l'isopentényl
diphosphate forme le farnésyl diphosphate. Deux molécules de
farnésyl diphosphate se condensent en joignant leurs
extrémités diphosphates, ce qui forme le squalène. Un
pyrophosphate inorganique est d'abord éliminé lors de la
formation du pré-squalène diphosphate, lequel est ensuite
réduit par NADPH avec élimination d'une autre molécule de
pyrophosphate inorganique.

Figure 3 Biosynthèse du
mévalonate.
La H MG-CoA réductase est inhibée par les
statines.


Figure 4 Biosynthèse du squalène,de
l'ubiquinone,du dolichol et d'autres
dérivés polyisopréniques.
Un résidu farnésyle est présent dans
l'hème a de la cytochrome oxydase. L'atomede carbone marqué par
une astérisque deviendra l'atome C11 ou C12 du
squalène. La squalène synthétase est une enzyme
microsomiale ; toutes les autres enzymes apparaissant sur cette figure
sont des protéines cytosoliques solubles, et quelques-unes sont
localisées dans les peroxysomes.
II.1.4. FORMATION DU
LANOSTEROL

Le squalène peut se replier en une structure qui
ressemble beaucoup à celle du noyau des stéroïdes (figure
5).Avant la fermeture des cycles, le squalène est transformé en
2, 3-époxy squalène par la squalène époxydase, une
oxydation à fonction mixte du réticulum endoplasmique. Le
groupement méthyle du C14 va se fixer sur le C13 et celui du
C8 sur le C14, cette réaction est catalysée
par l'oxydosqualène : lanostérol cyclase.
Figure 5. Biosynthèse du
lanostérol
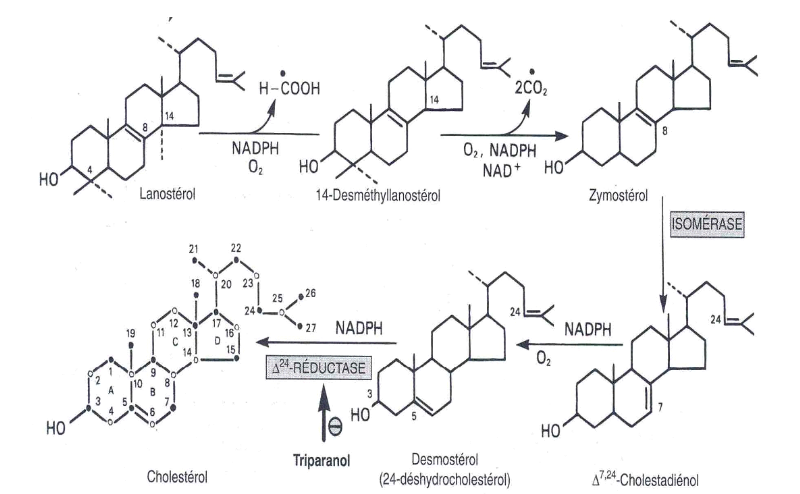
Figure 6 Biosynthèse du
cholestérol.
La numérotation des diverses positions est la
même que celle du noyau des stéroïdes.
II.1.5. FORMATION DE
CHOLESTEROL
La formation du cholestérol à partir du
lanostérol, a lieu dans les membranes du réticulum endoplasmique
et entraine des changements dans le noyau stéroïde et dans la
chaine latérale (figure 6). Les groupements méthyles fixés
sur le C14 et C4 sont éliminés pour former
le 14-desméthyl lanostérol puis le zymostérol. La double
liaison entre C8 et C9est ensuite déplacée
entre C5 et C6 en deux étapes pour former le
desmostérol. Enfin, la double liaison de la chaine latérale est
réduite pour produire le cholestérol (RUSSEL D.W, 1992).
a) Le farnesyldiphosphate donne naissance au dolichol
et à l'ubiquinone
Deux polyisoprénoides, le dolichol et l'ubiquinone se
forment à partir du farnésyl diphosphate par addition
supplémentaire d'isopentényl diphosphate, avec respectivement
jusqu'à 16 résidus (dolichol) ou 3 à 7 résidus
(ubiquinone). Au niveau de la membrane cellulaire, quelques protéines
associées au GTP, subissent une prénylation par des
résidus farnésyle ou géranyl (20 atomes de carbone). On
pense que la prénylation des protéines facilite leur ancrage dans
les membranes lipidiques et pourrait aussi être impliquée dans les
interactions entre protéines et dans le trafic des protéines
associées aux membranes.
b) La régulation de la HMG-CoA réductase
contrôle la synthèse du cholestérol
La régulation de la synthèse du
cholestérol s'exerce pratiquement au début de cette voie
métabolique à l'étape catalysée par la HMG-CoA
réductase. La réduction de synthèse du cholestérol
chez l'animal à jeun s'accompagne d'une diminution de l'activité
de cette enzyme, pourtant seule la synthèse hépatique est
inhibée par le cholestérol d'origine alimentaire. La HMG-CoA
réductase hépatique est inhibée par le mévalonate,
le produit immédiat de la réaction qu'elle catalyse, et par le
cholestérol, le produit principal de cette voie.
Le cholestérol et ses métabolites
répriment la transformation du gène de la HMG-CoA
réductase en activant un facteur de transformation, SREBP
(sterolregulatory element-binding protein), protéine se fixant à
un élément de régulation par les stérols). Les
SREBP constituent une famille de protéines qui régulent la
transcription d'une grande série de gènes de protéines
impliquées dans la capture et le métabolisme du
cholestérol et d'autres lipides par les cellules. Une variation diurne
se produit à la fois dans la synthèse du cholestérol et
dans l'activité de la réductase. Outre ces mécanismes
régulant le taux de synthèse des protéines,
l'activité des enzymes est également modulée de
façon plus rapide par des modifications post-traductionnelles (figure
7).
L'insuline ou les hormones thyroïdiennes augmentent
l'activité de la HMG-CoA réductase, tandis que le glucagon ou les
glucocorticoïdes la diminuent. L'activité est modifiée de
façon réversible par des mécanismes de
phosphorylation /déphosphorylation, dont certains peuvent
dépendre de l'AMPc, et donc être directement sensibles au
glucagon. Les tentatives d'abaisser le taux de cholestérol plasmatique
chez l'être humain en réduisant l'ingestion de cholestérol
alimentaire produisent des effets variables.
En général, une diminution de 100mg de
cholestérol alimentaire cause une diminution d'environ 0,13mnol/L dans
le sérum.

Figure 7 Mécanismes possibles de
régulation de la synthèse du cholestérol par l'HMG-CoA
réductase.
L'insuline joue un rôle dominant par rapport à
celui du glucagon.
c) Les facteurs qui influencent l'équilibre du
cholestérol dans les tissus
Au niveau tissulaire, l'équilibre du cholestérol
est régulé de la façon suivante (figure 8) :
l'augmentation du cholestérol cellulaire est due soit à une
capture de lipoprotéines contenant du cholestérol, par les
récepteurs comme celui des LDL ou le récepteur éboueur,
soit à l'incorporation dans les membranes cellulaires de
cholestérol libre à partir de lipoprotéines riches en
cholestérol,soit à la synthèse de cholestérol,soit
encore à l'hydrolyse du cholestérol estérifié par
la cholestéryl ester hydrolase. La diminution du cholestérol est
due soit à l'efflux du cholestérol membranaire vers les HDL via
ABCA-1,ABCG-1 ou SR-B1 (figure II.5),soit à l'estérification du
cholestérol par l'ACAT(acétyl-CoA :cholestérol
acyltransférase),soit encore à l'utilisation du
cholestérol pour la synthèse d'autres stéroïdes comme
les hormones ou les acides biliaires dans le foie.
Le récepteur des LDL est fortement
régulé

Les récepteurs des LDL (apo B-100,E)se trouvent
à la surface cellulaire dans des puits qui sont recouverts, du
côté cytosolique de la membrane cellulaire, par une
protéine appelée clathrine. Le récepteur est une
glycoprotéine transmembranaire, la région exposée se liant
à B-100 est du côtéamino-terminal. Après liaison au
récepteur,les LDL intactes sont capturées par endocytose.
L'apoprotéine et les esters de cholestérol sont ensuite
hydrolysés dans les lysosomes et le cholestérol est
transféré dans la cellule. Les récepteurs sont
recyclés vers la surface cellulaire. Ce flux entrant de
cholestérol inhibe la transcription des gènes de la HMG-CoA
synthase,de la HMG-CoA réductase et ceux d'autres enzymes
impliquées dans la synthèse de cholestérol. Il inhibe
aussi le récepteur des LDL lui-même via la voie de SREBP, il ya
ainsi suppression coordonnée de la synthèse et de la capture du
cholestérol. De plus, l'activité de l'ACAT est stimulée et
induit l'estérification du cholestérol. Ainsi, l'activité
des récepteurs des LDL à la surface cellulaire est
régulée par les besoins en cholestérol pour la
synthèse des membranes, des hormones stéroïdes ou des acides
biliaires (figure 8)(NESS G.C. et coll. 2000).
Figure 9. Facteurs influençant
l'équilibre du cholestérol au niveau cellulaire
| 


