Introduction
Des publications récentes ont réaffirmé
que les maladies veineuses thrombo-emboliques (MVTE), de par leur implication
dans l'aggravation de la morbi-mortalité hospitalière, restent un
problème de santé majeur dans les pays occidentaux.1,2
Elles viennent au 3ème rang des maladies cardio-vasculaires
dans le monde (après les cardiopathies ischémiques et les
accidents vasculaires cérébraux) avec une incidence annuelle de
160/100.000, se présentant principalement comme des thromboses veineuses
profondes (TVP) et/ou comme des embolies pulmonaires (EP).3
Malgré plus d'un siècle de recherche sur les
MVTE et leurs facteurs de risque, les connaissances sur
l'épidémiologie de ces affections restent incomplètes.
Cela transparaît, par exemple, au regard de la grande disparité
que l'on observe sur les incidences annuelles rapportées
(50-200/100.000).4 Par ailleurs, jusqu'à une date
récente, les MVTE étaient très rarement décrites au
sein des populations asiatiques et africaines ; si bien que lorsque
Boukinda et al (Congo), ou encore E. Bertrand et al (Côte d'Ivoire) ont
décrit quelques cas dans leurs pays respectifs, ceux sont ont
été présentés comme « des trouvailles
cliniques curieuses » en Afrique sub-saharienne.5,6
Malheureusement, cette hypothèse optimiste a été
réfutées par des observations récentes qui
suggèrent que les maladies veineuses thrombo-emboliques surviendraient
bel et bien chez le sujet noir et épouseraient au moins le même
profil épidémiologique que dans les autres groupes
démographiques.7,8
L'amélioration des connaissances sur les facteurs de
risque des MVTE a permis de définir des moyens de prévention
assez efficaces contre ces affections ; mais de nombreux travaux ont
démontré que ceux-ci sont insuffisamment appliqués par les
médecins. Dans l'étude ENDORSE par exemple (70.000 patients; 358
hôpitaux dans 32 pays), seule une minorité de médecins (58%
chirurgiens et 39% médecins de spécialités
médicales) appliquaient effectivement les recommandations sur la
prévention des MVTE.9 De tels résultats
rapportés dans les pays développés pourraient, au mieux,
être transposés dans les pays africains. En notre connaissance, il
n'existe pas de travaux ayant décrit l'attitude des équipes
hospitalières vis-à-vis de cet important problème au
Cameroun ; en Afrique Sub-saharienne même, nous avons trouvé
juste quelques essais.10,11 Le but de cette étude est
d'évaluer la prise en charge du risque de MVTE dans les principaux
hôpitaux de Yaoundé et de Douala
Objectifs
Objectif général :
Il s'agissait d'évaluer l'attitude des praticiens
vis-à-vis de la MVTE chez les patients admis dans les principaux centres
hospitaliers de Yaoundé et de Douala.
Objectifs spécifiques :
Au sein de notre population d'étude recrutée
à l'insu des équipes hospitalières, nous avons :
· Recherché les caractéristiques
démographiques des patients, les différents facteurs de risque de
MVTE identifiables, les signes cliniques de TVP et/ou d'EP.
· Evalué le niveau de risque de MVTE et la
probabilité clinique de TVP et/ou d'EP.
· Comparé l'attitude des praticiens avec les
recommandations de l'American College of Chest Physicians (ACCP).
· Evalué la morbidité et la
mortalité hospitalières (toutes causes confondues).
Revue de la littérature
Définition :
La thrombose veineuse profonde (TVP) désigne
l'oblitération de tout ou partie de la lumière d'une veine par un
caillot sanguin (ou thrombus) résultant d'une coagulation intra-veineuse
localisée. Il s'agit de l'un des pôles d'une entité
nosologique plus large, la maladie veineuse thrombo-embolique (MVTE) ; les
autres étant l'embolie pulmonaire (potentiellement létale) et la
maladie veineuse post-phlébitique (invalidante).
Il s'agit d'affections fréquentes, d'origine souvent
multifactorielle. L'examen clinique ne permettant pas un diagnostic de
certitude, le plus souvent le diagnostic est confirmé par
l'échographie doppler. Le bilan étiologique est orienté
par l'examen clinique et l'interrogatoire. Le traitement repose sur les
anticoagulants, la contention et le lever précoce. La prévention
des MVTE s'est de mieux en mieux codifiée au fur et à mesure
qu'ont été identifiés leurs facteurs de risque.
Epidémiologie :
Les caractéristiques épidémiologiques des
MVTE sont mal définies. On sait qu'elles touchent des millions de
personnes dans le monde, se situant alors au 3ème rang des
affections cardiovasculaires dans les registres de l'Organisation Mondiale de
la Santé (OMS).
L'incidence de la thrombose veineuse est variable en fonction
des méthodes employées pour le diagnostic et des populations
étudiées. En France, un travail récent
réalisé à Brest retrouve une incidence de 1,24 TVP pour
1 000 personnes.12 Aux Etats-Unis, Anderson retrouve une
incidence de 0,48 événement pour 1 000
personnes ;13 dans ce même travail, l'incidence annuelle
du premier épisode d'embolie pulmonaire est de 0,23 %o et l'incidence
annuelle du premier épisode de TVP isolée est de 0,53 %o.
Facteurs de risque :
(TableauA)
De nombreux facteurs sont impliqués dans la survenue
d'une TVP.
Tableau A. Classification des facteurs de risque de TVP selon
J.N. Fiessinger et al.14
Risque inhérent au patient
-Age = 4 ans
-Obésité
-MVTE antérieure
-Immobilisation/alitement = 4 jours
-Grossesse
-Post-partum
-Prise d'oestrogènes
-Thrombopathies : déficit en protéine C/S, en
ATIII, résistance à la protéine C, anticorps
anticardiolipine
-Hyperhomocystéinémie
Situations aiguës (indépendantes du
patient)
-Traumatisme-chirurgie orthopédique
-Chirurgie du pelvis
-Neurochirurgie
-Cancers
-Défaillance cardiaque
-Accident vasculaire cérébraux/paralysie de membre
inférieur
-Infarctus du myocarde récent
-Infection
-Voyage prolongé en avion
-Maladie inflammatoire intestinale
-Syndrome néphrotique
-Polyglobulie
-Hémopathies
-Dysprotéinémies
-Chimiothérapie anticancéreuse
-Maladie de Behçet
-Hémoglobinurie paroxystique nocturne
· Facteurs de risque liés à la
chirurgie :
Des niveaux de risque de maladie thrombo-embolique ont
été définis : les risques faible,
modéré, élevé et très élevé
(tableau B).
Tableau B - Niveau de risque thromboembolique veineux
Risque faible Chirurgie non compliquée, âge
< 40 ans
Risque modéré - Chirurgie majeure ou
mineure, âge 40-60 ans
- Chirurgie majeure, âge < 40 ans
- Chirurgie mineure + facteur de risque
Risque élevé - Chirurgie majeure +
âge > 60 ans
- Chirurgie majeure + âge 40-60 ans + facteur de
risque
Risque très
élevé - Chirurgie majeure + âge > 40 ans +
antécédents de maladie
thromboembolique ou cancer ou hypercoagulabilité.
-Chirurgie
orthopédique réglée des membres inférieurs,
fracture du col du fémur, accident vasculaire
cérébral,
polytraumatisme, lésions médullaire.
Risques en chirurgie générale :
L'incidence des thromboses veineuses diagnostiquées par
phlébographie en chirurgie générale sans prophylaxie est
de l'ordre de 19 %, celle des embolies des patients opérés ;
7 % présentent une thrombose proximale, 1,6 % ont une embolie pulmonaire
clinique fatale ou non fatale, dont 0,9% fatale.
Risques en chirurgie gynécologique :
L'incidence des thromboses veineuses sans prophylaxie est de
l'ordre de 16 %, celle des embolies pulmonaires fatale est de 0,4 %.
Risques en chirurgie orthopédique et en
traumatologie :
Chez les patients sans prophylaxie, la prévalence de
thromboses veineuses profondes après une chirurgie de prothèse
totale de hanche est de 50 %, avec 25 % de thrombose veineuse proximale. Pour
la chirurgie de prothèse totale de genou sans prophylaxie, on retrouve
près de 60 % de thromboses veineuses phlébographiques dont 20 %
de thromboses veineuses proximales. En chirurgie traumatologique au cours d'une
fracture du col fémoral on retrouve 60 % de TVP, dont 20 % de proximales
en l'absence de prophylaxie.
La survenue de thrombose veineuse après la sortie de
l'hôpital est fréquente. Les études phlébographiques
montrent une prévalence de 10 à 20 % de nouvelles thromboses
veineuses dans les 4 à 5 semaines après la sortie de
l'hôpital sans prophylaxie.15
· Affectations médicales et risques de
maladie thromboembolique :
Le risque a été moins bien étudié
- risques liés à un infarctus du
myocarde : Le risque de survenue d'une TVP est de l'ordre de 24 %
parmi les patients hospitalisés pour infarctus du myocarde qui ne
reçoivent pas de prophylaxie ;
- risques liés à un accident vasculaire
cérébral : L'incidence des TVP est de l'ordre de 55 %
dont 12 % de TVP. L'embolie pulmonaire est responsable d'environ 5 % des
décès précoces au décours d'un accident vasculaire
cérébral ;
-l'insuffisance cardiaque est un facteur de risque
indépendant de thrombose ;
-les risques liés au cancer et aux
hémopathies : Ils sont responsables de tableaux cliniques
particuliers, phlébites bleues, phlébites migrantes,
phlébites récidivantes. Une TVP apparemment idiopathique peut
révéler un cancer occulte.16 La fréquence des
thromboses chez les patients cancéreux et de 5 à 15
%.17
· Risques liés à
l'âge :
L'âge est un facteur de risque important de maladie
thromboembolique veineuse. L'incidence des thromboses veineuses augmente de
façon exponentielle avec l'âge. Après 40 ans, le risque
double tous les 10 ans.18 Oger retrouve dans une étude
française une incidence annuelle de 0,28 %o personnes entre 20 et 39 ans
et de 5 %o après 75 ans.12 Toutefois dans certaines
études après analyse multivariée, l'âge
n'apparaît plus comme facteur de risque indépendant, alors que
dans d'autres il le reste.19
· Antécédents de maladie
thromboembolique :
Après un premier épisode, le risque de
récidive est évalué entre 5 et 10 % par an.20
Hansson retrouve un taux de récidive de 7 % après 1 an, 21,1 %
après 5 ans de suivi en cas de premier épisode, alors que les
récidives à 5 ans sont de 27,9 % après un deuxième
épisode. Le risque de récidive est plus important en cas de
thrombose proximale.21
· Immobilisation :
L'immobilisation est un facteur de risque de thrombose
veineuse ; elle est souvent secondaire à une pathologie
médicale ou chirurgicale.
· Traitements hormonaux
Contraception orale :
L'utilisation d'une contraception orale augmente de deux
à six fois le risque de thrombose. Le risque absolu de survenue de
thrombose veineuse chez une femme prenant un oestroprogestatif reste faible,
estimé à 1-2 pour 10 000 femmes traitées par
an.3
Traitement hormonal substitutif :
Des études cas-témoin et prospectives retrouvent
une augmentation du risque de thrombose veineuse de 2 à 3.22
Toutefois, le risque absolu reste faible puisque l'on note une augmentation de
deux accidents thromboemboliques pour 10 000 femmes traitées par an
dans l'étude WHI (Women Health Initiative), et de 3,1 pour 10 000
femmes traitées par an dans l'étude HERS 2 Heart and oestrogen /
progestin Replacement Study.
· Grossesse :
La maladie thromboembolique veineuse est la première
cause de morbi / mortalité de la femme enceinte. Sa survenue est
évaluée entre 0,5 % et 3 % des grossesses, ce qui
représente un risque cinq fois plus important que chez les femmes du
même âge non enceintes. Le risque thrombotique est dix fois plus
élevé pendant le post-partum que pendant la
grossesse.23
· Voyages :
La prévalence des TVP augmente au cours de transports
aériens de longue durée (supérieure à 5 heures ou
à 4 500 km) ; le risque est de 2,3 à 4 pour 10 000
passagers.24
· Thrombophilie :
Le tableau C résume le risque de TVP en fonction du
type d'anomalie.
Déficit en antithrombine :
Sa prévalence au sein de la population
générale est estimée autour de 2 à 5 pour
10 000 ; elle est de 0,5 à 4 % chez des patients aux
antécédents de TVP. Les taux d'antithrombine sont normaux sous
antivitamine K (AVK), abaissés sous héparine non
fractionnée, très peu abaissés de 5 à 10 % par les
oestroprogestatifs.
Déficit en protéine C et
S :
La protéine C, et son cofacteur la protéine S
sont des anticoagulants naturels. La prévalence d'un déficit en
protéine C au sien de la population générale est
estimée autour de 3-4 pour 1000, et est de 3 à 4 % chez les
patients aux antécédents de TVP. Le taux de protéine S est
variable avec l'âge, le sexe et la prise d'un traitement hormonal, ce qui
rend souvent difficile son interprétation.
|
Tableau C.-Evaluation du risque thrombo-embolique veineux en
fonction du type de thrombophilie
|
|
Génotype
|
Odds ratio
|
|
Aucune anomalie
|
|
1
|
|
FII G2021A
|
Hétérozygote
|
3-5
|
|
Facteur V Leiden
|
Hétérozygote
|
5-10
|
|
Déficit en protéine C ou en protéine S
|
Hétérozygote
|
5-10
|
|
Déficit en AT
|
Hétérozygote
|
10-40
|
|
Facteur V Leiden + une des autres anomalies
|
Double hétérozygote
|
10-40
|
|
Facteur V Leiden
|
Homozygote
|
50-80
|
|
Déficit en protéine C ou en protéine S
|
Hétérozygote composite
|
> 100
|
|
Déficit en AT
|
Homozygote
|
Létal
|
Résistance à la protéine C
activée :
La plus fréquente des anomalies
génétiques associées à la maladie thromboembolique
veineuse (MTEV) est la résistance à la protéine C
activée (RPCA) découverte en 1993.25 L'anomalie est
due, dans la très grande majorité des cas, à une mutation
du facteur V, la mutation Leiden. La prévalence de cette anomalie dans
la population générale est élevée (environ 5
à 7 %). Entre 20 et 30 % des patients atteints d'une TVP
présentent une RPCA et sont porteurs de la mutation du facteur V. Le
pouvoir thrombogène de la mutation du facteur V Leiden est moindre que
les déficits en protéines C, S et en antithrombine.
Mutation du gène de la prothrombine :
Récemment, une mutation du gène de la
prothrombine a été identifiée, associée à
une augmentation de la concentration circulante de la protéine. Cette
mutation est observée chez 8 à 10 % des sujets atteints de MTEV,
et environ 2 % des cas dans la population générale.
Hyperhomocystéinémie :
L'élévation plasmatique de l'homocystéine
constitue un facteur de risque d'accidents vasculaires, artériels et
veineux. Le seuil au-delà duquel on définit
l'hyperhomocystéinémie est variable suivant les laboratoires, le
sexe et l'âge des patients, de 12 à 30 umol / l.
Anticorps
antiphospholipides :
Les anticorps antiphospholipides sont présents dans
plusieurs circonstances, et principalement dans les maladies auto-immunes et
les néoplasies. L'association des manifestations thrombotiques,
artérielles ou veineuses, d'avortements spontanés ou d'une
thrombopénie avec la présence durable d'anticorps
antiphospholipides, définit le syndrome des antiphospholipides. La
prévalence des anticorps antiphospholipides dans la population
générale est inférieure à 3 %. Les anticorps
antiphospholipides peuvent être des anticoagulants circulant de type
lupique, ou un anticorps anticardiolipine.
Augmentation du facteur
VIII :
Récemment, l'implication du facteur VIII dans la
maladie thromboembolique a été étudiée. Une
concentration élevée de facteur VIII apparaît comme un
facteur de risque significatif, indépendant et persistant de thrombose
veineuse. Un taux de facteur VIII supérieur à 150 % est
associé à un risque relatif d'événement
thrombotique de 4,8 (intervalle de confiance [IC] 95 % : 2,3-10)
après ajustement des paramètres inflammatoires et du groupe
sanguin.26 Le facteur VIII est par ailleurs un facteur
indépendant de récidive de thrombose veineuse.
Augmentation des facteurs IX, XI :
Un taux de facteur IX > 129 % multiplie le risque de
récidive de TVP par 2 à 3, et un taux de facteur XI > 120 %
multiplie le risque de TVP par 2,2.
· Anomalies du système fibrinolytique
L'hypofibrinolyse pourrait être impliquée dans la
genèse des thromboses. Les déficits de la fibrinolyse incluent
les déficits quantitatifs en plasminogène, les anomalies
qualitatives de la molécule, les augmentations du plasminogen
actovator inhibitor (PAI)-1 et plus rarement un défaut de
libération du tissue plasminogen activator (t-PA).
· Autres facteurs de risque :
Le rôle de l'obésité, du tabagisme et de
l'insuffisance veineuse reste toujours controversé.18
Physiopathologie :
· Mécanismes de la
TVP :
Les thrombi veineux sont constitués principalement de
fibrine et de globules rouges avec un nombre variable de plaquettes et de
leucocytes. Le pathologiste Rudolph Virshow a eu le mérite de
définir une triade de mécanismes impliqués dans la
survenue d'une TVP (triade éponyme). Cela a servi de tête de prou
à la compréhension de la pathogénie des TVP et à la
définition des cibles thérapeutiques. Chacun des
éléments de la triade (stase veineuse, lésions
endothéliales, hypercoagulabilité sanguine) pris isolément
ne semble pas pouvoir induire l'installation d'une TVP ; mais en
conjonction, ils sont très largement impliqués.
Altération
pariétale : Lors d'un traumatisme direct ou au
contact de foyers infectieux, la mise à nu du sous-endothélium
déclenche l'agrégation et l'activation des plaquettes ;
ensuite la coagulation s'amorce par son promoteur naturel, le facteur
tissulaire. Toutefois, le rôle de ce dernier n'est pas indispensable
à la constitution de la TVP, contrairement à la thrombose
artérielle.
Stase sanguine : Elle induit
une accumulation in situ des ferments de la coagulation associée
à un ralentissement de l'apport de leurs inhibiteurs. La TVP va
prédominer sur les zones de ralentissement circulatoire : les
membres inférieurs avec les sinus veineux des muscles soléaires,
les nids valvulaires, veine iliaque primitive gauche.
Hypercoagulabilité
sanguine : Elle est un élément plus complexe
car elle intègre des équilibres de cinétiques enzymatique
et cellulaire en permanente évolution : interactions entre des
facteurs génétiques (déficit en
anti-thrombine/protéine C/protéine S ; mutation du facteur V
de Leyden, ...) et des conditions favorisantes acquises (immobilisation
prolongée, ...).
Constitution et évolution du thrombus
(schéma de Sevitt) :
Classiquement le point de départ est une zone de
ralentissement circulatoire (nid valvulaire) : la stase veineuse va
induire la création de tourbillons à ce niveau avec
possibilité de dépôt de plaquettes et activation locale de
la coagulation. Cette première étape aboutit à la
formation de la tête de caillot, adhérente à la paroi
vasculaire.
La propagation du thrombus peut ensuite se faire en amont
comme en aval, de proche en proche, avec apparition des stries de Zahn :
alternance de thrombus blanc riche en plaquettes (dû aux turbulences) et
de thrombus rouge riche en fibrine (dû à la stase). Cette partie
forme le corps du caillot.
Une fois le thrombus formé, sa progression s'effectue
vers la lumière du vaisseau en couches superposées. Quand la
veine est complètement occluse, l'arrêt du flux aboutit à
la constitution de la queue du thrombus exclusivement rouge qui évolue
alors plus rapidement.
Au départ, le thrombus n'adhère pas à la
paroi vasculaire et son extrémité supérieure, flottant
librement dans la lumière veineuse, peut être le siège de
détachement de fragments de thrombus (fibrinolyse physiologique), puis
de leur fuite vers la circulation pulmonaire : survenue de l'embolie
pulmonaire.
Une fois le vaisseau totalement occlus, le thrombus devient
adhérent à la paroi et s'organise progressivement par
colonisation par des cellules inflammatoires et formation d'un tissu
granuleux : il en résulte un syndrome obstructif responsable de
phénomènes douloureux et des oedèmes. L'évolution
se fait ensuite vers un remaniement de la paroi (rétraction,
épaississement, éventuellement recanalisation ou
re-endothélialisation). L'issue de ces processus peut être le
dérèglement du jeu des valvules avec incontinence veineuse,
augmentation de la pression dans les réseaux veineux d'amont :
survenue de la maladie veineuse psot-phlébitique.
Diagnostic :
§ Clinique : forme de
présentation = TVP des membres inférieurs
Notions de base :
Les signes cliniques de TVP manque à la fois de
sensibilité (ils sont trop souvent absents : forme asymptomatique)
et de spécificité (ils peuvent évoquer d'autres affections
que la TVP).
Thromboses veineuses profondes des membres
inférieurs :
Classique phlegmatia alba dolens
C'est la présence de douleurs spontanées et
provoquées du mollet. Le bien trop classique signe de Homans n'est pas
spécifique d'une TVP, la douleur peut siéger à la face
interne de la cuisse, sur un trajet veineux. Cette même douleur n'a pas
de spécificité et peut aussi évoquer une lésion
tendineuse ou musculaire ou une douleur neurologique (sciatalgie).
|
Tableau D - Score de probabilité clinique
de thrombose veineuse profonde selon Wells.27
|
|
Caractéristiques
|
Score
|
|
Cancer actif (traitement en cours ou palliatif, ou dans les 6
mois).
|
1
|
|
Paralysie, parésie ou immobilisation plâtrée
des membres inférieurs.
|
1
|
|
Immobilisation (> 3 jours) ou chirurgie majeure (dans les 4
semaines)
|
1
|
|
Tuméfaction de toute la jambe
|
1
|
|
Tuméfaction du mollet avec plus de 3 cm entre les deux
jambes
|
1
|
|
Oedèmes prenant le godet.
|
1
|
|
Circulation veineuse collatérale.
|
1
|
|
Diagnostic alternatif de probabilité = à celui de
la TVP et probabilité clinique élevée
|
-2
|
|
Interprétation :
|
|
|
- Probabilité élevée
|
> 3
|
|
- Probabilité intermédiaire
|
1-2
|
|
- Probabilité faible
|
(-2)-0
|
L'oedème n'est pas spécifique et peut aussi
évoquer une affection ostéoarticulaire dont le kyste synovial de
Baker, un lymphoedème, une lipodystrophie, un syndrome post-thrombotique
veineux, une pelvienne, une insuffisance cardiaque droite. Les signes
inflammatoires avec augmentation de la température cutanée locale
n'ont pas de spécificité, et peuvent aussi évoquer une
lymphangite ou une cellulite inflammatoire. La dilatation veineuse
témoigne d'une circulation collatérale superficielle ; elle
n'a pas de spécificité et peut aussi évoquer une
insuffisance veineuse primaire ou une compression extrinsèque du
système veineux proximal. Ces signes cliniques peuvent être
isolés ; s'ils sont associés, leur valeur dans l'orientation
diagnostique est augmentée. Des scores cliniques ont été
proposés par certains auteurs. Ils trouvent une place importante dans
les stratégies diagnostiques (tableau D).
Phlébite bleue ou phlegmatia coerulea
dolens :
Bien que rare, il faut en connaître l'existence du fait
de sa sévérité et de l'urgence qu'elle impose. Elle
implique volontiers une étiologie néoplasique. C'est une
thrombose veineuse proximale intéressant le confluent fémoral et
saphène, provoquant une stagnation veineuse aiguë et un blocage de
l'alimentation artérielle avec spasme. Le tableau d'ischémie
aiguë s'associe à la manifestation clinique de TVP.
L'urgence provient de l'ischémie artérielle.
Elle impose un transfert immédiat en milieu spécialisé
vasculaire pour désobstruer les voies veineuses proximales
(thrombectomie, thrombolyse).
Thromboses veineuses pelvienne :
Le contexte est représenté par un
événement médical pelvien : chirurgie, grossesse,
post-partum. Les signes cliniques sont ceux d'une thrombose veineuse, mais au
niveau pelvien : douleurs utérovaginales, abdominales (importance
des touchers pelviens), urinaires, tableau fébrile parfois septique.
Thrombose de la veine cave
inférieure :
Elle peut provenir de l'extension d'un thrombus iliaque ;
un cancer rénal peut thromboser une veine rénale puis la veine
cave sus-rénale. Le tableau clinique peut concerner les deux membres
inférieurs avec une circulation collatérale abdominale.
§ Investigations
paracliniques :
Compte tenu des limites de l'examen clinique, toute suspicion
clinique de TVP fait obligatoirement appel à une vérification
paraclinique. Un traitement anticoagulant curatif, en attendant les
résultats de ces examens paracliniques, peut être
débuté, mais il ne doit en aucun cas être
considéré comme un test d'épreuve diagnostique.
D-dimères :
Les D-dimères sont des produits de dégradation
spécifiques de la fibrine. La méthode de dosage de type
enzyme-linked imunosorbent assay (Elisa) et
la méthode de référence. Dans le diagnostic de la
thrombose veineuse, la sensibilité pour le test Elisa conventionnel est
de 97 % et pour le test Elisa rapide de 98 %. Un taux normal (inférieur
à 500 ng/ ml en technique Elisa) permet d'exclure le diagnostic de
TVP.28 En revanche, du fait de la faible spécificité
du test, un taux augmenté de D-dimères n'est associé
à la présence d'une TVP que dans 40 % des cas. La faible
spécificité est due au fait que de nombreux états
cliniques augmentent les D-dimères : pathologies inflammatoires,
période postopératoire, cancer, infection, hématome,
grossesse, âge avancé, traumatisme, pathologie artérielle
aiguë.
Echographie Doppler :
Le diagnostic de thrombose veineuse récente repose sur
des signes directs et indirects.
-Signes directs : visualisation du thrombus
Le thrombus est visualisé sous la forme de
matériel endoluminal plus ou moins échogène, fixe ou
mobile. Il peut être totalement adhérent à la paroi
veineuse ou au contraire flottant dans la lumière.
-Signes indirects :
Le principal signe indirect de la thrombose veineuse
récente est l'incompressibilité de la veine à la pression
de la sonde. D'autres signes indirects sont retrouvés : la
dilatation veineuse, la perte de mobilité des valvules du fait de la
présence de thrombus, la stase veineuse, l'augmentation du flux des
veines collatérales.
-Performances :
L'échographie doppler a pris une place de choix dans le
diagnostic de TVP. Face à une suspicion clinique, l'utilisation de
l'échographie donne des résultats excellents, avec une
sensibilité et une spécificité de 97 %. Dans le cas
particulier des thromboses surales chez les patients asymptomatiques, les
performances sont inférieures : sensibilité de 36 à
92 %, spécificité de 83 à 100 %.29 Chez les
sujets asymptomatiques en postopératoire de chirurgie
orthopédique, la sensibilité est faible, aux environs de 60 %,
alors que la spécificité reste élevée : 95 %.
Pour les TVP asymptomatiques en contexte médical, la sensibilité
et la spécificité sont de 100 %. Dans le cas particulier d'une
suspicion d'embolie pulmonaire, l'échographie doppler veineux a une
très bonne spécificité (96 à 100 %), alors que sa
sensibilité est médiocre (20 à 67 %) (tableau E).
|
Tableau E - Sensibilité et
spécificité de l'écographie doppler veineux pour le
diagnostic de thrombose veineuse profonde (TVP) ou d'embolie pulmonaire
(EP)
|
|
Circonstance clinique
|
|
Sensibilité
|
|
Spécificité
|
|
TVP symptomatique
|
|
97
|
|
97
|
|
TVP symptomatique surale
|
|
36-93
|
|
83-100
|
|
Suspicion EP
|
|
20-67
|
|
96-100
|
|
TVP asymptomatique
|
|
|
|
|
|
- Chirurgie
|
|
60
|
|
95
|
|
- Médecine
|
|
100
|
|
100
|
·
Phlébographie :
Elle n'est plus utilisée en pratique quotidienne, mais
elle reste l'examen de référence dans les études cliniques
du fait de résultats non opérateur-dépendants et de sa
reproductibilité inter-observateurs.
· Angiographie par résonnance
magnétique :
Peu de séries sont actuellement disponibles, et celles
comparant l'angiographie par résonnance magnétique (ARM) à
la phlébographie concernant encore un nombre limité de patients.
Les résultats des premières études sont toutefois
excellents et résumé dans le tableau F.
|
Tableau F - Sensibilité et
spécificité de l'angiographie par résonance
magnétique comparée à la phlébographie pour le
diagnostic de thrombose veineuse profonde.
|
|
Série
|
|
Sensibilité
|
|
Spécificité
|
|
Lassy
|
|
100 %
|
|
100 %
|
|
Catalomo
|
|
100 %
|
|
90 %
|
|
Spritzer
|
|
100 %
|
|
92,9 %
|
· Angioscanner :
L'exploration iliocave des membres inférieurs peut
être faite en même temps que l'angioscanner des artères
pulmonaires. Sa sensibilité serait de 100 % et sa
spécificité de 96 %.
Démarche diagnostique :
Plusieurs démarches diagnostiques ont été
proposées dans la littérature. Elles associent les
différentes techniques définies ci-dessus :
probabilité clinique, dosage des D-dimères, échographie
doppler, phlébographie, le scanner et l'ARM n'ont pas encore
été validés dans ce type d'approche diagnostique. Nous
proposons la démarche diagnostique validée par Perrier (Fig. A)
SUSPICION DE TVP
Estimation de la probabilité
clinique
(faible-moyenne-élevée)
Dosage des D-dimères (Elisa)
= 500 ng/l > 500 ng/l
Pas de TVP
Echographie veineuse par compression
Négative Positive
Probabilité clinique TVP
Faible/Moyenne Elevée
Pas de TVP Phlébographie
Négative Positive
Pas de TVP TVP
Figure A : Démarche diagnostique
lors de suspicion de thrombose veineuse profonde (TVP).30
Elisa : enzyme-linked immunosorbent assay.
Bilan biologique :
L'origine de la thrombose est souvent multifactorielle :
plusieurs facteurs de risque sont le plus souvent associés pour
provoquer la thrombose veineuse.
Un bilan minimum est réalisé chez tous les
patients. Il comporte :
-Une analyse de facteurs de risque, des
antécédents, du contexte de survenue et de pathologies
associées ;
-Un examen clinique complet incluant les touchers
pelviens ;
-Un bilan biologique avec un hémogramme, un temps de
Quick, un temps de céphaline activé, une fibrinémie, une
vitesse de sédimentation (VS), un C réactive protéine
(CRP) ;
-Une radiographie du thorax.
Un bilan plus approfondi est réalisé chez les
patients ayant une thrombose insolite (proximale isolée, d'un membre
supérieur, viscérale, neurologique, ...), une thrombose
bilatérale d'emblée ou à bascule, une thrombose
récidivante, un antécédent de thrombose artérielle,
une thrombose secondaire mais avec un facteur de risque minime ou avec des
antécédents familiaux.
· Chez un sujet jeune (âge < 40
ans) :
On recherche une thrombophilie. Les dosages effectués
au stade aigu de la maladie ou pendant un traitement anticoagulant risque de ne
pas être fiables et de donner lieu à un diagnostic erroné.
En effet, à la phase aiguë d'une thrombose, au cours d'une maladie
inflammatoire ou d'une grossesse, les résultats peuvent être
faussés. L'héparine risque de modifier le dosage de
l'antithrombine, le traitement anticoagulant par les antivitamines K modifie
les taux de protéine C, de protéine S, ainsi que les
résultats des tests mesurant le taux d'anticoagulant circulant ou la
résistance à la protéine C activée. Lorsque cette
enquête biologique est indiquée, elle doit être
complète, il n'est pas rare qu'un patient souffrant d'une MTEV
présente plusieurs anomalies à la fois, ce qui peut modifier
l'attitude thérapeutique. Le bilan doit comprendre la mesure de
l'antithrombine, des protéines C et S, le test de résistance
à la protéine C activée, la recherche des mutations du
facteur V Leiden (si la RPCA est anormale) et de la prothrombine, ainsi que les
taux des facteurs VIII et IX, le dosage de l'hémocystéine, la
recherche de la mutation de la
méthyl-tétra-hydro-folate-réductase (MTHFR) (s'il existe
une hyperhomocystéinémie), la recherche d'anticoagulant circulant
et d'antiphospholipides. L'objectif de cette enquête coûteuse doit
être expliqué au patient, son consentement signé doit
être recueilli avant de pratiquer les examens
génétiques.
· Chez un sujet de plus de 40
ans :
On recherche un cancer : examen urologique et dosage de
prostate specific antigen (PSA) chez l'homme, mammographie, examen
gynécologique et échographie pelvienne chez la femme. Les autres
explorations (endoscopiques, échographies abdominales et scanner) ne
sont pas systématiques, mais sont réalisées s'il existe
des signes d'orientation clinique. Une surveillance clinique
répétée pendant au moins un an est indispensable. Il faut
toutefois se souvenir de la possibilité d'un cancer chez les sujets de
moins de 40 ans (testicules chez l'homme, sein ou utérus chez la femme),
ainsi que d'hémopathies.
Evolution et complications :
· Syndrome
post-thrombotique :
Sa fréquence de survenue après TVP proximale est
importante mais variable selon les études ; elle peut être
évaluée entre 20 et 50 % dans les deux premières
années suivant une TVP. Les formes sévères avec
ulcères surviennent dans 1 et 5 % des cas. Elle augmente avec la
contention élastique précoce qui a réduit de plus de 50 la
survenue de ce risque évolutif.
· Embolie pulmonaire :
L'embolie pulmonaire (EP) est l'expression thoracique de la
MTEV. Le diagnostic d'une EP repose maintenant sur des examens non invasifs. La
place de l'angiographie pulmonaire s'est considérablement réduite
ces dernières années. Les algorithmes décisionnels
s'appuient sur le calcul de la probabilité clinique, les
D-Dimères, l'échographie doppler veineux, la scintigraphie de
ventilation-perfusion, l'angioscanner thoracique et lorsque cela est
indispensable, l'angiographie pulmonaire. Dans le cas des formes graves d'EP,
l'échographie cardiaque est l'examen réalisé en
première intention.
Traitement curatif des TVP:
L'objectif du traitement est d'améliorer les
symptômes, d'éviter l'embolie pulmonaire, l'extension, les
récidives et le syndrome post-thrombotique. Le traitement repose sur la
contention et les anticoagulants. Le traitement anticoagulant peut être
débuté dès la suspicion clinique s'il n'existe pas de
risque hémorragique, en attendant la confirmation ou l'exclusion du
diagnostic.
· Anticoagulation :
Depuis les années 1970, l'hérapine est le
traitement de référence à la phase aiguë d'une TVP.
L'hérapine, lors du traitement initial de la thrombose, prévient
l'extension de la TVP et la survenue d'une embolie pulmonaire.
Héparines de bas poids
moléculaire :
Les HBPM sont employées en première intention.
Elles ont de nombreux avantages par rapport à l'héparine non
fractionnée (HNF). Les doses sont fixes et adaptées au poids,
elles sont administrées par voie sous-cutanée en une ou deux
injections par jour. Les HBPM sont au moins aussi efficaces et aussi
sûres que l'HNF. L'utilisation des HBPM réduit le coût de la
prise en charge, ce d'autant plus qu'elle est effectuée à
domicile.31 La durée initiale du traitement par
héparine est d'environ 4 à 5 jours. Le tableau 6 précise
les posologies recommandées selon les types d'HBPM.
Héparines non fractionné ou
héparine standard :
Les indications de l'HNF sont devenues rares. L'insuffisance
rénale sévère (clairance de la créatinémie
inférieur à 30 ml/min), qui contre-indique l'utilisation des
HBPM, est la plus fréquente des indications actuelles des HNF. Dans le
cas de patients présentant un risque hémorragique accru, l'HNF
intraveineuse est plus facile d'emploi du fait de sa demi-vie plus courte de la
plus grande efficacité de son antidote (sulfate de protamine). Lorsque
la voie veineuse est utilisée, un bolus intraveineux de 50 UI/kg est
préconisé, puis le relais est pris en perfusion continue à
la seringue électrique, à la posologie de 400 à 500
UI/kg/j. La dose est à adapter entre 1,5 et 2,5 fois celle du
témoin. Le premier contrôle du TCA est à effectuer 6 heures
après le début de la perfusion. Les autres contrôles sont
quotidiens ou chaque fois qu'il ya une modification des posologies, 6 heures
après la modification. La voie sous-cutanée peut être
utilisée en deux ou trois injections par jour. La posologie initiale
recommandée est de 250 UI/kg toutes les 12 heures, puis la dose est
adaptée au TCA,32 à maintenir entre 1,5 et 2,5 fois le
témoin.
Il est recommandé d'avoir un niveau
d'héparinémie supérieur ou égal à 0,2 UI/ml
lorsque le prélèvement est réalisé 1 heure avant
l'injection.
Antivitamines K :
Les antivitamines K ne peuvent pas être utilisées
seules dès le début du traitement. Le relais peut débuter
dès la 24 ou 48ème heure
d'héparine. Il faut maintenir inchangée la dose d'héparine
et administrer simultanément l'AVK jusqu'à ce qu'un
internatinal normalized ratio (INK) supérieur ou égal
à 2 soit obtenu pendant 2 jours consécutifs. Il est
déconseillé d'utiliser une dose de charge au début du
traitement, parce que la sensibilité du malade aux AVK est
imprévisible. La dose initiale d'AVK est de un comprimé par jour
(exemple du fluindione ou Préviscan®), pris le soir de
préférence à heure fixe. La dose administrée est
ajustée par quart de comprimé en plus ou en moins selon le
résultat de l'INR mesuré toutes les 48 ou 72 heures pendant cette
phase d'équilibration, selon que la demi-vie d'anticoagulant est courte
ou longue. La dose d'équilibre peut varier considérablement d'un
malade à l'autre, d'un quart de comprimé à deux
comprimés par jour. Pour aider le médecin, des algorithmes
permettant de prévoir cette dose ont été proposés,
notamment pour la Coumadine®33 et le
Préviscan®.34 Ensuite, une fois le traitement
équilibré, la surveillance biologique par l'INR est
réalisée tous les 8 jours, puis tous les 15 jours, puis tous les
mois. Il est préconisé de réduire la dose initiale de
moitié chez le sujet âgé.
|
Tableau G - Posologie recommandée pour
chacune des hérapines de bas poids moléculaire (HBPM) dans le
traitement curatif des thromboses veineuses profondes (TVP)
|
|
Molécules
|
|
|
|
Posologie
|
|
Lovenox ®
|
Enoxaparine DCI
|
|
|
100 UI anti-Xa/12 h
|
|
Fragmine®
|
Daltéparine DCI
|
|
|
100 UI anti-Xa/12 h
|
|
Fraxiparine®
|
Nadroparine DCI
|
|
|
85 UI anti-Xa/12 h
|
|
Fraxodi ®
|
Nadroparine DCI
|
|
|
171 UI anti-Xa/24 h
|
|
Innohep ®
|
Tinzaparine DCI
|
|
|
175 UI anti-Xa/24 h
|
· Surveillance :
La surveillance des traitements est bien entendu clinique,
à la recherche des signes d'extension de thrombose et de signes
hémorragiques, mais avant tout biologique. Avant l'introduction d'un
traitement par l'héparine, un bilan minimum est nécessaire. Il
doit comprendre une numération sanguine, un taux de prothrombine (TP),
un TCA, une numération plaquettaire, un calcul de la clairance de la
créatinémie chez le sujet de plus de 75 ans ou suspect
d'être une insuffisant rénal en cas d'utilisation d'une HBPM.
Pendant le traitement par HNF, le TCA est réalisé
régulièrement pour l'adoption du traitement, les plaquettes sont
dosées deux fois par semaine pendant 3 semaines. Pendant le traitement
par HBPM ; seul le taux de plaquettes est surveillé. La
surveillance de l'activité anti-Xa lors d'un traitement curatif n'est
pas indiquée. Les indications de ces dosages sont : une extension
de la thrombose veineuse, une hémorragie, un patient présentant
une insuffisance rénale, un sujet très âgé, un
traitement prolongé. A dose curative, toutes les molécules d'HBPM
ne génèrent pas la même activité anti-Xa. Les
valeurs attendues au pic d'activité vers la 4e heure sont
0,80 UI anti-Xa pour la tinzaparine (Innohep®), 1,20 UI anti-Xa pour la
nadroparine en une seule injection (Fraxodi®) et entre 0,5 et 1 UI anti-Xa
pour les HBPM prescrites en deux fois par jour.
La surveillance du traitement AVK est la mesure du temps de
Quick exprimé en INR. L'expression du temps de Quick en TP doit
être abandonnée. La fréquence de la surveillance est
variable. Plusieurs circonstances nécessitent un contrôle
supplémentaire de l'INR : en cas de complications, même
minime (épistaxis), lors d'une modification du régime
alimentaire, lorsqu'un médicament est introduit ou supprimé. Dans
ce dernier cas, le contrôle de l'INR est effectué même s'il
n'est pas décrit d'interaction entre les AVK et le médicament
introduit ou retiré. En effet, chez ces patients
polymédicamentés, les interactions médicamenteuses sont
souvent imprévisibles.
Le patient doit bénéficier d'une
éducation thérapeutique concernant son traitement anticoagulant.
Celle-ci permet de réduire les complications hémorragiques et
thrombotiques et d'améliorer la qualité de vie des
patients.19
La surveillance peut être effectuée par des
structures spécialisées souvent appelées cliniques des
anticoagulants (CAC) ou Cesta (centre de surveillance des traitements
antithrombotiques). Ces structures sont très nombreuses en Hollande,
Italie, Grand-Bretagne ou Amérique du Nord. La première structure
française spécialisée dans la gestion des traitements
antithrombotiques a été créée à Toulouse en
1998.35 Elle a des missions bien définies :
éducation thérapeutique du patient, conseil thérapeutique
aux médecins traitants centre d'expertise pour le traitement
antithrombotique, formation médicale avec édition de conduites
à tenir, diffusion d'informations et réalisation d'études
épidémiologiques. Les Cesta diminuent d'un facteur 3 à 4
la morbidité et la mortalité liées à l'utilisation
des AVK.36 Le suivi dans un Cesta est par ailleurs d'un bon rapport
coût-efficacité. Il permet une économie estimée
entre 1600 et 4 000 par patient-année du fait de la
réduction des hospitalisations pour accidents hémorragiques ou
thrombotiques.
|
Tableau H - Recommandations actuelles concernant
la durée du traitement anticoagulant dans la maladie thromboembolique
veineuse (MTEV)
|
|
Premier épisode avec un facteur de risque transitoire avec
ou sans mutation du facteur V ou XI
|
3 à 6 mois
|
|
|
|
|
Premier épisode idiopathique la durée est
supérieure ou égale
|
= 6 mois de traitement
|
|
|
|
|
Premier épisode avec antithrombine, cancer
évolutif, ou anticorps antiphospholipides
|
Traitement prolongé
|
|
|
|
|
Premier épisode avec autre thrombophilie
|
1 an ou plus
|
|
|
|
|
Récidive d'EP idiopathique ou EP associée à
une thrombophilie
|
1 an ou plus
|
|
|
|
Nouveaux antithrombotiques :
Le mélagatran et le ximélagatran sont des
hirudines. L'hirudine est une antithrombine directe. Le mélagatran,
molécule active, a une mauvaise biodisponibilité par voie orale.
Afin de pallier cet inconvénient, une prodrogue a été
synthétisée, le ximélagatran. Le ximélagatran pris
par voie orale est rapidement absorbé puis métabolisé en
forme active, le mélagatran. La demi-vie de la forme actuelle est
d'environ 3 heures et son élimination essentiellement rénale.
Dans une étude de phases trois, (THRIVE III), le ximélagatran a
été comparé à un placebo après 6 mois
d'antivitamines K. LI a été noté 2,8 %
d'événements thrombotiques dans le groupe ximélagatran,
contre 1,6 dans le groupe placebo (p<0,0001) sans augmentation du
risque hémorragique. D'autres essais sont en cours dans le traitement
curatif de la thrombose veineuse dès la phase aiguë.
Durée du traitement :
La durée du traitement reste toujours discutée
même si certains points sont maintenant acquis. Le traitement
anticoagulant oral réduit le risque de récidive thrombotique,
mais augmente en contrepartie le risque hémorragique. Il faut donc
trouver le meilleur rapport bénéfice/risque en fonction de chaque
situation clinique. De nombreux essais cliniques ont été
réalisés.37,38
Les résultats d'une étude récente vont
probablement bouleverser la prévention secondaire de la maladie
thromboembolique veineuse. En effet, l'étude Prevent39 montre
qu'après un épisode de thrombose veineuse idiopathique, un
traitement AVK au long cours avec un INR ciblé entre 1,5 et 2
comparé à un placebo, réduit de 48 % les récidives
des thromboses veineuses sans augmenter le risque hémorragique. La place
des nouveaux antithrombotiques reste à préciser.
· Contention veineuse :
Récemment, elle a démontré son
efficacité en réduisant de 50 % la maladie
post-thrombotique.40,41 La contention doit être mise en place
dès le diagnostic pour toute la durée du traitement
anticoagulant. La prolongation du port de la contention à la fin du
traitement anticoagulant est fonction de signes de maladie
post-thromboembolique à l'examen clinique et à
l'échographie doppler réalisés à l'arrêt du
traitement. Une contention de force III est prescrite à la phase
aiguë de la thrombose, puis elle peut être remplacée par une
contention de force II en fonction de la tolérance du patient. Le choix
du type de contention est fonction du siège de la thrombose : bas
jarret pour une thrombose surale, bas cuisse ou collant pour une thrombose
proximale.
· Lever
précoce :
Le lever dans la TVP est de plus en plus précoce.
Certaines thromboses, comme les thromboses veineuses distales, ne
nécessitent même pas d'alitement. La durée d'un alitement
pour une thrombose proximale est actuellement de 24 à 48 heures. Cas de
lever précoce, le taux de complications (récidives, embolie
pulmonaire et mortalité) n'est pas majoré.
· Thrombolyse :
Elle a été proposée dans la prise en
charge de la thrombose veineuse, le but étant de prévenir la
survenue de maladie post-thrombotique ; toutefois, la balance
bénéfice/risque hémorragique ne permet pas de l'indiquer
en pratique courante. Seuls des cas très restreints pourraient en
bénéficier.
· Interruptions de la veine cave
inférieure :
Les indications sont maintenant bien définies. Elles
sont représentées par la contre-indication au traitement
anticoagulant en présence d'une TVP proximale, la récidive
d'embolie pulmonaire sous traitement anticoagulant bien conduit, l'embolectomie
ou l'endartériectomie pulmonaire. Un filtre cave temporaire peut
être indiqué en cas de contre-indication temporaire au traitement
anticoagulant.
· Thrombectomie :
Les indications de la thromborectomie chirurgicale dans la
thrombose veineuse sont limitées à la phlegmatia caerulea ;
en effet, il n'existe pas de bénéficie concernant la maladie
post-thrombotique dans les autres cas. En revanche, ce traitement est
pourvoyeur de nombreuses récidives.
Traitement ambulatoire :
Ce traitement est envisageable si le diagnostic de TVP est
confirmé par un examen complémentaire (échographie le plus
souvent), s'il existe une possibilité de prise en charge à
domicile pour effectuer le relais AVK (médecin traitant, clinique des
anticoagulants), si le patient ou la famille peuvent mettre en place la
contention et si une surveillance par la famille, le médecin traitant et
l'infirmière est possible.
Plusieurs essais cliniques ont démontré les
avantages et la sécurité du traitement ambulatoire.13
De plus, la réduction du coût est indéniable. Il est
chiffré à environ 1700 pour les 10 premiers jours du traitement
dans un travail réalisé en Midi-Pyrénées.
Tableaux cliniques particuliers des thromboses
veineuses :
L'objectif du traitement est d'améliorer les
symptômes, d'éviter l'embolie pulmonaire, l'extension, les
récidives et le syndrome post-thrombotique. Le traitement repose sur la
contention et les anticoagulants. Le traitement anticoagulant peut être
débuté dès la suspicion clinique s'il n'existe pas de
risque hémorragique, en attendant la confirmation ou l'exclusion du
diagnostic.
· Thromboses veineuse
superficielles
Présentation clinique :
Le diagnostic en est facile. Leur siège concerne
souvent le trajet de la grande veine saphène. L'interrogatoire retrouve
une douleur importante sur le trajet veineux : jambe ou cuisse.
L'inspection note un trajet rouge, et la palpation une augmentation de chaleur
locale le long du trajet veineux douloureux. L'existence d'un cordon sur ce
trajet veineux signe le diagnostic. Si le diagnostic de TVS peut être
facilement porté, celui de la topographie et de son extension est
difficile et pourtant crucial pour le traitement. L'écho-doppler
veineux doit être pratiqué.
|
Tableau I - Traitement d'une thrombose veineuse
superficielle
|
|
|
Thrombose de varice
|
|
Thrombose de veine saine
|
|
Niveau distal
|
|
Tiers proximal, grande saphène
|
|
- Anticoagulant
|
|
- Anti inflammatoire local #177; vie générale
|
|
- Crossectomie
|
|
-crossectomie si extension à la crosse
|
|
- Contention élastique
|
|
- Cure des varices
|
|
|
|
- Cure des varices
|
|
|
|
|
Recherche étiologique :
Il existe des varices connues : thromboses
variqueuses (75 % des cas). Les signes cliniques de TVS siègent au
niveau des grosses varices : paquet variqueux de jambe, veine collectrice
de cuisse. L'intensité de la douleur réclame un geste
thérapeutique. Le traitement des varices doit être
réglé.
Il n'existe pas de varices : TVS sur veines saines.
Un échodoppler veineux doit être pratiqué pour
détecter l'association à un TVP, fréquente dans ce
contexte et source d'EP. Il faut ensuite rechercher une cause
générale : cancer (un cas sur cinq), maladie de Buerger,
maladie de Behçet, pathologie auto-immune, maladies
hématologiques, anomalie de la coagulation.
Traitement :
C'est une urgence. Le traitement est dépendant du
contexte étiologique et des résultats de l'échodoppler
veineux effectué de principe (Tableau I).42
· TVP au cours de la
grossesse :
Clinique
La grossesse favorise la survenue de MTEV. L'incidence de la
MTEV au cours de la grossesse est estimée entre 0,5 et 3 %. Les
thromboses post-partum. Le diagnostic est confirmé par
l'échographie doppler des membres inférieurs, examen non
vulnérant pour le foetus. Les D-dimères, ne peuvent pas
être utilisés dans ce cas car ils sont spontanément
augmentés au cours de la grossesse.
Traitement :
Tout comme celui d'une MTEV habituelle, le traitement associe
un repos au lit strict dont la durée est fonction du type de TVP, une
contention, et des anticoagulants.43
L'héparinothérapie, non fractionnée est
débutée par voie intraveineuse. L'héparine n'a pas d'effet
délétère pour le foetus car elle ne traverse pas la
barrière placentaire. Le relais de l'héparine calcique
sous-cutanée est ensuite pris. Les HBPM n'ont pas l'autorisation de mise
sous le marché (AMM) dans la grossesse, mais sont fréquemment
utilisées car elles n'ont pas non plus un passage placentaire et
qu'elles s'administrent en une ou deux injections par jour. Le contrôle
de l'activité anti-Xa est effectué toutes les 2 à 3
semaines pendant toute la durée du traitement. Les AVK sont
contre-indiquées pendant le premier trimestre de la grossesse, mais
peuvent être utilisées au cours du deuxième ou
troisième trimestre. En post-partum, en cas d'allaitement, seule la
warfarine (Coumadine®) peut être utilisée. L'accouchement est
le plus souvent déclenché, l'héparine sous-cutanée
est remplacée par de l'héparine intraveineuse à la
seringue électrique 24 à 48 heures avant l'accouchement.
L'héparine est stoppée quelques heures avant et reprise
dès que possible.
Un traitement préventif est prescrit chez les femmes
enceintes présentant un déficit connu en facteur de coagulation,
ou des antécédents de MTEV. Le traitement associe une contention
et des anticoagulants à dose préventive. La Calciparine®
à deux injections par jour ou une HBPM à dose préventive
peuvent être utilisées. Le moment de la mise en route du
traitement anticoagulant est discuté au cas par cas. La prophylaxie est
prescrite pour une durée de 1 mois après l'accouchement, ou plus
précocement en fonction du risque thrombotique.
· TVP de l'enfant :
Les thromboses veineuses de l'enfant sont souvent induites par
les cathéters ou des problèmes infectieux. Le traitement
anticoagulant repose sur les HNF ou les HBPM. Tous les AVK ne peuvent pas
être utilisés en pédiatrie.
Prophylaxie :
La prophylaxie de la MTEV fait appel à
différents moyens non médicamenteux :
surélévation des jambes, contention élastique,
mobilisation active et passive à lever précoce, compression
pneumatique intermittente ou stimulation électrique du mollet. Elles ont
pour rôle de luter contre la stase et d'accélérer le retour
veineux. Les moyens pharmacologiques font appel aux traitements
antithrombotiques : l'HNF, les HBPM, les AVK.
La prophylaxie doit être adaptée au niveau du
risque. L'estimation du niveau de risque doit tenir compte du type de chirurgie
ou de la pathologie médicale, mais aussi des facteurs de risque
liés au malade.
· Prophylaxie en
chirurgie :
Intervention à risque
faible :
Les méthodes physiques seules suffisent : pas de
prophylaxie médicamenteuse.
Intervention à risque
modéré :
Héparines de bas poids moléculaire
Les HBPM sont les héparines les plus utilisées
en prophylaxie. Il en existe plusieurs :
-daltéparine : 2 500 UI/24 h
-énoxaparine : 2 000 UI/24 h
-nadroparine : 3 100 UI/24 h
-réviparine : 1 750 UI/24 h
-tinzaparine : 2 500 à 3 500 UI/24 h
L'injection sous-cutanée est faite 1 à 2 heures
avant l'intervention, puis répétée quotidiennement. Les
HBPM entraînent une réduction du risque de TVP de 72 %. L'HNF est
maintenant réservée aux situations où les HBPM ne sont pas
utilisables et surtout en cas d'insuffisance rénale. La
Calciparine® est utilisée à la dose de 5 00 UI ( = 0,2 ml) x
2 par 24 h, en injection sous-cutanée, débutée 2 heures
avant l'intervention et poursuivie quotidiennement pendant 1 semaine ou du
moins pendant la durée de l'immobilisation.
Moyens physiques
La compression pneumatique intermittente entraîne une
réduction du risque de MTEV de 60 %, la contention de 64 %.
Intervention à risque élevé
et risque très élevé
Un exemple en est la chirurgie orthopédique
réglée.
Héparines
Les HBPM sont le plus souvent utilisées aux posologies
suivantes :
-daltéparine : 5 000 UI/24 h (début 12
heures avant)
-énoxaparine : 4 000 UI/24 h (début 12
heures avant) ; 3000 UI/12 h (début 12 heures avant) ;
-nadroparine : 40 UI/kg (2 heures avant, 12 heures
après puis quotidiennement jusqu'au 3e jour, ensuite 60
UI/kg/24 h)
-réviparine : 4 200 UI/24 h (début 12
heures avant)
-tinzaparine : 40 UI/kg (2 heures avant) puis 75 U/kg/24
h.
En chirurgie orthopédique réglée, il
existe une réduction du risque de 71 % avec cette prophylaxie. Les
résultats ne sont pas supérieurs à ceux de l'HNF
adaptée mais la méthode est plus simple. Les études
comparant l'efficacité des différentes HBPN entre elles sont
exceptionnelles. Un essai comparant la tinzaparine et Calciparine® est
là encore réservée aux cas où les HBPM ne sont pas
utilisables (3 500 UI toutes les 8 heures ajustée au TCA x
1,2-1,3).
La durée de la prophylaxie en chirurgie
orthopédique en chirurgie orthopédique a été
prolongée à 30-35 jours postopératoires. Les AVK sont
exceptionnelle utilisées dans cette indication.
L'aspirine à 160 mg réduit significativement
l'incidence des TVP/EP, ainsi que la mortalité par EP, mais elle n'est
pas recommandée dans cette indication.
Nouveaux antithrombose
-Hirudine
Le ximélagatran a été comparé
à l'énoxaparine dans la prévention de la maladie
thromboembolique veineuse en chirurgie orthopédique à haut risque
thrombotique dans l'étude Express. Le ximélagatran montre une
efficacité supérieure à celle de l'énoxaparine,
avec une réduction de risque relatif de TVP proximale et d'embolie
pulmonaire de 63 % dans le cas de la prothèse totale de hanche, et de 60
% dans celui de la prothèse totale du genou. Il existe en revanche une
petite majoration du risque hémorragique, 3,1 % dans le groupe
traité contre 1,2 % dans le groupe placebo.
L'hirune recombinante 15 mg x 2/24 h (Revasc®)
comparée à l'énoxaparine 40 mg /24 h, réduit
significativement l'incident des TVP proximales et des TVP de façon
générale, mais son utilisation est restreinte.
Pentasaccharides
Le pentasaccharide ou fondaparinux (héparine de
synthèse à élimination rénale) a été
testé en prévention de la maladie thromboembolique veineuse en
postopératoire après chirurgie orthopédique, par rapport
à l'énoxaparine. Une méta-analyse des quatre essais
réalisés montre qu'à la dose de 2,5 mg le fondaparinux 50
débuté 6 heures après la chirurgie permet de
réduire d'au moins 50 % le risque d'accidents veineux thrombotiques par
rapport à l'énoxaparine, sans augmentation significative du
risque hémorragique. De plus, des essais cliniques sont en cours avec un
pentasaccharide d'action prolongée (une injection par semaine au lieu
d'une injection par jour) appelé l'idraparinux.
· Prophylaxie en
médecine :
Prophylaxie après un infarctus du myocarde
L'HNF à faible dose réduit le risque de 71 %, et
à forte dose de 86 %.
Prophylaxie après un accident
ischémique cérébral
Le risque de TVP isotopique ou phlébographique est
réduit de 60 à 85 % avec l'HNF à faible dose, les HBPM ou
l'Orgaran® par voie sous-cutanée en deux injections par jour dans
des essais randomisés. En raison du risque de transformation
hémorragique, la prophylaxie par HBPM à forte posologie est
retardée au 3e jour.
Prophylaxie pour autres affectations
médicales
Les deux indications sont les affectations médicales
aiguës et les affectations médicales chroniques. Une récente
randomisée en double aveugle a comparé trois schémas
thérapeutiques (énoxaparine 40 mg, énoxaparine 20 mg et
placebo) chez les patients alités pour une affectation médicale
aiguë.
Ces patients, âgés de plus de 40 ans,
présentaient une insuffisance cardiaque (classe NYHA III ou
intraveineuse), une insuffisance respiratoire aiguë révélant
ou compliquant une insuffisance respiratoire chronique, une maladie infectieuse
ou rhumatologique aiguë associée à au moins un autre facteur
de risque thromboembolique veineux (âge > 75 ans, cancer,
antécédents thromboembolique veineux, obésité,
varices veineuses, thérapie hormonale, insuffisance cardiaque ou
respiratoire chronique). Seule la prophylaxie varie d 6 à 14 jours. Les
affectations médicales chroniques (cancer, insuffisance cardiaque et
bronchopneu-mopathie obstructive) ont été mal
évaluées.
Matériels et méthode
Type et lieu de l'étude :
Il s'agissait d'une enquête prospective, descriptive et
semi-longitudinale, conduite dans 5 hôpitaux tertiaires de Yaoundé
(Centre Hospitalier et Universitaire, Hôpital Général,
Hôpital Central, Hôpital Gynéco-obstétrique) et de
Douala (Hôpital Général). Durant 07 mois (Novembre
2005-Avril 2006), environ 170 médecins y ont participé à
leur insu. 948 patients hospitalisés dans les services de
médecine interne, chirurgie, réanimation et
gynéco-obstétrique ont été inclus.
Yaoundé et Douala sont les 2 grandes métropoles
du Cameroun avec environ 5 millions d'habitants. Elles abritent des
hôpitaux de référence d'une capacité avoisinant 300
lits chacun, offrant des soins de qualité dans diverses
spécialités. Mais en comparaison avec les hôpitaux
occidentaux, ces structures apparaissent sous-équipées. Ainsi, au
moment de notre étude, seulement les examens
tomodensitométriques, ultrasonographiques et phlébographiques
étaient disponibles dans 3 des 5 hôpitaux
impliqués tandis qu'une héparine de bas poids
moléculaire (énoxaparine) et une antivitamine K
(acénocoumarol) étaient les seules molécules
utilisables.
Patients :
Tous les patients retenus dans ce travail présentaient
un risque de MVTE et/ou des signes cliniques évoquant soit un diagnostic
de TVP, soit un diagnostic d'EP. Les facteurs de risque recherchés ici
ont été pris dans la liste du projet OPTIMEV.43 A
l'aide d'une échelle d'évaluation dérivé des
éléments de la triade de Virshow, l'échelle d'Autar
révisée, les patients ont été classés selon
les niveaux de risque thrombo-embolique bas, intermédiaire et
élevé. Des travaux ont démontré que cette
échelle était un outil fiable d'évaluation du risque de
MVTE (précision de 78%).45
De la même façon, les probabilités
cliniques de TVP et d'EP ont été évaluées chez les
patients symptomatiques en utilisant les biens connus scores de Well's pour TVP
et EP respectivement.27 Ces patients étaient ainsi
divisés en trois groupes à probabilités faible,
intermédiaire et forte.
Méthodologie :
Au moment de leur admission, puis au moins 2 fois par semaine,
chacun des patients admis était minutieusement examiné par des
investigateurs. Ceux-ci recherchaient principalement des facteurs de risque de
MVTE (encadré 1) et les signes cliniques évoquant une TVP ou une
EP (encadré 2). Chez les patients présentant des signes cliniques
de TVP ou d'EP, un score de probabilité clinique approprié
était calculé (encadré 3). Sur un questionnaire
standardisé, les investigateurs encerclaient les items présents
et mentionnaient les niveaux de risque et les probabilités cliniques
trouvés. Le coefficient de corrélation inter-observateurs pour le
calcul des scores était de 0.97 [95% IC 0.95-0.99]. Lorsque les valeurs
trouvées étaient différentes, un score consensuel
était retenu.
Dans les dossiers des patients, les investigateurs pouvaient
observer passivement l'attitude des praticiens vis-à-vis du risque de
MVTE et des TVP ou EP ; puis la comparer aux suggestions de l'ACCP. Au
final, on a pu ainsi définir comme critères primaires (1)
présence des facteurs de risque d MVTE, (2) présence des signes
cliniques de TVP ou d'EP, (3) attitude des praticiens vis-à-vis des MVTE
et son adéquation par rapport aux recommandations ; et comme
critères secondaires (1) survenue de TVP ou d'EP (2) durée
d'hospitalisation et mortalité toutes causes confondues.
Encadré 1. Facteurs de risque de maladies
veineuses thrombo-embolique.
Risque inhérent au patient
-Age = 4 ans
-Obésité
-MVTE antérieure
-Immobilisation/alitement = 4 jours
-Grossesse
-Post-partum
-Prise d'oestrogènes
Situations aiguës (indépendantes du
patient)
-Traumatisme-chirurgie orthopédique
-Chirurgie du pelvis
-Neurochirurgie
-Cancers
-Défaillance cardiaque
-Accident vasculaire cérébraux/paralysie de membre
inférieur
-Infarctus du myocarde récent
-Infection
-Voyage prolongé en avion
-Maladie inflammatoire intestinale
-Syndrome néphrotique
-Polyglobulie
-Hémopathies
-Dysprotéinémies
-Chimiothérapie anticancéreuse
-Maladie de Behçet
-Hémoglobinurie paroxystique nocturne
Encadré 1. Signes cliniques de TVP et
d'EP
Signes cliniques de TVP
-Douleurs spontanées
-OEdème/augmentation de volume
-Chaleur localisée
-Douleurs provoquées (Homans)
-Rougeur localisée
-Diminution du ballottement
-Dilatation de veines superficielles
-Asymétrie de pouls
-Touchers pelviens douloureux
-Signes d'AVC
Signes cliniques d'EP
-Douleurs thoraciques
-Dyspnée
-Tachycardie
-Hémoptysie
-Signes d'insuffisance ventriculaire droite aiguë
Encadré 3. Scores de probabilité
clinique de TVP et d'EP
Score de probabilité clinique de Wells pour
TVP
-Cancer évolutif 1
-Paralysie, parésie, immobilisation plâtrée
1
-Alitement > 3 jours ou chirurgie majeure < 4 semaines
1
-Tension douloureuse du membre inférieur 1
-Augmentation de volume global du membre inférieur 1
-Augmentation de volume > 3 cm comparé au membre
Asymptomatique 1
-OEdème prenant le godet 1
-Circulation veineuse collatérale 1
-Probabilité d'un autre diagnostic > celui de TVP
-2
*Probabilité faible : score=0
*Probabilité intermédiaire : score entre
1-2
*forte probabilité : score=3
Score de probabilité clinique de Wells pour
EP
-Age > 65 ans +1
-Antécédents personnels de MVTE +3
-Chirurgie ou fracture < 1 mois +2
-Cancer évolutif ou rémission > 1 an +2
-Douleur spontanée du mollet +3
-Hémoptysie +2
-Fréquence cardiaque entre 75-94/min +3
-Fréquence cardiaque = 95/min +5
-Douleur provoquée et oedème des membres
inférieurs +4
*Probabilité faible : score=3
*Probabilité moyenne : score entre 4-10
*Probabilité forte : score=11
Analyse :
L'analyse descriptive a concerné les données
démographiques, cliniques et les critères primaires et
secondaires. Les variables continues ont été exprimées
comme des moyennes +/- ET et les variables catégorielles comme des
pourcentages. Les tables de contingences ont été construites pour
présenter l'adéquation de l'attitude des praticiens et la
répartition des critères de jugement au sein des
différents niveaux de risque. Les variables continues ont
été comparées à l'aide du t-test impaire et les
variables discrètes à l'aide du test X2.
L'échantillon a été divisé selon le nombre
cumulé de facteurs de risque de MVTE en 4 classes (1) classe
1 : = 2 facteurs de risque, (2) classe 2 : 3 facteurs de risque, (3)
classe 3 : 4 facteurs de risque, (4) classe : = 5 facteurs de risque.
Les valeurs de p < 0.05 étaient considérées comme
statistiquement significatives. Pour les calculs statistiques, nous avons
utilisé le programme SPSS statistical software package (version 11.5.1,
SPSS Inc, Chicago, IL, USA).
Résultats
Patients :
948 patients hospitalisés ont été retenus
dans cette étude (57 +/- 12 ans, 60.1% d'hommes). Parmi eux, 365 (38.5%)
venaient des services de médecine interne, 287 (26%) de chirurgie et 222
(23%) de gynéco-obstétrique. La durée moyenne
d'hospitalisation était de 10 +/- 15 jours.
Facteurs de risque de MVTE :
La plupart des facteurs de risque thrombo-emboliques
décrits dans la littérature étaient présents. Les
plus fréquents étaient : l'âge > 40 ans (90%),
l'alitement prolongé (59%), les maladies infectieuses (39% dont 17%
d'infections au VIH), les actes chirurgicaux (28%), l'obésité
(22%), les cardiopathies chroniques (17%) et les AVC (15%). 485 (51.16%)
patients cumulaient un nombre de facteurs de risque = 2 contre 68 (7.17%) = 5.
Selon l'échelle d'évaluation du risque de Autar, le risque
pouvait être considéré comme faible chez 590 (62.23%)
patients, modéré et élevé chez 180 (18.98%) et 83
(8.75%) respectivement.
Le risque de MVTE n'a été évalué
par les praticiens que chez seulement 583 (61.5%).
|
Table 1. Caractéristiques de base, facteurs de
risqué de MVTE et attitude des praticiens
|
|
Number
|
Percent
|
|
Données démographiques
|
|
Number of admissions
Médecine
Interne
Gynéco-obstétrique
Chirurgie
Unité de Soins
Intensifs
Age (+/-
ET)
Sexe :
mâle
Durée d'hospitalisation (+/-
ET)
|
948
365
222
287
74
57 +/- 12
570
10 +/- 15
|
100
38.50
23.41
26.05
7.80
60.1
|
|
Facteurs de risque de MVTE
|
|
Nombre de patients à risque de MVTE
|
853
|
90
|
|
Facteurs intrinsèques
Obésité
Cancer
évolutif
AVC
Cardiopathies chroniques
Age > 40
ans
ATCD de MVTE
|
214
73
139
164
853
35
|
22.57
7.70
14.66
17.30
90
3.69
|
|
Facteurs aigus
Alitement > 3
jours
Médicaments prothrombotiques
Infections
Traumatisme
Infarctus du myocarde
Césarienne
Avortement/accouchement
Neurochirurgie/chirurgie lourde
Plâtres
Chirurgie
orthopédique
|
560
77
371
35
8
33
42
105
55
75
|
59
8.12
39.14
3.69
0.84
3.48
4.43
11.08
5.80
7.91
|
|
Nombre cumulé de facteurs de risque de
MVTE
|
|
Nombre de facteurs de risque (moyenne +/- ET)
=2 facteurs de
risque
3 facteurs de
risque
4 facteurs de
risque
=5 facteurs de
risque
|
3 +/- 1.01
485
187
113
68
|
51.16
19.72
11.91
7.17
|
|
Niveau de risque
|
|
Risque
faible
Risque
intermédiaire
Risque
élevé
|
590
180
83
|
62.23
18.98
8.75
|
|
Attitude des praticiens
|
|
Prévention chez patients à risque
faible
Prévention chez patients à risque
modéré à élevé
|
78[N=590]
123[N=263]
|
13.22
46.76
|
Table 1 (suite).
|
Table 2. Adéquation des mesures appliquées par
les praticiens
|
|
Risque faible
(N=590)
|
Risque modéré
(N=180)
|
Risque élevé
(N=83)
|
|
Patients évalués pour le risque de
MVTE
|
583(61.5%)
|
|
Nombre de patients symptomatiques
|
TVP : 67(7.06%)
EP : 2(0.21%)
|
|
Mesures physiques
Adéquates
Inadéquates
|
23(4%)
567(96.1%)
23(4%)
|
62(34.44%)
62(34.44%)
118(65.56%)
|
46(55.42%)
46(55.42%)
37(44.58%)
|
|
Médicaments
Adéquats
Inadéquats
|
35(5.9%)
555(94%)
35(5.9%)
|
49(27.22)
31(17.22%)
149(83%)
|
59(71.08)
48(58%)
35(42.16%)
|
|
Table 3. Critères de jugement secondaires
|
|
Nombre
|
Pourcentage
|
p
|
|
TVP
Chirurgie
Gynéco-obstétrique
Unité de soins intensifs
Médecine interne
Risque faible (N=590)
Risque modéré à élevé
(N=263)
|
101
35
26
25
18
20
84
|
10.65
3.7
2.74
2.64
1.9
2.10
8.86
|
< 0.05
< 0.01
|
|
EP
|
10
|
5.69
|
|
|
Décès toutes causes
confondues
TVP (N=101)
EP(N=10)
|
79
23
3
|
8.33
22.77
33.33
|
|
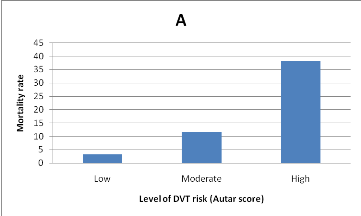 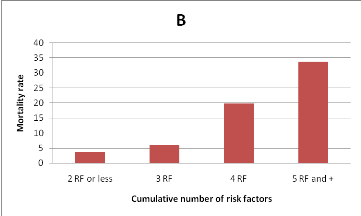
 
Figure 1. Mortality rate according to the level of DVT risk (A)
and the cumulative number of risk
factors (B).
Diagnostic de MVTE:
Les investigateurs ont retrouvé des signes cliniques
évocateurs de TVP chez 101 (10.65%) patients et d'EP chez 10 (1.05%). La
probabilité clinique était intermédiaire à forte
dans 79 et 4 cas en ce qui concernait la TVP et l'EP respectivement.
Pour leur part, les équipes hospitalières ont
suspecté la TVP chez 67 (7.06%) patients et l'EP chez 2. Aucune
référence n'a été faite sur l'utilisation d'un
score de probabilité clinique validé quel qu'il soit. Parmi
les patients suspects de faire une TVP, seulement 39 (38.61%)
ont bénéficié d'une exploration paraclinique,
l'échographie Doppler. Cet examen a confirmé le diagnostic dans
32 cas. Aucun autre examen n'a été effectué. La TVP est
survenue de manière significativement prépondérante en
milieu chirurgical (16) et gynéco-obstétrical (9) par rapport au
milieu médical (3, p < 0.05). Le risque relatif de développer
une TVP était 10.76 fois plus élevé dans le groupe des
patients à risque modéré à élevé par
rapport au groupe à risque faible. [IC 8.70-13.41].
Aucun des cas suspects d'EP n'a été
exploré.
Prise en charge des MVTE:
Sur les 263 patients ayant un risque modéré
à élevé théoriquement concernés par les
recommandations de l'ACCP, 128 (48.74%) n'ont bénéficié ni
de moyens physiques, ni de médicaments anti-thrombotiques (score de
pratique=0) ; 41% ont eu des mesures physiques et 47% des anticoagulants.
La dose médiane d'enoxaparine (la drogue communément
utilisée) était de 3000 UI [2000-1600] pour une durée
moyenne de 5 +/- 8. Les antivitamines K n'ont été
utilisées que chez quelques patients de médecine interne (13). Au
final, 447 (47.15%) patients avaient un score de pratique de 1 (concordance
avec les guidelines). Une petite proportion (5.87%) des patients à
risque faible ont été mis sous aspirine, héparine et
AVK.
Sur les 104 patients symptomatiques, 29 (27.88%) ont
bénéficié d'une prise en charge thérapeutique
idoine durant leur séjour hospitalier, 3 sont sortis avec une
prescription d'AVK et 7 d'enoxaparine.
Critères de jugement secondaires :
Soixante dix-neuf (8.33%) décès toutes causes
confondues ont été enregistrés. Le taux apparaissait plus
élevé parmi les patients symptomatiques : 23% chez ceux
suspects de TVP et 33% chez ceux suspects d'EP. Par ailleurs, on a noté
que ce taux évoluait proportionnellement au niveau du risque de MVTE ou
du nombre cumulé de facteurs de risque (figure 1).
Discussion
Cette enquête hospitalière est assurément
la première à avoir visé l'évaluation de l'attitude
des praticiens vis-à-vis des MVTE. Obtenus dans des structures
sanitaires de référence de notre pays, nos résultats
doivent être assez proches de la réalité sur les MVTE dans
les pays en voie de développement.
Prévalence des facteurs de risqué de
MVTE :
Ces résultats montrent que, chez nous aussi, le milieu
hospitalier est le lieu de conjonction de divers facteurs pro-thrombotiques.
Les facteurs prépondérants (obésité, âge,
alitement, actes chirurgicaux, cardiopathies chroniques, infections) sont
identiques à ceux trouvés dans l'étude
ENDORSE.9 Mais cette distribution semble curieusement
différente de celle décrite dans les milieux voisins ; par
exemple, Adoh A. et al (Côte d'ivoire) avaient trouvé comme
facteurs de risque prédominants l'anémie, la contraception orale
et la drépanocytose.46 Toutefois, cette apparente
disparité pourrait s'expliquer par le fait que le travail ouest-africain
a porté sur des TVP confirmées. On y retrouve d'ailleurs de
façon significative, comme dans notre travail, des facteurs comme les
maladies infectieuses et les cardiopathies chroniques.
Une fraction importante de notre population cumulait 2
facteurs de risque ou plus (51%), c'est-à-dire pas très loin des
48% décrits par Anderson et al aux USA ou encore les 69.8% par Richards
et al en Afrique du Sud.47,48 Environ 28% de nos patients avaient
un risque de MVTE modéré à élevé et parmi
ceux-ci, la durée d'hospitalisation était plus longue et le taux
de mortalité plus élevé ; cela suggère que les
MVTE sont aussi fortement impliquées dans l'aggravation de la
morbi-mortalité hospitalière dans notre milieu. La prise en
compte du risque thromboembolique veineux y serait donc aussi un objectif
primordial pour réduire la mortalité hospitalière.
Prévalence des MVTE:
104 patients ont présenté des signes cliniques
de MVTE ; 86.6% appartenaient aux groupes agrégés à
risque modéré à élevé. Comme l'ont
mentionné des études antérieures, les milieux chirurgical
et gynéco-obstétrical restent les principales pourvoyeuses de
MVTE (3.7% et 2.74% respectivement) contre 1.9% pour les affections
médicales.
La faible fréquence des investigations paracliniques
dans le groupe des patients symptomatiques pourrait constituer une faiblesse
pour notre étude (48% des cas suspects de TVP, aucun de ceux suspects
d'EP). Un certain nombre de raisons peuvent être énoncés
pour expliquer cette situation: insuffisance des équipements et des
opérateurs, problèmes financiers ou encore faible mobilisation
des praticiens. Toutefois, loin d'être ainsi un facteur de
dépréciation, ce résultat constituerait une occasion
idoine pour sensibiliser les praticiens sur l'importance, chez les patients
hospitalisés, de la prise en compte prompte du risque de MVTE, de la
recherche des signes cliniques de TVP ou d'EP ainsi que de l'utilisation de
scores de probabilité clinique validés. Initier un traitement
adéquat lorsque la probabilité est au moins modéré
serait surement une attitude sage et efficace pour sauver des vies en absence
de possibilité d'investigation.
Evaluation des pratiques
hospitalières :
Fort heureusement, les patients à risque
thrombo-embolique élevé étaient mieux pris en charge
(score de pratique = 1 dans 58% et 67% pour l'implémentation des mesures
préventives et curatives respectivement). Cette présentation
flatteuse dans des hôpitaux de référence cache certainement
un état moins luisant dans les hôpitaux d'échelon
inférieur.
Au total, 48.66% de patients ayant une indication de
prévention de MVTE n'ont pas eu de telles mesures. Akinmoladum a
rapporté un taux de 47.5% en milieu chirurgical au Nigéria et
Prasannan 99% en Malaisie dans la même milieu.11,49 Les
patients en milieu chirurgical semblent être mieux pris en charge comme
dans l'étude ENDORSE: 58% contre 39.5% en milieu médical.
| 

