²I.3.2. Les méthodes de mesure de
l'oxydation:
Toutes les méthodes de mesure du pouvoir antioxydant
d'un principe actif reposent sur le même principe également
provoquer une oxydation sur une matrice sensible, et mesurer le ralentissement
de dégradation de la matrice protégée par l'antioxydant
par rapport à un témoin sans protection.(Rolland ,2004).
²I.3.2.1 . Mesure en milieu lipidique :
a. Mesure de l'oxydation en temps
réel:
Elle se fait par la mesure de l'indice de peroxyde (le nombre
de 1 gramme d'oxygène actif du peroxyde contenus dans 1 gramme de corps
gras susceptible d'oxyder l'iodure de potassium avec libération
d'iode).l'efficacité de l'antioxydant liposoluble est mesurée par
une augmentation plus lente de l'IP par rapport à 1 témoin sans
protection. (Rolland , 2004).

Chapitre I : Les polyphénols et activité anti
oxydante.
b. Mesure de l'oxydation par tests de vieillissements
accélérés:
- Test de swift ou AOM (Active Oxygen Méthod ):
Ce test consiste à faire passer un courant d'air
purifié dans un échantillon d'huile à 97,8°C à
des intervalles régulières ,on mesure l'IP, et on
détermine le temps nécessaire à un indice de peroxyde de
100 meq d'oxygène actif/Kg de matière grasse .
Ce mode de mesure peut être réalisé par
d'autres tests :
.l'utilisation de l'appareil "Oxypress"
.l'utilisation de
l'appareil "Rancimat"
9ETE2E2E 2F1) isuai2Fil2FP laiu2FDDiN :
a. Mesure au DPPH :
Le DPPH (1,1 Diphényl 2 Pycril Hydrazil) est un radical
libre stable de couleur violette intense. La mesure de l'efficacité d'un
antioxydant (capacité à fixer des radiaux libres, donc arriter la
propagation de la réaction en chaîne). (Rolland, 2004).
,en particulier l'utilisation du paramètre CE50
(Concentration efficace de substrat pour produire 50% de réduction du
DPPH ) (Molyneux ,2004) ,se fait en mesurant la diminution de la coloration
violette, à 515nm-517nm, due à une recombinaison des radicaux
DPPH .
Lorsqu'une solution de DPPH est mélangé avec une
substance qui peut donner un hydrogéne, alors cette
réaction donne lieu à la forme réduite avec perte de la
couleur violette ( avec une couleur jaune pale résiduelle du groupements
picryl encor présent).
Représentons le radical DPPH par Z*, et le donateur de
proton par AH. La reaction primaire est :
Z* + AH ZH+ A*
Ou : ZH est la forme réduite du DPPH.
A* est le radical produit par cette première
étape.
Ce dernier subira d'avantages de réactions et
réagira avec une autre molécule de la mrme espèce,
produite par une réaction parallèle avec inhibition du
radical.
Ainsi le DPPH visa à représenter un radical
libre dont l'activité doit etre supprimé par la substance
antioxydante (polyphénol)
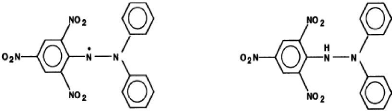
a: Diphenylpicrylhydrazyl (radical libre) b:
Diphenylpicrylhydrazine (non radicalair)
Figure 03 : Structure du DPPH (Molyneux
,2004).
b. Les paramètres influençant la mesure au
DPPH:
Cette mesure se fait grâce à un
spectrophotomètre visible, la solution est mise dans une cuve d'1 cm de
largeur avec un volume maximal de 4ml, pour une précision d'analyse, les
mélanges devraient être utilisés (comme 0,1 ml et 3,9ml et
vise vers ca) mais cela peut réduire la précision de la
mesure.
b.1. Solvantet et pH:
En ce qui concerne le solvant à utiliser, la
méthode semble fonctionner aussi bien avec du méthanol ou
l'éthanol qui interférent avec la réaction (ce sont les 2
solvants les plus communaiment utilisés), tandis que l'utilisation
d'extraits d'eau ou d' acétones semble donner des valeurs inferieures
(moindre).
Pour le pH, il a été suggéré que
le système devrait être maintenu à un pH se situant dans
une fourchette de 0,5 à 6,5 à l'aide de tampon d'acétates
mais ,cette précaution semble être abandonnée dans la
pratique actuelle. En effet, il existe une grande incertitude dans le sens du
pH dans ces valeurs principalement en milieu organique tels que le
méthanol et l'éthanol.
b.2. La concentration en DPPH:
En spectrophotométrie, la concentration en DPPH dans la
cuvette doit être
choisie de façon à donner des valeurs
d'absorbances inferieures à 01 (ce qui correspond à
l'intensité lumineuse que décroit en passant par
l'échantillon).Cela suppose une concentration entre 50 à 100
Um.
b.3. Longueur d'onde: L'absorbance est
mesurée à 515 nm, ce qui correspond au maximum d'absorbance.
b.4. Le temps de réaction:
Dans la méthode originale décrite par Blois, un
temps de température de 30minutes a été recommandé,
compte tenu du fait que le taux de la température est très
variable entre les substrats. La meilleure pratique semble être de suivre
la température jusqu'à la fin (en plateau).
-Le taux de température a été proposé
comme un autre paramètre pour caractériser les activités
antioxydantes.
Les huiles essentiels et
mesure de l'activité
antibactérienne
II. 1.Les huile essentielles :
II.1.1. Définition, localisation et
répartition :
Huile essentielle ou huile aromatique sont des produits
obtenus a partir d'une matière première végétale,
elles sont classées parmi les métabolites secondaires, leur
synthèse et accumulation se font généralement au niveau
des structures histologiques spécialisées, souvent
localisées sur la surface de la plante. Ces huiles peuvent êtres
stockées dans divers organes ; fleurs (origan), feuilles (citronnelle,
eucalyptus), écorces (cannelier), bois (bois de rose, santal), racines
(vétiver), rhizomes (acore), fruits (badiane) ou grains (carvi)
(Hernández, 2005).
Les huiles essentielles n'ont pas une présence
générale chez les végétaux. Environ 1%
des espèces élaborent des essences. Certaines
familles se caractérisent par le grand nombre d'espèces à
essences qu'elles groupent et en particulier les labiés (Thym, Menthe,
Lavande, Origan, Sauge, etc.), les Ombellifères (Anis, Fenouil,
Angélique, Cumin, Coriandre, Persil, etc.), les Myrtacées
(Myrthe, Eucalyptus), les Lauracées (Camphrier, Laurier-sauce, Cannelle)
(Benayad N, 2008).
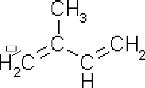
II.1.2. Chimie des HE :
Sur le plan chimique, les huiles essentielles sont des
molécules très volatiles, de structure extrêmement
complexe, synthétisées à partir d'unités
méthyle-2-buta-1,3-diène (isoprène) (figure04). Les
diverses combinaisons de ces unités, par réaction d'additions,
conduisent aux terpènes, sesquiterpènes, diterpènes, mais
aussi à leurs produits d'oxydation tels que les alcools,
aldéhydes, cétones, éther et ester terpéniques
(Hernández, 2005).
Les HE doivent leur nom à ce qu'elles sont très
réfringentes, hydrophobes et lipophiles. Elles ne sont que très
peu solubles ou pas du tout dans l'eau et on les retrouve dans
le protoplasme sous forme d'émulsion plus ou moins stable qui tende
à se collecter en gouttelettes de grosse taille. Par contre, elles sont
solubles dans les solvants des lipides (acétone, sulfure de carbone,
chloroforme, etc.) et, à l'inverse des glycérides, dans l'alcool
(Delaquis et al., 2002).
II.1.3. Propriétés des HE :
Elles ont des propriétés et des modes d'utilisation
particuliers et ont donne naissance a une branche nouvelle de la
phytothérapie : l'aromathérapie (Delaquis et al., 2002).
Les huiles essentielles possèdent de nombreuses
activités biologiques. En phytothérapie, elles sont
utilisées pour leurs propriétés antiseptiques contre les
maladies infectieuses, cependant, elles possèdent également des
propriétés cytotoxiques qui les rapprochent donc des
antiseptiques et désinfectants entant qu'agents antimicrobiens à
large spectre (Hernendez, 2005).
Chapitre II : Les Huiles essentielles et activité anti
bactérienne
Figure 04 : Structure du précurseur des
HE : l'isoprène.
(Sarni-Manchado et Cheynier, 2006)
IIM. AD plbaISHAIS'exMLFIKQAISHA (:
| 


