Introduction :
Les plantes véritable usine chimique ne cessent de nous
épater encore et encore par la richesse des constituants qu'elles
synthétisent que par les multiples utilisations qu'elles trouvent dans
notre vie quotidienne. Cela nous fait ouvrir les yeux sur la terre, sur sa
végétation et sur les possibilités médicinales car
malgré les énormes progrès réalisés par la
médecine moderne l'homme n'a eu que les plantes pour le guérir et
prévenir depuis la nuit des temps du fait que les plantes
présentent des remèdes naturels bien acceptés par
l'organisme .
La recherche sur les substances naturelles est un thème
porteur de puis quelques années et les laboratoires pharmaceutiques sont
toujours prêts à l'élaboration de nouveaux composés
actifs, à l'identification, à la caractérisation des
molécules naturelles et à la mise au point des médicaments
qui ont pour origine des substances naturelles et de s'inspirer de leurs
structures moléculaires pour imaginer de nouveaux médicaments.
Ces molécules que constitue le principe actif des plantes
médicinales appartiennent majoritairement aux métabolites
secondaires tels que les polyphénols, les huiles essentiels et les
alcaloïdes.
On s'est intéressé dans notre travail aux
molécules ayant des propriétés antioxydantes. Dans ce
cadre, on a étudié les extraits d'une espèce
végétale ; Centaurea microcarpa Coss et Dur., suivant
deux approches
- Une approche théorique visant:
· Présenter les polyphénols et les huiles
essentielles de façon générale
· Mettre en avant les activités anti oxydantes des
polyphénols et l'activité
antimicrobienne des huiles essentielles.
- Une approche expérimentale consistant à :
· Extraire des polyphénols, des flavonoïdes
et des huiles essentielles par différents
méthodes et déterminer les différents
facteurs qui influencent leur extraction ainsi que
les rendements.
(CCM) et une analyse spectrale par spectrophotométrie
UV-visible.
· Soumaitre les extraits brutes polyphénoliques a
une analyse chromatographique
Les polyphénols et
mJsXtJ IdJ Il'LF\ivité
antioxydante
I.1. Les polyphenols :
I.1.1. Définition des
polyphénols:
Avec environ 9000 structures naturelles
élucidées à ce jour, les polyphénols constituent
une famille importante de métabolites secondaires de faible poids
moléculaire du règne végétal (Akowah et al, 2004),
qui correspondent à une très large gamme de structures chimiques
et sont un bon témoin de l'extraordinaire capacité de
biosynthèse des plantes. Ce sont des corps dont la molécule
contient plusieurs fonctions phénols (Ferguson L, 2000), ces corps
jouent un rôle fondamental car sont des éléments importants
de qualités sensorielles (couleur et caractère organoleptique.)
et nutritionnelles des végétaux que consomme l'homme et leur
intervention dans la santé et maintenant reconnue dans des domaines
variés,anticoncerigene ,antioxydant, la lutte contre le vieillissement
des cellules (Sarni-Manchado et Cheynier,2006), anti oestrogenique et anti
inflammatoire, certains d'eux sont dits non nutritionnels car ils ne jouent
aucun rôle dans la plantes.
I.1.2 Localisation au niveau cellulaire et
tissulaire:
Une bonne reconnaissance de la localisation des composés
phénoliques dans les différents tissus et organes
végétaux est souvent essentielle pour orienter l'utilisation que
l'homme souhaite en faire.
A l'échelle cellulaire, la localisation des
composés est très caracteristique.Ils s'accumulent principalement
dans deux sites : d'une part la paroi cellulaire ou sont présentes les
lignines et la
vacuole RX \RQ \tRFké\ O\ SNénRl\ \RlXRe\ [lntNRF
l11\, KlMRnRl\, Ilnin\, I FRtlin\
flavonoïdes (quercétine, kamphérol) pourraient
également être présents au niveau du noyau et de la
membrane plasmique mais toujours à très faible concentration.
A l'échelle tissulaire, on observe également des
repartions très inégales des différents composés
phénoliques. Ainsi les anthocyanes et les pigments de type flavonols
sont généralement présent dans les couches cellulaires
externes des organes végétaux en particulier les épidermes
de fruits et des feuilles.(Sarni et Cheynier ,2006).
=Répartition au niveau des fruits et
légumes:
Plusieurs milliers de polyphénols ont été
identifiés chez les plantes dont plusieurs centaines dans les plantes
comestibles. Il est généralement admis que les humains
ingèrent environ 1 gramme de polyphenols par jour (Akowah et al,
2004).
Tableau 01 : Classement des fruits et
légumes les plus riches en polyphénols :
( Brad et al., 2008
)
|
Fruits et légumes
|
PP totaux ( mg GAE/100 g )
|
|
01
|
$ EtiFKIIIXtJ(JF IXEJI
|
321.3
|
|
02
|
Persil
|
280.2
|
|
03
|
Fraise
|
263.8
|
|
04
|
Choux de Bruxelles
|
257.1
|
|
05
|
Litchi
|
222.3
|
|
06
|
Raisin
|
195.5
|
|
07
|
Abricot
|
179.8
|
|
08
|
Pomme
|
179.1
|
|
09
|
Echalote
|
104.1
|
|
10
|
Datte
|
99.3
|
|
11
|
Brocoli
|
98.9
|
|
12
|
Cerise
|
94.3
|
|
13
|
Figue
|
92.5
|
|
14
|
Célerie
|
84.7
|
|
15
|
Oignon
|
76.1
|
|
16
|
Nectarine blanche
|
72.7
|
|
17
|
Fruit de passion
|
71.8
|
|
18
|
Poire
|
69.2
|
|
19
|
Mangue
|
68.1
|
|
20
|
Aubergine
|
65.6
|
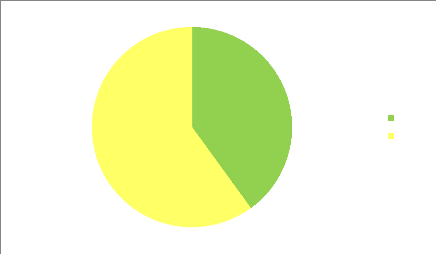
60%
0% 0%
40%
légume fruits
Figure 01 : Répartition des
polyphénols dans les fruits et légumes.
Les polyphénols sont particulièrement abondants
dans les fruits. Leur teneur Peut atteindre 263.8. mg GAE / 100 g dans certains
fruits comme les fraises, les pommes, les raisins.
Les légumes contiennent aussi des quantités
importantes de PP. le champion toute catégories est l'artichaut avec une
concentration de 321.3 mg GAE / 100 g.
Parmi les 20 premiers fruits et légumes les plus riches en
polyphénols. 60 % représentent les fruits et le reste des 40 %
est représenté par les légumes
q 11141 1 plKEdl-lafpWdl-f al-s SEOSKpnEC :
L'extraction, la séparation, la caractérisation et
le dosage des composées phénoliques se fait selon plusieurs
méthodes, les plus utilisées et employées sont
résumé dans le tableau qui suit :
Tableau 02 : Principales méthodes
d'études des composées phénoliques :
|
Techniques :
|
Principe:
|
Référence :
|
|
Extraction
|
Extraction par les
solvants (macération)
|
Le contacte entre le solvant(liquide) et la matière
végétale (solide) a pour but de libérer
les polyphénols présents dans les cellules par rupture du tissus
végétale et par diffusion.
|
Owen et johns, 1999
Hayouni et al.,2007
|
|
Extraction par
chromatographie sur
colonne
|
Elle consiste à absorber sur une résine du type
C18 pour les polyphénols et flavonoïdes des extraits
végétaux puis à éluer sélectivement les
substances polyphénoliques au moyen d'éthanol ou méthanol
aqueux .
|
|
|
Extraction supercritiques (SFE)
|
-Le CO2 supercritique, utilisé comme solvant
d'extraction, du fait de sa faible viscosité lui
confère une grande capacité de diffusion lui permettant d'avoir
accès à des composées phénoliques liés a la
paroi cellulaire et sa densité relativement élevé lui
confère un pouvoir de solvatation ce qui permet un meilleur taux
d'extraction. -Procédé non dénaturant.
-Temps d'extraction réduit.
|
Chan et Maznah ,2009
|
|
Separation et purification
|
Chromatographie sur couche mince (CCM)
|
Séparation et purification des différents
constituants en fonction de leur taille et de leur forme Les constituants du
mélange se séparent par migration différentielle : chacun
d'eux est d'autant plus entraîné par l'éluant qu'il est
plus soluble dans celui-ci et
moins adsorbé sur la phase stationnaire.
|
Tissut, 1967
|
|
Chromatographie liquide haute
performance (HPLC)
|
L'échantillon à analyser est poussé par un
liquide
(appelée phase mobile) dans une colonne remplie d'une
|
CastanedaOvando et al.,2009.
|
|
phase stationnaire de fine granulométrie (les "grains"
sont de très petite taille). Le débit d'écoulement de la
phase mobile est élevé ce qui entraîne une augmentation de
la pression dans le système. Ce débit élevé diminue
le temps nécessaire pour séparer les composants le long de la
phase stationnaire
|
|
Chromatographie
phase gaz (CPG)
|
Les différents solutés gazeux vont se
séparer par
migration différentielle le long de la phase
stationnaire.
|
Colin-Henrion et al.,2008
|
|
Caracterisation
|
Chromatographie sur couche mince (CCM
|
Les constituants du mélange se séparent par
migration différentielle : chacun d'eux est d'autant plus
entraîné par l'éluant qu'il est plus soluble dans celui-ci
et
moins adsorbé sur la phase stationnaire.
|
Lawson,2006
|
|
Spectrophotométrie UV-visible
|
méthode analytique quantitative qui consiste à
mesurer l'absorbance ou la densité optique d'une substance chimique
donnée en solution. Plus cette espèce est concentrée plus
elle absorbe la lumière dans les limites de proportionnalités
énoncées par la loi de Beer-Lambert. La densité optique
des solutions est déterminée par un spectrophotomètre
préalablement étalonné sur la longueur d'onde d'absorption
de l'espèce chimique à étudier.
|
Harbourne et al.,2009
|
|
HPLC-MS et RMN
|
|
Bassomo et al.,2004
|
|
Dosage
|
Dosage par
spectrophotométrie
|
Par méthode de Folin ( non spécifique)
|
Harbourne et al.,2009
|
|
Dosage par HPLC
|
Séparation sur colonne phase inverse C18 et
détection à l'aide d'un spectrophotomètre UV 171
|
Lawson,2006
|
².2. Les flavonoïdes
Les flavonoïdes présentent la plus grande classe
de polyphénols, ils relèvent du métabolisme secondaire et
sont très répondus dans le règne végétal. On
estime que 2% de l'ensemble du carbone photo-synthétisé par les
plantes est transformé en flavonoïdes (Alothmane et al.,2009).
Ils sont présent dans les feuilles, les fleurs, le
pollen et les fruits, leur concentration augmente avec l'exposition au soleil
et constituent de ce fait un écran protecteur contre la photo et la
thermodégradation (protègent la plante des agressions du
rayonnement UV) (Sarni-manchado et Cheynier, 2006). Ils participent aussi
à la coloration des fleurs et des fruits et existent le plus souvent a
l'état naturel sous forme d'hétérosides.
Les flavonoïdes sont des molécules
polyphénoliques avec un squelette diphenylpropane (C6-C3- C6) (Alothmane
et al., 2009), fait de 15 atomes de carbone, avec une grande diversité
structurale, en effet, on en dénombre 5000 composés
différents et présentant des propriétés de
solubilités différentes influençant leurs extraction
(Alothmane et al.,2009).
Plusieurs études ont soulignés que les
flavonoïdes de différentes sources botaniques agissent comme
antioxydants puissant encor plus que la vitamine C (Alothmane et al.,2009),
due principalement à la configuration catéchol
du noyau B. Cette activité s'exerce surtout dans les milieux
émulsionnés car ils sont peu solubles dans les phases lipidiques
et protègent efficacement les lipoprotéines ou liposomes
(Sarni-manchado et Cheynier, 2006). Les flavonoides agissent comme antioxydants
primaires et stabilisent les radicaux peroxydes, mais peuvent aussi
désactiver l'ion super-oxyde, le radical OH* ou l'oxygène
singulet, inhiber la lipoxygénase ou encor chélater les
métaux (surtout les flavonoïdes) (Sarni-manchado et Cheynier,
2006).
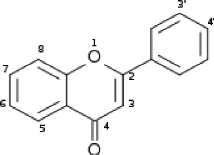
Figure 02: Squelette flavonoïdique (
C6-C3-C6)
Deux cycles aromatiques de type phényl A et B liés
par une chaine de trois carbone généralement cycliques.
Le degré d'oxydation du cycle détermine les
différentes classes de flavonoïdes
qiim Activités biologiques des
polyphénols :
Les composées phénoliques sont douées
d'activités diverses, probablement su a leurs diversités
structurales, le tableau suivant, englobe les activités biologiques des
polyphénols les plus importantes :
Tableau 03 : Principales activités
biologiques des composées phénoliques :
|
Classes de polyphénols
|
Activités
|
Références
|
|
Acide phénoliques
|
Anti carcinogènes Anti mutagènes
Anti oxydants
|
Ferguson, 2001
Sarni-Manchado et Chenyier ,2006
|
|
Stilbénes
|
Inhibent l'oxydation des LDL et l'agrégation des
plaquettes
Anti carcinogènes Anti mutagènes
|
Sarni-Manchado et Chenyier, 2006
Ferguson, 2001
|
|
Coumarines
|
Anti carcinogènes Anti mutagènes
Digestibilité des protéines
|
Ferguson,2001
Lazoui et al ,2006
|
|
Flavonoïdes
|
Anti carcinogènes Anti mutagènes
Anti oxydants
|
Ferguson, 2001
Alothane et al ,2009
|
|
Anthocyanes
|
Anti oxydants Colorants
|
Sarni-Manchado et Chenyier ,2006 Ferguson, 2001
|
|
Lignines
|
Anti carcinogènes Anti mutagènes
|
Ferguson,2001
|
|
Tanins
|
Anti oxydants Anti tumoral
Digestibilités des protéines
|
Mousavinejade et al. ,2009
Lazoui et al ,2006
|
|
Proanthocyanidines
|
Anti inflammatoires
Anti bactériens Anti fongiques
|
Ferguson,2001
|
| 


