Partie pratique
Matériels et méthodes

Chapitre IV : Matériels et méthodes.
IV.1.Matériel végétal :
IV.1.1. Origine:
L'étude a été menée sur une
espèce végétal ; Centaurea microcarpa Coss. et
Dur. Une plante choisis selon sa présence dans la région. La
partie aérienne servira comme matière première pour
l'extraction des substances polyphénoliques et des HE.
IV .1.2 Echantillonnage :
Les échantillons sont collectés prés de la
cimenterie de Hammam Dalâa. (figure06). L'échantillonnage est
effectué d'une manière aléatoire et à partir de
plusieurs points du site. IV.1.3.Préparation des
échantillons:
IV.1.3.1.Test d'humidité :
Le taux d'humidité est mesuré en
déposant une masse représentative de la plante, de 2 grammes
(trois fois) dans un incubateur (Memmert) pendant 4 heurs à 104°C
(figure07).Le test est très important car il nous permet de suivre au
mieux l'étape de séchage.

mf - ms
Teneur en eau (%) = .100
mf
mf : Masse fraiche. ms : Masse sèche.
Avant séchage Après séchage
Figure 07: 7Tste d']KXP idité Tde la
partie aérienne de Centaurea microcarpa Coss et Dur.
IV.1.3.2.Séchage de l'échantillon :
Les échantillons étales sont placés dans un
incubateur (Memmert) à 45°C pendant une semaine (168 heurs), pour
subir l'opération de séchage.
IV.1.3.3.Broyage :
Les échantillons séchés sont broyés
dans un broyeur de cuisine (Seb) puis mis dans des bocaux hermétiques et
conservés à sec (température ambiante) à l'abri de
l'humidité.
Le broyage de la plante permet d'augmenter la surface de
contact solvant-échantillon, une meilleure filtration du solvant au sein
du matériel végétal ce qui à pour
conséquence une augmentation de l'extraction (solide-liquide).
IV.2. Extraction des extraits bruts
polyphénoliques :
Plusieurs procédés d'extraction peuvent être
utilisés, du fait de la diversité des métabolites
secondaires, en particulier des polyphénols.
Pour l'extraction des polyphénols on a opté
pour l'utilisation de deux méthodes, dont le principe
général est le mrme, mais différent en ce qui est des
conditions d'extraction. La première est celle utilisée par
Akowuah et al., 2005, et la deuxième est celle utilisée par OWEN
et JOHNS 1999.
Tous les extraits obtenus subissent une filtration et une
évaporation.
IV.2.1. Principe des deux méthodes d'extraction
:
Ces deux méthode d'extraction ne sont qu'une extraction
par macération ,qui est un procédé d'extraction
solide-liquide discontinu qui consiste à laisser tremper le solide dans
un solvant à température ambiante ,durant elle ou on a fait
l'ébullition ,pour en extraire les constituants solubles .
IV.2.2. 0 pINI13e11133exNIDRIQ111335 WXD111e111Da11TEM
:
Dix grammes (10g) de chaque échantillon sont
pesés puis trompé respectivement et séparément dans
100ml de Chloroforme (Prolabo), Méthanol pure (Biochem),
Acétone70%, (Chemopharma), Méthanol 50% (Biochem) et Eau.
La verrerie utilisée (Béchers, pipettes,
entonnoirs et fioles), est préalablement lavée et
séchée.
Les fioles (d'une capacité de 250ml) contenant les
solutions d'échantillons sont incubées dans un bain marie
(Memmert) à une température de 40°C pendant 4h et 8h (figure
08).
10g dans
chaque fiole
10g dans chaque fiole
Plante broyée
(parties aériennes )
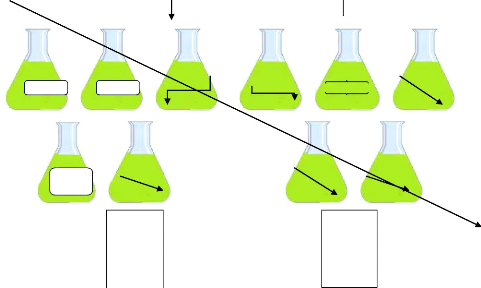
Chlorof
MeOh
50%
MeOh
MeOh
Eaue Eaue
50%
Acétone
70%
Chlorof
MeOh
Acétone
70%
Filtrations

Evaporation sous vide à 55°C
Figure 09 : 31R1RFRCEVIIIIFtIRCdeNSROSKpCROARRC
SIRZEK It Il., TE05
Après filtration sur tissu (Figure10.a), sur papier
Watman (n°=1) (Figure11.b) et sous vide (Fig12), lse filtrats sont soumis
à une évaporation à basse pression à 45°C
(rotavapor R-210 BUCHI), jusqu'à l'obtention d'extraits sec. Le poids
des extraits sec est pesé puis solubilisé par un volume connu de
solvant.
a. La filtration :
La filtration permet de clarifier les solutions
d'échantillons et d'éliminer les particules solides issues des
déchets de la plante. (Figure09)
- Une première filtration se fait à travers un
tissu de fina placé dans un bécher ; la pate ainsi
obtenue est pressé à la main pour chasser le
maximum de solvants et de solides solubles. - Une deuxième filtration
est assurée par le papier Watman porosité 1.
- Une dernière filtration, sous vide est suivie à
l'aide d'un filtre en verre fritté (porosité 4) pour
éliminer les imputées solubles.

a. Filtration à travers tissus
b. Filtration sur papier Watman.

c. Filtration sous-vide. Figure09:
Filtration des extraits.

Chapitre IV : Matériels et méthodes.
b.Evaporation :
Les filtrats obtenus subissent une évaporation sous
vide dans un rotavapor (rotavapor R-210 BUCHI) jusqu'à l'obtention
d'extraits sec de PP (figure10).Ces extraits brutes de polyphenols (EBP) sont
alors récupérés et pesés.
Poids de l'extrait sec après évaporation
Extraits brut de polyphénols (EBP) en % = X 100
Poids de l'échantillon

Figure 10: Evaporation des extraits par
rotavapor (R-210 BUCHI).

Chapitre IV : Matériels et méthodes.
IV.2.3. Méthode d'extraction d'OWEN et JOHENS
:
L'extraction a été réalisée avec
du Méthanol pur (99% Biochem). D'après le protocole suivie 200 mg
de poudre des parties aériennes de Centaurea microcarpa Coss et
Dur. Sont dissous dans un volume de 500 ml de Méthanol, le
mélange est conservé à température ambiante sous
agitation pendant une semaine de temps IIIIDCHE)lSRurldRnneill'eiIDiIlP
pINDnRlirN lIIILI E8).Après filtration par le papier Watman (n°=1),
le filtrat est soumis à une évaporation à basse pression
à 45°C (rotavapor R-210 BUCHI),
avru'àll'RniviRnld'pnleItrDplseF lLe lSRIdsldI ll'extrait sec est
pesé puis solubilisé par un volume connu de Méthanol
(figure12).

Figure 11: Extrait méthanolique
La quantification de l'extrait est calculée comme suit
:
(P1 #177; P2)

Le taux de la matière extraite (%)= x 100X X 100.
E
P1: poids du ballon vide (g)
P2:poids du ballon après évaporation (g). E: poids
de l'extrait sec (g).

Broyage

500ml de Méthanol pure Agitation (168h à
température ambiante)
éthanoli
Extrait
Filtration Evaporation à 55°C

Extrait sec



Figure : Protocol d'extraction des
composés phénoliques de la partie
aérienne de
Centaurea microcarpa Coss et Dur.
| 


