3.4. Méthode analytique
Les solutions de bleu de méthylène avant et
après adsorption ont été analysées à l'aide
d'un spectrophotomètre UV-Visible (Hack, SP1105) dans des cellules en
quartz et en verre de 1 cm d'épaisseur.
a. Droite d'étalonnage
Pour établir, la droite d'étalonnage, nous avons
mis en application la loi de Lambert-Beer
A=å .l.c [6]
À une longueur d'onde donnée cette loi
établie une relation entre l'absorbance et la concentration de la
substance.
b. Principe de la loi de Lambert-Beer
En spectroscopie UV-Vis, on utilise l'énergie
émise par une lumière monochromatique. Si un faisceau
monochromatique d'intensité I0 traverse la
solution à analyser, une partie de cette lumière
d'intensité Ir sera reflétée,
une autre, d'intensité Ia, sera
absorbée par la solution et enfin une troisième,
d'intensité I, traversera la solution à
analyser. (Figure 9).
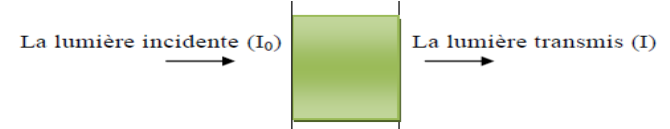
Figure 9. La traversée d'une lumière
monochromatique
On aura:
I0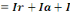 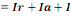 [7]
[7]
La lumière reflétée peut être
négligée, nous aurons :
I0= Ia+I
[8]
En mettant I0 et
Ia en relation, on trouve :
I=I0.10-ålc
[9]
Cette équation peut se réécrire
 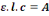 [10]
[10]
On obtient alors la loi de Beer-Lambert:
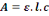
Avec :
A : absorbance ou densité optique (D.0) ;
å : coefficient d'absorption molaire
(L.mg-1.cm-1) ;
l : longueur du chemin optique ou épaisseur de la
cellule (1cm) ;
C : concentration du soluté
(mg.L-1).
L'absorption molaire traduit la probabilité de
transition entre la lumière et la solution c'est-à-dire plus
grande est l'absorption molaire plus l'interaction lumière-solution est
élevée.
La relation de Lambert-Beer prouve que l'absorbance d'un
faisceau monochromatique est directement proportionnelle à longueur du
chemin optique (å) à travers l'échantillon
(l), à la concentration de l'espèce absorbante
(C) et l'absorptivité, dépendant de la
substance.
Le tableau 8 présente les variations
de l'absorbances en fonction des concentrations de Bleu de
méthylène et les figure 10 à 16 donnent
l'évolution de l'absorbance en fonction de la concentration de la
solution pour différents pH de Bleu de Méthylène.
Tableau 8 : Variation de l'absorbance en fonction des
concentrations de la solution de Bleu de Méthylène pour
différents pH.
|
Ci (mg L-1)
|
pH 3,05
|
pH 4,01
|
pH 5,14
|
pH 6,69
|
pH 8,30
|
pH 10,01
|
pH 12,05
|
|
1
|
0,021
|
0,023
|
0,03
|
0,031
|
0,0 31
|
0,037
|
0,039
|
|
5
|
0,085
|
0,092
|
0,10
|
0,093
|
0,049
|
0,053
|
0,052
|
|
10
|
0,149
|
0,171
|
0,176
|
0,179
|
0,1
|
0,097
|
0,094
|
|
20
|
0,329
|
0,329
|
0,313
|
0332
|
0,192
|
0,101
|
0,186
|
|
30
|
0,495
|
0,488
|
0,453
|
0,502
|
0,389
|
0,319
|
0,237
|
|
40
|
0,669
|
0,658
|
0,62
|
0,637
|
0,503
|
0,496
|
0,393
|
|
50
|
0,855
|
0,819
|
0,786
|
0,756
|
0,748
|
0,698
|
0,594
|
|
60
|
0,999
|
1,008
|
0,925
|
0,902
|
0,898
|
0,998
|
0,881
|
|
70
|
1,173
|
1,167
|
1,098
|
1,07
|
1,089
|
1,054
|
1,029
|
|
80
|
1,302
|
1,322
|
1,251
|
1,245
|
1,399
|
1,203
|
1,371
|
|
90
|
1,497
|
1,5
|
1,408
|
1,420
|
1,425
|
1,448
|
1,417
|
|
100
|
1,625
|
1,659
|
1,547
|
1,575
|
1,599
|
1,501
|
1,561
|
|
R2
|
0,9961
|
0,99991
|
0,99982
|
0,9999
|
0,99979
|
0,99987
|
0,99979
|
|
(L.mg-1 cm-1)
|
0,016
|
0,017
|
0,016
|
0,016
|
0,016
|
0,017
|
0,016
|
|
ë max
|
664
|
662
|
664
|
664
|
664
|
662
|
662
|
Avec :
R : coefficient de corrélation
å : coefficient d'absorption molaire
(L.mg-1.cm-1)



Figure 10: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C; V : 100 mL ;
pH 3,05
Figure 11: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01 °C; V : 100 mL ;
pH 4,01
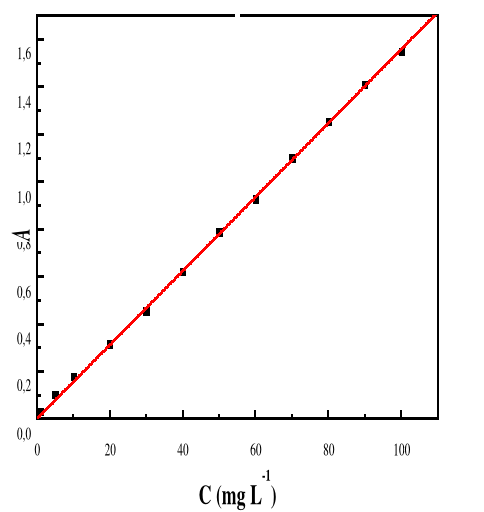
Figure 12: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ; pH
5,14
Figure 13: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C ; V : 100 mL ;
pH 6,69
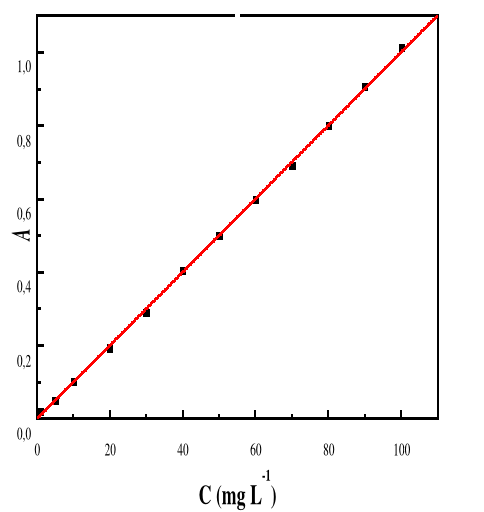
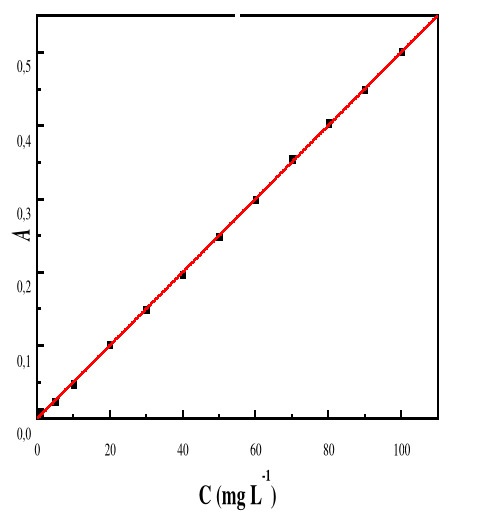
Figure 14: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 664 ; T : 28#177;01°C ; V : 100 mL ;
pH 8,30
Figure 15: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ;
pH 10,01
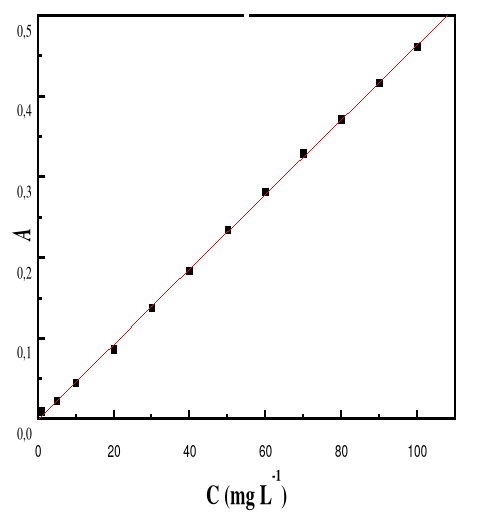
Figure 16: Evolution de l'absorbance en fonction de la
concentration de la solution de Bleu de Méthylène ë
max 662 ; T : 28#177;01°C ; V : 100 mL ;
pH 12,05
|
|



